2. 西北濒危药材资源开发国家工程实验室, 陕西师范大学生命科学学院, 陕西 西安 710062
2. National Engineering Laboratory for Resource Developing of Endangered Chinese Crude Drugs in Northwest of China, College of Life Sciences, Shaanxi Normal University, Xi'an 710062, China
骨质疏松 (osteoporosis,OP) 是以骨量减少和骨组织显微结构退行性改变为特征,致使骨脆性增加,易发生骨折的一种全身代谢性骨病[1]。目前全世界约2亿人患有骨质疏松,其发病率跃居常见病、多发病的第7位。中国是世界上拥有骨质疏松症患者最多的国家,约有患者9 000万,占总人口的7%。骨质疏松症严重地危害妇女及老年人的健康,已成为21世纪初世界广泛关注的严重社会问题之一[2, 3, 4]。
骨质疏松症可分为原发性和继发性两大类。在原发性骨质疏松症中,绝经后骨质疏松症 (PMOP) 占有很大比例。雌激素缺乏是PMOP发生的重要原因[5]。长期以来,临床上采用以雌激素和孕激素为主的激素替代疗法 (HRT) 来治疗PMOP,但长期应用HRT可增加子宫内膜癌和乳腺癌的危险性。另外临床上使用一些化学合成药,治疗费用高且不良反应大。因此寻找和研究安全有效的防治OP的药物已成为当今诸多科研人员的工作之重。
柚皮素 (naringenin) 是一类天然黄酮类化合物,广泛存在于枳实、化橘红、骨碎补、桃叶和菝葜等 多种天然植物中,具有抗菌、抗炎、抗癌和利胆等作用[6]。我国具有丰富的柚皮素资源,大力发展柚皮素的提取与应用研究前景广阔。柚皮素为柚皮苷的苷 元,目前研究发现柚皮苷对子宫摘除或药物所致的骨质疏松小鼠模型具有一定的防治作用[7,8],柚皮苷经口服途径进入体内后,其主要代谢物为柚皮素[9]。尽管相关的研究说明柚皮苷具有一定的促骨形成活性[7, 10],但其代谢物柚皮素的抗骨质疏松活性,仅见有个别体外实验研究报道[11, 12]。因此本文通过大鼠卵巢切除术成功构建妇女绝经后骨质疏松动物模型[13],研究柚皮素对病理实验动物骨代谢及相关组织生理功能和生化指标的影响,通过整体动物水平上的研究结果,反映柚皮素对绝经后骨质疏松症的防治作用,为该药物的进一步开发和利用提供参考。
材料与方法 实验动物32只3月龄未经产SD雌性大鼠,体重(250± 20) g,购自第四军医大学动物实验中心,动物合格证号: SCXK (陕) 2013-007。
试剂与仪器柚皮素 (西安天一生物技术有限公司,纯度≥98%); 17β-雌二醇 (Sigma Chemicals,美国); BGP ELISA检测试剂盒 (苏州卡尔文); DPD ELISA检测试剂盒 (苏州卡尔文); 戊巴比妥钠 (Bioszune美国); 青霉素注射液 (辰欣药业股份有限公司); 羧甲基纤维素钠CMC (上海懋圣工贸有限公司); AU-480全自动生化仪 (Beckman,美国); Lunar Prodigy Advance DEXA骨密度仪 (GE,美国); AGSG- 10KNG万能材料实验机 (Shimadzu,日本); Micro-CT (Siemens,德国); Zenyth 3100型荧光酶标仪 (ANTHOS,奥地利)。
药品的配制用生理盐水配制0.5% CMC溶液作为溶剂,将柚皮素配制成75 mg·mL-1的混悬液,17β-雌二醇配制为25 μg·mL-1的混悬液。药品配好后保存于4 ℃冰箱中,每次给药前取出置于超声波清洗机,37 ℃振荡预热15 min,每周配药1次。
动物模型构建 大鼠去卵巢手术大鼠适应性喂养3天后,随机将其分为两大组,假手术组 (假手术组) 8只和去卵巢手术组24只。假手术组只去除卵巢周围少量脂肪组织。去卵巢手术组行卵巢切除术[14, 15],术后注射3天40万IU·kg-1 (体重) 青霉素预防感染。
大鼠的分组及治疗手术完成待大鼠苏醒之后,将去卵巢手术组随机分为3个组: 去卵巢模型组 (OVX)、17β-雌二醇 (E2) 治疗组和柚皮素治疗组,每组8只,分笼喂养。每天适时添加饲料、换水,观察生存状态,给药前各组大鼠体重无统计学差异。大鼠术后一周基本恢复,进行药物治疗,各组灌胃药物及相应剂量: ① 假手术组: 同体积生理盐水; ② OVX组: 同体积生理盐水; ③ 柚皮素治疗组: 每天给予柚皮素75 mg·kg-1; ④ E2治疗组: 雌二醇25 μg·kg-1。连续灌胃12周,给药期间,每两周称量体重一次。
大鼠各种生理样本的收集与处理 血液将大鼠麻醉后固定,剪开腹腔,定位腹主动脉,用注射器经腹主动脉取血。将全血分别转移至带标记离心管中,4 ℃静置30 min后,以2 000×g、4 ℃离心20 min,移液器吸取上层血清分装于1.5 mL离心管,-80 ℃保存备用,避免反复冻融。
脏器大鼠抽血处死后,用镊子和剪刀分别取出心脏、肝、脾、肺、肾、子宫、胸腺和脑。生理盐水清洗后,用吸水纸吸干脏器表面水分,置于天平上称重计量并记录数据。子宫置于10% 的福尔马林溶液中,固定保存。72 h后石蜡包埋,进行HE染色,制成病理切片。
骨骼大鼠经腹主动脉抽血至死亡后,沿着大鼠关节取下其左右股骨,剔净附着的肌肉及结缔组织。将左侧股骨用浸泡过生理盐水的纱布包裹后,保存于 -80 ℃的冰箱中备用。右侧股骨用75% 的乙醇固定备用。
各项指标的检测 血清生化指标将制备好的血清样本解冻后振荡混匀,各取350 μL加入样品管,采用全自动生化仪检测血清中总蛋白 (TP)、白蛋白 (ALB)、球蛋白 (GLO)、谷丙转氨酶 (ALT)、谷草转氨酶 (AST)、谷氨酰胺转移酶 (GGT)、总胆红素 (TBIL)、直接胆红素 (DBIL)、间接胆红素 (IDBIL)、葡萄糖 (GLU)、血尿素氮 (BUN) 和肌酐 (CREA) 的含量。
骨转换指标酶联免疫法检测血清骨钙素 (BGP) 的含量[16]和尿液脱氧吡啶啉 (DPD) 的含量[17, 18]。通过CurveExpert1.4软件进行线性拟合,得BGP曲线方程为: y = a+bx+cx2 (a = -0.326,b = 8.082,c = 1.932; r = 0.999 5)。DPD的标准曲线为: y = a+bx+cx2 (a = 0.150,b = 12.224,c = -1.1992; r = 0.999 7)。
骨矿密度 (BMD) 及骨矿含量 (BMC)动物处死前3天,将大鼠麻醉,以俯卧位整齐排列于测试台上,用Lunar Prodigy Advance DEXA骨密度测定仪,通过小动物模式对大鼠进行全身扫描,获得图像后用GE公司配套软件对BMC和BMD进行分析。
大鼠股骨生物力学性能分析应用三点弯曲力学实验测定大鼠左侧股骨的生物力学性能,测量前将冻存于-80 ℃冰箱的大鼠左侧股骨样本取出,浸泡在生理盐水中3~4 h。采用万能材料实验生物力学机进行测试,将样本放置在两个支撑的横杆上,两个横杆之间距离为20 mm,标本的生理弯曲向上。载荷的加载棒位于标本的中央,以2 mm·min-1的加载速率匀速加载直至标本断裂,由力学实验测试机自带软件记录载荷-变形曲线和分析数据。所测定的生物力学参数包括最大载荷 (max-load) [N]、吸收能量 (energy) [N·mm]、骨结构硬度 (stiffness) [N·mm-1]、骨应力 (max-stress) [MPa]、和弹性模量 (elastic) [MPa]等。
大鼠股骨干骺端的骨小梁微结构检测选取保存于75% 乙醇中的大鼠右侧股骨样本,固定在样品杯中,每组3个,使用Micro CT沿股骨长轴方向扫描,扫描分辨率12 µm。扫描完成后,对样本进行三维重建,采用半自动的方式在每个二维平面上调整矩形的位置来提取干骺端的松质骨。在干骺线下1~2 mm处选取100层作为VIO,三维重建图直接用于骨小梁微组织结构测定[19]。采用Siemens公司的Micro View软件对三维重建的骨小梁进行分析,计算如下参数: 骨组织比例 (bone volume/tissue volume,BV/TV)、骨小梁数量 (trabecula number,Tb.N)、骨小梁厚度 (trabecula thickness,Tb.Th) 和骨小梁间隙 (trabecular separation,Tb.Sp)。
数据处理实验数据以平均数 ± 标准差表示,多组之间比较采用One-way ANOVA检验进行分析,数据资料应用Graph Pad Prism 5软件进行分析,设定P < 0.05差异具有显著性。
结果 1 柚皮素对去卵巢大鼠体重的影响随时间变化,大鼠体重不断增加。但是OVX组增加的速度明显高于假手术组和E2治疗组,如图 1所示。在灌胃第二周的时候,OVX组大鼠已显著高于假手术组和E2治疗组 (P < 0.01),而且这种差距随时间增加在不断增大。E2治疗组和假手术组大鼠体重无显著差异,一直保持到实验结果。而柚皮素治疗组与OVX组相比,能一定程度抑制体重的过快增长。

|
Figure 1 Effects of 12 weeks treatment on body weight. n = 8,x± s. P < 0.05,**P < 0.01 vs OVX (ovariectomy) |
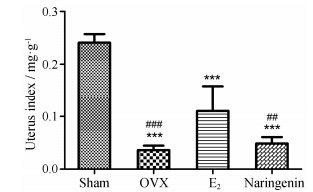
实验结束后,解剖大鼠时发现不同组大鼠子宫有明显差异。OVX模型组的子宫相对于假手术组大鼠子宫明显萎缩 (P < 0.001)。E2组大鼠子宫相对OVX组 (P < 0.001) 和柚皮素治疗组 (P < 0.01) 明显增生。柚皮素治疗组大鼠子宫相对OVX组无显著差异,大鼠的子宫体指数见图 2,病理切片见图 3。
|
Figure 2 Effects of 12 weeks treatment on uterus index of OVX rats. n = 8,x± s. ***P < 0.001 vs Sham; ##P < 0.01,###P < 0.001 vs E2 |

|
Figure 3 Hematoxylin/eosin-stained sections of rat uteri obtained from sham (A),OVX (B),E2 (C),and naringenin (D). ×40 |
大鼠处死后,迅速取出心脏、肝脏、脾、肺、肾、脑和胸腺进行称重,并与体重相比得脏器指数,发现各组大鼠脏器指数无显著差异,解剖时观察各脏器也未发现异常。说明经过3个月治疗,其脏器没有因为用药产生明显病变,进一步证实了药物的安全性 (图 4)。

|
Figure 4 Effects of 12 weeks treatment on the main organ indices of rat. n = 8,x± s |
通过血清生化指标的检测及数据统计发现,假手术组、OVX组、柚皮素治疗组和E2组的各项指标无显著差异,表明了柚皮素治疗过程中,没有对大鼠的肝肾功能产生明显的毒害作用,说明所选药物安全性高,毒副作用小。
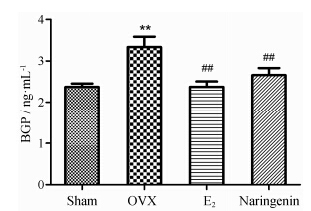
5 柚皮素对血清骨转化指标BGP的影响大鼠血清BGP检测结果显示,OVX组血清中的BGP明显高于假手术组 (P < 0.01),而E2组和柚皮素治疗组则不同程度地抑制由于卵巢切除导致的大鼠血清中BGP含量的升高 (图 5)。
|
Figure 5 Effects of 12 weeks treatment with naringenin or E2 on serum BGP. n = 8,x± s. **P < 0.01 vs Sham; ##P < 0.01 vs OVX |
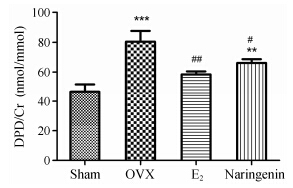
为去除尿浓缩稀释对DPD的影响,通常用脱氧吡啶啉/肌酐(DPD/Cr) 表示,大鼠尿DPD/Cr检测结果显示,OVX组和柚皮素治疗组大鼠DPD/Cr含量明显高于假手术组,但相对OVX组,E2组和柚皮素治疗组则有不同程度降低,说明柚皮素能够抑制卵巢切除后大鼠尿液DPD/Cr含量的提高 (图 6)。
|
Figure 6 Effects of 12-week treatment with naringenin or E2 on urine DPD/Cr. n = 8,x± s. **P < 0.01,***P < 0.001 vs Sham; #P < 0.05,##P < 0.01 vs OVX |
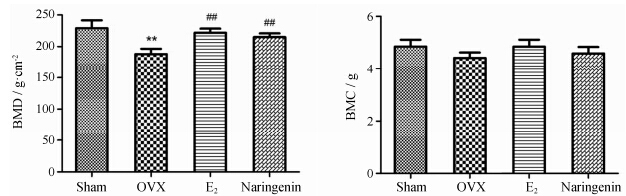
双能X线骨密度仪扫描结果显示,去卵巢12周后,OVX组大鼠股骨BMD显著低于假手术组 (P < 0.01)。与OVX相比,E2和柚皮素治疗12周后能不同程度地增加大鼠股骨骨密度 (P < 0.01),而BMC 在各组之间未见显著变化 (Figure 7">图 7)。
|
Figure 7 Effects of 12-week treatment on the bone mineral density (BMD) and total bone mineral content (BMC) in right femur of rats. n = 8,x± s. **P < 0.01 vs Sham; ##P < 0.01 vs OVX |
三点弯曲实验结果 (表 1) 显示,OVX组大鼠与假手术组相比,反映骨结构力学特性变化的股骨外在特性指标 (最大载荷、吸收能量和骨结构硬度) 和内在特性指标 (骨应力和弹性模量) 均显著性下降。与OVX相比,E2作用12周后,能极显著增加最大载荷、骨应力和弹性模量,柚皮素与OVX相比也一定程度地增加最大载荷、骨应力和弹性模量。
|
|
Table 1 Effects of 12-week treatment on biomechanical parameters of the femoral of rats. n = 8,x± s. P < 0.05,**P < 0.01,***P < 0.001 vs Sham; #P < 0.05,##P < 0.01,###P < 0.001 vs OVX |
MicroCT分析结果显示 (图 8,表 2): 去卵巢12周后,OVX组的股骨干骺端骨小梁Tb.Sp与假手术组相比显著升高,而BV/TV、Tb.N、Tb.Th均明显低于假手术组,提示去卵巢可导致大鼠骨小梁退化,诱发骨质疏松。而E2及柚皮素治疗12周可以不同程度地改善大鼠骨小梁的微结构特性。
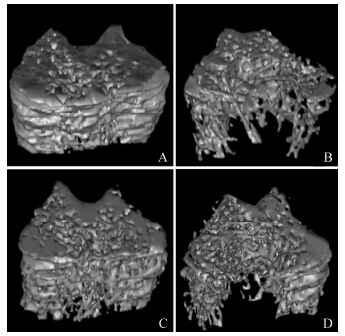
|
Figure 8 Representative sample from each group: 2D mapping of trabecular bone within the distal femur region. A: Sham; B: OVX; C: E2; D: Naringenin |
|
|
Table 2 Micro-CT 3-D parameters of trabecular bone in the distal femur region. n = 8,x± s. **P < 0.01,***P < 0.001 vs Sham; #P < 0.05,##P < 0.01,###P < 0.001 vs OVX |
本实验采用3月龄SD雌性大鼠通过卵巢切除 术构建绝经后骨质疏松动物模型,给药12周后通过各组大鼠体重、脏器系数、子宫病理切片、血尿生化指标、骨转换指标、骨密度、骨生物力学性能和骨组织计量学等指标全面、系统地评估柚皮素对PMOP的防治作用。17β-雌二醇是一种代表性的性激素,作为骨吸收抑制剂常用于骨质疏松的治疗,且已被证实对OVX大鼠骨质疏松有防治作用,所以本文采用17β-雌二醇作为阳性对照[20]。
通过大鼠体重分析可以看出,柚皮素能够抑制去卵巢所导致的大鼠体重增加。大鼠去卵巢后体重增加与术后大鼠雌激素的分泌降低有关,也是去卵巢后大鼠对抗骨质疏松的一种保护性反应。因为体重对骨密度的影响与骨所承受的机械负荷有关。大鼠体重增加可以刺激骨形成、增加骨量,抵抗机体受到的外界压力,但作用有限。大鼠去卵巢后,骨量和肌肉含量都是减少的,体重的增加是因为体内脂肪的堆积,这与间质细胞向脂肪细胞转化增多密不可分,这样必然会减少间质细胞向成骨细胞的转化[21]。其次体重的增加对于骨密度和骨强度下降的动物来讲又是一个增加骨折风险的因素[22, 23]。
切除卵巢后,大鼠子宫明显萎缩,子宫脏器指数较假手术组显著降低。卵巢的功能之一是分泌雌激 素,维持子宫功能,雌激素与孕激素等共同作用于子宫内膜。大鼠切除卵巢后,雌激素减少,内膜变薄,子宫缩小,这与绝经后妇女因雌激素缺乏对子宫的影响相似,同时也是去卵巢手术成功与否的一个重要指标[13]。给予E2治疗后,由于雌激素对子宫有很强刺激作用,导致E2组较OVX组子宫指数有显著 增加。柚皮素治疗组大鼠子宫指数较OVX组没有显著变化,子宫内膜无增生,这与其不存在直接的性激素样作用有关,提示柚皮素对绝经期妇女子宫的刺激作用等不良反应较少,在一定程度可作为雌激素类药物的替代品。
骨转化指标主要包括骨形成标志物BGP和骨吸收标志物DPD。BGP是由成骨细胞分泌的非胶原蛋白,是反映成骨细胞活性的敏感指标,也是反映骨形成的特异性指标[24]。DPD是骨组织细胞外基质成熟胶原不能还原的代谢产物,仅存在于骨的Ⅰ型胶原中,当羟赖氨酰氧化酶对成熟胶原作用时,DPD就从胶原分子中释放出来,进入血液循环,但是它不经过肝脏的进一步分解,而是直接排泄到尿中。尿DPD 90% 以上来自骨骼,不受食物成分的影响,其排泄受破骨细胞活力影响。为去除尿浓缩稀释对尿DPD的影响,通常用尿脱氧吡啶啉/肌酐 (DPD/Cr) 表示。因此DPD是反应骨吸收的特异性指标[25]。在这两个指标的检测中发现,OVX组的BGP和DPD含量明显高于假手术组,提示OVX组具有较高的骨转化率。E2组以及柚皮素治疗组BGP和DPD的含量较OVX组不同程度地降低,说明柚皮素和雌激素能够降低OVX导致的大鼠高骨转化率,重新建立成骨细胞和破骨细胞的平衡。
BMD是评价骨质疏松症形成及药物防治疗效的可靠指标之一。实验结果显示,OVX可以导致股骨BMD的下降,雌激素和柚皮素连续治疗12周后能够抑制BMD的降低,但BMC在各处理组之间未见明显差别。因为实验中发现OVX组大鼠股骨较假手术组和柚皮素治疗组粗,因此在进行骨密度测量时,OVX组股骨具有更大的投影面积,最后导致BMC在各处理组之间未见差异。
骨生物力学是研究骨组织在外力作用下的力学特征和骨在受力后的生物学效应,是对骨质量进行评定的一种可靠方法。有学者认为,骨量减少可以影响骨的生物力学性能,使骨生物力学强度降低,因此骨生物力学性能的变化是评价骨质疏松的一个重要而特殊的指标[26]。三点弯曲力学实验能很好地用于长骨力学性能的测定,在本次实验中采用三点弯曲实验,通过对骨应力、弹性模量、最大负荷、能量吸收、结构硬度指标的检测,来评价柚皮素对骨的生物力学性能的影响。实验结果显示,经柚皮素治疗和雌激素治疗后,在生物力学方面主要改善了股骨的内在特性。
在骨质疏松发生过程,先有骨形态 (骨结构) 的改变,然后有骨性能的改变,骨结构变化长期发展下去就会导致骨性能的改变[27, 28]。因此骨小梁微结构对骨生物力学性能的影响不容忽视。实验结果显示,OVX组的骨小梁结构显著退化,骨小梁体积比,骨小梁厚度及数量均下降,骨间隙增大,出现断裂甚至消失。经过柚皮素治疗12周后,与假手术组相比,尽管无法恢复到正常水平,但较OVX组有了显著改善,说明柚皮素可以有效抑制雌激素降低导致的骨组织结构退化。
长期以来,诸多的科研人员致力于对中草药的开发研究和临床实验。本实验发现对大鼠连续给药12周后,其生命活动、脏器指数及肝肾功能未见异常,说明所选药物柚皮素是安全的。本文在整体动物水平研究发现: 柚皮素能阻止雌激素减少引起的大鼠体重增加,降低骨转化率,增加OVX大鼠的骨质并有效改善骨组织微结构,使骨内在特性得到改善。可见柚皮素对大鼠OVX所致骨质疏松症具有明显的防治作用,可用于绝经后骨质疏松的治疗,值得进一步开发和利用。但其作用机制及代谢途径尚不明确,因而从分子和细胞水平研究其作用靶点仍是后续研究工作的重心。
| [1] | Garnero P, Delmas PD. Osteoporosis [J]. Endocrinol Metab Clin North Am, 1997, 26: 913-936. |
| [2] | Deal C. Potential new drug targets for osteoporosis [J]. Nat Clin Pract Rheumatol, 2009, 5: 20-27. |
| [3] | Roy A, Heckman MG, O'Connor MI. Optimizing screening for osteoporosis in patients with fragility hip fracture [J]. Clin Orthop Relat Res, 2011, 469: 1925-1930. |
| [4] | Bessette L, Davison KS, Jean S, et al. The impact of two educational interventions on osteoporosis diagnosis and treatment after fragility fracture: a population-based randomized controlled trial [J]. Osteoporos Int, 2011, 22: 2963-2972. |
| [5] | Cooper C, Harvey N, Cole Z, et al. Developmental origins of osteoporosis: the role of maternal nutrition [J]. Adv Exp Med Biol, 2009, 646: 31-39. |
| [6] | HL Y, H T, PB L. The biological activity of naringin and naringenin [J]. J Chin Med Mater (中药材), 2007, 30: 752- 754. |
| [7] | Pang WY, Wang XL, Mok SK, et al. Naringin improves bone properties in ovariectomized mice and exerts oestrogen-like activities in rat osteoblast-like (UMR-106) cells [J]. Br J Pharmacol, 2010, 159: 1693-1703. |
| [8] | Wei M, Yang ZL, Li P, et al. Anti-osteoporosis activity of naringin in the retinoic acid-induced osteoporosis model [J]. Am J Chin Med, 2007, 35: 663-667. |
| [9] | Zhang J, Brodbelt JS. Screening flavonoid metabolites of naringin and narirutin in urine after human consumption of grapefruit juice by LC-MS and LC-MS/MS [J]. Analyst, 2004, 129: 1227-1233. |
| [10] | Ang ES, Yang X, Chen H, et al. Naringin abrogates osteoclastogenesis and bone resorption via the inhibition of RANKL-induced NF-kappaB and ERK activation [J]. FEBS Lett, 2011, 585: 2755-2762. |
| [11] | La VD, Tanabe S, Grenier D. Naringenin inhibits human osteoclastogenesis and osteoclastic bone resorption [J]. J Periodontal Res, 2009, 44: 193-198. |
| [12] | Zhai YK, Pan YL, Niu YB, et al. Comparative study on the differentiation and maturation of rat calvarial osteoblasts by naringin and naringenin in vitro [J]. Chin Pharm J (中国药学杂志), 2013, 48: 1373-1379. |
| [13] | Nakamuta H. The ovariectomized animal model of postmenopausal bone loss [J]. Nihon Rinsho, 2004, 62 Suppl 2: 759-763. |
| [14] | Wei YZ, Tao SN, Yang GP, et al. The effect of ovariectomy on bone loss in differential age rat [J]. Acta Univ Med Nanjing (南京医科大学学报), 1999, 19: 203-205. |
| [15] | Qin LL, Chen JB, Gong HY, et al. Study of osteoporosis model in female rats of different old [J]. J China-Japan Friendship Hospital, 1997, 11: 6-9. |
| [16] | Monaghan DA, Power MJ, Fottrell PF. Sandwich enzyme immunoassay of osteocalcin in serum with use of an antibody against human osteocalcin [J]. Clin Chem, 1993, 39: 942- 947. |
| [17] | Hassager C, Risteli J, Risteli L, et al. Effect of the menopause and hormone replacement therapy on the car-boxy-terminal pyridinoline cross-linked telopeptide of type I collagen [J]. Osteoporos Int, 1994, 4: 349-352. |
| [18] | Risteli J, Elomaa I, Niemi S, et al. Radioimmunoassay for the pyridinoline cross-linked carboxy-terminal telopeptide of type I collagen: a new serum marker of bone collagen degradation [J]. Clin Chem, 1993, 39: 635-640. |
| [19] | Zhang G, Qin L, Hung WY, et al. Flavonoids derived from herbal Epimedium Brevicornum Maxim prevent OVX-induced osteoporosis in rats independent of its enhancement in intestinal calcium absorption [J]. Bone, 2006, 38: 818-825. |
| [20] | Westerlind KC, Wronski TJ, Ritman EL, et al. Estrogen regulates the rate of bone turnover but bone balance in ovariectomized rats is modulated by prevailing mechanical strain [J]. Proc Natl Acad Sci, 1997, 94: 4199-4204. |
| [21] | Huang DQ, Yang DJ, Li WR, et al. Correlation between adipogenic and osteogenic cells under the directional differentiation of mesenchymal stel cells [J]. Chin J Clin Rehabil (中国临床康复), 2006, 10: 31-33. |
| [22] | Kalu DN. The ovariectomized rat model of postmenopausal bone loss [J]. Bone Miner, 1991, 15: 175-191. |
| [23] | Notomi T, Okimoto N, Okazaki Y, et al. Tower climbing exercise started 3 months after ovariectomy recovers bone strength of the femur and lumbar vertebrae in aged osteopenic rats [J]. J Bone Miner Res, 2003, 18: 140-149. |
| [24] | Lipton A. Implications of bone metastases and the benefits of bone-targeted therapy [J]. Semin Oncol, 2010, 37 Suppl 2: S15-29. |
| [25] | Jia CY, Li P. Urine pyridine and deoxidization pyridine is the specific biochemical markers of bone resorption [J]. Chin J Clin Rehabil (中国临床康复), 2002, 6: 2256-2257. |
| [26] | Turner CH, Akhter MP, Raab DM, et al. A noninvasive, in vivo model for studying strain adaptive bone modeling [J]. Bone, 1991, 12: 73-79. |
| [27] | Ejiri S, Toyooka E, Tanaka M, et al. Histological and histomorphometrical changes in rat alveolar bone following antagonistic tooth extraction and/or ovariectomy [J]. Arch Oral Biol, 2006, 51: 941-950. |
| [28] | Stepan JJ, Alenfeld F, Boivin G, et al. Mechanisms of action of antiresorptive therapies of postmenopausal osteoporosis [J]. Endocr Regul, 2003, 37: 225-238. |
 2015, Vol. 50
2015, Vol. 50


