羊毛甾醇合酶基因 (lanosterol synthase gene,erg7) 编码的羊毛甾醇合酶是酿酒酵母甾醇生物合成途径中重要的限速酶,催化甲羟戊酸 (MVA)/麦角甾醇代谢途径的中间体2,3-氧化鲨烯的环化。2,3-氧化鲨烯也是三萜类化合物的合成前体[ 1 ]。因此,2,3-氧化鲨烯环化是麦角甾醇和三萜类化合物生物合成分支形成的关键位点。以酿酒酵母 (Saccharomyces cerevisiae) 为底盘细胞通过合成生物学技术组建三萜类化合物代谢途径时,下调2,3-氧化鲨烯流向麦角甾醇的代谢,以“节流”的方式积累菌体内的2,3-氧化鲨烯,可促进三萜类化合物的合成。有鉴于此,通过反义RNA技术下调麦角甾醇代谢,可为应用合成生物学技术在酿酒酵母中组建三萜类化合物代谢途径奠定基础。
20世纪80年代初,人们在研究反义核酸对原 核和真核基因表达调控的基础上,发明了反义技术 (antisense technology)。其中反义RNA技术根据核酸杂交原理,借助基因重组技术,将特异的反义基因连接到特定的表达载体上,转录出反义RNA,其与相应的mRNA形成双链,从而在核酸复制、转录及翻译水平上抑制靶基因的表达[ 2 ]。自1981年Tomizawa等[ 3 ]首次报道以来,反义RNA被作为一种调控特定基因表达的技术不断得到完善和发展,在许多领域取得了令人瞩目的成果。Liu等[ 4 ]通过利用反义RNA 技术显著减少了肌细胞中毒性RNA的积累而逆转了小鼠强直性肌营养不良症的症状。Zhang等[ 5 ]利用反义RNA技术,通过根癌农杆菌介导,将青蒿鲨烯合酶反义基因导入烟草以抑制烟草鲨烯合酶 的表达,降低了植物甾醇的生物合成,并促进了以法尼基焦磷酸为前体的其他代谢支路的生物合成。Jung等[ 6 ]利用反义RNA技术干扰酸性海藻糖酶基因在酿酒酵母中的表达,降低了酸性海藻糖酶基因的表达及酸性海藻糖酶活性,同时酿酒酵母的发酵性能也有所提高。
本研究利用酿酒酵母INVSc1的erg7基因编码 区和非编码区片段构建反义表达质粒,通过LiAc/SS Carrier DNA/PEG转化法将反义表达质粒导入INVSc1,以期得到麦角甾醇合酶基因表达下调且麦角甾醇含量降低的重组菌株。 材料与方法 菌株与质粒
酿酒酵母双倍体菌株INVSc1 (MATa his3Δ1 leu2 trp1-289 ura3-52/MATα his3Δ1 leu2 trp1-289 ura3-52) 购于Invitrogen公司。质粒pESC-URA购于德国Euroscarf公司。 试剂与仪器
Q5 DNA polymerase、T4 DNA连接酶和限制性内切酶购自New England Biolabs公司。Taq DNA聚合酶、DNA Marker、PCR产物纯化试剂盒和琼脂糖凝胶DNA回收试剂盒购自Transgene公司。酵母基因组提取试剂盒购自天根生物技术有限公司。反转录试剂盒购自天佑恒远生物科技有限公司。其他试剂均为国产分析纯。所用引物由Invitrogen公司合成。 培养基
INVSc1在YPD培养基 (1% 酵母提取物、2% 胰蛋白胨、2% 葡萄糖) 上培养,重组菌株在营养缺陷型培养基SD-URA上筛选和培养。 引物设计
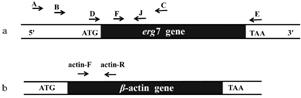
根据酿酒酵母erg7基因序列 (GenBank No: U23488) 设计引物,扩增5' 长片段 (包括erg7基因5' 非编码区启动子序列和部分编码区序列)、5' 短片段 (包括erg7基因5' 非编码区部分启动子序列和部分编码区序列) 和erg7基因编码区片段,如图1a。引物A与C扩增5' 长片段,引物B与C扩增5' 短片段,引物D与E扩增erg7基因编码区片段。为了比较INVSc1和重组菌株内erg7基因表 达水平,根据erg7基因和β-actin基因序列设计引物,如图1a和1b。引物具体序列见表1。
构建反义表达质粒
|
Figure 1 Principles for primers design |
|
|
Table 1 List of primer sequences |
以INVSc1基因组DNA 为模板,使用引物A和C、B和C、D和E,分别用 Q5 DNA polymerase扩增得到5' 长片段、5' 短片段和erg7基因编码区片段。PCR条件: 98 ℃预变性2 min; 然后进行30个循环: 98 ℃ 15 s,55 ℃ 15 s,72 ℃ 2 min; 循环结束后72 ℃延伸10 min。
分别将扩增出来的目的片段用Sac I和Not I进 行双酶切,回收目的片段,用T4连接酶分别将其连接到pESC-URA表达载体上。 转化酿酒酵母
采用LiAc/SS Carrier DNA/PEG转化法[ 7 ],用反义表达质粒转化INVSc1,在营养缺陷型培养基SD-URA上筛选重组菌株。 确证重组菌株
分别从营养缺陷型平板SD-URA上挑取10个单菌落,将单菌落重悬于100 μL的无菌水中,100 ℃加热10 min。以加热后的菌液为模板,分别以引物A和C、B和C、D和E进行PCR扩增验证。PCR条件: 94 ℃预变性4 min; 然后进行30个循环: 94 ℃ 15 s,52 ℃ 15 s,72 ℃ 3 min; 循环结束后 72 ℃延伸10 min。 比较erg7表达水平
取INVSc1和3种重组菌株的适量菌体,参照康为世纪酵母RNA提取试剂盒说明书,提取总RNA。参照北京天佑恒远生物科技有限公司反转录试剂盒说明书,将总RNA进行反转录,得到cDNA第一链,以其作为半定量PCR的模板。反转录条件: 37 ℃ 15 min,50 ℃ 5 min,98 ℃ 5 min。
通过半定量PCR方法比较INVSc1和3种重组菌株内erg7基因表达水平。以β-actin基因作为内参,以cDNA为模板,分别以引物F和J、 actin-F和actin-R进行PCR。PCR条件: 94 ℃预变性4 min; 然后进行25个循环: 94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s; 循环结束后72 ℃延伸10 min。 比较麦角甾醇含量
大量培养INVSc1和3种 重组菌株,10 000 r·min−1离心10 min,冷冻干燥菌体。分别称取1.0 g菌体,溶解于90 mL 20% 氢氧化钾和60 mL 50% 乙醇混合溶液中,90 ℃回流2 h[ 8, 9 ]。自然冷却后,回流液分别用150 mL正己烷萃取3次,每次静置30 min。合并萃取液,旋转蒸干,用3 mL三氯甲烷将产物从蒸馏瓶中溶出。分别取等量的样品进行TLC (展开剂为正己烷∶丙酮 = 4∶1) 和HPLC检测,比较INVSc1 和 3种重组菌株内麦角甾醇的含量。
色谱条件: 岛津高效液相色谱仪 (DGU-20A3,SPD-M20A,LC-20AT),Agilent C18液相色谱柱 (150 mm × 4.6 mm,5 μm),流动相为甲醇∶水 = 80∶20,流速为1 mL·min−1,柱温箱为30 ℃,检测波长为283 nm,进样量为20 μL。
结果 1 构建反义表达质粒及获得重组菌株
以INVSc1基因组DNA为模板,分别以引物A和C、B和C、D和E扩增得到5' 长片段 (2 169 bp)、5' 短片段 (1 372 bp) 和erg7基因编码区片段 (2 901 bp)。电泳结果表明,扩增片段大小均与理论值相符 (图2)。将扩增得到的片段用Not I和Sac I进行双 酶切,切胶回收目的片段,将其反向连接到表达载体pESC-URA上,获得反义表达质粒。测序表明上述反义表达质粒中反义片段序列均准确无误,证明3种 反义表达质粒构建成功。

|
Figure 2 PCR analysis of antisense expression vectors. M: Trans 15k DNA marker; 1: erg7 coding region fragment; 2: 5' short fragment; 3: 5' long fragment |
采用LiAc/SS Carrier DNA/PEG转化法,用构建的3种反义表达质粒转化INVSc1,在营养缺陷型培养基SD-URA上筛选重组菌株。在3个转化的平板上,各随机挑取10个单菌落进行PCR验证。其中筛选得到转入5' 长反义片段重组菌株6号 (图3A)、转入5' 短反义片段重组菌株1、& lt; /span>2、7、8、9、10号 (图3B) 和转入erg7基因编码区反义片段重组菌株2、 3、8、9号 (图3C)。选取转入5' 长反义片段重组菌株6号 (IN-A)、转入5' 短反义片段重组菌株1号 (IN-B) 和转入erg7基因编码区反义片段重组菌株2号 (IN-C) 进行后续实验。

|
Figure 3 PCR analysis of transformants harboring antisense fragment. A: 1−10 represent colonies transformed by expression plasmid with 5' long antisense fragment; B: 1−10 represent colonies transformed by expression plasmid with 5' short antisense fragment; C: 1−10 represent colonies transformed by expression plasmid with erg7 coding region antisense fragment |
提取INVSc1和3种重组菌株的总RNA (图4),以其为模板反转录得到cDNA。以cDNA为模板,以引物F和J、actin-F和actin-R进行半定量PCR。电泳结果表明,在β-actin基因表达水平相当的情况下,与INVSc1相比,转入erg7基因编码区反义片段重组菌株内羊毛甾醇合酶基因表达量没有显著变化,而转入5' 长反义片段重组菌株和转入5' 短反义片段重组菌株内羊毛甾醇合酶基因表达量明显降低(图5)。

|
Figure 4 Detection of total RNA extracted from the strains. 1: IN-A; 2: IN-B; 3: IN-C; 4: INVSc1 |

|
Figure 5Expression analysis of erg7 gene by semiquantitative PCR. 1−3: PCR products from INVSc1; 4−6: PCR products from IN-A; 7−9: PCR products from IN-B; 10−12: PCR products from IN-C |
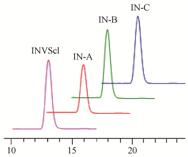
提取INVSc1和3种重组菌株内的麦角甾醇,进行TLC和HPLC检测。根据TLC斑点大小可知,与INVSc1相比,转入5' 长反义片段重组菌株内的麦角甾醇含量明显下降,而转入5' 短反义片段重组菌株和转入erg7基因编码区反义片段重组菌株内的麦角甾醇含量没有下降 (图6)。根据HPLC麦角甾醇峰面积可得出,转入5' 长反义片段重组菌株内的麦角甾醇含量下降至INVSc1的70.46%,而转入5' 短反义 片段重组菌株和转入erg7基因编码区反义片段重组菌株内的麦角甾醇含量与INVSc1基本一致 (图7)。TLC和HPLC结果均表明,对酿酒酵母erg7基因5'启动子和部分编码区进行反义抑制可降低其麦角甾醇的产量。

|
Figure 6TLC analysis of ergosterol content. 1: Ergosterol standard; 2: Hexane extracts from INVSc1; 3: Hexane extracts from IN-A; 4: Hexane extracts from IN-B; 5: Hexane extracts from IN-C |
|
Figure 7HPLC analysis of ergosterol content |
反义RNA技术与基因敲除 (gene knockout) 等功能缺失性研究方法相比具有许多优点,如操作简单、周期短、成本低等[ 10 ]。同时由于反义RNA技术并非完全抑制蛋白生成,因此,可避免致死突变的缺陷产生[ 11 ]。依据反义RNA作用机制,反义RNA与靶基因形成RNA∶RNA二聚体,影响前体mRNA的加工或阻止mRNA与核糖体的结合及移动以抑制翻译,反义片段的选择最好从翻译起始点延伸0.5~3.0 kb长的片段,而且互补于5' 非编码区的序列往往有较好的效果[ 12 ]。Zhou等[ 13 ]利用反义RNA技术,对水稻中编码脂肪醛脱羧酶的OsCER4基因起始密码子ATG上游约2 kb < span style='font-family:宋体;color:black'>的启动子和OsCER4基因进行反义抑制,使脂肪醛脱羧酶的表达量下降。本研究构建了酿酒酵母的3种反义表达质粒,分别将其转入INVSc1,将得到的3种反义重组菌株与相同生长条件下的INVSc1菌株进行比较,发现其生长状态没有明显变化。与INVSc1相比,转入5' 长反义片段重组菌株内的羊毛甾醇合酶基因表达明显下调,麦角甾醇含量也明显降低,表明对酿酒酵母erg7基因5' 启动子和部分编码区进行反义抑制可以下调麦角甾醇的生物合成。而转入5' 短反义片段重组菌株内虽然羊毛甾醇合酶基因表达明显下调,但麦角甾醇含量没有降低,其原因有待进一步研究。与此同时,转入erg7基因编码区反义片段重组菌株内羊毛甾醇合酶基因表达没有下调,麦角甾醇含量也没有降低,其原因可能是erg7基因的mRNA具有独特的二级结构,使其自身发生了折叠,不能形成单链序列,所以不能与erg7基 因 编码 区反义片段形成有效的互补而发挥作用[ 14 ]。
麦角甾醇在酵母细胞内参与调节膜的流动性和渗透性,为酵母细胞正常生长和代谢所必需[ 15 ]。如果完全阻断麦角甾醇代谢途径,则无法正常合成麦角甾醇,酿酒酵母的正常生长就会受到影响。本研究通过对酿酒酵母erg7基因5' 启动子区和部分编码区进行反义抑制以下调erg7基因的表达,使产生的麦角甾醇既能维持自身的正常生长,又能下调2,3-氧化鲨烯流向麦角甾醇的代谢,为应用合成生物学技术在酿酒酵母中组建三萜类化合物代谢途径奠定了 基础。
| [1] | Qin YZ, Zhao XY, Deng KQ, et al. Development on the molecular biology of oxidosqualene cyclase-the key enzyme in sterols biosynthesis [J]. Life Sci Res (生命科学研究), 2007, 11: 10-15. |
| [2] | Bourque JE. Antisense strategies for genetic manipulations in plants [J]. Plant Sci, 1995, 105: 125-149. |
| [3] | Tomizawa J, Itoh T, Selzer G, et al. Inhibition of ColE1 RNA primer formation by a plasmid-specified small RNA |
| [4] | Liu J, Wallace LM, Garwick-Coppens SE, et al. RNAi-mediated gene silencing of mutant myotilin improves myopathy in LGMD1A mice [J]. Mol Ther-Nucleic Acids, 2014, 3: e160. |
| [5] | Zhang Y, Liu Y, Wang H, et al. Regulation of squalene synthase gene expression in tobacco by antisense transformation with an Artemisia annua squalene synthase gene [J]. J Agric Biotechnol (农业生物技术学报), 2005, 13: 416-422. |
| [6] | Jung YJ, Park HD. Antisense-mediated inhibition of acid trehalase (ATH1) gene expression promotes ethanol fermentation and tolerance in Saccharomyces cerevisiae [J]. Biotechnol Lett, 2005, 27: 1855-1859. |
| [7] | Gietz RD, Schiestl RH, Willems AR, et al. Studies on the transformation of intact yeast cells by the LiAC/SS-DNA/PEG procedure [J]. Yeast, 1995, 11: 355-360. |
| [8] | Xie HJ, Lu Y, Qiu YM, et al. Determination of ergosterol in yeast by HPLC [J]. Prog Biotechnol (生物工程进展), 2000, 20: 75-76. |
| [9] | Li YH, Li XL. Determination of ergosterol in Cordyceps sinensis and Cordyceps black-bone chicken capsules by HPLC [J]. Acta Pharm Sin (药学学报), 1991, 26: 768-771. |
| [10] | Tummala SB, Junne SG , Papoutsakis ET. Antisense RNA downregulation of coenzyme A transferase combined with alcohol-aldehyde dehydrogenase overexpression leads to predominantly alcohologenic Clostridium acetobutylicum fermentations [J]. J Bacteriol, 2003, 185: 3644-3653. |
| [11] | Desai RP, Papoutsakis ET. Antisense RNA strategies for metabolic engineering of Clostridium acetobutylicum [J]. Appl Environ Microb, 1999, 65: 936-945. |
| [12] | Wang H, Wang XL, Zhou YP, et al. Construction and transformation of antisense RNA expression vector of Arabidopsis phytochrome A gene [J]. Guihaia (广西植物), 2009, 29: 669-672. |
| [13] | Zhou LY, Jiang DG, Li J, et al. Acquisition of wax biosynthesis related gene OsCER4 antisense-RNA transgenic plants by the cognate promoter [J]. J South China Agric Univ (华南农业大学学报), 2013, 34: 51-56 |
| [14] | Wang B, Cheng MH. Overview of antisense technology [J]. China Biotechnol (中国生物工程杂志), 2004, 24: 43- 47. |
| [15] | Lei J, Wang R, Zhang YY, et al. Construction of ERG6 deletion mutant of Saccharomyces cerevisiae [J]. Acta Agric Boreali-Occident Sin (西北农业学报), 2012, 21: 46-50. |
 2015, Vol. 50
2015, Vol. 50


