2. 北京中医药大学中药学院, 北京 100102;
3. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193;
4. 中药材规范化生产教育部工程研究中心, 北京 100102
2. School of Chinese Pharmacy, Beijing University of Chinese Medicine, Beijing 100102, China;
3. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China;
4. China Engineering Research Center of Good Agricultural Practice for Chinese Crude Drugs, Ministry of Education, Beijing 100102, China
甘草 (Glycyrrhiza uralensis Fisch.) 为豆科 (Legumrrihiza) 甘草属 (Glycyrrhiza) 多年生草本植物,具有清热解毒、缓急止痛、调和诸药等功效,是常用的大宗药材,素有“十方九草”之说,其主要活性成分为甘草酸[1]。甘草酸是以异戊二烯为基本结构单元构建的三萜类皂苷化合物,而鲨稀合成酶1 (squalene synthetase 1,SQS1) 是定位于植物细胞膜上的一种膜结合酶,是三萜类化合物生物合成途径中的关键酶,其表达量高低与甘草酸生物合成关系密切[2,3]。鉴于SQS1在萜类生物合成途径中的关键地位,目前已经从青蒿、百脉根、东北红豆杉、灵芝、刺五加等多种药用植物中克隆出编码SQS1的cDNA序列并对其基因表达进行了研究[4,5,6,7,8]。因此,研究甘草中对甘草酸合成具有关键调控作用的SQS1的影响显得尤为重要。
锰是植物生长发育必需的微量元素之一,作为一种重要的氧化还原剂和多种酶的活化剂在生物体内发挥着极其重要的生理生化作用[9]。最新的研究表明根施一定浓度的Mn2+能显著增加甘草药材中甘草酸含量[10]。目前有关Mn2+诱导特定基因表达进而促进有效成分积累方面的研究还较少,尤其是Mn2+调控影响甘草酸合成前提物鲨烯相对应催化酶SQS1的研究笔者还未见报道。因此,本文以甘草SQS1基因作为研究对象,利用实时荧光定量PCR (qRT-PCR) 手段分析不同浓度硫酸锰处理下甘草药材中SQS1基因的表达丰度,以期从分子层面揭示该基因与甘草酸合成的相关性,为进一步合理施肥提高栽培甘草药材质量奠定基础。
材料与方法 材料
2013年4月中旬将采自内蒙古赤峰且生长状况基本一致的一年生甘草苗移栽于北京中医药大学药用植物园花盆内,栽培基质为蛭石∶珍珠岩∶河沙=5∶1∶1,由北京中医药大学王文全教授鉴定为甘草Glycyrrhiza uralensis Fisch.。处理90天后取样并置于液氮中速冻,-70 ℃保存备用。 试剂
Trizol试剂盒 (美国Invitrogen公司); DL DNA-2000 Marker,Oligo dT primer,5×M-MLV Buffer,dNTP mixture (each 10 mmol·L-1),M-MLV (RNase H-),LA Taq DNA聚合酶 (宝生物工程 (大连) 有限公司); DNaseⅠ和RNase inhibitor (美国Fermentas (MBI) 公司); Eva_green (美国Biotium公司); 甘草酸对照品 [纯度 ≥ 98% (HPLC),成都曼斯特生物科技有限公司]; 乙腈 [HPLC级,购自美国赛默飞世尔科技 (中国) 有限公司]; 磷酸 [HPLC级,天津市光复精细化工研究所]; 异丙醇、氯仿、乙醇等试剂均为分析纯 (北京化学试剂公司); 硫酸锰 (MnSO4·H2O) (AR,天津市福晨化学试剂厂)。 仪器
Waters 2498型高效液相色谱仪 (美国沃特世科技有限公司); 2720型PCR仪 (美国ABI公 司); Chromo4荧光定量PCR仪 (美国BIO-RAD公司); centrifuge (MICRO 17TR) 离心机 (韩国Hanil公司 ); ASP-2680超微量分光光度计 (美国ACTGene公司); mixer vortex (Voltex-Genie2) 涡旋混合器 (美国SI公司); system electrophoresis Mupid (Mupid 2plus) 电泳槽 (日本TaKaRa公司); image system (EUV-LDUV) 凝胶成像系统 (韩国Biotech公司)。 材料的处理
实验初期向花盆中浇灌Hoagland 营养液以提供植物所需的基本养分,待植株生长正常后进行不同浓度的MnSO4·H2O处理,分别设置0 mg·L-1 (CK)、1.81、18.1、36.2和54.3 mg·L-1 5个硫酸锰浓度,其中1.81 mg·L-1为Hoagland全营养液中MnSO4·H2 O的浓度,并在此质量浓度基础上设置10、20、30倍及未施MnSO4·H2O的对照 (CK) 处理,用稀NaOH和稀HCl调pH值到7.0[11]。 总RNA的提取
参照Trizol试剂盒说明提取甘草总RNA,并利用超微量分光光度计检测各处理OD值,通过1.0% 琼脂糖电泳检测RNA的质量并拍照。 逆转录合成cDNA第一链
① DNase I消化去 除基因组DNA污染,消化体系 (100 μL): 10 μg模板RNA、4 µL RNase Inhibitor、10 µL 10×DNase I buffer、10 µL DNase I,用DEPC处理过的H2O补足至100 µL。将以上DNase I消化体系在200 μL离心管中 混匀,37 ℃静置90 min。② 逆转录过程如下: 首先 在200 μL离心管中配制如下体系一 (10 μL): 8.0 μL模板RNA、1.0 μL 50 μmol·L-1 Oligo dT、1.0 μL 10 mmol·L-1 dNTP Mixture。65 ℃ 5 min → 冰上 2 min → 瞬时离心。然后在以上体系中加入体系二 (20 μL): 10.0 μL模板RNA (引物的变性溶液)、1.0 μL 200 U·μL-1 M-MLV (RNase H-)、4.0 μL 5×M-MLV Buffer、0.5 μL 40 U·μL-1 RNase inhibitor、4.5 μL RNase free dH2O。30 ℃ 10 min → 42 ℃ 1 h → 70 ℃ 15 min → 立即冰上冷却。产物于 -20 ℃保存备用或立即进行PCR扩增。 引物的设计与合成
参考甘草相关文献最终选择18S rRNA作为内参基因,用于甘草的定量检测。根据qRT-PCR引物的设计要求,依据GenBank数据库提供的甘草18S和SQS1基因序列,利用Primer premier 5.0软件分段设计引物 (表 1),引物由北京中美泰和生物工程有限公司合成。
|
|
Table 1 Primer of PCR amplification of 18S and SQS1 genes. Primers with letters F and R were used for upstream and downstream,respectively |
① PCR反应体系 (20 μL): 5.0 μL模板cDNA、1.0 μL 5 μmol·L-1 Forward primer、1.0 μL 5 μmol·L-1 Reverse primer、3.2 μL 2.5 mmol·L-1 dNTP、2.0 μL 10×PCR buffer (含镁离子)、0.2 μL 1 U·L-1 LA Taq DNA聚合酶、7.6 μL ddH2O。② 采用两步法,于PCR仪中分别进行反应。18S PCR反 应程序为: 95 ℃预变性5 min → 95 ℃ 变性30 s → 65 ℃退火30 s → 72 ℃延伸50 s,40个循环。SQS1 PCR反应程序为: 95 ℃预变性5 min → 95 ℃变性 20 s→ 65 ℃退火25 s → 72 ℃延伸35 s,46个循环。 产物均于4 ℃保存备用或立即进行PCR凝胶电泳。 qRT-PCR扩增
扩增反应体系 (20 μL): 5.0 μL模板cDNA、1.0 μL 5 μmol·L-1 Forward primer、1.0 μL 5 μmol·L-1 Reverse primer、3.2 μL 2.5 mmol·L-1 dNTP、2.0 μL 10×PCR buffer (含镁离子)、0.2 μL 1 U·L-1 LA Taq DNA聚合酶、1.25 μL 1×Eva Green、6.05 μL ddH2O。将上述反应体系分别置于qRT-PCR仪中,进行PCR扩增反应,反应程序同上。每个反应体系至少重复3次。扩增完成后进行熔解曲线分析并比较Ct值 (cycle threshold,即每个反应管内的荧光信号达到设定的阈值时所经历的循环数)。 甘草酸含量测定
甘草酸含量测定参考《中国药典》(2010) 方法进行[1]。甘草酸对照品和样品色谱图见图 1,根据对照品色谱峰面积得回归方程为: Y = 564 080 X - 82 230 (r = 0.999 9),进行精密度、稳定性、重复性和加样回收实验等方法学考察,结果均良好。计算各浓度处理下甘草药材中甘草酸含量。每处理均为5个重复。
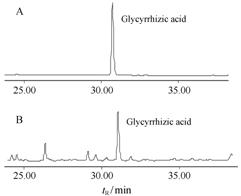
|
Figure 1 Chromatogram of reference substance (A) and sample of G. uralensis (B) |
根据Ct值利用2-△△Ct方法计算基因相对表达量值[12]。应用Excel软件进行数据录入及图表的绘制,采用SPSS16.0软件进行统计分析并比较SQS1基因表达与甘草酸含量之间的相关性。 结果 1 硫酸锰处理甘草根总RNA的提取
琼脂糖凝胶电泳显示,不同浓度处理下甘草根均获得比较明晰完整的具28S、18S和5.8S 3条带的RNA,亮度均匀,点样孔周围无污染和明显拖尾现象,且28S∶18S接近2∶1,见图 2。经分光光度计检测,OD260/OD230大于2.0,OD260/OD280均在1.8~2.0之间,表明RNA纯度较高、质量较好,可用于后续实验。
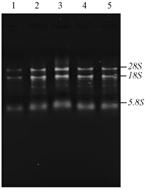
|
Figure 2 Agarose gel electrophoresis results of total RNA of G.uralensis in different concentration of MnSO4·H2O. 1-5: CK (0 mg·L-1),1.81 mg·L-1,18.1 mg·L-1,36.2 mg·L-1,54.3 mg·L-1 |
PCR扩增产物经1.0% 的琼脂糖凝胶电泳显示 (图 3),与对照相比两基因均在特定位置产生清晰单一的特异性片段,与预期结果一致,无引物二聚体及非特异性扩增。经qRT-PCR 验证两者的熔解曲线均显示明显的单一峰,表明扩增反应具有较高的专一性,设计的引物可用于qRT-PCR分析 (图 4)。

|
Figure 3 Agarose gel electrophoresis results of 18S and SQS1 genes of G.uralensis. M: DL DNA-2000 marker; A,C: 18S,SQS1 genes; B,D: Negative control |

|
Figure 4 Melting curves of 18S and SQS1 genes of G.uralensis |
以硫酸锰处理后的盆栽甘草cDNA为模板进行qRT- PCR,由图 5可知,经不同浓度硫酸锰处理内参基因18S和目的基因SQS1在甘草根部定量反应的Ct值分别在16.38~18.82和22.59~25.99之间有一定的变化,且均呈现出先降低后升高的变化趋势。18S和SQS1基因在0 mg·L-1 (CK) 浓度硫酸锰处理时均具有最大的Ct值,分别为18.76和25.95; 而在18.1 mg·L-1浓度硫酸锰处理时Ct值最小,分别为16.30和22.70,说明该浓度处理时这两个基因的循环阈值最低扩增效率最高,在植物体内的表达量也最丰富,因此也更容易被检测到 (图 6)。方差分析表明,与对照 (CK) 相比18S基因各处理间差异极显著 (P < 0.01),但1.81 mg·L-1和18.1 mg·L-1处理间差异不显著 (P > 0.05); SQS1基因各处理间差异均极显著 (P < 0.01)。
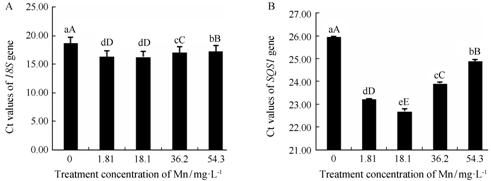
|
Figure 5 Ct values of 18S (A) and SQS1 (B) genes ofG.uralensis in different concentrations of MnSO4·H2O. Different lower-case letters mean significant differences among treatments at 0.05 level,different capital letters mean significant differences among treatments at 0.01 level,same as below |
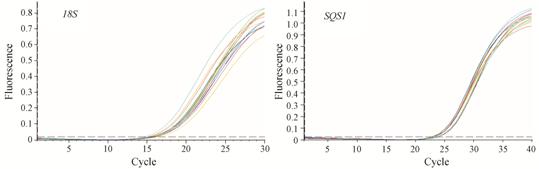
|
Figure 6 Amplification curves of 18S and SQS1 genes of G.uralensis in different concentrations of MnSO4·H2O |
硫酸锰处理的盆栽甘草经qRT-PCR扩增后,目的基因SQS1相对表达量的结果见图 7。由图 7可以 看出,不同浓度的硫酸锰处理对SQS1基因在甘草根部的表达影响不同,其相对表达量在3.11~8.93内是先随着硫酸锰处理浓度的增加而增加,随后又开始逐渐下降。在18.1 mg·L-1锰处理浓度时达到最大值为7.90,分别是0 mg·L-1 (CK)、1.81 mg·L-1、36.2 mg·L-1和54.3 mg·L-1处理的1.75、1.37、&l t;/ span>1.37和2.33倍; 在54.3 mg·L-1处理时其相对表达量最小,仅为3.39。方差分析表明,18.1 mg·L-1处理浓度时SQS1基因的相对表达量与其他4个处理差异极显著 (P < 0.01),这一结果说明锰处理浓度在18.1 mg·L-1时对甘草SQS1基因在根部的积累表达最有效。
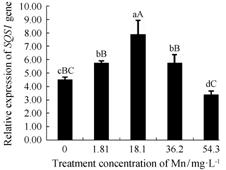
|
Figure 7 Relative expression of SQS1 gene of G.uralensis in different concentrations of MnSO4·H2O |
对硫酸锰处理的盆栽甘草甘草酸含量的测定结果 (图 8) 显示,其变化趋势与甘草SQS1基因相对 表达量的测定结果一致,均是先升高后降低。在1.81 mg·L-1和18.1 mg·L-1处理浓度时其甘草酸含量均达到最大值,且两者之间差异不显著 (P > 0.05),但与其他3个处理间存在极显著差异(P < 0.01); 54.3 mg·L-1处理浓度时甘草酸含量最低,但与0 mg·L-1 (CK) 和36.2 mg·L-1处理之间不存在显著差异 (P > 0.05),这一结果说明适量浓度的锰处理对甘草酸的积累具有较好的促进作用。

|
Figure 8 The content of glycyrrhizic acid of G.uralensis in different concentrations of MnSO4·H2O |
对不同浓度硫酸锰处理后甘草SQS1基因相对表 达量与甘草酸含量进行相关性分析,得回归方程Y = 0.826 + 0.023X,结果表明甘草SQS1基因表达量与甘草酸含量间相关系数高 (r = 0.737),表现出同升同降的变化趋势,呈极显著正相关关系 (P = 0.002 < 0.01),说明SQS1基因表达量的增加可以有效促进甘草植株下游相关次生代谢产物的积累,继而起到增加甘草酸含量的目的。
讨论
由于锰是植物生长的必需元素,在细胞组织水平上广泛存在,其不仅直接参与植物光合作用中电子传递系统的氧化还原过程及PSII系统中水的光解; 同时还是一些酶的重要组成元素,对维持植物的正常代谢发挥着重要作用[13,14]。目前对Mn2+诱导相关基因表达方面的研究已经证实了其部分生物学功能[14]。对植物中有许多基因编码的CDF蛋白的研究发现,植物液泡膜内Mn2+积累的增加与该基因的过量表达呈显著的正相关[15]。从酵母菌株上分离出来的CAX2基因,在烟草上过度表达时则会积累更多的Mn2+,并且对浓度不断升高的Mn2+具有较高耐性[16]。ZIP基因家族可以编码金属转运蛋白,同样可以通过运输Mn2+来增强植物对不利环境的耐性[17]。
关键酶基因及其在不同情况下的表达是植物生物合成途径中次生代谢产物积累的决定因素,植物某些特定基因的过度表达可以提高次生代谢产物的产率[18,19]。萜类生物合成途径以及相关酶研究的最终目的是提高目的化合物的产量,通过提高酶的表达量和活性,可增强目的萜类化合物的生物合成水平[18]。由于SQS能催化两分子的法呢酰基二磷酸 (farnesyl diphosphate,FPP) 缩合生成30个碳的鲨烯,是碳源流向三萜的关键调节酶,因此SQS的含量和活性决定了相关物质的产量[20,21]。外源性茉莉酸甲酯 (MeJA) 能有效刺激植物萜类次生代谢产物,诱导人参三萜皂苷合成途径中基因的表达和三萜皂苷含量的提高[22]。刺五加皂苷总含量与SQS基因的表达量间存在极显著正相关,呈现出同升同降的变化趋势[23]。
本实验利用qRT-PCR分析技术对不同浓度硫酸锰处理下盆栽甘草根部SQS1基因相对表达量进行了检测,结果表明,随着锰处理浓度的增加,甘草SQS1基因的相对表达量也显著增加,当达到一定浓度 (18.1 mg·L-1) 时又开始下降 (P < 0.01); 而对甘草酸含量的测定结果也发现,甘草酸含量在1.81 mg·L-1和18.1 mg·L-1锰处理浓度时达到最大值,与SQS1基因表达呈现出相同的变化趋势即先升高后下降。对SQS1基因表达量与甘草酸含量的相关分析也表明,两者之间具有极显著的正相关关系 (P < 0.01),相关系数达0.737。这一结果再次说明,适量浓度的锰处理对甘草SQS1基因的表达和下游次生代谢产物甘草酸的合成与积累具有明显的促进作用,这种关系的产生机制还有待进一步研究。
正大天晴药业集团股份有限公司为国内肝健康药物研发和生产基地之一,是国家重点高新技术企业、国家火炬计划连云港新医药产业基地重点骨干企业、“国内最佳研发生产线”十佳工业企业(第2名)、江苏省创新型企业。企业效益连续多年增长30%以上并连续多年位居全国医药行业百强之列,且逐年上升,工信部发布的2012年度中国制药工业百强榜中,正大天晴排名第28位。
公司现有员工2750人,拥有5个全资子公司、6个控股子公司,在连云港、南京、盐城和淮安分别建有研发和生产基地。正大天晴药业产品治疗涉及肝病、肿瘤、糖尿病、呼吸、心脑血管、感染等多个疾病领域,在肝病药物研发领域具备突出优势,2013年肝病药物产品在国内医院市场占有率已达到19%(IMS)。
正大天晴一贯重视研发创新工作,始终把技术创新视为企业生命的源泉,经过40多年的发展和探索,逐步形成了完善的创新体系。目前拥有研发人员500余名,高级工程师23名,博士17名,硕士200余名,博士、硕士及具有高级技术职称的人员占40%以上,逐渐形成了以国家“千人计划”等高端人才组成的海归团队、博士项目创新团队、高工经验技术团队和专家学术支持团队几大人才梯队,承担着正大天晴药业的新药研发、工艺改造等一系列重要的科研任务。公司先后成功地研制了具有自主知识产权的肝病治疗药物,并成功完成了数十个科研成果的产业化。
“十五”以来,公司先后承担了国家、省重点科技项目30多个,通过这些重点项目的实施及产业化,加大了企业与科研院所之间学术交流、产品研究、技术支持、成果转让等方面的合作力度,使得企业创新能力及科技管理水平得到了明显提高,为公司的快速发展提供了有力的支持。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China PartⅠ(中华人民共和国药典第一部) [S]. Beijing: China Medical Science Press, 2010: 80-81. |
| [2] | Kalra S, Kumar S, Lakhanpal N, et al. Characterization of squalene synthase gene from Chlorophytum borivilianum (Sant. and Fernand.) [J]. Mol Biotechnol, 2013, 54: 944-953. |
| [3] | Liu Y, Liu DJ, Liu CS, et al. Mechanism of genuineness of liquorice Glycyrrhiza uralensis based on CNVs of HMGR, SQS1 and β-AS gene [J]. Acta Pharm Sin (药学学报), 2012, 47: 250-255. |
| [4] | Liu Y, Ye HC, Li GF. Molecular cloning, Escherichia coli expression and genomic organization of squalene synthase gene from Artemisia annua [J]. Acta Bot Sin (植物学报), 2003, 45: 608-612. |
| [5] | Akamine S, Nakamori K, Hata S, et al. cDNA cloning, mRNA expression, and mutational analysis of the squalene synthase gene of Lotus japonicas [J]. Biochim Biophys Acta, 2003, 1626: 97-101. |
| [6] | Huang Z, Jiang K, Pi Y, et al. Molecular cloning and characterization of the yew gene encoding squalene synthase from Taxus cuspidate [J]. J Biochem Mol Biol, 2007, 40: 625-630. |
| [7] | Zhao MW, Liang WQ, Zhang DB, et al. Cloning and characterization of squalene synthase (SQS) gene from Ganoderma lucidum [J]. J Microbiol Biotechnol, 2007, 17: 1106-1109. |
| [8] | Long YH, Xing ZB, Wang MY, et al. Cloning and sequence analysis of squalene synthase gene in Eleutherococcus senticosus [J]. Biotechnol Bull (生物技术通讯), 2012, 12: 112-116. |
| [9] | Zheng HL. Trace Elements Nutrition Diagnosis (微量元素 营养诊断) [M]. Tianjin: Tianjin Science and Technology Translation Publishing Company, 2010: 12-13. |
| [10] | Wang D, Wan CY, Wang WQ, et al. Effects of manganese deficiency on growth and contents of active constituents of Glycyrrhiza uralensis Fisch. [J]. Commun Soil Sci Plant Anal, 2012, 43: 2218-2227. |
| [11] | Wang D, Wan CY, Wang WQ, et al. Effect of molybdenum on accumulation of glycyrrhizic acid based on material ingredients distribution [J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 1037-1042. |
| [12] | Kenneth JL, Thomas DS. Analysis of relative gene expression data using Real-Time Quantitative PCR and the 2-ΔΔCT method [J]. Methods, 2001, 25: 402-408. |
| [13] | Xu XH. Study on Absorption and Accumulation Mechanisms of Mangnase in Hyperaccumulator Phytolacca acinosa Roxb (Phytolaccaceae) (超积累植物商陆吸收累积锰机理研究) [D]. Hangzhou: Zhejiang University, 2006: 19. |
| [14] | Ren LM, Liu P. Review of manganese toxicity & the mechanisms of plant tolerance [J]. Acta Ecol Sin (生态学 报), 2007, 27: 357-367. |
| [15] | Delhaize E, Kataoka T, Hebb DM, et al. Genes encoding proteins of the cation diffusion facilitator family that confer manganese tolerance [J]. Plant Cell, 2003, 15: 1131-1142. |
| [16] | HirschiK D, Korenkov VD, Wilganowski NL, et al. Expression of Arabidopsis CAX in tobacco altered metal accumulation and increased manganese tolerance [J]. Plant Physiol, 2000, 124: 125-133. |
| [17] | Lopez-Millan AF, Ellis DR, Grusak MA. Identification and characterization of several new members of the zip family of metal ion transporters in Medicago truncatula [J]. Plant Mol Biol, 2004, 54: 583-596. |
| [18] | Gu W, Wu QN, Chao JG, et al. Molecular cloning of farnesyl pyrophosphate synthase from Alisma orientale (Sam.) Juzep. and its distribution pattern and bioinformatics analysis [J]. Acta Pharm Sin (药学学报), 2011, 46: 605-612. |
| [19] | Jun LH, Ben YL, He CY, et al. Effects of overexpression of the endogenous farnesyl diphosphate synthase on the artemisinin content in Artemisia annua L. [J]. J Integr Plant Biol, 2006, 48: 482-487. |
| [20] | Rong QX, Liu CS, Huang LQ, et al. Cloning and sequence analysis of squalene synthase gene and cDNA in Glycyrrhiza uralensis [J]. China J Chin Mater Med (中国中药杂志), 2011, 36: 1416-1420. |
| [21] | Dai ZB, Qian ZG, Hu YQ, et al. Cloning and characterization of cDNA encoding Psammosilene tunicoides squalene synthase [J]. Acta Pharm Sin (药学学报), 2008, 43: 1245-1250. |
| [22] | Kim OT, Bang KH, Kim YC, et al. Upregulation of ginsenoside and gene expression related to triterpene biosynthesis in ginseng hairy root cultures elicited by methyl jasmonate [J]. Plant Cell Tiss Organ Cult, 2009, 98: 25-33. |
| [23] | Xing ZB, Long YH, Lao FY, et al. Expression of squalene synthase gene in Eleutherococcus senticosus and its influence on saponins content [J]. Nonwood Forest Res (经济林研究), 2013, 31: 25-29. |
 2015, Vol. 50
2015, Vol. 50


