2. 四川天联药业有限公司, 四川 成都 610000
2. Sichuan Tianlian Pharmaceutical Co., Ltd, Chengdu 610000, China
脑肿瘤的治疗仍然是世界性的难题,其发病率随着人口老龄化而逐年提高,但是治疗效果并未随着科技进步而得到显著改善[1]。目前脑肿瘤的临床治疗手段主要有手术、化疗和放疗。一方面脑部功能区非常重要,“禁区”较多,手术切除倾向于保守。另一方面脑肿瘤成浸润生长,肿瘤组织与正常脑组织的边界模糊,手术难以将肿瘤细胞切除干净,从而极易复发。放疗的副作用较大,极大降低了患者生存质量,因此化疗仍然是治疗脑胶质瘤的主要手段[2]。
不同于外周系统肿瘤,血脑屏障 (blood brain barrier,BBB) 的存在极大限制了药物进入脑部。研究表明,超过98% 小分子药物和几乎100% 大分子药物不能透过血脑屏障[3]。从而使得很多对外周系统肿瘤有良好治疗效果的一线抗肿瘤药物对脑肿瘤无效,因此设计能够进入脑部的药物递送系统成为药剂学的研究热点之一[4, 5]。另外,药物进入脑部后如果在脑部弥散性分布,在提高对脑肿瘤治疗效果的同时也会对正常脑组织造成极大的伤害,因此研究者越来越关注具有双级靶向能力的药物递送系统,该系统既能透过血脑屏障,又能进一步靶向脑肿瘤细胞,从而有望具有更好的治疗效果[1]。
研究表明,多种受体在脑肿瘤细胞和血脑屏障高表达,如转铁蛋白受体、低密度脂蛋白受体等[1]。因此该类受体的特异性配体可以用作血脑屏障和脑肿瘤细胞双级靶向分子。转铁蛋白 (transferrin,Tf) 为转铁蛋白受体的特异性配体 (transferrin receptor,TfR),将其修饰于纳米载体表面可以达到靶向BBB和脑肿瘤的双级靶向效果,该设想已经在许多研究中得到证实[6, 7]。然而,内源性的Tf能竞争性抑制 Tf修饰的纳米粒与TfR特异性结合[8],且蛋白构象的改变容易导致其功能的丧失,从而不利于发挥靶向作用[9]。T7 (HAIYPRH) 是一种通过噬菌体展示技术筛选得到的短肽,能够与TfR特异性结合,结合常数高达10 nmol·L-1,并且由于结合位点的不同,内源性Tf不会抑制反而会促进T7修饰的纳米粒与TfR特异性结合[10]。所以T7更适合作为靶向分子,且目前已有多篇报道单独应用T7肽[8, 11]。
虽然特异性靶向分子修饰的纳米粒能提高靶向效果,但该靶向效果因受体饱和现象而受到限制[12]。为了提高药物递送的入胞能力,本课题引入细胞穿膜肽 (CPPs)。TAT (AYGRKKRRQRRR) 是一种细胞穿膜肽,能够将各种性质的药物高效率地传递进入细胞[13],该传递过程不需要配体-受体特异性结合,且无饱和现象[14]。但TAT缺乏细胞选择性,能够穿透所有细胞膜,这一缺点极大地限制了其在全身给药的肿瘤靶向系统中的应用[15]。
鉴于细胞穿膜肽和特异性配体各有优劣,为了达到优势互补目的,本课题将T7和TAT共同修饰到脂质体表面,以期利用T7的双级靶向能力和TAT入胞能力高的特点,进一步提高脂质体对脑肿瘤的靶向性。本文对T7和TAT双修饰脂质体的处方进行了优化,以脑肿瘤细胞C6的摄取为参照,考察了不同处方对细胞摄取的影响,并以bEnd.3细胞代表血脑屏障内皮细胞、C6细胞代表脑肿瘤细胞,对双修饰脂质体的靶向性进行了初步评价。
材料与方法 仪器和材料激光粒度仪/zeta电位分析仪 (Nano ZS90,Malvern,英国); 流式细胞仪 (CytomicsTM FC500,Beckman Coulter,美国); 透射电镜 (Hitachi,日本); NHS-PEG1000-Mal、NHS-PEG3500-Mal (北京 键凯科技有限公司); 1,2-dimyristoryl-sn-glycero-3- phosphoethanolamine (DSPE)、DSPE-PEG2000-Mal (Avanti polar lipids,美国); TAT peptide (Cys-AYGRKKRRQRRR) (成都凯杰生物科技有限公司); T7 (上海强耀生物科技有限公司); 注射液用大豆磷脂 (SPC,上海伟太药业有限公司); 胆固醇 (CHO,成都市科龙化工试剂厂); DSPE-PEG2000,2-dioleoyl-sn-glycero- 3-phosphoethanolamine-N-(carboxyfluorescein) (CFPE) (Avanti lipids,美国); DSPE-PEG1000-TAT、DSPE- PEG2000-TAT、DSPE-PEG2000-T7、DSPE-PEG3500-T7 (由本实验室合成); Triton X-100 (北京华美生科生物技术有限公司); 1640培养基 (Gibco,美国); Sephadex- G50 (Pharmacia,美国); 胎牛血清 (FBS,Hyclon,美国); 其他试剂均为市售分析纯。
CFPE标记的双修饰脂质体的制备根据文献[16],采用薄膜分散-超声法制备脂质体,称取处方量的SPC、CHO、DSPE-PEG2000、DSPE-PEG1000-TAT/DSPE- PEG2000-TAT,溶于混合溶剂中 (氯仿∶甲醇=2∶1),加入DSPE-PEG2000-T7/DSPE-PEG3500-T7、适量CFPE荧光标记脂质 (CFPE终浓度: 15 μg·mL-1),在37 ℃条件下旋转蒸发10 min除去有机溶剂,形成脂质膜,真空干燥2 h,以除去残留有机溶剂。加入pH 7.4 PBS 1 mL,在37 ℃、180 r·min-1摇床中避光水化1 h; 再水浴超声2~5 min,使脂质膜从瓶壁上完全脱落; 探头超声 (200 W、75 s) 以形成均匀的脂质体,备用。
DSPE-PEG2000-T7用量对脂质体的细胞摄取的影响采用DSPE-PEG-TAT的PEG链长2000,用量为1%,DSPE-PEG-T7的PEG链长为2000,筛选DSPE- PEG2000-T7的用量分别为2%、4%、6% 和8% (表 1)。按照上述方法制备脂质体,采用激光粒度仪/zeta电位分析仪测定所得脂质体的粒径和zeta电位。
|
|
Table 1 Composition of liposomes (mol%) used for optimizing of amount of DSPE-PEG-T7. LIP: Liposomes; T7: Brain tumor targeting peptide; TAT: Cell penetrating peptide; SPC: Soybean phospholipid; CHO: Cholesterol |
考察DSPE- PEG2000-T7的用量对C6细胞摄取的影响。C6细胞接种于6孔板内,待细胞融合度达80% 左右且细胞形态饱满后,分别加入适量未修饰脂质体 (PEG-LIP)、T7修饰脂质体 (T7-LIP)、TAT修饰脂质体 (TAT-LIP) 和双修饰脂质体 (T7-TAT-LIP),用培养基调整脂质浓度为0.3 μmol·mL-1。在37 ℃、5% CO2孵箱中孵育4 h,用胰酶消化、离心、重悬后,采用流式细胞仪检测细胞摄取的脂质体的荧光强度。
DSPE-PEG-T7中PEG链长对双修饰脂质体的细胞摄取的影响采用DSPE-PEG-TAT的PEG链长为2000、用量为1%,DSPE-PEG-T7的用量为6%,筛选PEG的链长分别为2000和3500 (表 2)。按照上述方法制备脂质体,并测定C6细胞对各脂质体的摄取。考察DSPE-PEG-T7中PEG链长对C6细胞摄取的影响。
|
|
Table 2 Composition of liposomes (mol%) used for optimizing of length of PEG of DSPE-PEG-T7 |
采用DSPE-PEG2000-T7的用量为6%,DSPE-PEG-TAT的用量为1%,筛选PEG链长分别为1000和2000 (表 3)。按照上述方法制备脂质体,并测定C6细胞对各脂质体的摄取,考察DSPE-PEG- TAT中不同PEG链长制备的脂质体对C6细胞摄取的影响。
|
|
Table 3 Composition of liposomes (mol%) used for optimizing of length of PEG of DSPE-PEG-TAT |
采用DSPE-PEG2000-T7的用量为6%,筛选DSPE-PEG1000-TAT的用量分别为0.5% 和1% (表 4)。按照上述方法制备脂质体,并测定C6细胞对各脂质体的摄取,考察DSPE-PEG1000-TAT的用量对C6细胞摄取的影响。
|
|
Table 4 Composition of liposomes (mol%) used for optimizing of amount of DSPE-PEG1000-TAT |
根据优化的处方同上述方法制备脂质体,采用激光粒度仪/zeta电位分析仪测定所得脂质体的粒径和zeta电位。采用透射电镜观察双修饰脂质体的形态。取适量脂质体样品稀释至合适浓度,滴加在覆有支持膜的铜筛网上,2% 磷钨酸染色,自然干燥后采用透射电镜观察其形态。
双修饰脂质体的稳定性考察分别取PEG-LIP、T7-LIP、TAT-LIP和T7-TAT-LIP各脂质体50 μL,加入1 mL PBS (pH 7.4) 中,混合后,加到96孔板中,每孔200 μL,在37 ℃、50 r·min-1摇床中孵育,分别于0、2、4、6、8、10、12和24 h采用化学发光仪于750 nm测定样品的透光率,以不加脂质体的PBS作为对照组。各样品各时间点的透光率与0 h透光率的比值为纵坐标,各时间点为横坐标,绘制透光率随时间的变化曲线。
另分别取PEG-LIP、T7-LIP、TAT-LIP和T7-TAT- LIP各脂质体50 μL,加入1 mL PBS (pH 7.4) 中,混合后,在37 ℃、50 r·min-1摇床中孵育,分别于0、2、4、8、20和24 h测定样品的粒径,以粒径为纵 坐标,各时间点为横坐标,绘制粒径随时间的变化曲线。
将制备好的PEG-LIP、T7-LIP、TAT-LIP和T7- TAT-LIP放置于4~8 ℃环境中,分别于制备的当天 (第0天) 和制备后第30天取样测定样品的粒径、电位和分布,考察4~8 ℃放置条件下样品的稳定性。
bEnd.3细胞对双修饰脂质体的摄取 bEnd.3细胞以每孔1×105个接种于6孔板内,3天后,移去培养基,分别加入适量PEG-LIP、T7-LIP、TAT-LIP和T7- TAT-LIP,用培养基调整脂质浓度为0.3 μmol·mL-1。在37 ℃、5% CO2孵箱中孵育0.5、1、2和6 h后,弃去脂质体悬液,细胞用PBS冲洗3次,0.25% 胰酶消化成单个细胞悬液,3 000 r·min-1离心5 min,弃去上清液,再将细胞用0.5 mL PBS重悬后,用流式细胞仪检测细胞摄取的脂质体的荧光强度。
C6细胞对双修饰脂质体的摄取 C6细胞以每孔1×105个接种于6孔板内,24 h后,移去培养基,分别加入适量PEG-LIP、T7-LIP、TAT-LIP和T7-TAT-LIP,用培养基调整脂质浓度为0.3 μmol·mL-1。在37 ℃、5% CO2孵箱中孵育0.5、1、2和6 h后,以下操作步骤同“bEnd.3细胞对双修饰脂质体的摄取”。
结果 1 DSPE-PEG2000-T7用量对脂质体的细胞摄取的影响为了实现最佳的入胞效果,本课题对DSPE- PEG2000-T7的用量进行了筛选。由该粒径和电位结果 (表 5) 可知,随着DSPE-PEG2000-T7用量的增加,脂质体的粒径略有增加; DSPE-PEG2000-T7的用量对脂质体的电位无显著影响。由C6细胞对不同脂质体的摄取结果 (图 1) 可知,随着DSPE-PEG2000-T7用量增加,C6对T7-LIP的摄取相对于C6对PEG-LIP摄取的倍数由1.02倍增加至1.58倍,表明T7单配修饰脂质体被C6细胞摄取的效果随着DSPE-PEG2000-T7用量增加而增加; C6对T7-TAT-LIP的摄取相对于C6对TAT-LIP摄取的倍数由1.37倍增加至1.64倍,表明T7和TAT的协同效果随着DSPE-PEG2000-T7用量增加而增加。由于DSPE-PEG2000-T7的用量≥8% 时,脂质膜不易从瓶壁上脱落,不利于脂质体的制备。因此,本课题确定DSPE-PEG2000-T7的用量为6%。
|
|
Table 5 Size and zeta-potential of liposomes with different amount of DSPE-PEG2000-T7 |
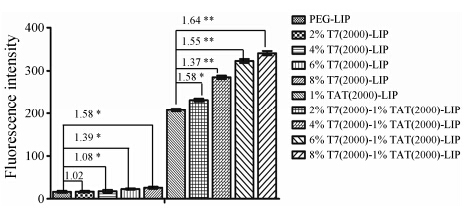
|
Figure 1 The uptake index of liposomes with different amount of DSPE-PEG2000-T7 by C6 cells. n = 3,x± s. Number represents the ratio between two column,P < 0.05,**P < 0.01 |
由于不同PEG链长对脂质体入胞的影响不同,为了实现最佳的入胞效果,本课题对DSPE-PEG-T7中PEG的链长进行筛选。随着DSPE-PEG-T7中PEG链长从2000增加到3500,粒径从112.4 nm增加到119.0 nm; DSPE-PEG-T7中PEG链长对脂质体的电位无显著影响,保持在 -6 mV左右。由C6细胞对不同脂质体的摄取结果 (图 2) 可知,C6对T7(3500)- LIP的摄取是PEG-LIP的1.45倍,C6对T7(2000)-LIP的摄取是PEG-LIP的1.39倍,表明T7单配体修饰的脂质体在C6细胞中的摄取,PEG为3500的链长优于2000。对于T7和TAT双修饰脂质体,C6细胞对T7 (3500)-TAT-LIP的摄取是TAT-LIP的1.39倍,C6细胞对T7(2000)-TAT-LIP的摄取是TAT-LIP的1.55倍,表明DSPE-PEG-T7中PEG链长为2000所制备的双修饰脂质体在C6细胞中的摄取优于PEG链长为3500,此结果与T7单配体脂质体摄取结果正好相反,其原因可能是随着PEG链长的增加,PEG屏蔽了TAT的入胞效果,所以本课题选择DSPE-PEG-T7中PEG链长为2000,即DSPE-PEG2000-T7。在此链长条件下,T7和TAT的协同效果最好。

|
Figure 2 The uptake index of liposomes with different PEG length of DSPE-PEG-T7 by C6 cells. n = 3,x± s. Number represents the ratio between two column,P < 0.05 |
DSPE-PEG-TAT中PEG的链长也会影响脂质体入胞效果,为了实现最佳的入胞效果,本课题对DSPE- PEG-TAT中PEG的链长进行筛选。随着DSPE-PEG-TAT中PEG链长从1000增加到2000,脂质体的粒径从113.5 nm增加到115.7 nm; DSPE-PEG-TAT中PEG链长对脂质体的电位无显著影响。由C6细胞对不同脂质体的摄取结果 (图 3) 可知,C6细胞对T7-LIP的摄取是PEG-LIP的1.39倍,C6细胞对T7(2000)-TAT (2000)-LIP的摄取是TAT(2000)-LIP的1.55倍,C6 细胞对T7(2000)-TAT(1000)-LIP的摄取是TAT(1000)- LIP的1.68倍,表明DSPE-PEG-TAT中PEG链长为1000时,T7和TAT的协同效果更好。因此,采用DSPE- PEG-TAT中PEG链长为1000,即DSPE-PEG1000- TAT。
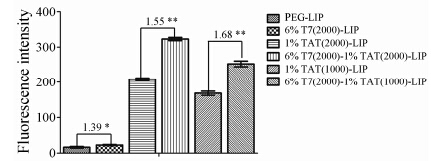
|
Figure 3 The uptake index of liposomes with different PEG length of DSPE-PEG-TAT by C6 cells. n = 3,x± s. Number represents the ratio between two column,P < 0.05,**P < 0.01 |
为了实现最佳的入胞效果,本课题还对DSPE-PEG1000-TAT的用量进行了筛选。DSPE-PEG1000-TAT用量从0.5% 增加到1% 时,双修饰脂质体的粒径从113.5 nm降低到108.3 nm,双修饰脂质体的电位从 -6.91 mV增加到 -3.59 mV,此结果跟TAT带正电荷有关。由C6细胞对不同脂质体的摄取结果 (图 4) 可知,当DSPE-PEG1000-TAT的用量为1% 时,C6细胞 对T7-TAT-LIP的摄取是TAT-LIP 1.68倍; 当DSPE- PEG1000-TAT的用量为0.5%时,C6细胞对T7-TAT-LIP的摄取是TAT-LIP的2.5倍,表明DSPE-PEG1000-TAT的用量为0.5% 时,T7和TAT的协同效果更好。因此,采用DSPE-PEG1000-TAT的用量为0.5%。
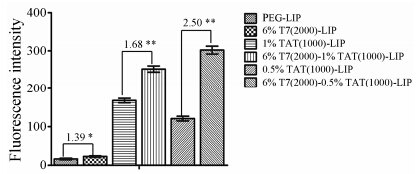
|
Figure 4 The uptake index of liposomes with different amount of DSPE-PEG1000-TAT by C6 cells. n = 3,x± s. Number represents the ratio between two column,P < 0.05,**P < 0.01 |
综上所述,本研究所得优化处方为: 6% DSPE- PEG2000-T7、0.5% DSPE-PEG1000-TAT、3.5% DSPE- PEG2000、57% 卵磷脂和33% 胆固醇。
5 双修饰脂质体的形态所有脂质体的粒径在100~120 nm (表 6,图 5),多肽修饰对脂质体粒径无显著影响,脂质体粒径分布均匀,略带负电。采用优化处方制备的双修饰脂质体形态多为规则的类球形,粒径约为110 nm。
|
|
Table 6 Size and zeta potentials of different liposomes. n = 3,x± s |
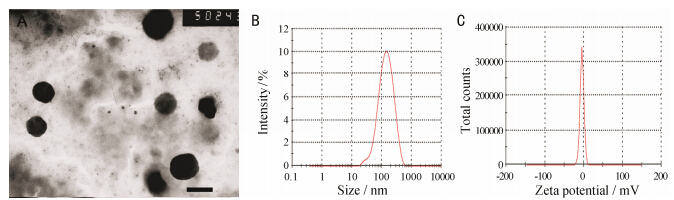
|
Figure 5 Transmission electron micrograph of T7-TAT-LIP (A,bar represents 100 nm); Partical size distribution of T7-TAT-LIP (B); Zeta potential of T7-TAT-LIP (C) |
粒径和浊度是考察脂质体稳定性的重要指标[17],由于脂质体储存于PBS中,因此考察了双修饰脂质体在PBS中的稳定性。各脂质体在PBS中,37 ℃条件下放置24 h的浊度无明显提高,同时粒径稳定在110 nm左右; 脂质体在4~8 ℃条件下放置30天,样品电位稳定在 -6 mV左右、粒径始终稳定在110 nm左右且PDI无明显增加,表明脂质体在PBS中的稳定性较好。
7 bEnd.3细胞对双修饰脂质体的摄取如图 6A所示,在不同时间点,双修饰脂质体的摄取均明显优于单配体修饰脂质体; bEnd.3细胞对T7- TAT-LIP的摄取与TAT-LIP的倍数随着摄取时间的延长而降低,倍数在6 h达到最低值,表明细胞摄取的协同效果在6 h时最低。但细胞摄取脂质体的绝对量在6 h达到最高值,表明随着时间的延长脂质体能够进一步被摄取进入细胞内。

|
Figure 6 The cellular uptake of bEnd.3 cells (A) and C6 cells (B) was measured at 0.5,1,2 and 6 h after treated with the same concentration of each liposomes. n = 3,x± s. P < 0.05,**P < 0.01,***P < 0.001 |
如图 6B所示,在不同时间点双修饰脂质体的摄取均显著优于单配体修饰脂质体; 当摄取时间为0.5 h时,C6细胞对T7-TAT-LIP的摄取是TAT-LIP的6.38倍,随着摄取时间延长,T7-TAT-LIP与TAT-LIP的摄取倍数逐渐降低,到6 h时,倍数降至2.49倍。C6细胞对各脂质体摄取的绝对值随着时间延长,摄取量增加,在6 h达到最高值,说明随着时间的延长同样可以增加C6细胞的摄取,此结果与bEnd.3细胞摄取一致。
讨论对于药物传递系统,纳米粒的粒径是决定递药系统体内和体外效果的关键因素之一[18]。对于无配体修饰、通过渗透和滞留增强效应 (EPR效应) 到达肿瘤组织的被动靶向纳米粒,粒径的最佳范围为100~200 nm[19]。本课题采用优化处方制备的双修饰脂质体形态多为规则的类球形,粒径为100~120 nm,在EPR效应最佳粒径范围内,有利于脂质体在肿瘤部位的蓄积。双修饰脂质体表面修饰T7和TAT后,脂质体的粒径和电位无显著改变,双修饰脂质体略带负电荷,有利于脂质体在生理条件下稳定,在4~8 ℃下可放置1个月。综上,本课题制备的双修饰脂质体在体外各性质稳定,可用于体内外靶向效果的评价。
T7肽为转铁蛋白受体的特异性配体,而转铁蛋白受体在脑毛细血管内皮细胞和脑肿瘤细胞上均高表达,已被用于血脑屏障和脑肿瘤细胞双级靶向递送研究。bEnd.3细胞系由于能够表达脑毛细血管内皮细胞的一些标志物,而常被用作评价纳米递药系统的脑靶向性[20]。本研究表明,修饰T7肽能够有效提高bEnd.3细胞对脂质体的摄取,此结果与文献[8]报道一致,说明T7肽确实有血脑屏障靶向能力。同时脑肿瘤细胞也高表达转铁蛋白受体,大鼠脑肿瘤细胞C6摄取修饰T7肽的脂质体的能力显著高于未修饰脂质体,说明T7肽能够提高脂质体对脑肿瘤的靶向性,与文献[8]报道一致。细胞摄取结果初步表明T7肽能够用于血脑屏障和脑肿瘤双级靶向药物递送。
配体与受体的相互作用具有特异性好的优点,因此相关配体常被用作纳米递药系统的靶向分子。然而受体往往容易饱和,从而限制了配体介导纳米系统入胞。为克服此缺点,本研究在脂质体表面共同修饰了具有特异性识别转铁蛋白受体能力的T7,以及具有非特异性穿膜能力的TAT。研究表明,细胞摄取双修饰脂质体的能力显著高于T7修饰的脂质体和TAT修饰的脂质体,证明二者的协同作用很好,有望具有更好的血脑屏障和脑肿瘤靶向性。
本研究初步证明所设计的T7和TAT双修饰脂质体能够提高内皮细胞和脑肿瘤细胞的摄取,具有潜在的血脑屏障和脑肿瘤靶向性。该结果尚待进一步考察其体内靶向性、载药后的抗肿瘤活性和安全性,以全面验证该双修饰脂质体的双级靶向递药能力。
| [1] | Gao HL, Pang ZQ, Jiang XG. Targeted delivery of nano-therapeutics for major disorders of the central nervous system [J]. Pharm Res, 2013, 30: 2485-2498. |
| [2] | Liu Y, Lu WY. Recent advances in brain tumor-targeted nano-drug delivery systems [J]. Expert Opin Drug Deliv, 2012, 9: 671-686. |
| [3] | Pardridge WM. Vector-mediated drug delivery to the brain [J]. Adv Drug Deliv Rev, 1999, 36: 299-321. |
| [4] | Lammers T, Kiessling F, Hennink WE, et al. Drug targeting to tumors: principles, pitfalls and (pre-) clinical progress [J]. J Control Release, 2012, 161: 175-187. |
| [5] | Jiang XG. Research progress in brain-targeting drug delivery systems [J]. Fudan Univ J Med Sci (复旦学报医学版), 2012: 441-448. |
| [6] | Li HY, Qian ZM. Transferrin/transferrin receptor-mediated drug delivery [J]. Med Res Rev, 2002, 22: 225-250. |
| [7] | Recht L, Torres CO, Smith TW, et al. Transferrin receptor in normal and neoplastic brain tissue: implications for brain-tumor immunotherapy [J]. J Neurosurg, 1990, 72: 941-945. |
| [8] | Han L, Li JF, Huang SX, et al. Peptide-conjugated polyamidoamine dendrimer as a nanoscale tumor-targeted T1 magnetic resonance imaging contrast agent [J]. Biomaterials, 2011, 32: 2989-2998. |
| [9] | Mahmoudi M, Shokrgozar MA, Sardari S, et al. Irreversible changes in protein conformation due to interaction with superparamagnetic iron oxide nanoparticles [J]. Nanoscale, 2011, 3: 1127-1138. |
| [10] | Oh S, Kim BJ, Singh NP, et al. Synthesis and anti-cancer activity of covalent conjugates of artemisinin and a transferrin-receptor targeting peptide [J]. Cancer Lett, 2009, 274: 33-39. |
| [11] | Kuang YY, An S, Guo YB, et al. T7 peptide-functionalized nanoparticles utilizing RNA interference for glioma dual targetting [J]. Int J Pharm, 2013, 454: 11-20. |
| [12] | Kibria G, Hatakeyama H, Ohga N, et al. Dual-ligand modification of PEGylated liposomes shows better cell selectivity and efficient gene delivery [J]. J Control Release, 2011, 153: 141-148. |
| [13] | Fonseca SB, Pereira MP, Kelley SO. Recent advances in the use of cell-penetrating peptides for medical and biological applications [J]. Adv Drug Deliv Rev, 2009, 61: 953-964. |
| [14] | Torchilin VP, Rammohan R, Weissig V, et al. TAT peptide on the surface of liposomes affords their efficient intracellular delivery even at low temperature and in the presence of metabolic inhibitors [J]. Proc Natl Acad Sci USA, 2001, 98: 8786-8791. |
| [15] | Bechara C, Sagan S. Cell-penetrating peptides: 20 years later, where do we stand? [J]. FEBS Lett, 2013, 587: 1693-1702. |
| [16] | Zong TL, Mei L, Gao HL, et al. Synergistic dual-ligand doxorubicin liposomes improve targeting and therapeutic efficacy of brain glioma in animals [J]. Mol Pharm, 2014, 11: 2346-2357. |
| [17] | Sharma G, Modgil A, Layek B, et al. Cell penetrating peptide tethered bi-ligand liposomes for delivery to brain in vivo: biodistribution and transfection [J]. J Control Release, 2013, 167: 1-10. |
| [18] | Li SD, Huang L. Pharmacokinetics and biodistribution of nanoparticles [J]. Mol Pharm, 2008, 5: 496-504. |
| [19] | Zhan CY, Wei XL, Qian J, et al. Co-delivery of TRAIL gene enhances the anti-glioblastoma effect of paclitaxel in vitro and in vivo [J]. J Control Release, 2012, 160: 630-636. |
| [20] | Hu KL, Li JW, Shen YH, et al. Lactoferrin-conjugated PEG-PLA nanoparticles with improved brain delivery: in vitro and in vivo evaluations [J]. J Control Release, 2009, 134: 55-61. |
 2015, Vol. 50
2015, Vol. 50


