CD20抗原是分子量为35 kD的非糖基化跨膜蛋白,CD20作为B细胞表面特有的分化抗原,在95% 以上的B细胞淋巴瘤细胞膜上高密度表达,而在造血干细胞、血浆细胞和其他正常组织中不表达,且CD20分子在与单克隆抗体结合后,无显著内化及脱落,是B淋巴细胞瘤免疫靶向治疗的理想靶点[1, 2, 3, 4]。目前抗CD20单克隆抗体产品已显示良好的临床疗效并得到广泛应用。大量研究表明,CD20单抗与B细胞淋巴瘤表面抗原结合后,主要通过补体依赖的细胞毒作用 (CDC) 以及抗体依赖细胞介导的细胞毒作用 (ADCC) 将肿瘤细胞溶解[5]。ADCC效应是CD20单抗杀伤肿瘤靶细胞重要机制之一。CD20单抗与B细胞淋巴瘤细胞表面的CD20抗原结合后,导致抗体Fc段构象改变并与细胞毒效应细胞表面上表达的FcRγIIIa (CD16) 结合,从而激发NK、巨噬细 胞等效应细胞的杀伤活性,释放穿孔素和颗粒酶,对肿瘤靶细胞进行杀伤。
目前以CD20抗原为靶点的嵌合、人源化及其他各种突变体抗体药物质量研究中,其生物学活性主要采用的是CDC活性测定。但在抗CD20单抗的另一作用机制ADCC生物学活性领域鲜有问津。传统的ADCC测活方法多为基于新鲜制备的外周血单核细胞 (peripheral blood mononuclear cell,PBMC) 或者NK细胞作为效应细胞的杀伤实验[6, 7],以上方法存在细胞分离和培养困难、变异大、操作繁琐、背景值高等缺陷,因此迫切需要研究建立评价ADCC生物学活性的新方法。研究表明,在NK细胞中Fc受体 (FcR) 活化,尤其是FcRγIIIa受体 (CD16) 活化能够引起NFAT信号通路的激活,这种激活依赖于靶细胞和效应细胞通过抗体同时桥联作用,也就是说抗体与FcRγIIIa受体的直接结合不足以活化受体复合物,FcRγIIIa受体活化还需要靶细胞通过抗体的参与[8, 9, 10]。本文以荧光素酶报告基因检测系统为平台,利用稳定转染FcγRIIIa受体以及NFAT (nuclear factor of activated T-cells) 反应元件质粒的急性T细胞白血病细胞系 (Jurkat细胞),以WIL2-S细胞系 (人B淋巴细胞) 为靶细胞,建立了灵敏、快速的抗CD20单抗ADCC生物学活性检测方法[11]。
材料与方法 细胞系WIL2-S细胞系 (购自ATCC); Jurkat/ NFAT-luc+FcγRIIIa细胞系 (购自Promega公司),该细胞系是稳定转染FcγRIIIa受体以及NFAT反应元件质粒的急性T细胞白血病细胞系,FcγRIIIa受体是介导ADCC生物学活性的必要分子,通过单抗将效应细胞与靶细胞连接起来,激活NFAT通路,启动荧光素酶报告基因的表达。
供试品抗CD20单抗参比品和供试品为本室留样。
试剂及仪器胎牛血清 (FBS)、无酚红RPMI 1640培养基、MEM非必需氨基酸溶液 (NEAA) 及潮霉素B溶液为GIBCO公司产品; 牛血清白蛋白 (BSA)、G418硫酸盐及Bio-GloTM Luciferase Assay System为Promega公司产品; SpectraMax M5多功能酶标仪及SoftMax分析软件为美国Molecular Devices公司产品; PLA2.0平行线分析软件为Stegmann公司产品。
ADCC剂量效应曲线的绘制收集对数生长期的WIL2-S细胞及Jurkat/NFAT-luc+FcγRIIIa细胞,1 000 r·min-1离心5 min后以含0.5% BSA的无酚红RPMI 1640培养基 (稀释液) 重悬细胞,调整细胞数 分别至1×106和6×106 mL-1,首先将靶细胞WIL2-S接种于白色不透明96孔细胞培养板中,每孔25 μL; 以稀释液预稀释抗CD20单抗至18 μg·mL-1,再以稀释液进行1∶5倍稀释,共设9个稀释度,每一稀释 度设2个复孔; 将稀释好的抗CD20单抗加入已接种WIL2-S细胞的培养板内,每孔25 μL,再加入效应细胞Jurkat/NFAT-luc+FcγRIIIa,每孔25 μL; 以25 μL稀释液代替抗CD20单抗作为阴性对照孔 (negative),75 μL稀释液作为背景孔 (background,BG); 置 37 ℃、5% CO2条件下诱导6 h后,室温条件下平衡至少15 min; 加入荧光素酶底物溶液,每孔75 μL,混合后在室温条件下反应5 min,用SpectraMax M5酶标仪在细胞培养板上读取相对光单位 (relative light units,RLU) 数值,并按照以下公式计算诱导倍数 (fold of induction,FI)。FI = RLU (反应均值 - 背景均值) / RLU (阴性对照均值 - 背景均值); 利用SoftMax软件分析数据,以抗CD20单抗浓度对数为x轴,对应的FI值为y轴,选用四参数方程回归模型,拟合抗CD20单抗的剂量效应曲线。
实验条件的优化靶细胞的选择: 分别以表达CD20(+) 的人B淋巴细胞WIL2-S、Raji及Daudi细胞作为靶细胞进行检测; 抗体浓度范围的选择: 设定抗CD20单抗的预稀释浓度为3 μg·mL-1,分别按照1∶3、1∶4的梯度稀释,同时设定抗CD20单抗的 预稀释浓度为18 μg·mL-1,按照1∶5的梯度稀释进行检测; 效靶比的选择: 固定效应细胞数量 (6×106 mL-1),以改变靶细胞数量的方式分别设定效靶比为3∶1、4∶1、5∶1、6∶1、7.5∶1、10∶1、15∶1和30∶1进行检测; 诱导时间的选择: 分别设定诱导时间为3、4、5、6、7和23 h,进行检测。
方法学验证靶细胞专属性: 以CD20(-) 的C8166细胞及稀释液代替WIL2-S细胞进行检测。效应细胞专属性: 以未转染NFAT-luc-FcγRIIIa的Jurkat细胞及稀释液代替Jurkat/NFAT-luc+FcγRIIIa细胞进行检测。抗体专属性: 以抗HER-2单抗及稀释液代替抗CD20单抗进行检测。精密性实验: 制备抗CD20单抗预稀释浓度分别为18 μg·mL-1的50%、75%、100%、125% 和150% 的样品,每个样品重复测定4次,根据各样品的半数有效浓度 (EC50),以100% 样品作为参比品,按照以下公式: 相对效价 (%) = 参比品EC50 / 样品EC50×100%,计算相对效价及其变异系数CV (%),从而验证该方法的精密性。准确性实验: 制备抗CD20单抗预稀释浓度分别为18 μg·mL-1的50%、75%、100%、125% 和150% 的样品,每个样品重复检查4次,按公式: 回收率 (%) = 相对效价测定值/相对效价理论值×100%,计算回收率从而验证该方法的准确性。
结果 1 抗CD20单抗的ADCC剂量效应曲线利用SoftMax软件分析数据,以抗CD20单抗 浓度对数为x轴,对应的诱导倍数值为y轴,选用四参数方程回归模型,拟合抗CD20单抗的剂量效应曲线。所得数据符合四参数方程式: y = (A - D) / [1 + (X / C)B] + D,即在半对数坐标纸上呈典型的S型曲线,r2 > 0.99,式中A为下渐近线,D为上渐近线,B为斜率,C为半数有效剂量。见图 1。EC50为7.32 ng·mL-1 (式中C值)。

|
Figure 1 Dose-response curve of anti-CD20 mAb ADCC bioassay |
分别以表达CD20(+) 的人B淋巴细胞WIL2-S、Raji及Daudi细胞作为靶细胞进行检测,结果见图 2。上述3种细胞作为表达CD20分子的人B淋巴细胞,均可作为抗CD20单抗介导ADCC生物学活性的靶细胞,WIL2-S细胞呈现更好的剂量效应曲线,最大诱导倍数达50.4,分别为Raji细胞和Daudi细胞的2.585倍和2.625倍。

|
Figure 2 Optimization of dose-response curve from three groups of different CD20(+) target cells |
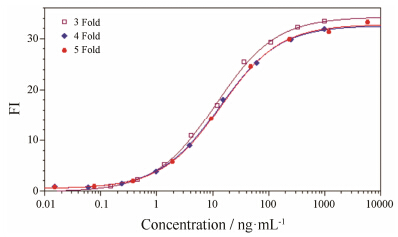
分别对抗CD20单抗进行1∶3倍、1∶4倍 (预稀释浓度为3 000 ng·mL-1) 及1∶5倍 (预稀释浓度为18 000 ng·mL-1) 的梯度稀释,共设9个稀释度,结果见图 3。基于保证剂量效应四参数曲线平台及保证诱导效果的考虑,在检测抗CD20单抗ADCC生物学活性时,最终选择起始稀释浓度为18 000 ng·mL-1,1∶5倍的稀释方案。
|
Figure 3 Optimization of dose-response curve from three groups of different dilutions |
固定效应细胞 (6×106 mL-1) 调整靶细胞使之效靶比分别为3∶1、4∶1、5∶1、6∶1、7.5∶1、10∶1、15∶1和30∶1,共8组。结果见图 4。改变不同效靶比得到不同ADCC诱导倍数的结果,E∶T = 6∶1时可以得到最大诱导倍数。

|
Figure 4 Optimization of dose-response curve from eight groups of different values of E∶T (Effector cell∶Target cell) |
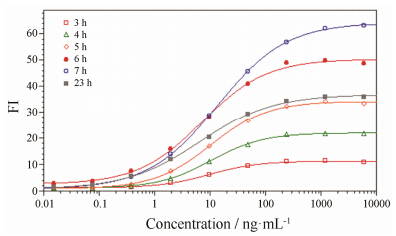
改变加入靶细胞、抗CD20单抗及效应细胞后的诱导时间,共设立3、4、5、6、7及23 h共7组。结果见图 5。改变不同诱导时间得到不同ADCC诱导倍数的结果,诱导时间为6~7 h均可得到较大诱导倍数,考虑到工作效率等因素,选择诱导时间为6 h。
|
Figure 5 Optimization of dose-response curve from seven groups of different induction times |
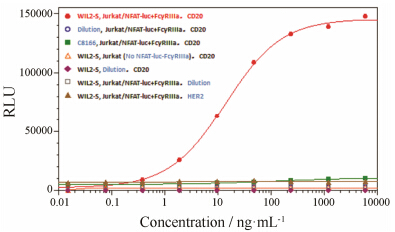
在专属性研究中共设立6组对照,见表 1。结果 (图 6) 可见,ADCC实验的成功依赖于专属的靶细胞、效应细胞及抗体的共同存在。
|
|
Table 1 Groups of ADCC assay for specificity verification |
|
Figure 6 Specificity of anti-CD20 mAb ADCC bioassay |
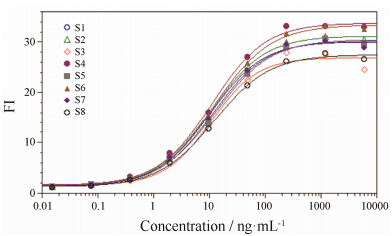
利用优化后的条件进行8次独立检测,EC50平均值为 (11.43 ± 0.88) ng·mL-1,变异系数CV为7.74%,绘制剂量效应曲线,见图 7。以第1次结果数据做参比,用PLA2.0软件对数据进行平行线分析,结果显示8条曲线的回归分析、线性及平行性均通过统计学检验。
|
Figure 7 Repeatability results of anti-CD20 mAb ADCC |
制备50%、75%、100%、125%和150% 回收率样品,重复检测4次,结果见表 2。4 组样品的相对效价 (%) 平均值分别为 (44.39 ± 3.93) %、(72.74 ± 2.78) %、(128.28 ± 7.01) % 以及 (168.19 ± 2.70) %; 对应回收率分别为 (88.78 ± 7.85) %、(96.99 ± 3.70) %、 (102.63 ± 5.61) % 以及 (112.12 ± 1.80) %,变异系数CV (%) 均小于10%。分别以4组样品的相对效价理论值与实测值进行直线回归分析,相关系数为0.990 5,两回归线的斜率b之间差异无统计学意义(t = 0.033,P > 0.05),表明相对效价理论值与实测值的剂量效应曲线相同。
|
|
Table 2 Potency and recovery of anti-CD20 mAb ADCC (n = 4) |
近年来包括rituximab在内的众多重磅炸弹类药品的专利期即将结束,因此以CD20作为靶点的抗体生物类似药 (biosimilar)、人源化抗体、新型高亲和力抗体突变体等一直是国内外研发的热点。目前我国有超过10家单位专注于各类抗CD20单抗的研制。因此,如何确保众多抗CD20单抗药物的安全有效是质量控制标准化研究面临的重要任务之一。
生物学活性是生物技术药物有效性评价的关键质量属性 (critical quality attribute,CQA),抗CD20单抗的ADCC活性是其发挥生物学效应的重要因素,由于经典的ADCC方法是利用PBMC作为效应细胞,该方法变异很大,因此目前尚无稳定而可靠的ADCC活性检测方法,大多抗CD20单抗的质量控制中未对其ADCC活性进行有效评价,因此迫切需要建立稳定而可靠的方法对抗CD20单抗ADCC活性这一关键质量属性进行质量控制。
本文建立的抗CD20单抗ADCC生物学活性测定新方法是基于ADCC作用的信号转导通路,利用CD16分子以及NFAT报告基因稳定转染的Jurkat细胞系建立了ADCC生物学活性测定。抗CD20抗体经倍比稀释后,可以得到较好的S型剂量效应曲线。通过试验条件的优化,选择WIL2-S作为靶细胞,单抗预稀释浓度为18 000 ng·mL-1,按照1∶5倍进行梯度稀释; 效靶比选择在6∶1; 诱导时间选择6 h。方法学验证数据显示,ADCC的实验成功必须基于特异的CD20阳性靶细胞、特异性的单抗以及FcγRIIIa阳性效应细胞,由于EC50值不仅取决于单抗的亲和力还会受到效靶比、诱导时间、实验用缓冲液等条件影响,导致不同实验条件EC50值的变异度较大,因此评价ADCC的方法利用相对效价更加合理可信,相对效价数值越高,则说明单抗的ADCC生物学活性越大[12]。同时,本研究按照《中国药典》方法学验证的要求对该方法进行了全面验证,该方法操作简便易行,专属性强、重复性好、准确性高,可作为抗CD20单抗ADCC生物学活性的常规检查方法,用于评价包括人鼠嵌合单抗、人源化单抗、全人源单抗和糖基化改造单抗在内的各类抗CD20单抗的ADCC活性,更重要的是该方法可以用于评价糖基化修饰与抗CD20单抗功能的关系,这也为该类制品工艺稳定性评价及结构与功能关系奠定基础,保证了该类产品质量可控、安全可靠。
| [1] | Tedder TF, Streui M, Schlossman SF, et al. Isolation and structure of a cDNA encoding the B1 (CD20) cell-surface antigen of human B lymphocytes [J]. Proc Natl Acad Sci USA, 1988, 85: 208-212. |
| [2] | Tedder TF, Engel P. CD20: a regulator of cell-cycle progression of B lymphocytes [J]. Immunol Today, 1994, 15: 450-454. |
| [3] | Reff ME, Carner K, Chambers KS, et al. Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD20 [J]. Blood, 1994, 83: 435-445. |
| [4] | Cancro MP, Allman DM, Hayes CE, et al. B cell maturation and selection at the marrow-periphery interface [J]. Immunol Res, 1998, 17: 3-11. |
| [5] | Johnson P, Glennie M. The mechanisms of action of rituximab in the elimination of tumor cells [J]. Semin Oncol, 2003, 30 (1 Suppl 2): 3-8. |
| [6] | Miller AS, Tejada ML, Gazzano-Santoro H. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro [J]. Methods Mol Biol, 2014, 1134: 59-65. |
| [7] | Mata MM, Mahmood F, Sowell RT, et al. Effects of cryopreservation on effector cells for antibody dependent cell-mediated cytotoxicity (ADCC) and natural killer (NK) cell activity in (51)Cr-release and CD107a assays [J]. J Immunol Methods, 2014, 406: 1-9. |
| [8] | Nimmerjahn F, Ravetch JV. Fcgamma receptors as regulators of immune responses [J]. Nat Rev Immunol, 2008, 8: 34-47. |
| [9] | Aramburu J, Azzoni L, Rao A, et al. Activation and expression of the nuclear factors of activated T cells, NFATp and NFATc, in human natural killer cell: regulation upon CD16 ligand binding [J]. J Exp Med, 1955, 182: 801-810. |
| [10] | Rao A. NFATp, a cyclosporin-sensitive transcription factor implicated in cytokine gene induction [J]. J Leukoc Biol, 1955, 57: 536-542. |
| [11] | Parekh BS, Berger E, Sibley S, et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay [J]. MAbs, 2012, 4: 310-318. |
| [12] | Wang L, Rao CM, Li YH, et al. Development of a method for determination of biological activity of vascular endothelial growth factor trap [J]. Chin J Biol (中国生物制品学杂志), 2009, 22: 895-906. |
 2015, Vol. 50
2015, Vol. 50


