随着细胞生物学、分子生物学、有机化学等多学科交叉的深入发展,近年来光亲和标记 (photoaffinity labeling) 技术取得了令人瞩目的进展[1, 2, 3, 4]。该技术是研究蛋白质组学的主要手段之一,广泛应用于生命科学的基础研究领域,尤其为确定未知靶标蛋白以及揭示活性小分子配体与靶标蛋白的作用模式提供了有效的途径。
近期,利用以光亲和标记技术标记的氨基酸掺入功能肽段的方式研究B型和D型肝炎病毒的人体受体,使肝炎病毒感染人体的机制研究取得了重要的进展[5]。在此背景下,将光亲和标记技术应用于寡聚核苷酸及siRNA领域,研究寡聚核苷酸和siRNA与体内其他生物大分子的详细作用机制将会是未来的研究方向之一。
光亲和标记探针分子通常由配体、光亲和基团、报告基团及连接各基团的连接链组成。该探针分子 以配体与靶标大分子的特异性识别为基础,在不影响二者结合的前提下,在配体的适宜位置引入光敏基团和报告基团两个功能片段。在配体特异性识别 受体后,光敏基团经特定波长光照产生高活性的中间体并与受体大分子进一步发生共价结合,从而使探针与受体的结合更加稳定而便于检测。光亲和基 团的合成与性质研究已有广泛报道[6, 7, 8, 9]。目前最广泛用于锁定靶蛋白的光敏活性基团是三氟甲基苯基双吖丙啶,它不仅能与O-H、N-H、S-H等杂原子反应,也能对C-H键进行插入反应[6]。配合光敏基团使用的报告基团有荧光基团和生物素 (biotin) 等,而以生物素作为报告基团最为广泛[10, 11, 12]。生物素与生物素亲和素 (avidin) 有着很强的特异性结合能力(1×10-15 mol·L-1),可以高效地富集、纯化或识别被标记蛋白。
为了拓展光亲和标记技术的适用领域,结合“点击化学技术 (click chemistry)”与“光亲和技术”,本课题组设计合成了可与含有炔基侧链的配体连接的生物素光亲和分子1(图 1)。光敏基团与报告基团分别采用常用的三氟甲基苯基双吖丙啶与生物素。在连接臂的设计上,为了使探针分子具有一定的水溶性,以便在细胞内寻找靶点的过程中,探针分子的分布和生物体内水溶性酶及靶标的分布有一定趋同性,本研究选择水溶性较好的三乙二醇作为报告生物素与具有叠氮的光敏基团的连接链; 为了使光敏基团更加接近小分子配体,提高探针分子对大分子靶标的特异性识别能力,Click反应的活性部位则选择了较短的叠氮乙胺作为连接链。
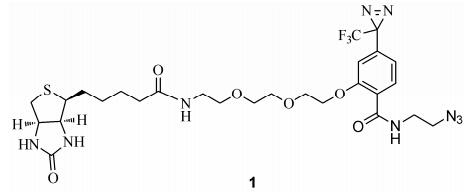
|
Figure 1 Biotin photoaffinity labeling molecule 1 |
分子1既可以直接与小分子配体连接构建生物素标记光亲和探针,应用到下游结合靶点的寻找中,也能够在配体与靶标结合后再通过“点击化学”的方式与配体连接。后者被称为无标签 (tag-free) 方式,即在具有炔基侧链的配体分子识别蛋白等大分子受体后,其炔基在Cu(I) 催化下通过Click反应与光亲和探针分子1的叠氮基形成稳定的1,2,3-三氮唑化 合物 (Huisgen 1,3-偶极环加成反应)[13, 14]。这一过程有效地避免了因探针分子体积过大而可能导致其在细胞内吸收、分布行为与未标记的小分子配体产生差异。这类Click反应目前已经成为生命科学领域重要的工具反应,尤其在RNA结构修饰与标记领域有广泛的应用[15]。探针分子1可以广泛用于配合具有炔基连接臂的不同配体。希望应用该类探针分子对核糖核苷酸2'位进行标记,为今后对寡聚核苷酸和siRNA的标记提供基础化学技术手段支持。
结果与讨论以间甲氧基溴苯为原料,通过7步反应可制得光敏标记基团化合物2[16, 17, 18]。以此为原料可以进一步合成生物素标记的光亲和探针片段。使用三乙二醇为起始原料,经过5步反应制得化合物3[19, 20, 21]。随后完成生物素及光亲和部分两个功能片段的拼接。化合物2连接化合物3之后,再将其上的醛基氧化成羧基,不经纯化直接用N-羟基丁二酰亚胺活化羧基后形成羧基端活化的化合物6[22, 23, 24]。化合物6与2-叠氮乙胺反应,进一步脱除Boc保护基得到化合物7。化合物7与羧基端活化的生物素8反应得到目标探针分子1 (合成路线1)。
化合物9是以2-N-乙酰基保护的鸟苷为原料,通过微波烷基化与炔丙氯反应在糖环的2'-O引入炔丙基,后经CF3CO2H脱除DMTr保护制得[25]。由于鸟苷是寡聚核苷酸和siRNA化学修饰领域的重要修饰位点,应用探针分子1通过Click反应对2'-O-炔丙基鸟苷9进行标记,得到鸟苷生物素光亲和探针分子终产物10 (合成路线2),表明1对鸟苷的2'-O-炔丙基有较好的标记能力,为此类探针分子对寡聚核苷酸包括siRNA的标记提供了技术基础。
结论本文应用已有的光亲和标记技术,设计合成了一种新的生物素光亲和探针分子1,其能够通过Click反应与2'-位具有炔丙基的鸟苷9进行标记连接,因而可以广泛应用于具有炔基的其他核苷、(环) 核苷酸和寡聚核苷酸的标记及其靶蛋白的确定与结合模式研究。
实验部分所有商用试剂均购自美国ACROS公司和Aldrich化学公司,一般化学溶剂购自北京化工厂,并未作 进一步纯化。薄层色谱硅胶GF254 (60型) 为青岛海洋化工集团公司生产,柱色谱硅胶 (200~300目) 为青岛海洋化工集团公司生产。HR-ESI-MS使用MDS SCIEX QSTAR和Bruker DALTONICS APEX质谱 仪测定; 核磁共振测试使用Brukerultrashield 400和Brukerultrashield 600,氢谱和碳谱以TMS为内标。化合物10的分离与纯化使用安捷伦C18色谱柱 (4.6 mm × 250 mm,5 µm) 分析柱。
2-羟基-4-[3-(三氟甲基)-3H-双吖丙啶-3-基] 苯甲醛的合成 (2)化和物2的合成参见文献[16, 17, 18]。 1H NMR (400 MHz,CDCl3) δ 11.05 (s,1H),9.92 (s,1H),7.60 (d,J = 8.0 Hz,1H),6.96~6.63 (m,2H)。19F NMR (376 MHz,CDCl3) δ -64.6 (s)。
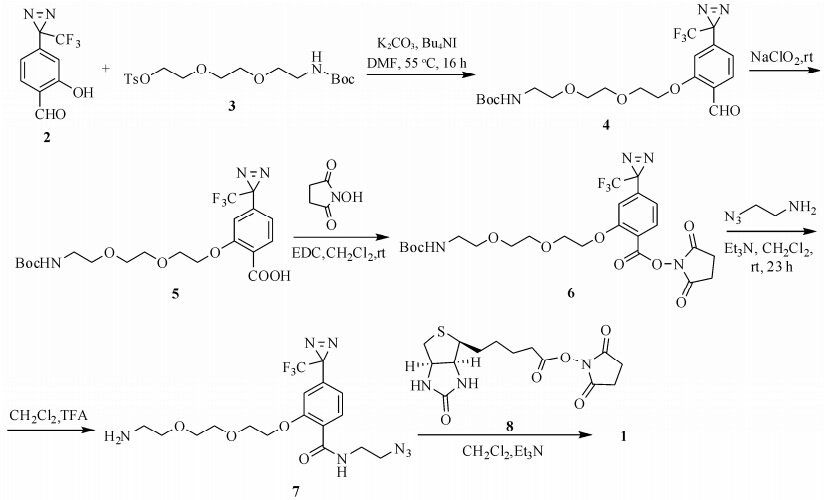
|
Scheme 1 Synthesis of biotin photoaffinity labeling molecule 1 |
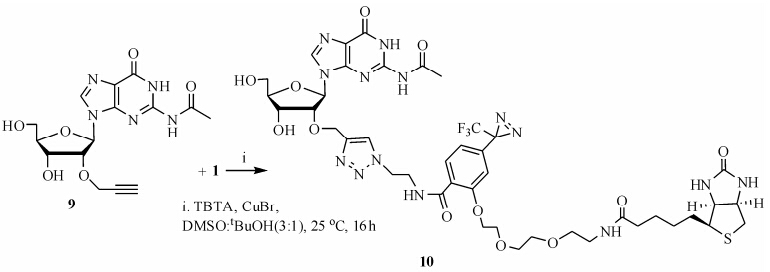
|
Scheme 2 Click reaction of biotin photoaffinity labeling molecule 1 and 2'-propinyl guanosine analogue 9 |
化和物3的合成参见文献[19, 20, 21]。1H NMR (400 MHz,CDCl3) δ 7.80 (d,J = 8.3 Hz,2H),7.35 (d,J = 8.0 Hz,2H),4.20~4.15 (m,2H),3.73~3.67 (m,2H),3.60~3.52 (m,4H),3.50 (t,J = 5.2 Hz,2H),3.29 (dd,J = 10.2,5.0 Hz,2H),2.45 (s,3H),1.44 (s,9H); HR-MS (ESI-TOF-) 计算值C18H29NO7SNa [M+Na]+ 426.155 7,实测值426.155 8; C18H29NO7SK [M+K]+ 442.129 6,实测值442.130 9。
2-[2-[2-[2-甲酰基-5-(3-三氟甲基-3H-双吖丙啶- 3-基)苯氧基]乙氧基]乙氧基]乙氨基甲酸叔丁酯的合成 (4)将2 (0.44 g,1.9 mmol) 溶于DMF (40 mL),冰水浴下加入K2CO3 (0.49 g,3.5 mmol),搅拌30 min,恢复至室温,加入原料3 (0.77 g,1.9 mmol) 和Bu4NI (80 mg),55 ℃下反应16 h。反应完毕,减压蒸除溶剂,加入乙酸乙酯稀释反应液,用2 mol·L-1 HCl溶液洗涤,再用饱和NaCl溶液洗涤,无水硫酸镁干燥,滤液浓缩,硅胶柱色谱分离,得黄棕色油状产物0.56 g,收率63%。1H NMR (400 MHz,CDCl3) δ10.50 (d,J = 0.6 Hz,1H),7.87 (d,J = 8.1 Hz,1H),6.88 (d,J = 8.1 Hz,1H),6.77 (s,1H),4.32~4.26 (m,2H),3.96~3.91 (m,2H),3.76~3.63 (m,6H),3.56 (t,J = 5.1 Hz,3H),3.34 (d,J = 4.9 Hz,3H),1.45 (s,9H); 19F NMR (376 MHz,CDCl3) δ -64.7 (s,1H); MS (ESI) m/z: 460.2 [M-H]-,484.5 [M+Na]+; HR-MS (ESI-TOF-) 计算值C20H27N3O6F3 [M+H]+ 462.184 6,实测值462.185 5; 计算值C20H26N3O6F3Na [M+Na]+ 484.166 6,实测值484.166 8。
2-(8-叔丁氧羰酰胺基-3,6-二氧杂-辛烷氧基)-4- [3-(三氟甲基)-3H-双吖丙啶-3-基]苯甲酸的合成 (5)将4 (0.49 g,1.05 mmol) 溶于DMSO (20 mL) 中,加入NaH2PO4 (10%,30 mL)。室温下,将NaClO2 (0.19 g,2.1 mmol) 的水溶液 (2 mL) 滴加至反应液中。搅拌12 h,反应液用乙酸乙酯 (10 mL) 稀释,冰水浴下调节pH = 2,乙酸乙酯萃取,有机层用水洗,无水硫酸镁干燥,滤液浓缩,得粗产物黄棕色固体0.46 g。MS (ESI) m/z: 476.3 [M−H]-; HR-MS (ESI-TOF-) 计算值C20H27N3O7F3 [M+H]+ 478.179 6,实测值478.179 4; 计算值C20H26N3O7F3Na [M+Na]+ 500.161 5,实测值500.161 6。
2-(8-叔丁氧羰酰胺基-3,6-二氧杂-辛烷氧基)-4- [3-(三氟甲基)-3H-双吖丙啶-3-基]-苯甲酸-N-琥珀酰亚胺酯的合成 (6)化合物5 (0.46 g) 溶于CH2Cl2 (80 mL) 中,加入N-羟基丁二亚酰胺 (0.14 g,1.2 mmol) 和EDC (0.23 g,1.2 mmol),室温下反应12 h,加入CH2Cl2 (20 mL) 稀释反应液,用水洗,无水硫酸镁干燥,滤液浓缩,硅胶柱色谱纯化,得无色固体0.54 g。MS (ESI) m/z: 597.5 [M+Na]+; HR-MS (ESI-TOF-) 计算值C24H30N4O9F3 575.195 9,实测值575.197 6 [M+H]+; 计算值C24H29N4O9F3Na [M+Na]+ 597.177 9,实测值597.178 1; 计算值C24H29N4O9F3K [M+K]+ 613.151 8,实测值613.151 8。
2-(8-氨基-3,6-二氧杂-辛烷基)-4-[3-(三氟甲基)- 3H-双吖丙啶-3-基]-苯甲酰-(2-叠氮乙基)胺的合成 (7)将化合物6 (0.54 g) 溶于二氯甲烷 (20 mL) 溶液中,加入叠氮乙胺 (0.12 g,1.4 mmol) 和三乙胺 (0.14 mL,0.93 mmol),室温搅拌过夜。蒸干溶剂重新溶于二氯甲烷 (10 mL) 溶液中,加入三氟乙酸 (1 mL),室温反应过夜,蒸除溶剂。加入碳酸钠水溶液游离氨基,二氯甲烷萃取,饱和食盐水洗涤二氯甲烷层。有机相用无水Na2SO4干燥,蒸除溶剂,柱色谱分离得白色固体0.16 g,收率34% (从化合物4计)。1H NMR (400 MHz,CDCl3) δ 8.31 (t,J = 5.1 Hz,1H),8.14 (d,J = 8.3 Hz,1H),6.88 (d,J = 8.2 Hz,1H),6.68 (s,1H),4.26 (t,J = 4.6,2H),3.91 (t,J = 4.6 ,2H),3.78~3.49 (m,12H),2.94 (t,2H); 19F NMR (376 MHz,CDCl3) δ -64.86 (s); MS (ESI) m/z: 446.4 [M+H]+,468.4 [M+Na]+; HR-MS (ESI-TOF-) 计算值C17H22N7O4F [M+H]+ 446.175 8,实测值446.175 3。
琥珀酰胺生物素酯的合成 (8)化和物8的合成参见文献[14]。1H NMR (400 MHz,DMSO-d6) δ 6.43 (s,1H),6.37 (s,1H),4.36~4.27 (m,1H),4.20~4.12 (m,1H),3.16~3.07 (m,1H),2.88~2.78 (m,5H),2.67 (t,J = 7.4 Hz,2H),2.59 (d,J = 12.4 Hz,1H),1.69~1.62 (m,3H),1.53~1.42 (m,3H); MS (ESI) m/z: 342.1 [M+H]+,364.1 [M+Na]+。
生物素光亲和探针分子的合成 (1)化合物7 (25 mg,56 μmol) 溶于二氯甲烷 (10 mL) 中,加入三乙胺 (0.5 mL) 和化合物8 (29 mg,85 μmol),室温下搅拌3 h,蒸干溶剂,硅胶柱色谱分离得到淡黄色琥珀状固体28.3 mg,收率75%。1H NMR (400 MHz,CDCl3) δ 8.32 (s,1H),8.16 (d,J = 8.3 Hz,1H),6.88 (d,J = 8.2 Hz,1H),6.68 (s,1H),6.44 (s,2H),5.56 (s,1H),4.56~4.37 (m,1H),4.35~4.17 (m,3H),3.99~3.81 (m,2H),3.70 (dd,J = 5.5,2.9 Hz,2H),3.66~3.56 (m,4H),3.52 (d,J = 2.9 Hz,4H),3.44 (s,1H),3.38 (dd,J = 10.3,5.1 Hz,2H),3.08 (dd,J = 11.8,7.2 Hz,1H),2.85 (dd,J = 12.8,4.8 Hz,1H),2.69 (d,J = 12.8 Hz,1H),2.14 (t,J = 7.4 Hz,2H),1.71~1.55 (m,4H),1.38 (dd,J = 15.1,7.6 Hz,2H); 13C NMR (101 MHz,CDCl3) δ 173.3 (s),164.5 (s),164.0 (s),156.8 (s),133.8 (s),132.9 (s),123.0 (s),121.8 (q,JC-F = 274.8 Hz),119.7 (s),110.9 (s),70.54 (s),70.1 (s),70.0 (s),69.0 (s),68.5 (s),61.8 (s),60.2 (s),55.6 (s),50.8 (s),40.5 (s),39.4 (s),39.0 (s),35.9 (s),28.2 (s),28.9 (s),25.6 (s); 19F NMR (376 MHz,CDCl3) δ -64.8 (s); MS (ESI) m/z: 672.3 [M+H]+,694.2 [M+Na]+; HR-MS (ESI-TOF-) 计算值C27H36N9O4F3SNa [M+Na]+ 694.235 4,实测值694.235 8。
N2-乙酰基-2'-O-炔丙基鸟苷的合成 (9)化合 物9的合成方法参见文献[25]。1H NMR (400 MHz,DMSO-d6) δ 12.06 (s,1H),11.72 (s,1H),8.27 (s,1H),5.91 (d,J = 6.1 Hz,1H),5.34 (d,J = 4.5 Hz,1H),5.12 (s,1H),4.59~4.40 (m,1H),4.31 (s,1H),4.31~4.10 (m,2H),3.95 (d,J = 2.0 Hz,1H),3.59 (dd,J = 29.4,11.5 Hz,2H),3.42 (s,1H),2.18 (s,3H); 13C NMR (101 MHz,DMSO-d6) δ 173.5 (s),154.8 (s),148.8 (s),148.1 (s),137.5 (s),120.0 (s),86.2 (s),84.5 (s),80.4 (s),79.7 (s),77.7 (s),68.7 (s),61.1 (s),57.1 (s),23.8 (s); MS (ESI) m/z: 362.2 [M-H]-; HR-MS (ESI- TOF-) 计算值C15H16N5O6 [M-H]- 362.110 6,实测值362.110 3; 计算值C15H17ClN5O6 [M+Cl]- 398.086 7,实测值398.086 9。
生物素光亲和标记鸟苷的合成 (10)化合物9 (3.2 mg,8.8 μmol) 与化合物1 (5.4 mg,8.0 μmol) 在氩气保护下溶于DMSO: tert-BuOH (3∶1) 混合溶液中,氩气保护下加入TBTA (17.0 mg,32 μmol) 和CuBr (4.6 mg,32 μmol),室温搅拌16 h,HPLC分离 (安捷伦C18色谱柱,5 µm,4.6 mm × 250 mm)。流动相梯度0~40 min从5% 乙腈-TEAA升到40% 乙腈- TEAA,检测波长为254 nm,保留时间36 min,得 到目标产物2.2 mg,产率28%。HR-MS (ESI-TOF+) 计算值C42H54F3N14O12S [M+H]+ 1 035.371 3,实测值 1 035.373 2。
| [1] | Fleming SA. Chemical reagents in photoaffinity labeling [J]. Tetrahedron, 1995, 51: 12479-12520. |
| [2] | Kotzyba-Hibert F, Kapfer I, Goeldner M. Recent trends in photoaffinity labeling [J]. Angew Chem Int Ed Engl, 1995, 34: 1296-1312. |
| [3] | Dormán G, Prestwich GD. Using photolabile ligands in drug discovery and development [J]. Trends Biotechnol, 2000, 18: 64-77. |
| [4] | Hatanaka Y, Sadakane Y. Photoaffinity labeling in drug discovery and developments: chemical gateway for entering proteomic frontier [J]. Curr Top Med Chem, 2002, 2: 271- 288. |
| [5] | Yan H, Zhong G, Xu G, et al. Sodium taurocholatecotransporting polypeptide is a functional receptor for human hepatitis B and D virus [J]. Elife, 2012, 1: e00049. |
| [6] | Nassal M. 4'-(1-Azi-2, 2, 2-trifluoroethyl)phenylalanine, a photolabile carbene-generating analog of phenylalanine [J]. J Am Chem Soc, 1984, 106: 7540-7545. |
| [7] | Kanoh N, Takayama H, Honda K, et al. Cleavable linker for photo-cross-linked small-molecule affinity matrix [J]. Bioconjug Chem, 2010, 21: 182-186. |
| [8] | Jin H, Huang ZD, Kuang CX, et al. Iron-catalyzed bromination of aryl azides by N-bromosuccinimide: efficient method for the synthesis of brominated aryl azides [J]. Chin Chem Lett, 2011, 22: 310-313. |
| [9] | Qiu WW, Li JY, Li J, et al. Photoaffinity labeling in drug discovery [J]. Chin Bull Life Sci (生命科学), 2005, 17: 296-303. |
| [10] | Gilbert BA, Rando RR. Modular design of biotinylatedphotoaffinity probes: synthesis and utilization of a biotinylated pepstatin photoprobe [J]. J Am Chem Soc, 1995, 117: 8061- 8066. |
| [11] | Wilchek M, Bayer EA. The avidin-biotin complex in bioanalytical applications [J]. Anal Biochem, 1988, 171: 1-32. |
| [12] | Hatanaka Y, Kempin U, Jong-Jip P. One-step synthesis of biotinylphotoprobes from unprotected carbohydrates [J]. J Org Chem, 2000, 65: 5639-5643. |
| [13] | Wang Q, Chan TR, Hilgraf R, et al. Bioconjugation by copper(I)-catalyzed azide-alkyne [3+2] cycloaddition [J]. J Am Chem Soc, 2003, 125: 3192-3193. |
| [14] | Chan TR, Hilgraf R, Sharpless KB, et al. Polytriazoles as copper(I)-stabilizing ligands in catalysis [J]. Org Lett, 2004, 6: 2853-2855. |
| [15] | Phelps K, Morris A, Beal PA, et al. Novel modifications in RNA [J]. ACS Chem Biol, 2012, 7: 100-109. |
| [16] | Mayer T, Maier ME. Design and synthesis of a tag-free chemical probe for photoaffinity labeling [J]. Eur J Org Chem, 2007, 2007: 4711-4720. |
| [17] | Bentz EL, Gibson H, Hudson C, et al. Aryldiazirine-modified pyroglutamates: photoaffinity labels for glutamate [J]. Synlett, 2006, 2: 247-250. |
| [18] | Kurono M, Shimomura A, Isobe M. Synthesis of photoaffinity probes of tautomycin [J]. Tetrahedron, 2004, 60: 1773-1780. |
| [19] | Schmidt F, Rosnizeck IC, Spoerner M, et al. Zinc(II) cyclen-peptide conjugates interacting with the weak effector binding state of Ras [J]. Inorg Chim Acta, 2011, 365: 38-48. |
| [20] | Itoh Y, Ishikawa M, Kitaguchi R, et al. Development of target protein-selective degradation inducer for protein knockdown [J]. Bioorg Med Chem, 2011, 19: 3229-3241. |
| [21] | Alexandre W, Francois B, Jacqueline MB. Tri-and tetravalent photoactivable cross-linking agents [J]. Synthesis, 2012, 44: 2249-2254. |
| [22] | Gu M, Yan J, Bai Z, et al. Design and synthesis of biotin-tagged photoaffinity probes of jasmonates [J]. Bioorg Med Chem, 2010, 18: 3012-3019. |
| [23] | Hashimoto M, Yang J, Holman GD. Cell-surface recognition of biotinylated membrane proteins requires very long spacer arms: an example from glucose-transporter probes [J]. ChemBioChem, 2001, 2: 52-59. |
| [24] | Hashimoto M, Hatanaka Y, Yang J, et al. Synthesis of biotinylated bis (D-glucose) derivatives for glucose transporter photoaffinity labeling [J]. Carbohydr Res, 2001, 22, 331: 119-127. |
| [25] | Yamada T, Peng CG, Matsuda S, et al. Versatile site-specific conjugation of small molecules to siRNA using click chemistry [J]. J Org Chem, 2011, 76: 1198-1211. |
 2015, Vol. 50
2015, Vol. 50


