艾滋病 (AIDS) 是由人类免疫缺陷病毒 (human immunodeficiency virus,HIV) 感染T细胞、树突状细胞、NK细胞、巨噬细胞等免疫细胞引起的感染性疾病,现尚无上市的预防性疫苗,且患者体内病毒无法被彻底清除,只能依靠药物治疗降低体内病毒载量[1, 2]。现有抗HIV药物六类共26种,包括进入抑制剂、融合抑制剂、核苷类逆转录酶抑制剂 (nucleoside reverse transcriptase inhibitors,NRTIs)、非核苷类逆转录酶抑制剂 (non-nucleoside reverse transcriptase inhibitors,NNRTIs)、整合酶抑制剂 (integrase inhibitors,INIs) 和蛋白酶抑制剂 (protease inhibitors,PIs)[3]。高效抗逆转录病毒疗法 (highly active antiretroviral therapy,HAART) 是临床治疗的主要方法,该方法是以一个基础药物与两个核苷类逆转录酶抑制剂联合使用,其中基础药物包括NNRTIs、INIs和PIs[4]。WHO和我国推荐的成人和青少年抗病毒治疗一线方案,即患者首次用药方案都是以一个非核苷类逆转录酶抑制剂为基础药物合并两个核苷类逆转录酶抑制剂联合治疗[5, 6]。由于药物的专利保护、生产成本及我国抗病毒药物用药历史等原因,我国与WHO的方案略有不同,其主要区别在于我国推荐的一线核苷类逆转录酶抑制剂为齐多夫定 (zidovudine,AZT) + 拉米夫定 (lamivudine,3TC) 或替诺福韦酯 (tenofovir disoproxil,TDF) + 3TC,而WHO推荐的一线核苷类逆转录酶抑制剂为TDF+恩曲他滨 (emtricitabine,FTC) 或TDF+ 3TC (表 1)。
|
|
Table 1 The first-line antiretroviral therapy (ART) regimens for adults recommended by WHO and China. EFV: Efavirenz; NVP: Nevirapine; TDF: Tenofovir disoproxil; FTC: Emtricitabine; 3TC: Lamivudine; AZT: Zidovudine. NNRTIs: non-Nucleoside reverse transcriptase inhibitors; NRTIs: Nucleoside reverse transcriptase inhibitors. aRecommended by WHO[5]; bRecommended by China[6] |
由于HIV病毒无法被彻底清除,故患者需终身服药。而长期用药除会引起药物副作用的累积外,患者体内还会产生耐药病毒而使得药物失效,此时必须改变用药方案,否则会导致治疗失败[7, 8]。作为一线基础药物的EFV和NVP已在临床应用了17年,超过五分之一患者体内出现针对这两种药物的耐药病毒 (如HIVRT-K103N出现几率为11.4%),且此类耐药多为多药耐药[9]。因此当以NNRTIs为基础药物治疗失败后,使用其他作用机制的药物作为基础药物则成为必然选择。
整合酶抑制剂是以HIV整合酶为靶点的一类重要抗艾滋病药物,此类药物抑制了HIV逆转录生成的双链DNA整合至宿主染色体的过程[10]。目前FDA批准的整合酶抑制剂有RAL、elvitegravir (EVG) 和DTG ,其中EVG为组方药成分之一,无单独制剂。RAL (Merck公司) 分别于2007和2008年在美国和欧洲上市,2013年10月我国批准其进口,现属自费药物。由GSK研发的DTG于2013年8月被FDA批准上市,我国尚未批准进口该药物。
本文以3TC和AZT作为HAART两个核苷类逆转录酶抑制剂,分别比较了以RAL和DTG为代表的INIs和以EFV和NVP为代表的NNRTIs为基础药物的抗HIV-1复制的体外药效学。
材料与方法 细胞和质粒人肾上皮细胞系293T细胞购自ATCC; 野生HIV-1质粒 (pNL4-3.Luc.R-E-) 由美国国立卫生院 (National Institutes of Health,NIH) 惠赠; 水泡性口膜炎病毒外壳糖蛋白 (vesicular stomatitis virus glycoprotein,VSV-G) 质粒由美国伊利诺伊大学Dr. Lijun Rong教授惠赠。
化合物齐多夫定 (zidovudine,AZT,纯度为98%)、拉米夫定 (lamivudine,3TC,纯度为99.7%) 和依法韦仑 (efavirenz,EFV,纯度为98%) 购自厦门迈克制药有限公司。奈韦拉平 (nevirapine,NVP,纯度为98%) 购自上海迪赛诺公司。雷特格韦 (raltegravir,RAL,纯度为99.28%)、埃替拉韦 (elvitegravir,EVG ,纯度为99.87%) 和度鲁特韦 (dolutegravir,DTG,纯度为98.95%) 购自上海昶衍化工科技有限公司。
HIV-1IN-G140S,Q148H质粒构建[11]以野生HIV-1质粒为模板引入定点突变: 整合酶140位Gly→Ser,148位Gln→His。HIV-1整合酶拟突变位点两端有AgeⅠ和SalⅠ酶切位点,设计两端引物ForwardAgeⅠ、ReverseSalⅠ和含点突变位点的引物Forward140,148、Reverse140,148。采用重叠延伸PCR法,以野生HIV-1质粒为模板,分别以ForwardAgeⅠ和Reverse140,148及Forward140,148和ReverseSalⅠ为引物PCR扩增28个循环,分别得到PCR产物1和产物2。再以产物1和 产物2为模板,以ForwardAgeⅠ和ReverseSalⅠ为引物PCR扩增28个循环,得到PCR产物3。该产物3的5'-和3'-端分别有AgeⅠ和SalⅠ酶切位点,中间有Gly140→Ser和Gln148→His定点突变。然后利用AgeⅠ、SalⅠ内切酶和T4连接酶 (NEB公司) 将含有G140S、Q148H耐药位点的序列引入野生HIV-1质粒并测序。引物 (表 2) 合成及测序分别由北京睿博兴科生物技术有限公司和北京擎科兴业生物有限公司完成。
|
|
Table 2 Sequence of primers used in experiments. The underlined letters were the restriction cleavage sites and the mutant nucleotides were in bold |
以野生HIV-1质粒为模板引入定点突变: 逆转录酶67位Asp→Asn、70位Lys→Arg、215位Thr→Phe。先 构建HIV-1RT-D67N,K70R质粒,然后将T215F引入HIV-1RT-D67N,K70R。在HIV-1逆转录酶拟突变位点两端有ApaⅠ和AgeⅠ酶切位点,设计两端引物ForwordApaⅠ、ReverseAgeⅠ和包含突变位点的引物Forword67,70、Reverse67,70。采用重叠延伸PCR法,以野生HIV-1 质粒为模板,分别以ForwordApaⅠ和Reverse67,70及Forword67,70和ReverseAgeⅠ为引物PCR扩增28个 循环,分别得到PCR产物4和产物5。再以产物4和产物5为模板,以ForwardApaⅠ和ReverseAgeⅠ为引物PCR扩增28个循环,得到PCR产物6。该产物6的5'-和3'-端分别有ApaⅠ和AgeⅠ酶切位点,中间有Asp67→Asn、Lys70→Arg定点突变。然后利用ApaⅠ、AgeⅠ内切酶和T4连接酶 (NEB公司) 将含有D67N、K70R耐药位点的序列引入野生HIV-1质粒并测序。按HIV-1RT-D67N,K70R质粒构建方法,以HIV-1RT-D67N,K70R为模板,以ForwordApaⅠ、ReverseAgeⅠ、Forword215和Reverse215为引物,构建HIV-1RT-D67N,K70R,T215F质粒。
野生型及耐药型HIV-1重组病毒制备[12]转 染前24 h将293T细胞以2.2×106细胞数接种至 100 mm细胞培养皿,37 ℃、5% CO2培养。用磷酸 钙沉淀法共转染3 μg VSV-G质粒和8 μg HIV-1wt、HIV-1IN-G140S,Q148H或HIV-1RT-D67N,K70R,T215F质粒到293T细胞。转染16 h后,用PBS冲洗细胞并换新鲜培养基继续培养32 h。收集上清液,经0.45 μm滤膜过 滤后,分装并 -80 ℃保存。生成野生型及耐药型重组病毒颗粒VSVG/HIV-1wt、VSVG/HIV-1IN-G140S,Q148H和VSVG/HIV-1RT-D67N,K70R,T215F。
VSVG/HIV-1重组病毒p24抗原测定[12]分别倍比稀释VSVG/HIV-1wt、VSVG/HIV-1IN-G140S,Q148H和VSVG/HIV-1RT-D67N,K70R,T215F病毒原液,取450 μL病毒稀释液并用50 μL裂解液进行裂解,按p24抗原ElISA试剂盒说明书 (ZeptoMetrix,Cat: 0801111) 测定并计算野生型及耐药型重组病毒液的p24抗原浓度。
化合物对野生或耐药HIV-1抑制活性检测[12]感染前24 h,将293T细胞按6×104/孔密度接种至 24孔板。感染前15 min将化合物加入细胞培养液,同时加入DMSO溶剂作为空白对照,加入0.5 mL病毒液感染 (依据p24浓度将病毒原液稀释至0.1~0.5 ng·mL-1)。感染48 h后,弃去上清液,每孔加入50 μL细胞裂解液 (Promega),取20 μL细胞裂解产物与 50 μL荧光素酶底物进行反应,用FB12化学发光检测器测定荧光素酶的相对活性。以DMSO为对照,计算不同化合物对野生型及耐药HIV-1复制的半数抑制浓度 (IC50)。
联合用药药效学评价实验设计和数据处理[13]本研究根据周氏中效模型原理制定联合用药实验方案,即评价两个或两个以上药物联合应用的抗HIV-1体 外药效学时,主要评价参数为联合指数 (combination index,CI) 和剂量降低指数 (drug reduction index,DRI)。其中CI值是联合用药方式评价参数。当CI = 1时,药效为加和作用; CI > 1时,药物间相互拮抗; CI < 1时,药物间相互协同,且CI值越小,药物间协同效应越强 (表 3)。DRI是指达到同一效应时药物 联合使用的剂量比单独使用剂量降低的倍数,该值越大表示联合用药时药物剂量降低越多,可降低相应药物副作用的发生和减慢耐药病毒的产生。
|
|
Table 3 Description and symbols of synergism or antagonism in drug combination studies analyzed with CI method[13] |
应用VSVG/HIV-1wt模型进行联合用药药效学评价方法如下: 首先测定单个药物对VSVG/HIV-1wt复制的半数抑制浓度 (IC50),测定方法同前。根据联合给药方案中不同药物的IC50比例进行混合配制 (本文中药物组合IC50比例为组合内各个药物的IC50浓度单位统一为nmol·L-1后的绝对数字比例,即未约分),给药剂量倍比稀释,设置为4×IC50、2×IC50、IC50、0.5× IC50、0.25×IC50、0.125×IC50、0.062 5×IC50,测定以上混合药物浓度下的VSVG/HIV-1wt复制抑制率。同次实验需同时测定单个药物在8×IC50、4×IC50、2×IC50、IC50、0.5×IC50、0.25×IC50、0.125×IC50剂量下的VSVG/ HIV-1wt复制抑制率。应用CompuSyn软件(version 1.0,Ting-Chao Chou; Nick Martin) 处理实验数据,将单个药物及混合药物不同浓度下的抑制率输入软件,浓度单位统一为nmol·L-1,软件自动绘制出联合用药的量效曲线、联合指数-剂量图和剂量降低指数-剂量图,并计算药物的IC50、CI和DRI。应用VSVG/ HIV-1IN-G140S,Q148H和VSVG/HIV-1RT-D67N,K70R,T215F模型进行联合用药药效学评价方法同VSVG/HIV-1wt。
结果 1 VSVG/HIV-1RT-D67N,K70R,T215F对核苷类逆转录酶抑制剂耐药自1987年AZT首次应用于临床以来,FDA共批准了8个核苷类逆转录酶抑制剂,此类药物是HAART的重要组成[4]。由于患者长期使用此类药物,体内已出现多种稳定耐药病毒[8]。本研究以HIV-1RT-D67N,K70R,T215F为代表,该病毒的特点为对AZT和3TC均耐药。作者首先构建了模式病毒并用核苷类逆转录酶抑制剂AZT和3TC进行验证: 以VSVG/HIV-1RT-D67N,K70R,T215F为实验组,VSVG/HIV-1wt为对照组,EFV、NVP和DTG为阴性对照。结果显示,AZT和3TC对野生HIV-1复制的半数抑制浓度分别为4.0和1 300 nmol·L-1; 对HIV-1RT-D67N,K70R,T215F复制的半数抑制浓度分别为45和7 200 nmol·L-1,HIV-1RT-D67N,K70R,T215F对AZT和3TC均产生耐药,其耐药倍数分别为11倍和5.5倍,此 结果与文献报道一致 (表 4)[14]。与核苷类逆转录酶抑制剂结合于逆转录酶催化中心不同,NNRTIs结合在 距离催化中心10 Å的疏水口袋[15],故当催化中心发生突变时,EFV和NVP与逆转录酶的结合能力无显著改变,本结果也显示,VSVG/HIV-1RT-D67N,K70R,T215F对EFV和NVP不耐药; DTG作用于整合酶,逆转录酶突变对DTG抑制活性无显著影响,研究结果显示VSVG/HIV-1RT-D67N,K70R,T215F对DTG不耐药 (表 4)。以上研究结果表明VSVG/HIV-1RT-D67N,K70R,T215F模型构建成功,可用于化合物的药效学评价。
|
|
Table 4 Antiviral susceptibilities of NRTIs against HIV-1RT-D67N,K70R,T215F. aThe experiments were repeated twice. bThe folds changes of IC50 comparing to that of the wild-type HIV-1 |
HIV-1IN-G140S,Q148H是临床最常见的整合酶抑制剂耐药病毒[16],本研究构建了VSVG/HIV-1IN-G140S,Q148H模式病毒,并用现有3种整合酶抑制剂进行验证。以VSVG/HIV-1IN-G140S,Q148H为实验组,VSVG/HIV-1wt为对照组,AZT和3TC为阴性对照。结果显示,RAL、EVG和DTG对野生HIV-1复制的半数抑制浓度分 别为8.0、1.3和1.1 nmol·L-1; 对HIV-1IN-G140S,Q148H的半数抑制浓度分别为1 400、4 100和5.7 nmol·L-1。HIV-1IN-G140S,Q148H对3个药物均产生耐药,其中DTG的耐药倍数 (5.2倍) 显著低于RAL (175倍) 和EVG (3 154倍),本研究所得到的耐药倍数与文献报道一致 (表 5)[17]。而核苷类逆转录酶抑制剂AZT和3TC作用于逆转录酶,对HIV-1wt和HIV-1IN-G140S,Q148H的半数抑制浓度相近,即HIV-1IN-G140S,Q148H对AZT和3TC不耐药 (表 5)。结果表明VSVG/HIV-1IN-G140S,Q148H模型构建成功,可用于化合物的药效学评价。
|
|
Table 5 Antiviral susceptibilities of INIs against HIV-1IN-G140S,Q148H. aThe experiments were repeated twice. bThe folds changes of IC50 comparing to that of the wild-type HIV-1 |
核苷类逆转录酶抑制剂是每种治疗方案所必需,而3TC和AZT是我国抗艾滋病最重要的两个一线药物,本研究在所有的实验方案中均以这两个药物为核苷类逆转录酶抑制剂的代表,与不同NNRTIs (EFV和NVP) 或INIs (DTG和RAL) 进行联合使用,比较其抗野生HIV-1体外药效学。
研究联合用药药效学首先需要确定每种药物的比例,依据表 4和表 5的结果确定各个药物组合在VSVG/HIV-1wt模型中的药物摩尔浓度比为EFV∶3TC∶AZT = 1∶1 500∶8; NVP∶3TC∶AZT = 30∶ 1 500∶8; RAL∶3TC∶AZT = 8∶1 500∶8; DTG∶3TC∶AZT = 1.5∶1 500∶8。在设定药物浓度比例下,在同次实验中测定不同浓度下单个药物及3个药物联合使用的抗HIV-1复制活性 (抑制率),绘制量效曲线,计算CI值和DRI值。结果显示 (图 1),以EFV、NVP、RAL和DTG为基础药物的药物组合,分别在45%、20%、27%、45% 抗野生HIV-1复制活性时药物间表现为弱协同作用,协同效应随抑制活性升高而增强; 各个药物组合中3个药物的DRI值均大于1,其中双核苷类逆转录酶抑制剂3TC和AZT的DRI值随着抑制活性升高而增加,基础药物EFV的DRI值随抑制率升高略有降低,NVP的DRI值随抑制活性升高略有增加,RAL和DTG的DRI值随抑制活性升高而增加,增加幅度3TC > AZT > EFV,3TC > AZT > NVP,3TC> RAL > AZT,3TC > DTG > AZT。
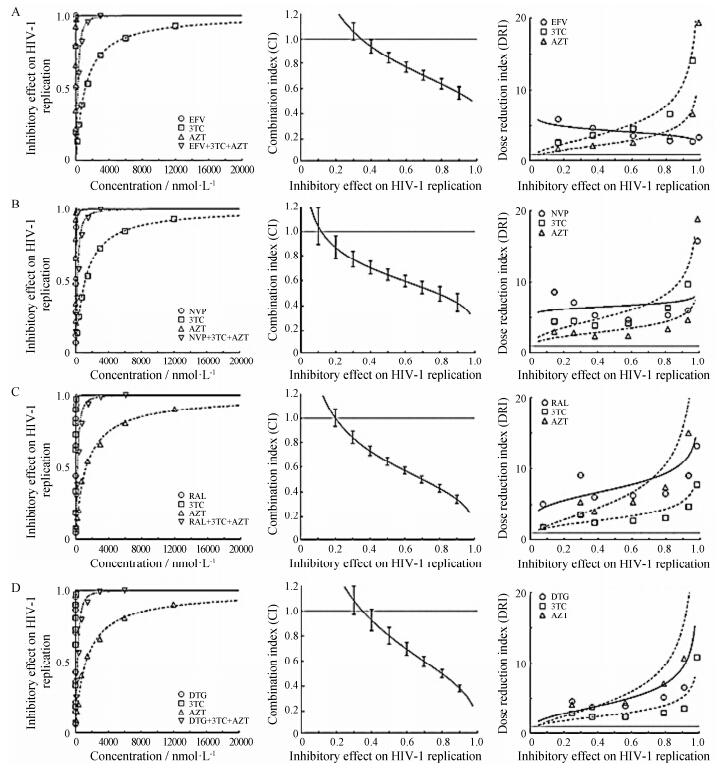
|
Figure 1 Effect of drug-combinations on HIV-1wt replication. From the left to right: the dose-effect curve,the effect-CI plot and the effect-DRI plot of drug-combinations against HIV-1wt,respectively. A: Effect of EFV+3TC+AZT on HIV-1wt replication; B: Effect of NVP+3TC+AZT on HIV-1wt replication; C: Effect of RAL+3TC+AZT on HIV-1wt replication; D: Effect of DTG+3TC+AZT on HIV-1wt replication |
感染类疾病与一般常见病 (如高血压、糖尿病、免疫性疾病等) 不同,病原体感染 (病毒、细菌或真菌) 是致病原因,完全彻底清除或阻断病原体是临床的治疗目的,高抑制率的药物浓度是评价药物药效的重要指标。因此,本研究重点关注95% HIV-1复制抑制时每种药物剂量改变的特点。
在对野生HIV-1复制抑制95% 药效时,以整合 酶抑制剂 (RAL或DTG) 为基础药物的效果优于非核苷类逆转录酶抑制剂 (EFV或NVP),前者药物之间为强协同作用,后者为协同作用 (表 6); 通过分析AZT和3TC的DRI值,整合酶抑制剂 (RAL或DTG) 对AZT的剂量降低幅度与NNRTIs相近; 对3TC的剂量降低幅度高于NNRTIs (表 7)。综合CI和DRI结果,以DTG为基础药物的药物联合使用对野生HIV-1药效优于NNRTIs; 与整合酶抑制剂RAL效果相当。
|
|
Table 6 CIs of drug-combinations against HIV-1wt. aWeighted average CI=[CI50+2CI75+3CI90+4CI95]/10. bSymbols of synergism (+) or antagonism (-) analyzed with CIs |
|
|
Table 7 DRIs of drug-combinations against HIV-1wt |
本研究以HIV-1RT-D67N,K70R,T215F为例,考察了不同药物组合对核苷类逆转录酶抑制剂耐药病毒联合用药体外药效学。依据表 4和表 5的结果确定在VSVG/HIV-1RT-D67N,K70R,T215F模型中各个药物组合的药物摩尔浓度比例为EFV∶3TC∶AZT = 1∶7 000∶45; NVP∶3TC∶AZT = 25∶7 000∶45; DTG∶3TC∶AZT = 1.5∶7 000∶45。在设定药物浓度比例下,在同次实验中测定不同浓度下单个药物及3个药物联合使用抗HIV-1RT-D67N,K70R,T215F复制活性 (抑制率),绘制量效曲线,计算CI值和DRI值。结果显示 (图 2),在以EFV、NVP和DTG为基础药物的药物组合中,分别在30%、32%、40% 抗HIV-1RT-D67N,K70R,T215F复制活性时药物间表现出弱协同作用,协同效应随抑制活性升高而增强; 各个药物组合中3个药物的DRI值均大于1,其中3TC和AZT的DRI值随着抑制活性升高显著增加,EFV和NVP的DRI值随抑制率升高略有增加,DTG增加幅度略高于EFV和NVP,增加幅度3TC > AZT > EFV,3TC > AZT > NVP,3TC> AZT > DTG。
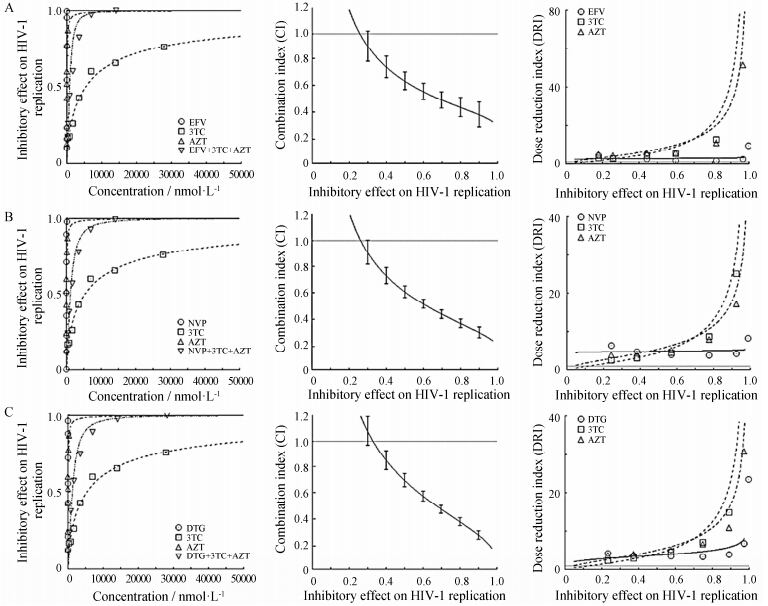
|
Figure 2 Effect of drug-combinations on HIV-1RT-D67N,K70R,T215F replication. From the left to right: the dose-effect curve,the effect-CI plot and the effect-DRI plot of drug-combinations against HIV-1RT-D67N,K70R,T215F,respectively. A: Effect of EFV+3TC+AZT on HIV-1RT-D67N,K70R,T215F replication; B: Effect of NVP+3TC+AZT on HIV-1RT-D67N,K70R,T215F replication; C: Effect of DTG+3TC+AZT on HIV-1RT-D67N,K70R,T215F replication |
在对HIV-1RT-D67N,K70R,T215F复制抑制95% 药效时,当以DTG为代表的整合酶抑制剂作为基础药物时,3个药物表现为强协同作用,协同效果优于EFV的 联合使用效果 (协同作用),与NVP的联合使用效果 (强协同作用) 相当 (表 8); 通过分析AZT和3TC的DRI值,DTG对AZT和3TC的剂量降低幅度与NVP相近,低于EFV (表 9)。综合CI和DRI结果,认为以DTG为基础药物对核苷类逆转录酶抑制剂耐药HIV-1复制的药效与EFV和NVP相近。
|
|
Table 8 CIs of drug-combinations against HIV-1RT-D67N,K70R,T215F. aWeighted average CI=[CI50+2CI75+3CI90+4CI95]/10. bSymbols of synergism (+) or antagonism (-) analyzed with CIs |
|
|
Table 9 DRIs of drug-combinations against HIV-1RT-D67N,K70R,T215F |
本研究以HIV-1IN-G140S,Q148H为例,考察了以 DTG和RAL为基础药物对整合酶抑制剂耐药病毒 联合用药体外药效学。依据表 4和表 5的结果确定 在HIV-1IN-G140S,Q148H模型中的药物摩尔浓度比例为RAL∶3TC∶AZT = 2 000∶1 500∶8; DTG∶3TC∶AZT = 6∶1 500∶8。在设定药物浓度比例下,在同次实验中测定不同浓度下单个药物及3个药物联合使用抗HIV-1复制活性 (抑制率),绘制量效曲线,计算CI值和DRI值。结果显示 (图 3),在以RAL和DTG为基础药物的药物组合中,分别在35% 和25% 抗HIV-1IN-G140S,Q148H复制活性时药物间表现出弱协同作用,协同效应随抑制活性升高而增强; 各个药物组合中3个药物的DRI值均大于1,且DRI值随抑制活 性升高而增加,增加幅度RAL > 3TC > AZT,DTG > 3TC > AZT。
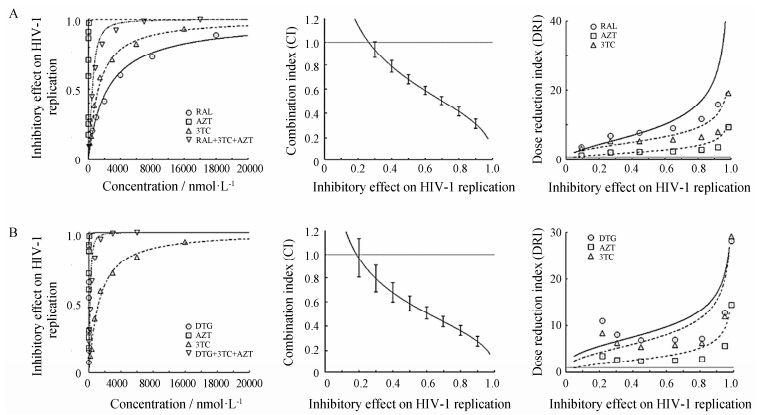
|
Figure 3 Effect of drug-combinations on HIV-1IN-G140S,Q148H replication. From the left to right: the dose-effect curve,the effect-CI plot and the effect-DRI plot of drug-combinations against HIV-1IN-G140S,Q148H,respectively. A: Effect of RAL+3TC+AZT on HIV-1IN-G140S,Q148H replication; B: Effect of DTG+3TC+AZT on HIV-1IN-G140S,Q148H replication |
在对HIV-1 IN-G140S,Q148H复制抑制95% 药效时,DTG和RAL均显示为强协同作用 (表 10); 通过分析AZT和3TC的DRI值,DTG对AZT和3TC剂量降低幅度高于RAL (表 11)。另外,需要指出HIV-1IN-G140S,Q148H对DTG的耐药倍数显著低于RAL。综合分析,认为以DTG为基础药物的抗整合酶抑制剂耐药HIV-1药效优于RAL。
|
|
Table 10 CIs of drug-combinations against HIV-1IN-G140S,Q148H. aWeighted average CI=[CI50+2CI75+3CI90+4CI95]/10. bSymbols of synergism (+) or antagonism (-) analyzed with CIs |
|
|
Table 11 DRIs of drug-combinations against HIV-1-G140S,Q148HIN |
本研究通过应用野生、核苷类逆转录酶抑制剂耐药和整合酶抑制剂耐药HIV-1重组病毒体外模型,比较了以整合酶抑制DTG与RAL以及DTG与两个非核苷类逆转录酶抑制剂 (EFV和NVP) 为基础药物的抗HIV-1体外联合用药药效学,结果显示以DTG为基础药物的药物联合使用对野生HIV-1药效优于
NNRTIs,与RAL效果相当; 以DTG为基础药物对核苷类逆转录酶抑制剂耐药HIV-1复制的药效与EFV和NVP相近; 以DTG为基础药物的抗整合酶抑制剂耐药HIV-1药效优于RAL。
通过药物作用环节对联合用药药效学分析,认为以DTG为基础药物的药物联合使用对野生HIV-1药效优于NNRTIs的可能原因为[4]: 核苷类逆转录酶抑制剂与NNRTIs联合使用只作用于病毒RNA逆转录过程,而与INIs联合使用作用于病毒RNA逆转录和前病毒DNA形成两个过程,当后两者联合使用时,核苷类逆转录酶抑制剂能提高INIs药物与HIV-1双链DNA靶点的比例,有利于INIs更好地发挥抗HIV-1作用; 有研究证明整合酶是病毒逆转录所必需的,该酶可能与逆转录酶或逆转录起始复合物成分存在直接的相互作用,因此,INIs和核苷类逆转录酶抑制剂联合使用的协同效应更强。DTG和RAL作用机制相似,两者与核苷类逆转录酶抑制剂的联合使用的抗野生HIV-1药效相近。
从药物副作用方面分析,EFV的常见副作用 (发生率 > 5%) 为皮疹和神经精神病学不良反应; NVP的常见副作用 (发生率15%) 为皮疹; RAL的常见副作用 (发生率 ≥ 2%) 为失眠、头痛、眩晕、恶心和乏力; DTG的常见副作用 (发生率 > 2%) 仅为头痛、失眠[18],病人依从性较好。从耐药情况方面分析,临床上NNRTIs (主要由EFV和NVP引起) 的耐药发生几率为21.6%[9],INIs (主要由RAL和EVG引起) 的耐药发生几率为3.2%[16],DTG对目前临床上整合酶抑制剂耐药病毒具有很好的抑制作用,并且该药物本身具有较高的耐药屏障[19]。因此,综合安全性、有效性及耐药情况分析,以DTG为基础药物的临床治疗效果可能优于我国现有一线治疗方案。
本研究明确了DTG联合用药的体外药效学,以该药物为基础药物的抗野生HIV-1药效优于NNRTIs,与RAL效果相当; 抗核苷类逆转录酶抑制剂耐药HIV-1药效与EFV和NVP相近; 抗整合酶抑制剂耐药HIV-1药效优于RAL。研究结果为临床选择药物提供了实验数据,应用本研究方法可安全快速构建与临床出现的耐药病毒突变位点完全一致的模式病毒,确定最佳联合用药治疗方案。
| [1] | Sepkowitz KA. AIDS-the first 20 years [J]. N Engl J Med, 2001, 344: 1764-1772. |
| [2] | Cunningham AL, Donaghy H, Harman AN, et al. Manipulation of dendritic cell function by viruses [J]. Curr Opin Microbiol, 2010, 13: 524-529. |
| [3] | Ramana LN, Anand AR, Sethuraman S, et al. Targeting strategies for delivery of anti-HIV drugs [J]. J Control Release, 2014, 192C: 271-283. |
| [4] | Kulkarni R, Hluhanich R, McColl DM, et al. The combined anti-HIV-1 activity of emtricitabine and tenofovir with the integrase inhibitors elvitegravir or raltegravir show high levels of synergy in vitro [J]. Antimicrob Agents Chemother, 2014, 58: 6145-6150. |
| [5] | World Health Organization. Consolidated Guidelines on the Use of Antiretroviral Drugs for Treating and Preventing HIV Infection [S]. Geneva: WHO Press, 2013: 28-30. |
| [6] | Zhang FJ, Wang J, Wang FS, et al. The National Free Antiretroviral Treatment of AIDS Handbook (国家免费艾滋 病抗病毒药物治疗手册) [M]. 3rd ed. Beijing: People's Medical Publishing House, 2012: 55. |
| [7] | Whitney JB, Lim SY, Wainberg MA. Evolutionary mechanisms of retroviral persistence [J]. AIDS Rev, 2011, 13: 234-239. |
| [8] | Wainberg MA, Zaharatos GJ, Brenner BG. Development of antiretroviral drug resistance [J]. N Engl J Med, 2011, 365: 637-646. |
| [9] | Stanford University. NNRTI mutation pattern & susceptibility [EB/OL]. 2014-09-03. http://hivdb.stanford.edu/pages/pheno Summary/Pheno.NNRTI.Simple.html. |
| [10] | Pommier Y, Marchand C, Neamati N. Retroviral integrase inhibitors year 2000: update and perspectives [J]. Antivir Res, 2000, 47: 139-148. |
| [11] | Cao YL, Li SX, Chen H, et al. Establishment of pharmacological evaluation system for non-nucleoside reverse-transcriptase inhibitors resistant HIV-1 [J]. Acta Pharm Sin (药学学报), 2009, 44: 355-361. |
| [12] | Cao YL, Guo Y. Screening of HIV-1 replication inhibitors by using pseudotyped virus system [J]. Acta Pharm Sin (药学学报), 2008, 43: 253-258. |
| [13] | Chou TC. Theoretical basis, experimental design and computerized simulation of synergism and antagonism in drug combination studies [J]. Pharmacol Rev, 2006, 58: 621-681. |
| [14] | Brehm JH, Koontz D, Meteer JD, et al. Selection of mutations in the connection and RNase H domains of human immunodeficiency virus type 1 reverse transcriptase that increases resistance to 3′-azido-3′-dideoxythymidine [J]. J Virol, 2007, 81: 7852-7859. |
| [15] | Rawal RK, Murugesan V, Katti SB. Structure-activity relationship studies on clinically relevant HIV-1 NNRTIs [J]. Curr Med Chem, 2012, 19: 5364-5380. |
| [16] | Stanford University. INI mutation pattern & susceptibility [EB/OL]. 2014-09-03. http://hivdb.stanford.edu/pages/pheno Summary/Pheno.INI.Simple.html. |
| [17] | Kobayashi M, Yoshinaga T, Seki T, et al. In vitro antiretroviral properties of S/GSK1349572, a next-generation HIV integrase inhibitor [J]. Antimicrob Agents Chemother, 2011, 55: 813-821. |
| [18] | FDA. Antiretroviral drugs used in the treatment of HIV infection [EB/OL]. 2014-09-03. http://www.fda.gov/forpatients/illness/hivaids/treatment/ucm118915.htm. |
| [19] | Karmon SL, Markowitz M. Next-generation integrase inhibitors [J]. Drugs, 2013, 73: 213-228. |
 2015, Vol. 50
2015, Vol. 50


