2. 中国药科大学, 江苏 南京 210009
2. China Pharmaceutical University, Nanjing 210009, China
近年来研究发现,炎症反应参与了动脉粥样硬化 (atherosclerosis,AS) 发生、发展的全过程,其中血液中单核细胞黏附于血管内皮并进入内膜下形成泡沫细胞是AS发生发展的关键环节,而黏附分子在这一过程中起着决定性作用[1]。血管内皮细胞黏附分子-1 (vascular cell adhesion molecule-1,VCAM-1) 是主要表达于血管内皮细胞表面的诱导型黏附分子,可介导单核细胞牢固地黏附于血管内皮并进入内膜下[2]。VCAM-1表达是单核细胞向内膜下募集的关键环节,其表达水平与内膜下泡沫细胞聚集量密切相关,减少VCAM-1表达可有效抑制单核-内皮细胞黏附,延缓AS发生和发展[3, 4],提示抑制VCAM-1表 达可能是防治AS的有效途径之一。
番红花酸为中药番红花主要活性成分之一,具有与番红花相似的抗氧化、抗凝血等多种药理作 用,前期研究表明番红花酸具有显著抗AS作用[5],但对其确切机制目前仍未完全阐明。本研究采用体 外培养的人脐静脉内皮细胞 (human umbilical vein endothelial cells,HUVECs),观察番红花酸对血管紧张素Ⅱ (angiotensin Ⅱ,AngⅡ) 诱导的VCAM-1表达和单核-内皮细胞黏附的影响并探讨其可能机制,以进一步阐明番红花酸抗AS作用机制。
材料与方法 药品、试剂与仪器番红花酸 (> 98%),成都瑞芬思生物科技有限公司; M199、RPMI 1640培养基、Ⅰ型胶原酶,Gibco公司; 胎牛血清,Hyclone公司; AngⅡ、二乙酰二氯荧光素 (DCFH-DA),Sigma公 司; VCAM-1、核因子κB (NF-κB) 抗体 (p65),Santa Cruz公司; actin抗体、二抗、胰酶、超氧化物歧化酶 (superoxide dismutase,SOD)、总抗氧化能力 (total antioxidant capacity,TAC) 检测试剂盒,碧云天生物技术研究所; 人单核细胞株 (THP-1) 购于武汉大学中国典型培养物保藏中心; 其余试剂皆为分析纯。酶联免疫检测仪,Bio-Rad; 荧光免疫分析仪,PerkinElmer公司; 荧光倒置显微镜,Olympus公司。
HUVECs分离、培养无菌条件下取新鲜脐带15~20 cm,磷酸盐缓冲液 (PBS) 冲洗静脉腔,注入37 ℃预热的Ⅰ型胶原酶溶液 (0.1%),室温消化20 min,收集内皮细胞悬液,1 000 r·min-1离心10 min。弃上 清液,加入含20% 胎牛血清的M199培养液悬浮细 胞,置于5% CO2、37 ℃培养箱培养,每两天更换一次培养液。待细胞生长至近融合时,0.25% 胰酶消化后传代培养。实验采用第2~5代细胞。
单核-内皮细胞黏附实验将生长近融合的HUVECs用0.25% 胰酶消化后,按细胞数2×105/孔接种于24孔培养板,待细胞长至融合状态时,按下列方法分组并进行相应处理: 对照组、AngⅡ组和番红花酸组 (0.1,1,10 μmol·L-1)。番红花酸各组分别加入相应浓度番红花酸,对照组和AngⅡ组加入相应溶剂,37 ℃孵育24 h,更换培养液,AngⅡ组和番红花酸 组再加入AngⅡ (0.1 μmol·L-1),对照组加入相应溶剂,37 ℃孵育12 h。弃培养液,PBS洗涤,每孔加入含单核细胞 (1×106/mL) 的RPMI 1640培养液500 μL,37 ℃孵育2 h,弃培养液,PBS洗去未黏附的单核细胞。参照文献方法[6],每孔随机选择6个不同视野 (×100),记数黏附的单核细胞,取均值,每组6孔。
VCAM-1蛋白表达检测VCAM-1蛋白表达采用ELISA方法检测。将生长近融合的HUVECs用0.25% 胰酶消化后,按细胞数2×104/孔接种于96孔培养板,细胞分组及药物处理同“单核-内皮细胞黏附实验”项下。在加入AngⅡ (0.1 μmol·L-1) 孵育12 h后,弃培养液,PBS洗涤,0.25% 戊二醛固定20 min,5% 脱脂奶封闭2 h; 加入抗VCAM-1抗体(1∶500) 50 μL,4 ℃放置过夜,PBS洗涤; 再加入辣根过氧化物酶标记的二抗 (1∶500) 100 μL,37 ℃孵育1 h,蒸馏水洗涤; 加入DAB显色液100 μL,室温、避光显色20 min,加入4 mol·L-1 H2SO4 50 μL终止反应,采用酶标仪测定450 nm处吸光度。
NF-κB活化水平检测NF-κB活化采用免疫细胞化学方法检测。将灭菌后的盖玻片置24孔培养板中,采用细胞爬片方法使HUVECs生长于盖玻片上,细胞分组及药物处理同上。加入AngⅡ (0.1 μmol·L-1) 孵育2 h,弃培养液,PBS洗涤后4% 多聚甲醛固定 30 min。取出盖玻片,3% 过氧化氢溶液浸泡10 min灭活内源性过氧化物酶,20% 山羊血清室温封闭30 min。滴加抗p-NF-κB (p65) 单克隆抗体,4 ℃放置过夜。滴加生物素化二抗,室温孵育30 min; PBS洗涤,滴加辣根过氧化物酶标记的链霉菌抗生物素蛋白,室温放置30 min; PBS洗涤,DAB显色,每个样本随机选择5个视野,显微成像系统拍照,采用图像分析仪测定光密度。
细胞内活性氧 (ROS) 水平测定细胞内ROS采用荧光染料DCFH-DA检测。将生长近融合的HUVECs用0.25% 胰酶消化后,按细胞数2×104/孔接种于96孔培养板,细胞分组及药物处理同上。更换含DCFH-DA的无血清培养液 (10 μmol·L-1),孵育20 min,弃培养液,PBS洗涤3次,加入新鲜培养液 和AngⅡ (0.1 μmol·L-1),孵育1 h后,弃培养液,PBS洗涤,加入0.5 mol·L-1 NaOH溶液200 μL裂解细 胞,采用荧光免疫分析仪测定各孔荧光强度 (激发波长485 nm,发射波长525 nm)。
HUVECs抗氧化能力测定生长近融合的HUVECs用0.25% 胰酶消化后,按细胞数1×106/孔接种于6孔培养板,细胞分组及药物处理同“单核-内皮细胞黏附实验”项下。在加入AngⅡ (0.1 μmol·L-1) 孵育12 h后,弃培养液,洗涤后加入PBS,刮下细胞后采用超声细胞破碎仪裂解细胞,12 000×g离心10 min,收集上清液,按试剂盒说明测定细胞TAC、SOD活性,BCA法测定蛋白含量。
统计学处理数据以均数 ± 标准差 (x± s) 表示,组间比较应用单因素方差分析和LSD法,采用SPSS21.0统计软件包进行处理,以P < 0.05为差异具有统计学意义。
结果 1 番红花酸对单核-内皮细胞黏附的影响正常情况下,单核-内皮细胞黏附较少,但与AngⅡ孵育12 h后,黏附于HUVECs的单核细胞数 显著增加 (P < 0.01),而与番红花酸预孵能明显抑制AngⅡ诱导的单核-内皮细胞黏附 (P < 0.05,P < 0.01)。见图 1。
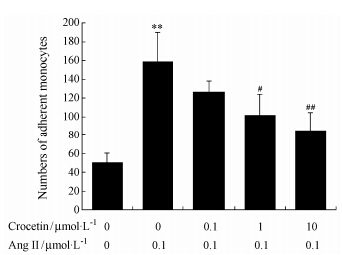
|
Figure 1 Effect of crocetin on AngⅡ-induced monocyte- endothelial cell adhesion. After pretreatment with crocetin for 24 h,HUVECs were stimulated with AngⅡ (0.1 μmol·L-1) for 12 h,followed by incubation with monocytes for 2 h. Monocytes adherent to HUVECs in 6 randomly selected fields under microscope were counted and averaged. n = 6,x± s. **P < 0.01 vs control group; #P < 0.05,##P < 0.01 vs AngⅡ group. AngⅡ: Angiotensin Ⅱ; HUVECs: Human umbilical vein endothelial cells |
对照组内皮细胞VCAM-1表达量很少,而AngⅡ(0.1 μmol·L-1) 刺激12 h后,其蛋白表达水平显著升高 (P < 0.01); 1和10 μmol·L-1番红花酸可明显抑制AngⅡ诱导的VCAM-1蛋白表达 (P < 0.05,P < 0.01),见图 2。此结果与番红花酸抑制单核-内皮细胞黏附作用基本一致,提示番红花酸抑制AngⅡ诱导的单 核-内皮细胞黏附与下调VCAM-1表达有关。

|
Figure 2 Effect of crocetin on AngⅡ-induced VCAM-1 protein expression in HUVECs. HUVECs were preincubated with crocetin for 24 h,followed by stimulation with AngⅡ (0.1 μmol·L-1) for 12 h. Expression of VCAM-1 protein was determined by cell ELISA. n = 6,x± s. **P < 0.01 vs control group; #P < 0.05,##P < 0.01 vs AngⅡ group. VCAM-1: Vascular cell adhesion molecule-1 |
静息状态下,HUVECs内NF-κB活化水平极低 (图 3A),而AngⅡ刺激2 h后,NF-κB活化明显增 加(图 3B),且主要位于细胞核,部分胞浆中也可见活化的NF-κB; 在与不同浓度番红花酸预孵24 h后,NF-κB活化均明显减少 (图 3C、D、E)。此作用与番红花酸抑制VCAM-1表达及单核-内皮细胞黏附作用基本一致,提示番红花酸减少单核-内皮细胞黏附与抑制NF-κB活化继而减少VCAM-1表达有关。

|
Figure 3 Representative photomicrographs of immunocytochemical examination of NF-κB activation (A-E). Confluent HUVECs were pretreated with crocetin for 24 h,followed by stimulation with AngⅡ (0.1 μmol·L-1) for 2 h. Cells were subjected to immunocytochemical examination as described in the methods. A: Control; B: AngⅡ; C: Crocetin 0.1 μmol·L-1; D: Crocetin 1 μmol·L-1; E: Crocetin 10 μmol·L-1 (×200). F: Quantitative analysis of immunocytochemical staining. Results were presented as percentage of the optical density in control group. n = 4,x± s. **P < 0.01 vs control group; ##P < 0.01 vs AngⅡ group. NF-κB: Nuclear factor kappa B |
与AngⅡ (0.1 μmol·L-1) 孵育1 h后,细胞内ROS水平显著升高 (P < 0.01),而与番红花酸预孵能明显降低细胞内ROS水平 (P < 0.05,P < 0.01)。见表 1。
|
|
Table 1 Effect of crocetin on AngⅡ-induced ROS generation in HUVECs. Confluent cells were preincubated with crocetin for 24 h,followed by stimulation with AngⅡ (0.1 μmol·L-1) for 1 h. Intracellular ROS was quantified with a fluorescent probe DCFH-DA (10 μmol·L-1). n = 6,x± s. **P < 0.01 vs control group; #P < 0.05,##P < 0.01 vs AngⅡgroup. ROS: Reactive oxygen species; HUVECs: Human umbilical vein endothelial cells |
由表 2可见,与AngⅡ孵育12 h后,HUVECs细胞内总抗氧化能力及SOD活性均明显下降,提示与AngⅡ孵育后细胞内抗氧化体系明显受损,此结果与AngⅡ明显增加胞内ROS水平一致。与番红花酸预孵后,细胞内总抗氧化能力和抗氧化酶活性均显著升高,提示番红花酸可明显提高HUVECs抗氧化能力,降低细胞内ROS水平。
|
|
Table 2 Effect of crocetin on TAC and SOD activity in HUVECs. Following preincubation with crocetin for 24 h,HUVECs were exposed to AngⅡ (0.1 μmol·L-1) for 12 h. Cell lysates were examined for TAC and SOD activity using commercially available kits. n = 6,x± s. **P < 0.01 vs control group; #P < 0.05,##P < 0.01 vs AngⅡgroup. TAC: Total antioxidant capacity; SOD: Superoxide dismutase |
VCAM-1是主要表达于血管内皮细胞表面的诱导型黏附分子,是单核细胞黏附于血管内皮并进入内膜下的关键介质,多种AS危险因素可通过诱导VCAM-1表达而启动AS进程[7]。大量研究表明,AS危险因 素高血压、糖尿病等均可引起肾素血管紧张素系统 (RAS) 过度激活、循环及血管局部AngⅡ水平均明显升高,诱导血管内皮细胞VCAM-1表达明显上调,而应用血管紧张素转化酶抑制剂 (ACEI) 及AngⅡ受体拮抗剂均可有效抑制内皮细胞VCAM-1表达,减少血管壁单核-巨噬细胞浸润和泡沫细胞沉积,延缓AS发生和发展[8],提示抑制VCAM-1表达可能是防治AS的有效措施之一。本研究结果显示,与AngⅡ孵育12 h后,HUVECs表达的VCAM-1水平显著升高,其表面黏附的单核细胞也明显增加,而番红花酸能显著抑制VCAM-1表达,减少单核细胞黏附,此结果与番红花酸减少家兔血管壁单核-巨噬细胞浸润、减轻AS作用一致[9],提示番红花酸抗AS作用可能与抑制VCAM-1表达、减少单核细胞进入内膜下有关。
大量研究表明,VCAM-1等黏附分子的表达在基因转录水平受NF-κB调控[10]。正常状态下,细胞中的NF-κB与其抑制物IκB (inhibitor kappa B) 结合,以无活性形式存在于胞浆中。当细胞受到AngⅡ及ROS等刺激时,细胞内的IκB激酶 (inhibitor kappa B kinase,IKK) 被激活,后者可使IκB磷酸化而解离,NF-κB的核定位信号暴露出来并迅速发生核移位,启动基因转录[11]。作为氧化还原敏感性转录因子,NF-κB的活化受细胞内氧化还原状态调控,ROS可诱导NF-κB活化,促进VCAM-1表达[12],而此作用可被抗氧化剂有效抑制[13],这些结果为使用抗氧化剂防治AS提供了依据。本研究显示,AngⅡ可明显增加HUVECs胞内ROS水平,诱导NF-κB活化,此作用与其上调VCAM-1表达、增加单核-内皮细胞黏附作用一致。而在与番红花酸预孵后,细胞内ROS水平明显下降,NF-κB活化水平显著下降,提示番红花酸抑制VCAM-1表达和单核内皮细胞黏附与降低ROS水平进而抑制NF-κB活化有关。此外,本研究显示,番红花酸可明显提高细胞SOD活性,增强细胞总抗氧化能力,有助于增强细胞ROS清除能力。由于番红花酸对AngⅡ诱导的烟酰胺腺嘌呤二核苷酸磷酸 (NADPH) 氧化酶活性无明显影响[14],而后者是细胞内源性ROS的主要来源,提示番红花酸可能主要通过增强ROS清除能力而降低细胞内ROS水平。
综上所述,番红花酸可明显抑制AngⅡ诱导的单核-内皮细胞黏附,其机制与减少细胞内ROS水平,进而抑制NF-κB活化和VCAM-1表达有关,这一作用可能是番红花酸抗AS的主要机制之一。
| [1] | Jaipersad AS, Lip GYH, Silverman S, et al. The role of monocytes in angiogenesis and atherosclerosis [J]. J Am Coll Cardiol, 2014, 63: 1-11. |
| [2] | Blankenberg S, Barbaux S, Tiret L. Adhesion molecules and atherosclerosis [J]. Atherosclerosis, 2003, 170: 191-203. |
| [3] | Gai YT, Shu Q, Chen CX, et al. Anti-atherosclerosis role of N-oleoylethanolamine in CB2 [J]. Acta Pharm Sin (药学学报), 2014, 49: 316-321. |
| [4] | Park JG, Ryu SY, Jung IH, et al. Evaluation of VCAM-1 antibodies as therapeutic agent for atherosclerosis in apolipoprotein E-deficient mice [J]. Atherosclerosis, 2013, 226: 356-363. |
| [5] | Zheng SG, Qian ZY, Tang FT, et al. Suppression of vascular cell adhesion molecule-1 expression by crocetin contributes to attenuation of atherosclerosis in hypercholesterolemic rabbits [J]. Biochem Pharmacol, 2005, 70: 1192-1199. |
| [6] | Li DY, Mehta JL. Antisense to LOX-1 inhibits oxidized LDL-mediated upregulation of monocyte chemoattractant protein-1 and monocyte adhesion to human coronary artery endothelial cells [J]. Circulation, 2000, 101: 2889-2895. |
| [7] | Libby P. Inflammation in atherosclerosis [J]. Nature, 2002, 420: 868-874. |
| [8] | Pacurari M, Kafoury R, Tchounwou PB, et al. The renin-angiotensin-aldosterone system in vascular inflammation and remodeling [J]. Int J Inflam, 2014, doi: 10.1155/2014/689360. |
| [9] | Zheng SG, Qian ZY, Sheng L, et al. Crocetin attenuates atherosclerosis in hyperlipidemic rabbits through inhibition of LDL oxidation [J]. J Cardiovasc Pharmacol, 2006, 47: 70- 76. |
| [10] | Zhu YP, Shen T, Lin YJ, et al. Astragalus polysaccharides suppress ICAM-1 and VCAM-1 expression in TNF-α-treated human vascular endothelial cells by blocking NF-κB activation [J]. Acta Pharmacol Sin, 2013, 34: 1036-1042. |
| [11] | Pateras I, Giaginis C, Tsigris C, et al. NF-κB at the crossroads of inflammation and atherosclerosis: searching for new therapeutic links [J]. Expert Opin Ther Targets, 2014, 8: 1-13. |
| [12] | Van der Heiden K, Cuhlmann S, Luong le A, et al. Role of nuclear factor κB in cardiovascular health and disease [J]. Clin Sci, 2010, 118: 593-605. |
| [13] | Liang CJ, Wang SH, Chen YH, et al. Viscolin reduces VCAM-1 expression in TNF-α-treated endothelial cells via the JNK/NF-κB and ROS pathway [J]. Free Radic Biol Med, 2011, 51: 1337-1346. |
| [14] | Zheng SG, Qian ZY, Wen N, et al. Crocetin suppresses angiotensin Ⅱ-induced vascular smooth-muscle cell proliferation through inhibition of ERK1/2 activation and cell-cycle progression [J]. J Cardiovasc Pharmacol, 2007, 50: 519- 525. |
 2015, Vol. 50
2015, Vol. 50


