2. 中国中医科学院 医学实验中心, 北京 100700
2. The Experimental Research Center, China Academy of Chinese Medical Sciences, Beijing 100700, China
溃疡性结肠炎 (ulcerative colitis,UC) 是一种病因尚不十分清楚的慢性非特异性炎症疾病。临床表现为腹痛、腹泻、里急后重、黏液脓血便等[1]。UC的常规治疗药存在停药后易复发,长期用药副反应多,部分顽固性病例疗效不理想等缺点[2]。黄芩汤是《伤寒论》中经典治痢名方,由黄芩、芍药、甘草和大枣配伍而来。课题组前期研究结果显示黄芩汤中主要 含黄酮类和萜类化合物,具有明显的抗炎、解热和镇痛作用[3]。目前临床上应用黄芩汤治疗UC取得了显著疗效[4],但其具体的抗炎作用机制还不清楚。核因子-κB (nuclear factor kB,NF-κB) 是高度保守的一种转录因子, 能调控多种炎症细胞因子基因的表达[5, 6]。已有研究[7]显示NF-κB与炎症性肠病密切相关。本实验通过观察黄芩汤对UC大鼠结肠组织NF-κB p65蛋白表达及血清细胞因子的影响,探讨其治疗UC的可能作用机制。
材料与方法 动物健康SPF级SD大鼠,雄性,体重180~200 g,由北京维通利华实验动物技术有限公司提供,合格证为SCXK (京) 2012-0001。
药品与试剂黄芩 (Scutellaria baicalensis Georgi)、芍药 (Paeonia lactiflora Pall.)、炙甘草 (Glycyrrhiza uralensis Fisch.)、大枣 (Ziziphus jujuba Mill.) 购自北京同仁堂公司,经中国中医科学院中药研究所李先端研究员鉴定后,储存于本实验室。黄芩汤由上述4味药配伍而成,按本实验室方法制备[8],黄芩、白芍、炙甘草、大枣分别配伍 (9∶6∶6∶6,g),称重后分别用10倍和8倍饮片重量的水煎煮1 h,滤过,滤液合并后用旋转蒸发仪挥去水分,60 ℃真空干燥箱干燥,称重,粉碎成粉末,过筛 (40目) 即得黄芩汤水提物 (HQT) 样品,其质量经指纹图谱相似度和多成分含量分析控制,提取率约为36%,与对照图谱相似系数为0.998,主要含黄酮和萜类化合物,其中主要成分质量分数黄芩苷为10.094%,汉黄芩苷为2.334 3%,千层纸素A-苷为0.953 3%,黄芩素为0.411 4%,汉黄芩素为0.149 8%,千层纸素A为0.093 8%,甘草素二糖苷为0.790 6%,甘草苷为0.344 4%,异甘草素二糖苷为0.036 1%,甘草素为0.032 2%,异甘草苷为0.060 7%,异甘草素为0.003 5%。
柳氮磺胺吡啶肠溶片 (salazosulfapyridine,SASP,批号: 20130506,上海中西三维药业有限公司),2,4,6-三硝基苯磺酸 (TNBS,Sigma公司),IL-6、TNF-α、PGE2 ELISA试剂盒 (上海泛柯实业有限公司),免疫组化及DAB显色试剂盒 (武汉博士德生物工程有限公司),兔抗鼠NF-κB p65单克隆抗体 (CST公司)。
造模方法采用Morris等[9]报道的方法制备大鼠溃疡性结肠炎模型,大鼠禁食24 h后,一次性将TNBS (100 mg·kg-1) 和50% 乙醇溶液0.25 mL用橡胶输液管缓慢注入距肛门约8 cm处的肠腔内,捏紧肛门,倒置几分钟即可。正常组注入相同体积的生理盐水,术后常规饲养。
实验分组及样品采集将造模成功的大鼠按体重随机分为模型组、阳性药SASP组、黄芩汤高、中、低剂量组和正常组,每组7只。造模3天后开始给 药,黄芩汤高、中、低剂量组分别按20、10、5 g·kg-1灌胃给药 (g·kg-1,生药量/大鼠体重,按照临床人用剂量27 g/70 kg/天,大鼠给药剂量相当于临床人用 剂量的7.2、3.6、1.8倍),阳性药SASP混悬液组按0.5 g·kg-1灌胃给药,正常组和模型组给予等剂量的生理盐水,每日1次,连续5天。末次给药后大鼠禁食24 h,第2天各组大鼠眼眶取血,以3 000 r·min-1转速离心15 min,分离血清,置 -20 ℃冰箱冷冻保存。取血完毕后处死大鼠,取出距肛门8 cm处结肠组织,沿肠系膜缘剪开肠腔,用生理盐水冲洗肠内容物,剪成2段,一段置于多聚甲醛溶液内固定,另一段置于中性甲醛溶液内固定,石蜡包埋进行常规病理切片、HE染色及免疫组化染色。
指标检测及方法 外观指标造模前、造模后和给药后分别观察大鼠精神及活动状况,记录饮食量及体重。
病理学指标肉眼及镜下观察结肠组织形态。按常规包埋、切片,厚度为4 μm,进行HE染色,高倍显微镜下选取视野,根据溃疡大小、炎症浸润和结构损伤程度等进行结肠组织病变损伤程度比较[10, 11]。
血清中细胞因子测定NO含量用Griess法测定,IL-6、TNF-α、PGE2含量用ELISA试剂盒测定,具体步骤按试剂盒说明书进行操作。
免疫组化染色各组结肠组织按常规包埋、切片。采用S-P法检测大鼠结肠组织中核因子NF-κB p65蛋白表达。结肠组织用中性甲醛固定24 h后,常规脱水、浸蜡、包埋、切片,然后二甲苯脱蜡,梯度酒精水化,采用复合消化液和抗原修复液进行抗原修复,PBS洗3次,用3% H2O2溶液孵育10 min (去除内 源性过氧化氢酶活性),滴加1∶200浓度的兔抗鼠NF-κB p65单克隆抗体,4 ℃过夜,PBS洗3次,滴加聚合HRP标记抗兔IgG 37 ℃孵育50 min,PBS冲洗,DAB显色,常规脱水,用中性树胶封片。每张切片在高倍镜下 (400×) 随机选取4个视野,以出现棕黄色染色为阳性信号,检测NF-κB p65积分光密度,以均值表示每个标本积分光密度。
统计学方法实验数据用SPSS 19.0统计软件进行分析,数据以± s表示,各组数据间比较采用t检验进行分析,P < 0.05为差异有统计学意义,P < 0.01为差异极具统计学意义。
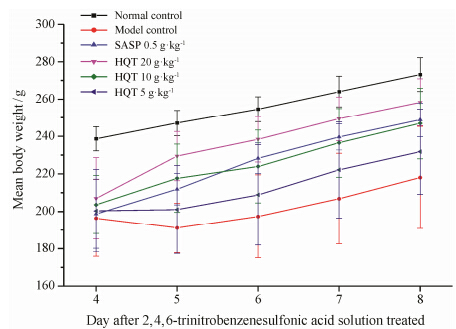
结果 1 黄芩汤对UC大鼠精神活动状况、饮食量及体重的影响造模后,正常组大鼠仅在第1天出现稀便、懒动、竖毛和体重轻度下降症状,第2天即开始恢复,体重持续上升,而模型组大鼠第1天即出现不同程度的血便、稀便、懒动、竖毛、毛泽无光、食量减少和体重下降等症状,此后3天上述症状有不同程度加重。给药后,阳性药SASP组和黄芩汤组上述症状出现不同程度的好转。大鼠饮食量及体重统计结果见图 1、2。

|
Figure 1 Effects of Huangqin Tang (HQT) on food intake of ulcerative colitis rats |
|
Figure 2 Effects of Huangqin Tang (HQT) on body weight of ulcerative colitis rats (n = 7,x± s) |
UC大鼠结肠组织HE染色结果见图 3,高倍镜下各组大鼠结肠组织病变损伤情况比较结果见表 1。

|
Figure 3 Effects of Huangqin Tang (HQT) on colon tissue damage of rats. A: Normal control; B: Model control; C: SASP 0.5 g·kg-1; D: HQT 20 g·kg-1; E: HQT 10 g·kg-1; F: HQT 5 g·kg-1 |
|
|
Table 1 Microscopic damage of colon tissue of rats (10×40). n = 7. “-”: Normal colonic mucosa and colonic mucosal gland structure; “±”: No focal inflammation under the colonic mucosa; “+”: Limited focal inflammation under colonic mucosa gland; “++”: Large inflammatory infiltration under colonic mucosa gland; “+++”: Large inflammatory infiltration under colonic mucosa gland,disappear and loss of normal structure |
肉眼观察大鼠结肠组织: 正常组大鼠结肠外观正常,未见充血,颜色正常,浆膜面、黏膜面和肌层未见有明显病变。模型组大鼠部分结肠明显充血、瘀血,个别肠黏膜颜色呈褐色,直肠部位较重。肠黏膜及肌层明显变薄,粪便有节段性充满肠道,部分味恶臭。模型较严重的个别与周边组织粘连。SASP组大鼠结肠未见明显充血、瘀血,病变明显减轻。黄芩汤3个不同剂量组大鼠结肠充血、瘀血,肠颜色及肌层厚度与模型组相比有不同程度减轻。
镜下观察大鼠结肠组织: 正常组大鼠结肠黏膜完整,黏膜下未见炎症,肌层结构正常。模型组大部分大鼠结肠黏膜有炎症,细胞浸润,结肠腺体消失,被浸润的炎症细胞替代,以单核细胞、淋巴细胞、嗜酸性细胞代替了正常细胞,个别黏膜层明显变薄,个别肌层组织炎症较重,失去了正常结构。SASP组大鼠结肠黏膜炎症浸润,肠腺溃疡,与模型组相比病变明显减轻。黄芩汤3个不同剂量组大鼠结肠黏膜炎症浸润,肠腺溃疡,肌层病变与模型组相比,病变都有明显减轻。
3 黄芩汤对UC大鼠血清中NO、IL-6、TNF-α、PGE2含量的影响大鼠造成UC模型后,连续给药5天后血清中NO、IL-6、TNF-α、PGE2含量变化结果如表 2所示。UC模型组血清中NO、IL-6、TNF-α、PGE2含量均显著高于正常组,黄芩汤高、中、低剂量组血清中的NO含量均显著低于模型组; 对于IL-6、TNF-α、PGE2含量,黄芩汤各剂量组与模型组相比均有降低,其中黄芩汤高、中剂量组与模型组相比有显著性差异; 对于TNF-α指标,黄芩汤高、中、低剂量组呈现明显的量效关系。
|
|
Table 2 Effects of Huangqin Tang (HQT) on concentrations of NO,IL-6,TNF-α and PGE2 after 5 days oral administration on ulcerative colitis rats. n = 7,x± s. P < 0.05,**P < 0.01 vs normal control; △P < 0.05,△△P < 0.01 vs model control |
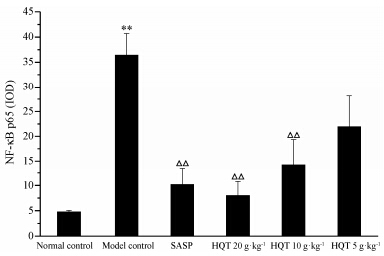
免疫组化检测发现,正常组大鼠结肠组织仅少量细胞胞质内可见黄色颗粒,模型组胞质胞核均可见棕黄色和褐色颗粒,SASP组和黄芩汤高、中、低剂量组与模型组相比细胞核内棕黄色和褐色颗粒均有明显减少,结果见图 4; 各组大鼠结肠组织NF-κB p65的表达量见图 5,黄芩汤高、中、低剂量组NF-κB p65表达与模型组相比均有明显降低,呈现一定的量效关系,其中,黄芩汤高、中剂量组与模型组相比有显著性差异,黄芩汤低剂量无显著性差异。

|
Figure 4 Effects of Huangqin Tang (HQT) on expression of NF-κB p65 protein in colon tissue of rats (×200). A: Normal control; B: Model control; C: SASP 0.5 g·kg-1; D: HQT 20 g·kg-1; E: HQT 10 g·kg-1; F: HQT 5 g·kg-1 |
|
Figure 5 Effects of Huangqin Tang (HQT) on concentration of NF-κB p65 protein in colon tissue of rats. **P < 0.01 vs normal control; △△P < 0.01 vs model control |
黄芩汤临床上广泛用于溃疡性结肠炎、急性胃肠炎、细菌性痢疾等胃肠道疾病的治疗[12, 13]。UC是一种炎症性肠病,发病机制未明确,目前认为是免疫、遗传、环境、微生物、细胞和分子因素共同作用的结果[14]。近年研究发现,免疫因素是UC发生与发展的主因[15],UC的发病涉及到免疫反应的整个过程,是多个免疫因素共同作用的结果。本研究从细胞因子调控以及与炎症密切相关的核转录因子NF-κB的信号通路调控方面探讨黄芩汤对UC的作用机制。
本研究所采用的大鼠UC模型属免疫复合法,相比于化学刺激法、免疫法造模,该模型动物易存活,制作简单,是现在最常用的UC动物模型之一,产生的肠炎模型更接近于人Crohn’S病,适合于炎症性肠病免疫学研究。
研究结果显示,大鼠UC造模后,在外观体征上表现出体重下降、食量下降、不同程度的血便、稀便、懒动、竖毛和毛泽无光等变化,且随时间延长有加重趋势,阳性药SASP组及黄芩汤各剂量组给药过程中外观体征均有明显改变; 病理组织学观察结果显示,相对于模型组大鼠的结肠充血、瘀血、肠颜色、肌层厚度的异常变化以及镜下观察到模型组大鼠结肠黏膜炎症,细胞浸润,结肠腺体消失被浸润的炎症细胞替代,个别黏膜层明显变薄,个别肌层组织炎症较重,失去正常结构的程度,SASP组及黄芩汤不同剂量组大鼠的病变都有明显减轻,说明黄芩汤对UC模型大鼠具有较显著的治疗作用。
细胞因子在肠道免疫反应的调节中起重要作用,促炎细胞因子与抗炎细胞因子失衡被认为是UC重要发病机制之一。NO、IL-6、TNF-α和PGE2等在溃疡性结肠炎的发生和发展中起着重要作用[16, 17, 18]。测定血清中NO、IL-6、TNF-α和PGE2水平可反映溃疡性结肠炎的病情变化,并可作为观察疗效和判断预后的生物学指标之一。细胞因子测定结果显示,UC模型组血清中NO、IL-6、TNF-α和PGE2含量均显 著高于正常组,黄芩汤高、中、低剂量组血清中的NO含量均显著低于模型组; 对于IL-6、TNF-α、PGE2含量,黄芩汤各剂量组与模型组相比均有降低,其 中高、中剂量组与模型组相比有显著性差异; 对于TNF-α指标,黄芩汤高、中、低剂量组呈现明显的量效关系。SASP是治疗溃疡性结肠炎的临床常用药,对于以上细胞因子的影响,黄芩汤各剂量组与SASP组作用大致相当,未见组间有明显差异,说明黄芩汤可减少UC大鼠炎性细胞因子的分泌,减轻肠道炎性反应和黏膜损伤,进而对UC起到治疗作用。
本研究中细胞因子的结果显示,对于TNF-α黄芩汤具有较好的抑制作用,且呈现一定的量效关系,其他3种细胞因子缺乏良好的量效关系,这种药效 量效关系不明显的现象也是中药研究中客观存在的问题。考虑到中药成分复杂,中药的多成分以及方剂配伍后成分变化的复杂性决定了方剂作用的途径是多方面、多靶点的,同一靶器官也可能有多个成分对多个靶点的作用,对某一靶器官的作用也可能会对另一靶器官产生反射性影响。即使以有效部位为受 试物,其成分也相当复杂,虽然其中所含的成分主要为同一类成分,但还有许多不清楚的成分,即使是同一类成分,作用也不会完全相同。另外考虑动物的个体差异、样本数有限等客观原因,在药效学实验中未能出现明显的量效关系是可以理解的。但结果仍可 体现黄芩汤对其的抑制作用。
NF-κB是一种具有多向转录调节作用的转录因子,参与众多炎症反应相关基因的转录调控。NF-κB最常见的形式是由p50和p65亚单位组成的异二聚体,p65亚单位是主要的促炎单位,其活化在UC发病中起关键作用,许多与UC相关的促炎细胞因子都存在NF-κB结合位点。从本研究中大鼠结肠组织NF-κB p65蛋白表达结果可以看出,模型组胞质胞核均可见棕黄色和褐色颗粒提示NF-κB p65表达增加,SASP组和黄芩汤高、中、低剂量组与模型组相比细胞核内棕黄色和褐色颗粒均有明显减少,且各组大鼠结肠组织NF-κB p65的表达量化结果与模型组相比均有明显降低,呈现一定的量效关系,其中,SASP组、黄芩汤高、中剂量组与模型组相比有显著性差异,黄芩汤低剂量无显著性差异。结果显示黄芩汤和SASP对于UC大鼠结肠组织NF-κB p65的表达均具有明显的抑制作用。基于NF-κB对炎性细胞因子的明确调控作用和以上实验结果,抑制NF-κB p65活化,进而下调复杂的促炎细胞因子网络,减轻肠道炎性反应和黏膜损伤,可能是黄芩汤治疗UC发病的重要作用机制之一。
研究发现,黄芩汤的单体成分黄芩素、汉黄芩素、白杨素和千层纸素A等也是通过抑制NF-κB活性起到抗炎作用的[19, 20, 21, 22, 23, 24, 25]。但中药复方是一个复杂的整体,药效物质基础可能是其中的单体成分,更多的是复方中多成分共同作用的结果,所以对于黄芩汤的药效物质基础及作用机制均有待于进一步探讨,以便更好的为临床用药提供参考。
| [1] | Chow DKL, Leong RWL, Tsoi KKF, et al. Long-term follow-up of ulcerative colitis in the Chinese population [J]. Am J Gastroenterol, 2009, 104: 647-654. |
| [2] | Ukil A, Maity S, Das PK. Protection from experimental colitis by theaflavin-3, 3'-digallate correlates with inhibition of IKK and NF-κB activation [J]. Br J Pharmacol, 2006, 149: 121-131. |
| [3] | Huang L, Ye WH, Cai BW, et al. A preliminary study on the pharmacology of the compound prescription Huangqin Tang and its component drugs [J]. China J Chin Mater Med (中国中药杂志), 1990, 15: 51-53, 64. |
| [4] | Yu XF, Lü XZ, Dong WB. Clinical observation of ulcerative colitis treated by Huangqin Tang [J]. J Emerg Tradit Chin Med (中国中医急症), 2010, 19: 1510, 1529. |
| [5] | Sohn KH, Jo JM, Cho WJ, et al. Bojesodok-eum, a herbal prescription, ameliorates acute inflammation in association with the inhibition of NF-κB-mediated nitric oxide and proinflammatory cytokine production [J]. Evid-Based Complement Alternat Med, 2012: 457370. |
| [6] | Cortez M, Carmo LS, Rogero MM, et al. A high-fat diet increases IL-1, IL-6, and TNF-α production by increasing NF-κB and attenuating PPAR-γ expression in bone marrow mesenchymal stem cells [J]. Inflammation, 2013, 36: 379- 386. |
| [7] | Jobin C, Sartor RB. NF-κB signaling proteins as therapeutic targets for inflammatory bowel diseases [J]. Inflamm Bowel Dis, 2000, 6: 206-213. |
| [8] | Li T. Study on the Chemical Basis and Pharmacokinetics of Huangqin Tang (黄芩汤物质基础与药代动力学特征研究) [D]. Beijing: China Academy of Chinese Medical Sciences, 2013. |
| [9] | Morris GP, Beck PL, Herridge MS, et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon [J]. Gastroenterology, 1989, 96: 795-803. |
| [10] | Chen ZN, Shen MC, Guo MY. Practical Surgical Pathology (实用外科病理学) [M]. Shanghai: Shanghai Medical University Publishing House, 1997: 676-681. |
| [11] | Yu BJ, Wang ZQ. The Preclinical Safety Evaluation and Practice (新药临床前安全性评价与实践) [M]. Beijing: Military Medical Sciences Publishing House, 1997: 78-80. |
| [12] | Zhang BG, Li XX, Liu QF. Modern pharmacodynamics research and clinic application of Huangqin Tang [J]. China J Chin Mater Med (中国中药杂志), 2008, 33: 2587-2590. |
| [13] | Zhou YP, Yang ZJ, Chen C, et al. Clinical observation of effect of Huangqin Tang plus on regulating T cells subpopulations of ulcerative colitis patients [J]. Gansu J Tradit Chin Med (甘肃中医), 2004, 17: 32-34. |
| [14] | Lu ZY, Zhong NS. Internal Medicine (内科学) [M]. 7th Ed. Beijing: People's Medical Publishing House, 2008: 410-414. |
| [15] | Felley-Bosco E, André M. Proteomics and chronic inflammatory bowel diseases [J]. Pathol Res Pract, 2004, 200: 129-133. |
| [16] | Liu DQ, Wu CQ, Shi W, et al. Sufferer's chang in tumor necrosis factor, interleukin-8, nitric oxide synthase and nitric oxide of ulcerative colitis [J]. Clinic Focus, 2006, 21: 114- 115. |
| [17] | Papadakis KA, Targan SR. Tumor necrosis factor: biology and therapeutic inhibitors [J]. Gastroenterology, 2000, 119: 1148-1157. |
| [18] | Halter F, Tarnawski AS, Schmassmann A, et al. Cyclooxygenase 2-implications on maintenance of gastric mucosal integrity and ulcer healing: controversial issues and perspectives [J]. Gut, 2001, 49: 443-453. |
| [19] | Chen YC, Yang LL, Lee TJF. Oroxylin A inhibition of lipopolysaccharide-induced iNOS and COX-2 gene expression via suppression of nuclear factor-κB activation [J]. Biochem Pharm, 2000, 59: 1445-1457. |
| [20] | Chen YC, Shen SC, Chen LG, et al. Wogonin, baicalin, and baicalein inhibition of inducible nitric oxide synthase and cyclooxygenase-2 gene expressions induced by nitric oxide synthase inhibitors and lipopolysaccharide [J]. Biochem Pharm, 2001, 61: 1417-1427. |
| [21] | Chi YS, Cheon BS, Kim HP. Effect of wogonin, a plant flavone from Scutellaria radix, on the suppression of cyclooxygenase-2 and the induction of inducible nitric oxide synthase in lipopolysaccharide-treated RAW 264.7 cells [J]. Biochem Pharmacol, 2001, 61: 1195-1203. |
| [22] | Kang BY, Chung SW, Kim SH, et al. Involvement of nuclear factor-κB in the inhibition of interleukin-12 production from mouse macrophages by baicalein, a flavonoid in Scutellaria baicalensis [J]. Planta Med, 2003, 69: 687-691. |
| [23] | Lin CC, Shieh DE. The anti-inflammatory activity of Scutellaria rivularis extracts and its active components, baicalin, baicalein and wogonin [J]. Am J Chin Med, 1996, 24: 31-36. |
| [24] | Wakabayashi I, Yasui K. Wogonin inhibits inducible prostaglandin E2 production in macrophages [J]. Eur J Pharm, 2000, 406: 477-481. |
| [25] | Zhang DY, Wu J, Ye F, et al. Inhibition of cancer cell proliferation and prostaglandin E2 synthesis by Scutellaria baicalensis [J]. Cancer Res, 2003, 63: 4037-4043. |
 2015, Vol. 50
2015, Vol. 50


