2. 福建中医药大学, 生物医药研发中心, 福建 福州 350122;
3. 福建中医药大学, 中西医结合研究院, 福建 福州 350122
2. Centre of Biomedical Research and Development, Fuzhou 350122, China;
3. Academy of Integrative Medicine, Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China
三叶青为葡萄科崖爬藤属植物三叶崖爬藤 (Tetrastigma hemsleyanum Diels et Gilg),其块根又名为蛇附子、石猴子、石抱子、拦山虎、雷胆子、破石珠、阴灵子、三叶扁藤、金丝吊葫芦,是福建、浙江地区传统习用青草药,习称为“一粒珠”[1]。三叶青具有清热解毒、祛风化痰、活血止痛的功能,现代药理研究表明三叶青具有抗炎、镇痛及解热、抗肿瘤、抗病毒、调节免疫[1]等作用,并广泛用于多种中成药或保健品,如华佗风痛宝、结石康胶囊、三叶青粉末、金丝地甲胶囊、金芪片等。三叶青中的化学成分研 究已有报道[2, 3, 4, 5, 6],但以这些分离得到的成分为指标的质量控制却未见报道。近年来,随着分析技术的发 展,超高效液相色谱 (UPLC) 串联三重四级杆质谱 (QqQ-MS/MS) 由于其分离速度快、灵敏度高、测定准确性强而被广泛运用于中药及复方的分析中[7, 8],而目前关于三叶青块根药材质量控制的研究报道也较少[9, 10],并且大量三叶青药理研究表明其抗肿瘤药效物质基础为黄酮类成分[11, 12, 13, 14, 15]。因此,本实验针对其10种黄酮类成分进行同时定量研究,为三叶青的质量控制提供科学依据。
材料与方法 仪器ACQUITY UPLC H-Class超高效液相色谱仪 (美国Waters公司); Xevo TQMS三重四级杆 质谱 (美国Waters公司); CPA225D型十万分之一分析天平 (德国Sartorius公司); KQ-500E台式超声波清洗器 (昆山市超声仪器有限公司); FY135型中草药粉碎机 (天津市泰斯特仪器有限公司)。
试剂乙腈 (色谱纯,德国Merck公司); Milli-Q超纯水 (美国Millipore公司),其余试剂均为分析纯。
药品对照品儿茶素 (catechin)、原花青素B1 (procyanidin B1)、原花青素B2 (procyanidin B2)、芦丁 (rutin)、异槲皮苷 (isoquercitrin)、山柰酚-3-O- 芸香糖苷 (kaempferol-3-O-rutinoside) 及紫云英苷 (astragalin) 由本实验室从三叶青中分离制备,1H、 13C NMR和MS数据与文献[16, 17, 18, 19]比较确认; 纯度经HPLC-DAD (面积归一法) 检测含量均大于98.0%。内标甘草苷 (liquiritin) 购自上海同田生物技术股份有限公司,槲皮苷 (quercitrin)、槲皮素 (quercetin)、山柰酚 (kaempferol) 购于中国食品药品检定研究院。三叶青30批样品分别采自或购自不同产地,经福建中医药大学药用植物实验室范世明高级实验师及生药教研室黄泽豪副教授鉴定,均为葡萄科植物三叶青 (Tetrastigma hemsleyanum Diels et Gilg) 的干燥块根,样本存放于福建中医药大学药学院药用植物标本室。
色谱条件Waters CORTECS C18 (2.1 mm × 100 mm,1.6 μm); 流动相: 溶剂A (乙腈) 与溶剂B (0.1%甲酸水),梯度洗脱 (0~0.5 min,溶剂A 8%~10%; 0.5~2.5 min,溶剂A 10%~15%; 2.5~4.5 min,溶剂 A 15%~20%; 4.5~6.5 min,溶剂A 20%~40%; 6.5~8.5 min,溶剂A 40%~60%),流速: 0.25 mL·min-1,柱温: 45 ℃,进样量: 1 μL。
质谱条件电喷雾负离子模式,毛细管电压: 2.5 kV; 脱溶剂气流: N2,流速800 L·h-1,脱溶剂温度200 ℃; 锥孔气流: N2,流速50 L·h-1; 离子源温 度: 150 ℃; Extractor: 3.00 V; 碰撞气体: 氩气。采用MRM定量模式,10种分析物及内标的质谱分析条件参数见表 1。
|
|
Table 1 MS analysis of parameters of 10 detected compounds and liquiritin (IS) |
取三叶青药材粉碎,过60目筛得三叶青药材粉末。取三叶青0.5 g,精密称定,置具塞三角瓶中,精密加入80% 甲醇25 mL,密塞,称定重量,超声处理 (功率250 W,频率50 kHz) 30 min,放冷,再称定重量,用80% 甲醇补足减失重,摇匀,0.22 μm滤膜滤过,取续滤液,稀释5倍,按1∶1 (300∶300 μL) 加入内标后测定。
对照品溶液的制备取原花青素B1、儿茶素、原花青素B2、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、紫云英苷、槲皮苷、槲皮素、山柰酚对照品适量,精密称定,加入甲醇分别制备含0.95、1.39、1.22、1.132、1.244、1.108、0.206、1.00、0.922和1.215 mg·mL-1的单一对照品储备液。其他不同质量浓度的对照品溶液由50% 甲醇稀释储备液得到。内标液为甘草苷,浓度为500 ng·mL-1。
结果 1 方法学考察 1.1 质谱测定方法原花青素B1、儿茶素、芦丁、山柰酚-3-O-芸香糖苷、槲皮素的子离子质谱裂解见图 1。三叶青样品和混合标准品依法按上述色谱及质谱条件下分析,10种分析物及内标均分离良好,三叶青的UPLC-MS/MS总离子流色谱图见图 2。
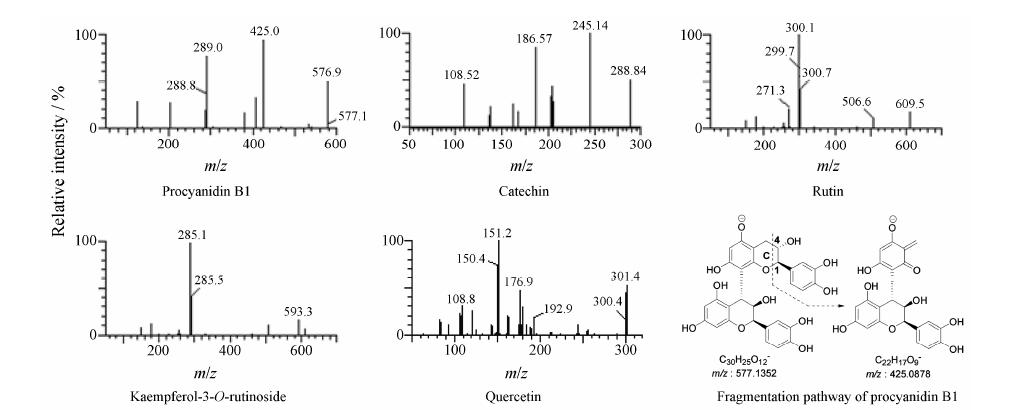 |
Figure 1 Chemical characterization of the analytes by product ion scan and fragmentation pathway of procyanidin B1 |
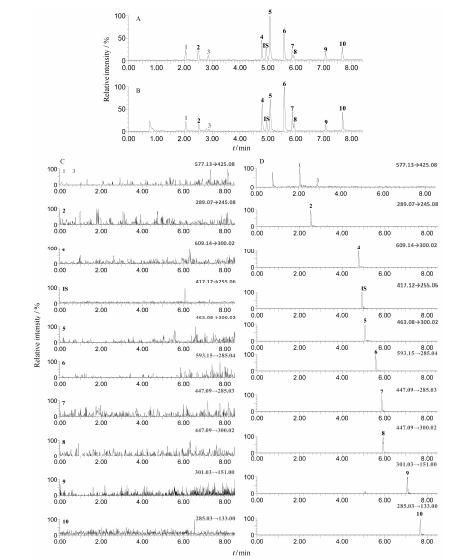 |
Figure 2 UPLC-MS/MS chromatograms of reference (A),blank solution(C) and Tetrastigma hemsleyanum sample (B,D). Peak 1: Procyanidin B1; Peak 2: Catechin; Peak 3: Procyanidin B2; Peak 4: Rutin; Peak 5: Isoquercitrin; Peak 6: Kaempferol-3-O-rutinoside; Peak 7: Astragalin; Peak 8: Quercitrin; Peak 9: Quercetin; Peak 10: Kaempferol; IS: Liquiritin |
取各对照品储备液,用50% 甲醇稀释配制系列梯度浓度的对照品混合溶液,测定前按1∶1 (300∶300 μL) 加入内标。依法测定峰面积,以峰面积与内标峰面积的比值 (Y) 对分析物浓度 (X) 作线性回归,绘制标准曲线,得到回归方程和相关系数,并以信噪比10计算定量限 (LOQ),以信噪比3计算检测限 (LOD),结果见表 2。
|
|
Table 2 Calibration curves,linear ranges,LOQ and LOD of 10 detected compounds |
精密吸取线性最低浓度点、低、中、高QC混合对照品溶液1 μL,一天内连续进样6次,及连续6天测定,根据标准曲线计算浓度,其日内精密度和日间精密度RSD范围均在1.87%~5.39%,表明仪器精密度良好。
1.4 稳定性取本品按供试品制备方法制备供试品溶液,分别于0、2、6、10、12和24 h依法测定,根据标准曲线计算浓度,其RSD范围均在1.52%~4.40%,表明样品在24 h内稳定。
1.5 重复性精密称取同一批三叶青样品6份,按供试品制备方法制备供试品溶液,依法测定,计算10种分析物的含量,其RSD范围均在2.31%~5.70%,表明方法重复性良好。
1.6 回收率精密称取重复性实验同批次已知含量的三叶青样品6份,约0.25 g,精密加入低、中、高三个浓度的10种对照品,按供试品制备方法制备供试品溶液,依法测定含量,计算各个化合物回收率范围在95.44%~110.40%,其RSD范围均在2.37%~8.69%,表明方法回收率良好。
2 样品含量测定分别精密称取不同批次的三叶青样品粉末0.5 g,按供试品制备方法制备供试品溶液,依法测定峰面积,根据标准曲线计算其含量,结果见表 3。所有数据均运用DPS14.50数据处理软件处理: 采用系统聚类分析方法,以10种分析物含量为变量,以卡方距离为指标,对30批三叶青样品进行系统聚类 (可变类平均法) 分析,得到三叶青样品聚类图,见图 3。当距离大于3.00时,可以将其分为两大类。其中,当距离介于2.10~3.00时,可将第二类样品继续细分为2类。当距离介于1.50~2.50时,可将第一类样品继续细分为2类。
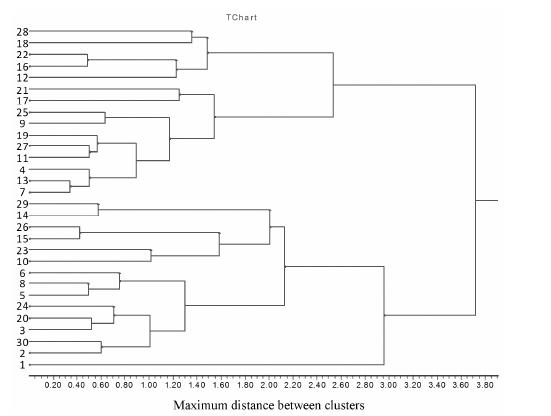 |
Figure 3 Fuzzy cluster of the Tetrastigma hemsleyanum in 30 different samples |
|
|
Table 3 Determination of 10 detected compounds in Tetrastigma hemsleyanum (μg·g-1). 1: Procyanidin B1; 2: Catechin; 3: Procyanidin B2; 4: Rutin; 5: Isoquercitrin; 6: Kaempferol-3-O-rutinoside; 7: Astragalin; 8: Quercitrin; 9: Quercetin; 10: Kaempferol; IS: Liquiritin. -: Not detected |
通过比较了三叶青的回流提取和超声提取,不同浓度甲醇、乙腈作为提取溶剂,最终优选80% 甲醇超声提取。在此基础上,考察了超声提取的次数、溶剂用量及提取时间对提取的影响,结果表明80% 甲醇超声提取1次,50倍量,提取30 min即可。
比较了不同粒径色谱柱对三叶青10种黄酮类成分的分离效果,考察了Waters CORTECS C18 (2.1 mm × 100 mm,1.6 μm)、Phenomenex kintecx C18 (2.1 mm × 100 mm,1.7 µm)、Waters HSS T3 C18 (2.1 mm × 100 mm,1.8 μm),最终选择粒径1.6 µm Waters CORTECS C18色谱柱因其分离度和灵敏度均明显高于其他超高效液相色谱柱,并且将手性异构体原花青素B1和B2完全基线分离。另外,流动相系统的选择,先后比较了4种流动相系统: 乙腈- 0.1% 甲酸水、乙腈-水- 0.1% 醋酸铵水、甲醇- 0.1% 甲酸水、甲醇- 0.1% 醋酸铵水,表 明乙腈- 0.1% 甲酸水最佳。另外,色谱分离上虽然成分紫云英苷 (7) 和槲皮苷 (8) 未能基线分离,但是其在质谱定量通道上447.09 → 284.03 (7) 与447.09 → 300.02 (8) 互不干扰,故两者均可以准确定量。
通过Mass Tune针对待测10种黄酮类成分质谱参数进行优化,考察了最佳的毛细管电压、锥孔电压、碰撞能量,优选最佳的MRM模式定量离子对。化合物儿茶素最佳定量离子对为289.07 → 245.08,裂解的子离子m/z 245为其母离子失去一分子CO2产生的 [M-H-CO2]- 峰,原花青素B1和B2定量离子对都是577.13 → 425.08,其裂解的子离子m/z 425为其母离子中一个儿茶素单元发生C环1,4位RDA裂解产生的碎片峰,槲皮素301.03 → 151.00,其子离子m/z 151为其母离子C环1,4位RDA裂解合A环的碎片峰 [1,4A]-,而山柰酚m/z 133的子离子为其母离子C环1,4位RDA裂解合B环的碎片峰 [1,4B]-,此外其他苷类成分则是苷键裂解,产生各自的苷元碎片峰。考察子离子碰撞能量时发现原花青素B1和B2虽然互为手性异构体,子离子一样,但是其产生子离子最佳响应的碰撞能量不同,提示即使互为手性异构体也应分别对其质谱条件进行优化。另外,本次实验发现测定的几种氧苷类黄酮 (芦丁、异槲皮苷、山柰酚- 3-O-芸香糖苷、紫云英苷、槲皮苷) 在负离子模式下产生的苷元子离子既有 [M-H-糖基]-,也有 [M-2H-糖基]-,并且产生这两种子离子的响应值不完全一致,提示对于黄酮苷类成分的定量,其苷元的子离子选择也需要分别进行考察。
对于30批三叶青含量测定的结果表明,不同产地三叶青中10种黄酮含量差异很大,甚至有些批次中未检测出。从收集的30批次的平均值来看,三叶青块根中含量相对较高的依次为儿茶素 (2)、原花青素B1 (1)、山柰酚-3-O-芸香糖苷 (6)、芦丁 (4)、异槲皮苷 (5)、紫云英苷 (7),而原花青素B2 (3)、槲皮苷 (8)、槲皮素 (9)、山柰酚 (10) 含量较低。将所有批次进行聚类分析后发现三叶青样品总共可聚为两大类,其中福建、浙江收集的7种产地栽培品中,S 7,S 9,S 16三个产地为其中一大类,而S 2,S 6,S 8,S 10产地为另一大类,说明不同种植基地其三叶青引种来源可能不一致。另外,不同产地的野生三叶青样品含量经比较发现,10种黄酮含量也差异悬殊,可能不同产地具有不同生态环境,同时三叶青可能存在多种变种所致。
综上,本文建立UPLC-MS/MS法同时测定三叶青中10种黄酮成分的定量分析方法简便、快捷、准确,为综合评价三叶青的质量提供参考。
致谢: 福建省测试技术研究所曾文灿老师在质谱测定中给予帮助。
| [1] | Chen LY, Guo SH. Progress in studies of chemical composition and pharmacological effects of Tetrastigmatis hemsleyani [J]. J Zhejiang Univ Tradit Chin Med (浙江中医药大学学报), 2012, 36: 1368-1370. |
| [2] | Li YQ, Lu WC, Yu ZG. Chemical constituents from Tetrastigma hemsleyanum [J]. Chin Tradit Herb Drugs (中草药), 2003, 34: 982-983. |
| [3] | Liu D, Yang JS. A study on chemical components of Tetrastigma hemsleyanum Diels et Gilg. native to China [J]. China J Chin Mater Med (中国中药杂志), 1999, 24: 611-612. |
| [4] | Liu D, Ju JH, Lin G, et al. Study on chemical components of Tetrastigma hemsleyanum Diels et Gilg. native to China [J]. Chin Pharm J (中国药学杂志), 2000, 35: 31-33. |
| [5] | Huo X, Yang NJ, Liu WW, et al. Determination of chemical constituents of ether extract of Radix Tetrastigmae Hemsleyani [J]. Chin J Pharm Anal (药物分析杂志), 2008, 28: 1651- 1653. |
| [6] | Liu D, Ju JH, Lin G, et al. New C-glycosylflavones from Tetrastigma hemsleyanum [J]. Acta Bot Sin (植物学报), 2002, 44: 227-229. |
| [7] | Yang Y, Wang HJ, Yang J et al. Chemical profiling and quantification of Chinese medicinal formula Huang-Lian-Jie-Du decoction, a systematic quality control strategy using ultra high performance liquid chromatography combined with hybrid quadrupole-orbitrap and triple quadrupole mass spectrometers [J]. J Chromatogr A, 2013, 1321: 88-99. |
| [8] | Huang MQ, Zhao HY, Xu W, et al. Rapid simultaneous determination of twelve major components in Pien Tze Huang by ultra-performance liquid chromatography coupled with triple quadrupole mass spectrometry [J]. J Sep Sci, 2013, 36: 3866-3873. |
| [9] | Pu JB, Liang WQ, Zheng JX, et al. HPLC method for determination of quercetin and kaempferol in Tetrastigma hemsleyanum [J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2011, 18: 134-135. |
| [10] | Zheng JX, Hu YJ, Liang WQ, et al. UV-vis method for determination of total flavonoids in Tetrastigma hemsleyanum [J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2009, 16: 386-387. |
| [11] | Ding L, Ji QX. Study preliminary on the anti-tumor effect of the extract of Tetrastigma hemsleyanum Diels et. Gilg [J]. Strait Pharm J (海峡药学), 2011, 23: 46-48. |
| [12] | Ni KF, Jin B, Jiang FS, et al. TIMP-2mRNA expression effect of Tetrastigma hemsleyanum Diels et Giig flavone on H-22 solid tumors in mice [J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2009, 16: 195-196. |
| [13] | Ni KF, Ding ZS, Huang T, et al. Inhibition effect of Tetrastigma hemsleyanum Diels et Giig flavone on H-22 solid tumors in mice [J]. J Zhejiang Univ Tradit Chin Med (浙江中医药大学学报), 2008, 32: 732-734. |
| [14] | Feng ZQ, Ni KF, He Y, et al. Experimental study on efect of Tetrastigma hemsleyanum Diels et Gilg flavone on inducing apoptosis of SGC-7901 cell line iv vitro [J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2006, 11: 669- 672. |
| [15] | Zhang LM, Fang RJ, Yang FQ. Experimental study on efect of Tetrastigma hemsleyanum Diels et Gilg flavone on inducing apoptosis of SMMC-7721 cell line iv vitro [J]. Lishizhen Med Mater Med Res (时珍国医国药), 2010, 21: 2850-2851. |
| [16] | Zeng P, Zhang Y, Pan C, et al. Phenolic constituents from Lysimachia patungensis [J]. Acta Pharm Sin (药学学报), 2013, 48: 377-382. |
| [17] | Yi Y, Wu X, Wang Y. Studies on the flavonoids from the flowers of Hylocereus undatus [J]. J Chin Med Mater (中药材), 2011, 34: 712-716. |
| [18] | Cui Y. Chemical constituents from Viola diamantiaca [J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 1498-1501. |
| [19] | Mou XN, Yang WQ, Wang WJ, et al. Chemical constituents from the fruits of Areca catechu [J]. J Jinan Univ (Nat Sci) (暨南大学学报自然科学与医学版), 2014, 35: 57-60. |
 2014, Vol. 49
2014, Vol. 49


