2. 湖北大学生命科学学院感染与免疫研究中心, 湖北 武汉 430062;
3. 湖北绿色生物资源转换协同创新中心, 湖北 武汉 430062
2. Center for Infection and Immunity Research, College of Life Sciences, Hubei University, Wuhan 430062, China;
3. Hubei Collaborative Innovation Center for Green Transformation of Bioresources, Wuhan 430062, China
目前,有多个TNF-α的单克隆抗体 (mAb) 批准上市用于类风湿关节炎(rheumatoid arthritis,RA) 和其他自身免疫病的治疗[1, 2, 3, 4],但是这些单抗缺乏针对炎症组织的特异性。研究表明,系统给药的抗体只有极少部分被RA患者的炎症关节摄取[5, 6],而且,较长的血浆半衰期使其过度暴露于正常组织,致使RA患者发生感染和肿瘤的风险显著增加[7, 8]。小分子的抗体片段如scFv及抗体Fab片段,因具有较强的组织穿透力并快速从血浆清除,对正常组织毒副作用小而倍受关注,但较短的血浆半衰期又使其在靶组织中的摄取非常有限[9]。作者认为解决这一矛盾的一个较具前景的方法是在TNF-α的小分子抗体片段上共价连接一个炎症组织中特异性表达抗原的配体,借助抗原-配体的相互作用,将抗TNF-α的抗体片段靶向性导入炎症组织。这种新型的生物制剂将同时兼备对靶组织的特异性和正常组织的低毒性。
纤维连接蛋白 (fibronectin,FN) 是胞外基质的重要组成成分,FN前体mRNA的选择性拼接可产生不同类型的FN[10]。保留额外域B (extra domain B,ED-B) 的FN (B-FN) 在成人正常组织中不表达,但在胚胎和肿瘤组织中丰富表达[11, 12, 13]。B-FN作为血管生成的标志物[14],其单抗BC1和scFv L19已广泛用于抗恶性肿瘤血管生成的靶向治疗[15, 16, 17]。研究表明,B-FN同样特异性高表达于RA的炎症滑膜和部分其他自身免疫病的炎症组织中[18, 19]。L19融合的IL-10和TNFRII能选择性的积累于小鼠的炎症关节,对小鼠关节炎的疗效显著高于单独的IL-10或TNFRII[20, 21]。L19在临床上还用于RA的影像学诊断[22]。这些资料表明,B-FN是靶向治疗RA和其他自身免疫病的优良抗原。
作者构建了抗TNF-α scFv (TNF-scFv) 及其多价抗体[23, 24, 25],证实了TNF-scFv及其多价抗体对小鼠关节炎模型具有显著的治疗作用[24]。本研究利用重组DNA技术,通过一段选自人血清蛋白 (HSA) 的柔性连接肽共价连接TNF-scFv和L19,构建了抗TNF-α/抗ED-B基因工程双特异抗体BsDb,并对双特异抗体的生物学活性和药动学特征进行了分析和评价。
材料与方法 质粒、菌株和细胞株TNF-scFv的表达质粒TNF-scFv/pTS[23]和L19的表达质粒L19/pLS (EMBL accession no. AJ006113) 为本实验室构建和保存,其中质粒pTS/TNF-scFv作为基础质粒,用于构建双特异抗体的表达质粒。大肠杆菌Top10 (用于分子克隆和质粒的保存),大肠杆菌BL21 star (DE3) (用于蛋白表达的宿主细胞) 均购自天根生化科技 (北京) 有限公司。小鼠成纤维细胞L929,购自美国ATCC,本实验室保存,需要时用含有10% 胎牛血清 (FBS,Hyclone) RPMI-1640培养于37 ℃、5% CO2培养箱中备用。
试剂与动物重组人TNF-α (rhTNF-α) 购自Peprotech公司; 重组B-FN购自Speed Biosystem; FITC标记的抗组氨酸标签 (His tag) 单克隆抗体以及FITC标记的抗c-Myc标签的单克隆抗体购自Santa Cruz; 限制性内切酶、T4DNA连接酶、pfu DNA多聚酶以及DNA回收试剂盒购自大连宝生物 (TaKaRa),Ni-NTA亲和层析凝胶购自Pharmacia; 牛II型胶原、弗氏完全佐剂购自Sigma公司。放线菌素D购自Fluka化学公司。DBA/1小鼠,雄性,(16 ± 2) g,购自上海斯莱克实验动物研究中心,并用标准的啮齿类动物饲料进行喂养,所有相关实验动物的操作严格按照国家科技部发布的《实验动物管理条例》(1988年11月14日2号令) 进行。
双特异抗体BsDb的构建以TNF-scFv/pTS[23]为基础质粒,构建BsDb的表达质粒。首先以质粒L19/pLS为模板,PCR扩增编码HSA连接肽与L19的融合基因,其中HSA连接肽包括HSA的490~513的24个氨基酸。扩增的引物见表 1。为了便于产物的克隆,在P1的5' 引入了EcoR I位点,P2的5' 引入 了BamH I位点,同时P1带有HSA连接肽的24个 氨基酸编码序列和L19编码序列氨基端的20个核苷酸。扩增反应条件为: 95 ℃预变性5 min,95 ℃变性 1 min,55 ℃退火1 min,72 ℃延伸1 min,循环30次,72 ℃延伸5 min。对扩增产物及质粒pTS进行EcoR I/ BamH I双酶切,回收酶切片段,进行连接反应,将编码HSA连接肽和L19的融合基因连入载体pTS中,形成双特异抗体BsDb的表达载体BsDb/pTES,转化大肠杆菌Top10,进行质粒的扩增,提取质粒进行序列测定,确保片段的的正确连接和序列正确。最后,经序列正确的质粒BsDb/pTES转化大肠杆菌BL21 star (DE3),形成稳定表达BsDb的基因工程重组菌株。
|
|
Table 1 Primers used for the construction of BsDb. Shown are the primers P1and P2 for the amplification of HSA-linker-L19 fusion gene. The underlined nucleotides are EcoRI and BamH I restriction sites,separately. The bold sequence is the fragment encoding the 24aa HSA linker. The sequences in shadow are the 20 nucleotides in the amino terminal and 20 nucleotides in the carboxyl terminal of L19,separately |
含有质粒BsDb/pTES大肠杆菌BL21 star (DE3) 接种25 mL含50 μg·mL-1卡那霉素的LB培养基,37 ℃摇动培养过夜,以1∶40转接于1 L含50 μg·mL-1卡那霉素的LB培养基,置于5 L的摇瓶中于37 ℃摇动培养至A600为0.6~0.8,加入终浓度为0.4 mmol·L-1的IPTG ,继续培养4~5 h,诱导BsDb的表达。离心 (8 000×g) 收集表达菌体,重悬于250 mL含50 mmol·L-1 Tris/ HCl (pH 8.0),100 mmol·L-1 NaCl,2 mmol·L-1 EDTA,100 μg·mL-1溶菌酶,10 μg·mL-1 DNase和10 μg·mL-1 RNase的缓冲液中,超声破碎菌体,于4 ℃、12 000×g离心20 min,分别收集上清液和沉淀,进行SDS/PAGE检测,观察BsDb的表达情况。将凝胶上的蛋白条带电转至0.45 μm硝酸纤维膜 (美国Pall Gelman),取出膜,于含5% 的脱脂牛奶的1×PBS (pH 7.4) 缓冲液中4 ℃封闭过夜,1×PBS洗膜3次,每次3 min; 将膜分别浸泡于含HRP标记抗His tag单抗(1∶1 000稀释) 和HRP标记抗c-Myc单抗 (1∶1 000稀释) 的1×PBS (pH 7.4) 缓冲液中,37 ℃孵育2 h,1×PBS洗膜3次,每次3 min; 加入DAB显色剂,待显色到理想的程度,用自来水冲洗,终止反应。
双特异抗体BsDb的纯化和复性将上述1 L 表达培养物的超声沉淀用含20 mmol·L-1 Tris/HCl,pH 8.0,3% Triton X-100和1 mol·L-1尿素的缓冲液清洗2次,重悬于200 mL的变性缓冲液 (20 mmol·L-1 Tris/HCl,pH 8.0,8 mol·L-1尿素,150 mmol·L-1 NaCl,10 mmol·L-1咪唑) 中,置于25 ℃缓慢摇动过夜,确保包涵体蛋白完全溶解。离心 (4 ℃、12 000×g) 30 min,取包涵体蛋白离心上清液,经固定化的Ni2+ 亲和层析 (IMAC) 纯化。将包涵体蛋白上样于10倍柱体积的上述变性缓冲液平衡的10 mL Ni-NTA柱,流速0.5 mL·min-1。流穿后,用含20 mmol·L-1 Tris/HCl,pH 8.0,8 mol·L-1尿素,500 mmol·L-1 NaCl,20 mmol·L-1咪 唑的缓冲液洗涤至基线,流速为1 mL·min-1,充分去除非特异结合的蛋白质; 最后用含20mmol·L-1 Tris- HCl (pH 8.0),150 mmol·L-1 NaCl,8 mol·L-1尿素,500 mmol·L-1咪唑的缓冲液进行洗脱,流速为1 mL·min-1,收集蛋白质峰,进行SDS/PAGE检测。用上述变性缓冲液将洗脱的包涵体蛋白稀释到250 μg·mL-1,装入适当大小的透析袋。进行逐步移除变性剂尿素的透 析复性。对100倍体积分别含4,2、1及0 mol·L-1的硼酸缓冲液 (0.9% 硼酸溶液,0.3% NaOH溶液,pH 9.6) 从高到低分步透析,每个尿素浓度透析4 h,同时在2、1及0 mol·L-1的透析过程中于硼酸缓冲液中加入0.5 mol·L-1 L-精氨酸和GSH/GSSG (1 mmol·L-1/ 1 mmol·L-1) 作为添加剂。最后,蛋白置于100倍体积20 mmol·L-1 Tris-HCl (pH 8.0) 中透析2次,每 次4 h,彻底除去其中残留的尿素和其他杂质,并通过0.22 μm的滤膜过滤除菌,超滤浓缩,冻干备用。
抗原结合ELISA100 ng/孔TNF-α及100 ng/孔B-FN分别包被于96孔ELISA板,每孔于100 μL 0.1 mol·L-1的碳酸盐缓冲液 (pH 9.6) 中,4 ℃过夜。PBST洗板2次,用100 μL含5% 的脱脂牛奶的1×PBS (pH 7.4) 缓冲液于37 ℃封闭2 h。PBST洗板3次,于每孔中加入100 μL不同浓度的BsDb及对照抗体,每个抗体浓度做3复孔,置ELISA板于37 ℃温箱中孵育1.5 h。PBST洗板3次,于每孔中加入 100 μL HRP标记的抗c-Myc单抗 (1∶1 000稀释),置ELISA板于37 ℃温箱中孵育1 h。PBST洗板3 次,于每孔中加入100 μL 显色液 (1 mmol·L-1 OPD,0.016% H2O2),37 ℃避光孵育10 min,酶标仪读取每孔490 nm处的吸收值。
抑制TNF-α的细胞毒作用EDTA消化收集培养的L929细胞,用RPMI-1640 (10% FBS) 培养基调整浓度为2.5×105个/mL,100 µL/孔加入96孔细胞培养板中,37 ℃、5% CO2培养过夜。另取一块96孔培养板,于第3~12孔加入100 μL RPMI-1640 (2% FBS) 培养基倍比稀释的双特异抗体BsDb。同样的方法处理TNF-scFv及CD3-scFv,每种抗体浓度梯度做3复孔,剩余的孔1和孔2加入100 μL的培养基; 于第2~12孔加入100 μL RPMI-1640 (2% FBS) 培养基 稀释的TNF-α,至终质量浓度为1 ng·mL-1,剩余的孔1加入100 μL培养基,置37 ℃温箱中孵育2 h。 弃掉第1块培养板中的培养液,将第2块培养板的 孵育物转移100 μL至第1块培养板的相应孔中,与每孔中补加放线菌素D至终质量浓度为1 μg·mL-1,37 ℃、5% CO2培养24 h。于每孔中加入5 mg·mL-1 MTT溶液10 μL,37 ℃、5% CO2培养3 h,弃掉培养基,PBS洗板3次,每次2 min,于每孔中加入DMSO 50 μL,摇动培养板,使细胞内结晶全部溶解,酶标仪阅读每孔的570 nm的吸收值 (A570),如下公式计算每种抗体对TNF-α细胞毒的抑制率 (%): 抑制率 (%) =[[A570, M - A570, T]/[A570, N - A570, T]]×100%,其中A570, M为加入TNF-α和抗体的3复孔平均吸收值; A570, T为只加TNF-α的3复孔平均吸收值; A570, N为既不加TNF-α又不加抗体的3复孔的平均吸收值。为了证实BsDb在结合B-FN的情况下,仍然能够中和TNF-α生理效应,对上述实验进行了调整。即在96孔细胞培养板中首先包被1 μg/孔的B-FN,1×PBS洗板后于每孔中加入不同浓度的BsDb,25 ℃孵育2 h,用1×PBS洗板3次,充分去除未结合的BsDb,然后于 每孔中加入100 μL细胞悬液,并加入终质量浓度为 1 ng·mL-1的TNF-α和终质量浓度为1 μg·mL-1的放线菌素D,37 ℃、5% CO2培养24 h。后续抑制作用的分析与上述一致。
胶原诱导的小鼠关节炎模型建立胶原诱导的小鼠关节炎模型 (collagen-induce arthritis in mice,CIA) 的建立按照报道的标准操作进行[26]。于每只DBA/1小鼠尾基部或背部皮下3~5个点注射250 μg牛Ⅱ型胶原 (CⅡ) 和等量的弗氏完全佐剂 (250 μg CⅡ溶解于125 μL的醋酸溶液,加入等量体积含分枝杆菌250 μg的弗氏完全佐剂,充分混匀,制成乳浊液)。小鼠3周后腹腔注射上述同样剂量的乳浊液进行加强免疫。观察小鼠的关节变化,关节炎的发生在二免后11天左右发生,发病初期主要出现指关节的红肿,从一个关节累及到多个关节,进一步发展到腕关节和踝关节的肿胀和变形。
免疫组织化学取小鼠炎症足和正常足,4% 的多聚甲醛固定,5% 硝酸脱钙,并进行石蜡包埋。随后进行切片,厚度为5 μm。切片浸入10 mmol·L-1的枸橼酸缓冲液,于微波炉中最大火力加热至沸腾,冷却10 min,反复两次,进行抗原修复。1×PBS洗片3次,每次5 min。标准羊血清25 ℃封闭30 min。1×PBS洗片3次,每次5 min,加入10 μg·mL-1 BsDb和对照抗体 (L19和TNF-scFv),37 ℃孵育1 h。1×PBS洗片3次,每次5 min,加入HRP标记的抗His tag的单克隆抗体 (1∶1 000稀释),37 ℃孵育1 h。1×PBS洗片3次,每次5 min,加入含0.016% (v/v) H2O2的 1 mmol·L-1的DAB溶液,显色5~10 min,自来水冲洗终止反应,苏木精复染2 min,自来水冲洗,显微镜下观察并照相,Adobe Photoshop 7.0进行图像处理。
融合蛋白的药动学分析35只CIA小鼠随机分成7个实验组。于每只小鼠尾静脉注射7.4 MBq放射性131I标记的双特异抗体BsDb (溶于50 μL 1×PBS),分别于时间点10 min、30 min、1 h、4 h、12 h、24 h、48 h处死5只CIA小鼠。取每只小鼠的肝、脾、肾、肺、炎症足、正常足和血液,用γ计数器 (德国Berthold公司) 检测血液和各组织的放射剂量,各组织对BsDb的摄取以每克组织中放射剂量占注射总放射剂量的百分比 (ID%/g) 表示。为了比较BsDb与TNF- scFv的药动学,35只CIA小鼠随机分成7个实验 组,每只小鼠尾静脉注射7.4 MBq放射性131I标记的TNF-scFv (溶于50 μL 1×PBS),分别与时间点10 min、30 min、1 h、4 h、12 h、24 h、48 h处死5只CIA小鼠。取每只小鼠的肝、脾、肾、肺、炎症足、正常足和血液,用γ计数器 (德国Berthold公司) 检测血液和各组织的放射剂量,计算各组织中TNF-scFv的ID%/g。
数据处理所有分组数据采用mean ± SEM表示,并通过t-test分析组间差异性。
结果 1BsDb的表达、鉴定及纯化
如图 1所示,PCR获得的HSA连接肽和scFv L19的融合基因成功连入质粒载体pTS,通过阳性重组 子的筛选和序列测定,确定双特异抗体BsDb的表达载体pTES构建成功。HSA连接肽是从HSA中遴选一段的具有高度柔性的24肽,连接HSA的IIIa结 构域的螺旋6和IIIb结构域螺旋1。已经证实它具备IgG铰链区的功能,能够使两个连接的scFv进行独立的折叠和灵活伸展,以有效的结合各自的抗原[23, 24]。BsDb的编码基因在强启动子T7的控制下,在大肠杆菌中获得了高效表达,表达产物以包涵体的形式存在于大肠杆菌培养物的超声沉淀中,分子质量大约为63 kDa,占沉淀中总蛋白的30% 左右 (图 2)。Western blotting进一步鉴定,证实该63 kDa的蛋白条带为目的蛋白双特异抗体BsDb。在变性条件下,BsDb通过固定化的Ni2+ 亲和层析 (IMAC) 一步纯化可达到95% 以上的纯度 (图 2)。通过缓慢去除变性剂尿素的透析复性以及超滤浓缩,可以从1 L大肠杆菌培养物中获得20~25 mg目的蛋白,浓度可达1 mg·mL-1。
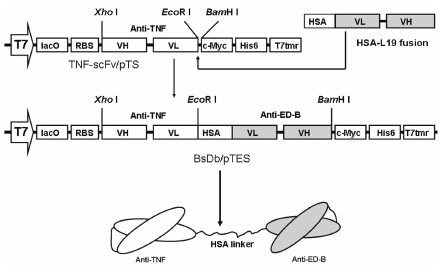
|
Figure 1 Construction scheme of BsDb. Shown are the Xho I/ BamH I cassettes of the expression vector pTES for the production of BsDb. The fusion gene encoding HSA linker and L19 obtained by PCR was cloned into the plasmid pTS via EcoR I/BamH I sites,resulting in the plasmid pTES. The VH and VL domain with the same antigen specificity are associated,forming two different scFvs linked by the HSA linker. LacO,lac operator; RBS,ribosome binding site; T7,T7 promoter; c-Myc,c-Myc Tag; His6,6×His tag; T7 tmr,T7 terminator |
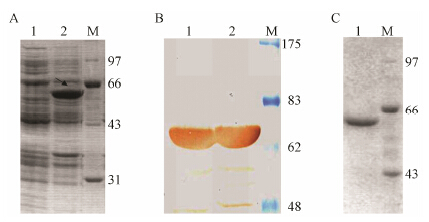
|
Figure 2 Expression,purification and identification of BsDb. A: SDS/PAGE analysis of the expression of BsDb under reducing condition. The arrows indicate the expected BsDb. Lane M,the molecular mass standards (kDa); lane 1,supernatant of E. coli cells harboring pTES; lane 2,pellet of E. coli cells harboring pTES. The molecular mass (kDa) on the right of the gel. B: Identification of BsDb by Western blot. Lane M,prestained molecular mass standards (kDa); lane 1,BsDb stained with the anti-his tag mAb; lane 2,BsDb stained with the anti-c-Myc mAb. The molecular mass (kDa) on the right of the membrane. C: SDS/PAGE under reducing condition shows the results of purification. Lane M,molecular mass standards (kDa); lane 1,BsDb. The molecular mass (kDa) on the right of the gel |
利用间接ELISA检测了BsDb与两种抗原TNF-α及B-FN的免疫反应性。如图 3所示,与其亲本抗体TNF-scFv和L19一样,BsDb可特异性的结合TNF-α及B-FN,而对照抗体CD3-scFv没有结合作用。而且,BsDb对两种抗原的亲和力与其亲本抗体TNF-scFv和L19没有显著性的差异。为了进一步证实BsDb能否特异性结合炎症关节中的B-FN,对CIA小鼠的炎症关节进行了组织切片,用BsDb进行了免疫组化分析,发现炎症关节中的血管翳能被BsDb染色 (图 4)。血管翳是RA中的一个高度血管化的肉芽组织,从关节滑膜发展并逐渐浸润到关节骨和软骨,引起骨和软骨组织的降解和破坏[18, 22]。B-FN作为重要的胞外 基质(ECM),主要由炎症微环境激活的关节成纤维样细胞 (FLSs) 合成,FLSs则是血管翳的主要组成细胞,B-FN则为血管翳中丰富的胞外基质[27],作者的实验结果与文献报道一致。至于正常关节,没有血管翳的形成,因而没有发现任何染色,关节滑膜为仅由少量细胞构成的薄层结构。对照抗体L19与BsDb的染色结果非常相似,而TNF-scFv无论是在正常关节还是炎症关节中都没有染色作用(图 4)。以上结果表明,BsDb保留了其亲本抗体的抗原结合活性,同时对抗原的亲和力并没有因为共价连接而受到损害。
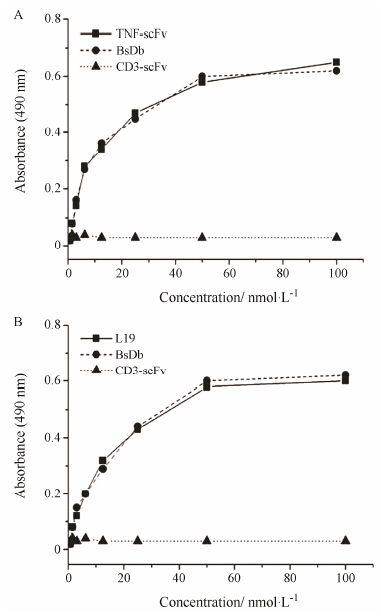
|
Figure 3 Antigen-binding of BsDb. A: Indirect antigen- binding ELISA shows BsDb could bind to human TNF-α with similar affinity to that of TNF-scFv; B: Indirect antigen-binding ELISA shows BsDb could bind to ED-B domain with similar affinity to that of L19. Mean values from three independent experiments are shown by the line |
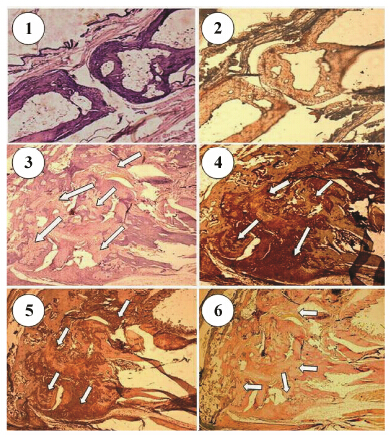
|
Figure 4 Immunostaining of the ED-B fibronectin on the section of normal paws and arthritic paws using BsDb as the first antibody and anti-His tag mAb as the second antibody. 1: A normal joint dyed with haematoxylin and eosin (HE); 2: The same joint stained with BsDb; 3: An arthritic paw dyed with HE. Arrows indicate the pannus formation and erosion of bone and cartilage; 4: The same paw stained with BsDb. Arrows indicate ED-B fibronectin was stained in the pannus; 5: The same paw stained with L19. Arrows indicate ED-B fibronectin was stained in the pannus; 6: The same paw stained with TNF-scFv. Arrows indicate no stain of ED-B fibronectin in the pannus. The normal joint stained with L19 and TNF-scFv is similar to BsDb (data not shown) |
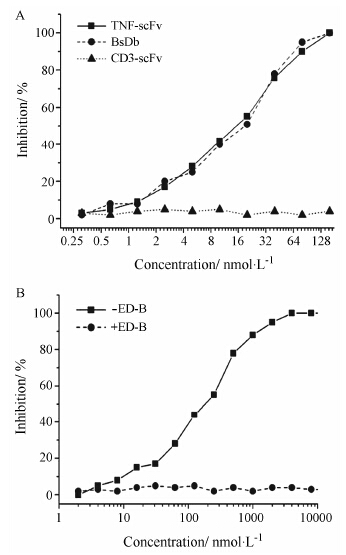
TNF-α对小鼠成纤维细胞L929具有细胞毒作用,于是分析了BsDb对TNF-α细胞毒的抑制作用。如图 5所示,BsDb与TNF-scFv一样,能够有效抑制TNF-α诱导L929细胞的凋亡。抑制率与BsDb及TNF-scFv的剂量正相关。抑制1 ng·mL-1 TNF-α的细胞毒作用,BsDb 50% 抑制的浓度 (IC50) 为20 nmol·L-1,100% 抑制的浓度为160 nmol·L-1。BsDb对TNF-α细胞毒的抑制作用与TNF-scFv相比,没有显著性差异。在生理条件,BsDb必须特异性结合炎症组织中的B-FN,同时还必须中和TNF-α的生理作用,才能发挥靶向治疗的作用。为了模拟体内的这种情形,先在96孔培养板上包被B-FN,然后与BsDb作用,洗去未结合的BsDb。在这种情况下,只有特异性结合B-FN的BsDb才能保留在培养板上并抑制TNF-α的细胞毒。结果表明,即使BsDb与B-FN结合,仍能中和TNF-α的细胞毒作用。相反,如果用大量的游离的B-FN与BsDb一起孵育以抑制BsDb与板上包被的B-FN结合,则不能观察到对TNF-α的细胞毒的抑制作用。说明BsDb可同时结合两种抗原并能中和TNF-α的生理活性。
|
Figure 5 Inhibition of TNF-α action by MTT assay. A: % inhibition of TNF-α cytotoxicity by different concentration of BsDb and TNF-scFv; B: BsDb bound to B-FN able to inhibit TNF-α cytotoxicity. Mean values from three independent experiments are shown by the line |
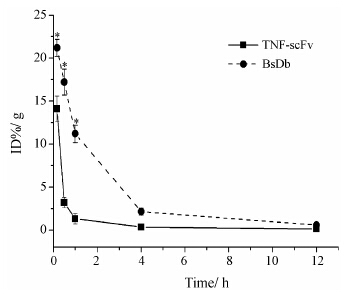
为了验证L19的共价连接可赋予BsDb靶向 RA炎症关节的能力,在小鼠CIA模型上对BsDb和TNF-scFv药动学特征进行了比较研究。BsDb和TNF- scFv在CIA小鼠血浆中的清除见图 6,BsDb为缺乏Fc区的抗体片段的融合蛋白,因而与TNF-scFv相似,快速的从小鼠血浆中清除,拥有较短的血浆半衰期。通过GraphPad Prism 4.0的单相指数消除进行曲线拟合,计算出BsDb的血浆半衰期 (t1/2β) 为(0.50 ± 0.05) h,TNF-scFv的血浆半衰期 (t1/2β) 为 (0.21 ± 0.06) h。BsDb相对于TNF-scFv血浆半衰期有一定的延长,可能是由于L19的共价连接增大了分子量的缘故。
|
Figure 6 Plasma levels of 131I-labeled BsDb and 131I-labeled TNF-scFv after injection to arthritic mice through the tail vain. Each data point represents mean ± SEM (n = 5). **P < 0.01 vs TNF-scFv |
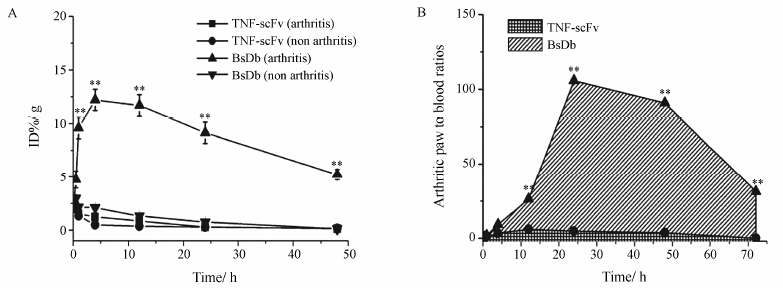
评价药物组织特异性的一个重要指标是药物在靶组织中的积累和保留作用。BsDb和TNF-scFv在炎症关节和正常关节中的摄取动力学曲线见图 7。BsDb在小鼠炎症足中的迅速积累,并在注射后4 h到达最高,但未发现BsDb在正常足中积累。单个炎症足最高平均摄取 (12.2 ± 1.50) % ID/g的BsDb,是同时间点正常足摄取量的6倍多。48 h仍然有 (5.23 ± 1.00) % ID/g的BsDb保留于炎症足中,是同时间点正常足 中摄取量的近50倍。TNF-scFv在炎症足中没有积累作用,单个炎症足对TNF-scFv的最大摄取为 (2.42 ± 0.50) % ID/g,发生在注射后30 min,48 h后几乎完全从炎症足中清除。TNF-scFv在正常足中的摄取表现为相似的结果。这些结果表明,BsDb可选择性的积累于CIA小鼠的炎症关节,并能够在炎症关节中保留较长的时间。说明L19的共价连接赋予了TNF-scFv对炎症关节的组织特异性。
|
Figure 7 Uptake kinetics of 131I-labeled BsDb and 131I-labeled TNF-scFv in arthritic paws and normal paws of mice and ratios of the %ID/g in arthritis paw to the %ID/g in blood. A: Uptake kinetics of 131I-labeled BsDb and 131I-labeled TNF-scFv in arthritic paws and normal paws after intravenous injection; B: Ratios of the %ID/g of 131I-labeled BsDb and the %ID/g of 131I-labeled TNF-scFv in arthritic paws to the %ID/g in blood at different time points after injection. Data are expressed as mean ± SEM (n = 5). **P < 0.01 vs TNF-scFv |
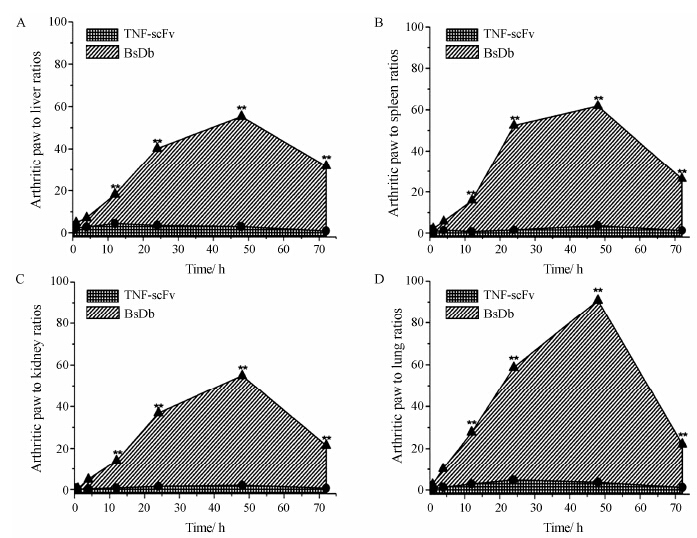
另一个用于评价药物组织特异性的重要指标是药物在靶组织中的摄取与血浆及正常组织中摄取的比率,即靶血比和靶组比。BsDb和TNF-scFv在注 射后不同时间的靶血比如图 7所示。BsDb在24 h 靶血比最大 (101∶1),其次为48 h (87.1∶1) 及72 h (31.3∶1),如此高的靶血比显然是因为BsDb在炎症关节中特异性积累和停留,同时在血浆中快速清除造成的。然而作者未发现TNF-scFv具有如此高的靶血比。BsDb快速从正常组织中清除,同样具有较高的靶组比。如图 8所示,BsDb在炎症关节与肝脏中 的分布比率 (靶肝比) 最高为52.3∶1,靶肾比最高为52.8∶1,靶脾比为58.1∶1,靶肺比为87.1∶1。而TNF-scFv却没有如此高的靶组比。这些结果表明,BsDb对炎症关节具有较高的组织特异性,即选择性分布于炎症关节,低暴露于正常组织。
|
Figure 8 Ratios of the %ID/g of 131I-labeled BsDb and %ID/g of 131I-labeled TNF-scFv in arthritic paws to the %ID/g in normal tissues of mice at different time points after injection. Arthritic paw to liver (A),spleen (B),kidney (C),and lung (D). Data are expressed as mean ± SEM (n = 5). **P < 0.01 vs TNF-scFv |
TNF-α单抗用于临床已接近20年时间,疗效确切。经历了鼠源单抗、人鼠嵌合单抗,人源单抗的发展历程,逐步解决了抗体免疫原性的问题,有效的提高了抗体的疗效[28]。但其不良的药动学特征是目前亟待解决的问题,因为它导致了不可忽视的不良反应,表现为RA患者长期用药发生严重感染和恶性肿瘤[7, 8]。小分子抗体片段保留了完整抗体结合抗原的特异性,具有较短的血浆半衰期,对正常组织毒性低,是构建组织特异性药物运载体系的良好载体。而作为病理修饰的胞外基质 (ECM) B-FN具有丰富、稳定和高度组织特异性等特点,是有效靶向恶性肿瘤和慢性炎症的优良抗原[11, 12, 13, 14, 15, 16, 17, 18, 19]。这些发现促使作者构建抗TNF-α/抗ED-B的单链双特异抗体,目的是利用L19特异性结合炎症组织中ED-B的作用将抗TNF-α单链抗体片段靶向导入炎症组织,从而改善其组织特异性。
通过DNA重组技术共价连接TNF-scFv和L19,形成一种新型的双特异抗体BsDb,并在大肠杆菌中实现了BsDb的高效表达。通过IMAC纯化和体外的复性制备,获得了BsDb的功能蛋白。体外生物学活性分析表明,BsDb可同时结合TNF-α及B-FN,并中和TNF-α的生理效应,而且BsDb对两种抗原的亲和力与其亲本抗体相似,说明双特异抗体BsDb构建成功。遗憾的是,BsDb在大肠杆菌形成了包涵体,需要复杂的复性过程才能获得活性蛋白,这不利于其制备和工业化生产。ScFv在大肠杆菌中形成包涵体是一个较为普遍的现象[29],因其二硫键较多,在大肠杆菌中难以形成正确配对和构象。在后期工作中,作者将尝试新的表达系统。已有多种双特异抗体在毕赤酵母中分泌表达的报道[30, 31, 32],因为毕赤酵母不仅具有真核细胞多种翻译后的修饰功能,如折叠、二硫键形成、糖基化及分泌等,而且还能象原核细胞一样高密度的培养,与大肠杆菌或其它的真核表达系统相比在重组蛋白的生产上具有无可替代的优势,毕赤酵母表达系统或许能解决BsDb的生产问题。药动学研究发现,BsDb保持了小分子抗体片段快速从血浆和正常组织清除的特性,血浆半衰期大约为0.5 h,而大多数IgG在小鼠体内的血浆半衰期在30 h左右[33],这与以前报道的抗体片段因缺乏Fc而在血浆和组织中的清除要显著快于完整的单抗一致[33]。然而,与其他L19作为载体的重组蛋白[20, 21]相似,BsDb能够选择性 的积累于CIA小鼠的炎症关节,并可保留于炎症关节72 h以上,这种高效积累和长时间的保留作用使得BsDb具有较高的靶血比和靶组比,说明BsDb具备了高度的靶组织特异性和正常组织的低毒性,也说明本研究达到了预期目标。
作者已证实了TNF-scFv及其多价抗体能显著的改善小鼠CIA,相信通过L19的融合提高其组织特 异性,BsDb在疗效上将会具有更加出色的表现。构 建的BsDb具有优越的药动学特征,代表未来RA生物治疗剂的一个发展方向。它将有效克服目前上市的TNF-α单抗在炎症组织摄取过低、过长暴露于正常组织、不良反应较大的缺点,在RA及其他自身免疫疾病的治疗上具有广阔的应用前景。因此,本研究为BsDb临床前期研究打下了坚实的基础。
| [1] | Armuzzi A, Lionetti P, Blandizzi C, et al. Anti-TNF agents as therapeutic choice in immune-mediated inflammatory diseases: focus on adalimumab [J]. J Immunopathol Pharmacol, 2014, 27 (1 Suppl): 11-32. |
| [2] | Meroni PL, Valesini G. Tumour Necrosis Factor α Antagonists in the Treatment of Rheumatoid Arthritis: An Immunological Perspective [J]. BioDrugs, 2014, 28 (Suppl 1): 5-13. |
| [3] | Papoutsaki M, Costanzo A. Treatment of psoriasis and psoriatic arthritis [J]. BioDrugs, 2013, 27 (Suppl 1): 3-12. |
| [4] | Fiorino G, Danese S, Pariente B, et al. Paradoxical immune-mediated inflammation in inflammatory bowel disease patients receiving anti-TNF-α agents [J]. Autoimmun Rev, 2014, 13: 15-19. |
| [5] | Choy EH, Connolly DJ, Rapson N, et al. Pharmacokinetic, pharmacodynamic and clinical effects of a humanized IgG1 anti-CD4 monoclonal antibody in the peripheral blood and synovial fluid of rheumatoid arthritis patients [J]. Rheumatology (Oxford), 2000, 39: 1139-1146. |
| [6] | Tabrizi M, Bornstein GG, Suria H. Biodistribution mechanisms of therapeutic monoclonal antibodies in health and disease [J]. AAPS J, 2010, 12: 33-43. |
| [7] | Alawneh KM, Ayesh MH, Khassawneh BY, et al. Anti-TNF therapy in Jordan: a focus on severe infections and tuberculosis [J]. Biologics, 2014, 8: 193-198. |
| [8] | Askling J, van Vollenhoven RF, Granath F, et al. Cancer risk in patients with rheumatoid arthritis treated with anti-tumor necrosis factor alpha therapies: does the risk change with the time since start of treatment? [J]. Arthritis Rheum, 2009, 60: 3180-3189. |
| [9] | Cuesta AM, Sainz-Pastor N, Bonet J, et al. Multivalent antibodies: when design surpasses evolution [J]. Trends Biotechnol, 2010, 28: 355-362. |
| [10] | Carnemolla B, Balza E, Siri A, et al. A tumor-associated fibronectin isoform generated by alternative splicing of messenger RNA precursors [J]. J Cell Biol, 1989, 108: 1139- 1148. |
| [11] | Galler K, Junker K, Franz M, et al. Differential vascular expression and regulation of oncofetal tenascin-C and fibronectin variants in renal cell carcinoma (RCC): implications for an individualized angiogenesis-related targeted drug delivery [J]. Histochem Cell Biol, 2012 137: 195-204. |
| [12] | Ventura E, Sassi F, Parodi A, et al. Alternative splicing of the angiogenesis associated extra-domain B of fibronectin regulates the accessibility of the B-C loop of the type III repeat 8 [J]. PLoS One, 2010, 5: e9145. |
| [13] | Sauer S, Erba PA, Petrini M, et al. Expression of the oncofetal ED-B-containing fibronectin isoform in hematologic tumors enables ED-B-targeted 131I-L19SIP radioimmunotherapy in Hodgkin lymphoma patients [J]. Blood, 2009, 113: 2265-2274. |
| [14] | Castellani P, Viale G, Dorcaratto A, et al. The fibronectin isoform containing the ED-B oncofetal domain: a marker of angiogenesis [J]. Int J Cancer, 1994, 59: 612-618. |
| [15] | Mortara L, Orecchia P, Castellani P, et al. Schedule-dependent therapeutic efficacy of L19mTNF-α and melphalan combined with gemcitabine [J]. Cancer Med, 2013, 2: 478-487. |
| [16] | Locher R, Erba PA, Hirsch B, et al. Abundant in vitro expression of the oncofetal ED-B-containing fibronectin translates into selective pharmacodelivery of 131I-L19SIP in a prostate cancer patient [J]. J Cancer Res Clin Oncol, 2014, 140: 35-43. |
| [17] | Poli GL, Bianchi C, Virotta G, et al. Radretumab radioimmunotherapy in patients with brain metastasis: a 124I-L19SIP dosimetric PET study [J]. Cancer Immunol Res, 2013, 1: 134-143. |
| [18] | Kriegsmann J, Berndt A, Hansen T, et al. Expression of fibronectin splice variants and oncofetal glycosylated fibronectin in the synovial membranes of patients with rheumatoid arthritis and osteoarthritis [J]. Rheumatol Int, 2004, 24: 25-33. |
| [19] | Claudepierre P, Allanore Y, Belec L, et al. Increased Ed-B fibronectin plasma levels in spondyloarthropathies: comparison with rheumatoid arthritis patients and a healthy population [J]. Rheumatology (Oxford), 1999, 38: 1099-1103. |
| [20] | Trachsel E, Bootz F, Silacci M, et al. Antibody-mediated delivery of IL-10 inhibits the progression of established collagen-induced arthritis [J]. Arthritis Res Ther, 2007, 9: R9. doi: 10.1186/ar2115. |
| [21] | Ventura E, Balza E, Borsi L, et al. Selective targeted delivery of the TNF-alpha receptor p75 and uteroglobin to the vasculature of inflamed tissues: a preliminary report [J]. BMC Biotechnol, 2011. doi: 10.1186/1472-6750-11-104. |
| [22] | Vollmer S, Vater A, Licha K, et al. Extra domain B fibronectin as a target for near-infrared fluorescence imaging of rheumatoid arthritis affected joints in vivo [J]. Mol Imaging, 2009, 8: 330-340. |
| [23] | Liu M, Wang X, Yin C, et al. One-step on-column purification and refolding of a single-chain variable fragment (scFv) antibody against tumour necrosis factor alpha [J]. Biotechnol Appl Biochem, 2006, 43 (Pt 3): 137-145. |
| [24] | Liu M, Wang X, Yin C, et al. Targeting TNF-alpha with a tetravalent mini-antibody TNF-TeAb [J]. Biochem J, 2007, 406: 237-246. |
| [25] | Liu M, Wang X, Yin C, et al. A novel bivalent single-chain variable fragment (scFV) inhibits the action of tumour necrosis factor alpha [J]. Biotechnol Appl Biochem, 2008, 50 (Pt 4): 173-179. |
| [26] | Yoshimura S, Asano K, Nakane A. Attenuation of collagen-induced arthritis in mice by salmon proteoglycan [J]. Biomed Res Int, 2014. doi: 10.1155/2014/406453. |
| [27] | Chang SK, Gu Z, Brenner MB. Fibroblast-like synoviocytes in inflammatory arthritis pathology: the emerging role of cadherin-11 [J]. Immunol Rev, 2010, 233: 256-266. |
| [28] | Chan AC, Carter PJ. Therapeutic antibodies for autoimmunity and inflammation [J]. Nat Rev Immunol, 2010, 10: 301-316. |
| [29] | Boeggeman EE, Ramakrishnan B, Qasba PK. The N-terminal stem region of bovine and human beta 1, 4-galactosyltransferase I increases the in vitro folding efficiency of their catalytic domain from inclusion bodies [J]. Protein Expr Purif, 2003, 30: 219-229. |
| [30] | Luo D, Mah N, Wishart D, et al. Construction and expression of bi-functional proteins of single-chain Fv with effector domains [J]. J Biochem, 1996, 120: 229-232. |
| [31] | Jafari R, Holm P, Piercecchi M, et al. Construction of divalent anti-keratin 8 single-chain antibodies (sc(Fv)(2)), expression in Pichia pastoris and their reactivity with multicellular tumor spheroids [J]. J Immunol Methods, 2011, 364: 65-76. |
| [32] | Jorgensen ML, Friis NA, Just J, et al. Expression of single-chain variable fragments fused with the Fc-region of rabbit IgG in Leishmania tarentolae [J]. Microb Cell Fact, 2014. doi: 10.1186/1475-2859-13-9. |
| [33] | Caravella J, Lugovskoy A. Design of next-generation protein therapeutics [J]. Curr Opin Chem Biol, 2010, 14: 520-528. |
 2014, Vol. 49
2014, Vol. 49


