2. 中国医学科学院、北京协和医学院, 药物研究所, 北京 100050
2. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
流感病毒由于其传染性强、种类繁杂、演变速度快,成为威胁人类健康的最易变异的病原体之一。传统的流感治疗药物是针对病毒靶点的,如M2离子通道抑制剂以及神经氨酸酶抑制剂 (neuraminidase inhibitors,NAIs)[1]。由于流感病毒高突变率以及病毒之间重组现象的发生,已有的抗流感药物难以应对多变的流感病毒,也导致了流感病毒对疫苗作用的逃逸[2]。针对病毒靶点药物的大量使用进一步加速了流感耐药株的出现。因此,新型作用机制抗流感药物的研发尤为迫切。
与病毒蛋白相比,参与病毒复制的宿主因子相对不易产生变异,而且病毒复制所必须的一些宿主因子对宿主细胞并非至关重要,这些因子是治疗干预的极好靶点[3]。此外,流感病毒感染细胞后宿主免疫系统将做出一系列的反应,如天然免疫识别信号通路和干扰素系统被激活。因此调节宿主环境使之抑制病毒增殖的策略可限制病毒耐药性的发展。
目前针对宿主的抗流感病毒靶点可分为3类: 第一类是流感病毒复制中起作用的宿主靶点和信号通路,阻断病毒和宿主之间的相互作用可干扰流感病毒的复制; 第二类是流感病毒感染后发挥天然免疫作用的宿主免疫因子,可用于抵抗流感病毒的感染; 第三类是与流感引起的免疫失调和组织损伤相关的宿主调节靶点,可用于抑制过度的炎症反应,使天然免疫系统正常发挥作用。
1 流感病毒复制所需的宿主靶点 1.1 流感病毒复制周期所需的宿主蛋白流感病毒的生活周期包括病毒的吸附、穿入、脱衣、mRNA的合成、蛋白质的合成、vRNA的复制、病毒颗粒的组装和释放。如图 1所示,上述复制周期的各个阶段均需要宿主蛋白的帮助。
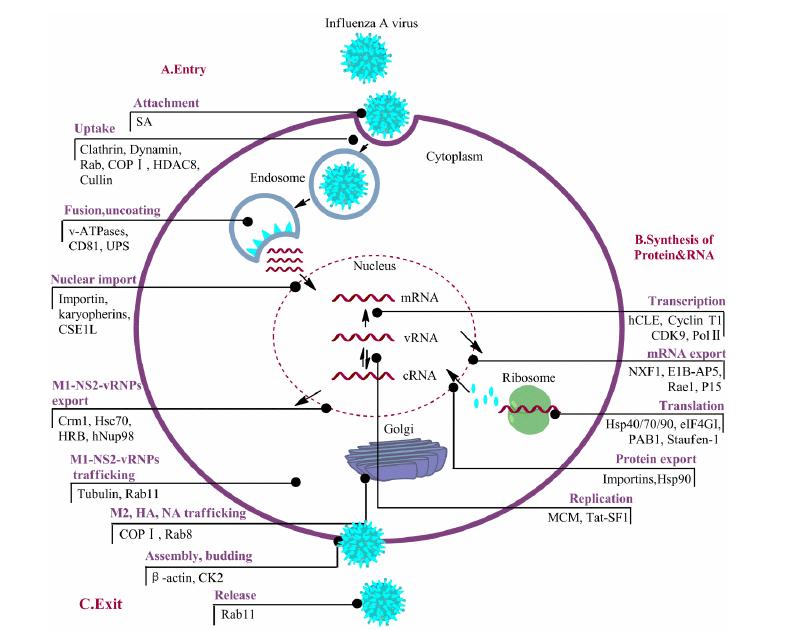 |
图 1 流感复制周期中所需的宿主蛋白 |
在入胞阶段,有些宿主因子在病毒吸附于宿 主细胞的过程中发挥作用,如流感病毒的主要受 体唾液酸 (siallic acid,SA),可被病毒膜蛋白血凝素 (haemagglutinin,HA) 识别并结合; 有些参与病毒进入细胞的过程,如参与囊泡形成的网格蛋白 (clathrin),动力蛋白 (dynamin) 等[4]; 有些参与流感病毒在内吞体间的运输以及从内吞体到核周的运输,如Rab蛋白、COPI复合体、组氨酸脱乙酰酶8 (histone deacetylase 8,HDAC8)、骨架蛋白Cullin等[5, 6, 7]; 有 些参与流感病毒与内吞体的融合及脱衣过程,如v-ATPases、分化抗原簇81 (cluster of differentiation 81,CD81) 和泛素蛋白酶系统 (ubiquitin proteasome system,UPS)[8, 9, 10],另外还有一些宿主因子参与vRNPs的入核过程,如识别核定位信号的蛋白Importin、核转运蛋白Karyopherins及调控其核质间循环的染色体分离1样蛋白 (CSE1 chromosome segregation 1-like,CSE1L) 等[11,12]。
vRNPs进入细胞核后,在细胞CLE人同源物 (cellular human homolog of CLE,hCLE)、细胞周期 蛋白T1 (cyclin T1)、细胞周期依赖激酶9 (cyclin- dependent kinase 9,CDK9) 和RNA聚合酶Ⅱ (RNA polymeraseⅡ,PolⅡ) 等核内宿主因子的作用下完成vRNA转录[13]。接着经多种宿主因子的剪切,加工完成的病毒mRNA在细胞因子核mRNA输出因子1 (nuclear mRNA export factor 1,NXF1)、异种核蛋白U样蛋白1 (heterogeneous nuclear ribonucleoprotein U-like protein 1,E1B-AP5)、mRNA输出因子1 (mRNA export factor 1,Rae1) 及NTF2相关输出蛋白1 (NTF2-related export protein 1,P15) 等一系列蛋白的帮助下通过核孔复合体转运至胞质[5]。mRNA转运出核后,在核糖体上经多种监管蛋白和分子伴侣的控制进行蛋白质的合成,如热休克蛋白40 (40 kDa heat shock protein,Hsp40)、Hsp70、Hsp90[14, 15, 16],NS1与真核 延伸因子4GI (eukaryotic initiation factor 4GI,eIF4GI)、多聚腺苷酸结合蛋白 (polyadenylate-binding protein cytoplasmic,PAB1)、双链RNA结合蛋白Staufen-1相互作用以稳定核糖体[17]。组成vRNPs的4种流感病毒蛋白聚合酶B1 (polymerase B1,PB1)、聚合酶B2 (polymerase PB2,PB2)、聚合酶A (polymerase A,PA) 和核衣壳蛋白 (nucleoprotei n,NP) 在Importins和Hsp90调控下进行核转位[11,18],并与细胞的微型染色体维持复合体IREF-1 (minichromosome maintenance complex IREF-1,MCM) 以及Tat特异因子1 (Tat- specific factor 1,Tat-SF1) 相互作用起始vRNA的复制,进而形成新的vRNPs[19,20]。
M1-NS2-vRNPs复合体在染色体区域维持因子1 (chromosome region maintenance 1,Crm1)、热休克同源蛋白70 (70 kDa heat shock cognate,Hsc70)、人类免疫缺陷病毒快速结合因子 (human immunodeficiency virus rev-binding,HRB) 和人核孔蛋白98 (human nucleoporin 98,hNup98) 等蛋白的帮助下通过核孔复合体转运至胞质[21, 22, 23],再被微管蛋白和Rab11转运到质膜[24]。新合成的M2、HA和NA也在COPI和Rab8的协助下由高尔基体转运至质膜区域,在质膜上组装成病毒颗粒[12]。组装好的病毒在β-actin、酪蛋白激酶Ⅱ (casein kinase 2,CK2) 和脂类的帮助下出芽。随后NA切割细胞表面唾液酸,在Rab11的调控下释放病毒颗粒[25]。
1.2 参与流感病毒复制的信号通路在流感病毒感染早期,细胞中一系列的信号通路被激活。有些通路是抗病毒免疫应答的重要组分,而有些通路是病毒复制所必须的,这些信号通路几乎参与流感病毒生命周期中各个阶段的活动[26]。目前研究较多的信号通路包括Ras/Raf/丝裂原激活蛋白激酶/细胞外信号调节激酶 (Ras/Raf/mitogen activated protein kinase/ extracellular regulated protein kinase,Ras/Raf/MEK/ ERK)、核因子-κB (nuclear factor-kappa B,NF-κB)、蛋白激酶C (protein kinase C,PKC) 和磷酸肌醇-3激酶/蛋白激酶B (phosphoinositide-3-kinase/protein kinase B,PI3K/AKT)。抑制参与流感病毒复制的信号通路可以作为抗病毒药物研究的重要方向。
Ras/Raf/MEK/ERK信号通路属于丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK) 级联反应途径,MAPK级联反应的激活是流感病毒感染的一个特点。研究表明,流感病毒HA在细胞膜表面的积累促使MAPK途径的活化,从而使RNP有效运出[26,27]。特异的MAPK/ERK途径的抑制剂U0126会使病毒RNP复合体滞留在核中并且影响核输出蛋白NS2的功能[28]。
NF-κB信号通路是流感病毒感染后激活的另一个重要的细胞通路。虽然NF-κB被认为是天然免疫的重要因子[29],研究表明此通路被阻抑反而使流感病毒的复制受损。NF-κB通过诱导促凋亡因子如肿瘤坏死因子相关细胞凋亡诱导配体 (tumor necrosis factor related apoptosis inducing ligand,TRAIL)、FasL以及活化caspase发挥作用,这一过程促进病毒RNPs从细胞核中运出。另外,NF-κB还不同程度的调节病毒RNA的合成,促进病毒的复制[27]。NF-κB抑制剂除了有直接的抗病毒作用外,还会抑制高致病流感病毒感染细胞后细胞因子和趋化因子的过度产生,从而间接影响流感的发展[30]。
PKC属于丝氨酸/苏氨酸激酶大家族,在钠离子转运过程中起重要作用,对维持内吞体的低pH是非常必要的,因此PKC途径在包膜病毒通过受体介导的内吞作用进入细胞这一过程中发挥关键作用[26]。在流感病毒感染时,HA可快速激活PKC,因此PKC抑制剂可阻止流感病毒进入细胞[27]。
PI3K/AKT信号通路是病毒在感染期用来减慢凋亡速度和延长复制时间的策略之一[31]。在流感感染的细胞中,PI3K的活化受到病毒NS1蛋白的调节,NS1蛋白结合P85β亚基并引起PI3K依赖的AKT的磷 酸化[32]。AKT直接磷酸化caspase 9使其失活。AKT同样磷酸化另一个凋亡调节因子肝糖原合成酶激酶(glycogen synthase kinase-3β,GSK-3β) 并使其失活,最终病毒引起的凋亡反应被活化的AKT通路抑制。PI3K/AKT信号通路还通过P53依赖的途径和负向调节c-Jun氨基末端激酶 (c-Jun N-terminal kinase,JNK) 通路保护细胞避免快速凋亡[33]。
流感病毒利用细胞内的多种宿主因子和信号通路完成其自身的复制,目前应用全基因组siRNA筛选、基因组学、蛋白组学和生物信息学确定了大量病毒复制过程中所依赖的宿主因子,抑制这些宿主因子或阻断相关的信号通路可以减弱流感病毒的复制并且阻止流感耐药突变的发展。
2 发挥天然免疫功效的宿主靶点及信号通路流感病毒不仅利用宿主细胞的各类蛋白和信号通路帮助其自身复制,感染宿主后还会引起宿主一系列的天然免疫应答。天然免疫系统是宿主第一道防 线,对抵抗流感病毒至关重要,天然免疫中参与病毒防御的机制包括体液防御和细胞防御。体液调节因子主要包括唾液酸为基础的抑制剂、钙依赖的凝集素抑制剂、抗菌肽、天然IgM和补体等,这些调节因子在病毒防御机制中的作用已有大量总结性报道[34,35]。因此,这里主要就细胞内先天免疫调节通路,以及与此相关的免疫调节靶点进行阐述。
2.1 细胞内的先天免疫调节通路细胞针对流感病毒的感染会引起一系列的天然免疫应答,首先细胞要识别流感病毒并激活反应通路,然后细胞的干扰素系统被活化从而发挥其抗病毒的效果,另外凋亡和自噬通路也参与病毒引起的反应并促发免疫应答。
细胞内针对病毒的天然免疫应答是通过识别病原体相关分子模式 (pathogen-associated molecular patterns,PAMPs) 促发的。如图 2所示,细胞内至少存在3种通路识别感染的流感病毒并对其作出反应: RIG-1样受体 (retinoic acid-inducible gene 1 protein like helicases,RLR) 途径、Toll样受体 (toll-like receptors,TLR) 途径和NOD样受体 (nucleotide oligomerization domain like receptors,NLR) 途径。
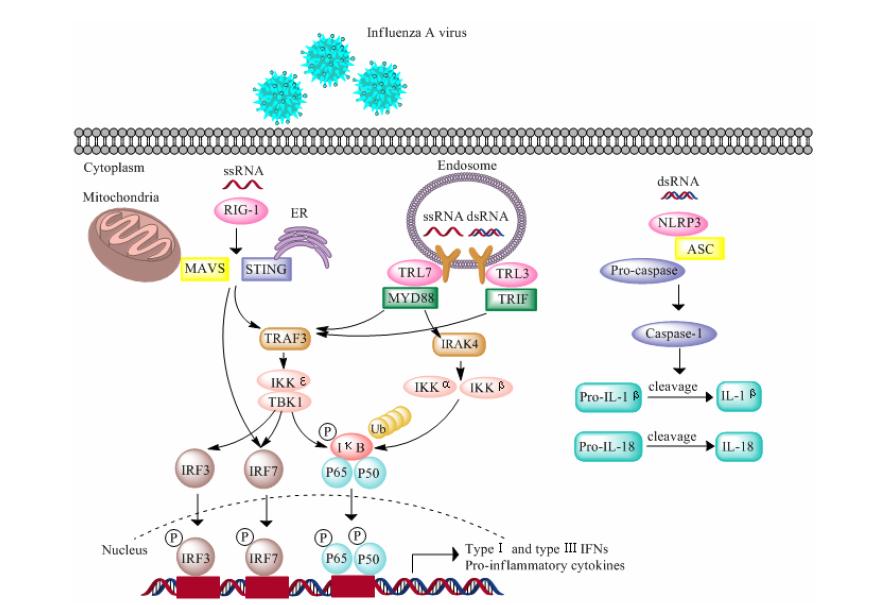 |
图 2 细胞中针对流感病毒的先天免疫识别通路 |
RIG-1是一种胞质蛋白,可识别带5'-帽子的流感病毒单链RNA (single stranded RNA,ssRNA),接着激活线粒体抗病毒信号蛋白 (mitochondrial antiviral signaling protein,MAVS),MAVS与内质网上的干扰素刺激因子 (stimulator of interferon genes,STING) 相互作用进一步激活了NF-κB和干扰素调节因子3/7 (interferon regulatory factor 3/7,IRF3/7),而促使I型和 Ⅲ 型干扰素和促炎细胞因子产生[36]。TLR 途径中,TLR3和TLR7在细胞表面或内吞体中识别病毒RNA,TLR7识别ssRNA并通过髓样分化因子88 (myeloid differentiation factor88,MyD88) 激活下游通路,而TLR3识别流感病毒双链RNA (double stranded RNA,dsRNA),通过含TIR的衔接子 (TIR containing adapter,TRIF) 激活下游通路并诱导干扰素产生。NLR通路中,含热蛋白结构域NOD样受体3 (NOD-like receptor pathway pyrin domain containing 3,NLRP3) 和凋亡相关斑点样蛋白 (apoptosis-associated speck- like protein,ASC) 组成的胞质炎症复合体结合并激活caspase-1,促使白介素-1β (interleukin-1β,IL-1β) 和白介素-18 (interleukin-18,IL-18) 产生[37]。
TLR和RIG-1通路激活最终导致细胞因子、趋化因子和干扰素转录增加,从而招募中性粒细胞,激活巨噬细胞并使树突状细胞成熟。Ⅰ型干扰素和 Ⅲ 型干扰素作用于同一或邻近细胞的IFN受体,激活一系列的抗病毒级联反应,包括酪氨酸激酶2 (tyrosine kinase 2,TK2)、酪氨酸激酶1 (janus kinase 1,JAK1) 和磷酸化信号传导及转录激活因子1/2 (signal transducers and activators of transcription 1/2,STAT1/2),从而诱导上百种含干扰素刺激反应元件 (interferon stimulating response elements,IRSE) 的基因转录[38],进而激活大量抗病毒相关基因的表达,如2',5'-寡腺苷酸合成酶 (oligoadenylate synthetase,OAS)、双链RNA依赖性蛋白激酶 (double-stranded RNA-dependent protein kinase,PKR)、IFN诱导跨膜蛋白3 (IFN-inducible transmembrane protein 3,IFITM3)、tetherin、viperin和Mx蛋白[36]。另外,P53直接调控单核细胞趋化蛋白1 (monocyte chemoattractant protein-1,MCP-1)、干扰素调节因子9 (interferon regulatory factor 9,IRF9)、PKR和干扰素刺激基因15 (interferon stimulated gene15,ISG15) 的基因表达,这些基因在抗病毒反 应起始阶段发挥重要作用[39]。病毒感染树突状细胞 (dendritic cells,DCs) 后导致RIG-1和TLR7活化从 而促进IL-1β和IL-23的释放,这些细胞因子协同作用促使恒定自然杀伤细胞 (invariant natural killer T,iNKT) 产生免疫调节相关的细胞因子如IFN-γ和IL-22,它们将增强天然和适应性免疫应答[40]。IFN-γ作为反应调节细胞因子,可促使DCs和人胆管上皮细胞 (biliary epithelial cells,BECs) 产生炎症细胞因子从而招募巨噬细胞和中性粒细胞到感染和炎症部位。
近期研究表明,在流感感染的短期内抑制凋亡通路PI3K/AKT上调,而后期促进凋亡基因P53和caspase 3活化,因此推断流感在感染的早期对细胞凋亡的抑制可保证病毒RNA和蛋白最大量的产生,而感染后期细胞凋亡的加速又可促进病毒的扩散。阻断caspase 3或NF-κB的活化可使病毒核糖核蛋白滞留在细胞核中从而抑制病毒的复制[41]。另外,自噬也参与了病原体感染细胞所产生的反应,引发细胞产生天然和适应性免疫应答。病毒以不同的方式干扰细 胞的自噬过程,通常是与一个关键的自噬相关蛋白beclin-1相互作用实现的,beclin-1参与自噬体的形成和自噬体与溶酶体的融合过程[34]。
基于对流感病毒引起的天然免疫的探索和理解,应合理地利用天然免疫反应来防控流感。如刺激天然免疫反应 (如活化TLRs) 或许是增加流感疫苗有效性的重要方式,激活干扰素系统利用抗病毒蛋白抑制流感病毒也是一种可行的抗流感策略。
2.2 抑制过度炎症反应的免疫调节靶点虽然天然免疫系统可以对病毒感染做出一系列有利于机体的保护反应,但它并不总能成功地使机体抵御流感造成的损伤,甚至造成过度的炎症反应,导致机体的严重损伤。一些高致病性的病毒如H5N1毒株,可以引起细胞因子失调,造成肺组织损伤和引发系统性疾病。抑制过度炎症反应的免疫调节靶点可帮助机体 抵御炎症造成的损伤。目前研究的这类靶点有环氧合酶-2 (cyclooxygenase-2,COX-2)、鞘氨醇-1-磷酸盐 (sphingosine-1-phosphate,S1P)、过氧化物酶体增殖物激活受体 (peroxisome proliferator activated receptor,PPAR) 和高迁移率族蛋白B1 (high-mobility group box 1,HMGB1) 等。
COX-2因为参与炎症和免疫应答常作为抗炎药物的靶点。COX-2被证实在H5N1引起的促炎反应中起调节作用,选择性COX-2的抑制剂不但抑制炎症因子的过度产生,还抑制H5N1流感病毒的复制[42],因此调节COX-2可达到抑制病毒复制和免疫调节的双重作用。
S1P是G蛋白偶联受体中一个家族的配体,在 炎症和免疫方面起重要作用。S1P受体激动剂AAL-R可抑制细胞因子反应并减少肺损伤,从而使保护性的免疫应答维持其效果[43,44]。
PPAR是核激素受体,其中一个亚型PPAR-γ参与调节细胞因子的产生。激活PPAR-γ受体可以抑制肿瘤坏死因子 (tumor necorsis factors α,TNFα)、IL-1β、IL-6、诱导型一氧化氮合酶 (inducible nitric oxide synthase,iNOS) 等细胞因子的产生,因此PPAR激动剂可调节病毒感染后引起的炎症反应,减弱免疫紊乱和组织损伤[45,46]。
核因子HMGB1可由免疫细胞主动分泌而来,也可从坏死细胞中被动释放而作为外源性的炎症细胞因子[47]。在流感病毒感染的细胞中,HMGB1可以造成过度的炎症反应从而加重流感感染的程度。HMGB1和病毒NP蛋白相互作用,从而使vRNPs被招募到染色质的转录活性位点上,支持病毒的有效转录和复制[48,49]。因此HMGB1抑制剂可以作为减弱炎症和抑制流感的新策略。
天然免疫应答最佳的结果是阻止病毒的散播,既不造成过度的炎症反应又能促进防止同一毒株感染的适应性应答。针对上述靶点的免疫调节剂可使免疫应答回归至稳态,因此通过调控这类靶点可使天然免疫系统更好的发挥作用,避免过度炎症对机体的损伤。
3 总结与展望由于流感耐药性的产生,直接针对病毒蛋白的抗流感药物越来越难以发挥其效果,因此与流感相关的宿主靶点的研究成为现今研究的热点。流感病毒通过与细胞内的一些蛋白相互作用或借助一些信号通路帮助其自身有效复制,与此同时,面对流感病毒的感染,宿主细胞的免疫机制被激活以防御入侵的病毒,而高致病性的流感病毒会引发过度的炎症反应[50,51]。因此目前抗流感药物宿主靶点的研究目标主要是针对参与流感病毒复制或天然免疫调节的宿主因子。
鉴于此,未来针对宿主靶点的抗流感药物的研究策略可包括: ① 阻断病毒与宿主之间的相互作用,以抑制流感病毒的复制。这需更深层次地了解病毒与宿主的相互作用关系网络,确定流感病毒复制各个阶段所需要的宿主蛋白,以及参与流感病毒复制的信号通路,通过抑制这些蛋白或通路达到抗流感的作用。② 应用具有天然免疫活性的药物,如体液中的抗菌肽、防御素等,另外药物设计也可控制细胞对病毒的信号识别通路、干扰素系统、自噬和凋亡通路等来抑制流感病毒。但在药物设计时要注意进行合理优化,确保其抗病毒效果不会引发过度的炎症反应。③ 在严重的流感感染情况下,应用抑制过度炎症反应的药物从而避免流感病毒引起的免疫失调和组织损伤,如抑制NF-κB信号通路、COX-2靶点等。④ 可以考虑联合用药来增强药物的抗病毒效果以及防止病毒耐药的产生,即将针对病毒靶点的药物和宿主靶点的药物或影响宿主细胞功能的药物合用,如金刚烷胺、利巴韦林和奥塞米韦联合用药治疗H1N1的疗效比单独用药的疗效好[52]; 还可以将直接针对靶点的药物和抗炎药物合用,以达到更好地抑制流感病毒的效果。总之,针对宿主靶点的新治疗策略将会在未来流感的治疗和预防中发挥其重要的优势。
| [1] | Zhang Q, Zhao QJ, Xiong RS, et al. Research progress of anti-influenza virus agents [J]. Acta Pharm Sin (药学学报), 2010, 45: 289-299. |
| [2] | Sheu TG, Fry AM, Garten RJ, et al. Dual resistance to adamantanes and oseltamivir among seasonal influenza A (H1N1) viruses: 2008-2010 [J]. J Infect Dis, 2011, 203: 13-17. |
| [3] | Baillie JK, Digard P. Influenza-time to target the host? [J]. N Engl J Med, 2013, 369: 191-193. |
| [4] | Edinger TO, Pohl MO, Stertz S. Entry of influenza A virus: host factors and antiviral targets [J]. J Gen Virol, 2014, 95: 263-277. |
| [5] | Müller KH, Kakkola L, Nagaraj AS, et al. Emerging cellular targets for influenza antiviral agents [J]. Trends Pharmacol Sci, 2012, 33: 89-99. |
| [6] | Yamauchi Y, Boukari H, Banerjee I, et al. Histone deacetylase 8 is required for centrosome cohesion and influenza A virus entry [J]. PLoS Pathog, 2011, 7: e1002316. |
| [7] | Huotari J, Meyer-Schaller N, Hubner M, et al. Cullin-3 regulates late endosome maturation [J]. Proc Natl Acad Sci USA, 2012, 109: 823-828. |
| [8] | Bertram S, Glowacka I, Steffen I, et al. Novel insights into proteolytic cleavage of influenza virus hemagglutinin [J]. Rev Med Virol, 2010, 20: 298-310. |
| [9] | He J, Sun E, Bujny MV, et al. Dual function of CD81 in influenza virus uncoating and budding [J]. PLoS Pathog, 2013, 9: e1003701. |
| [10] | Widjaja I, de Vries E, Tscherne DM, et al. Inhibition of the ubiquitin-proteasome system affects influenza A virus infection at a postfusion step [J]. J Virol, 2010, 84: 9625-9631. |
| [11] | Gabriel G, Klingel K, Otte A, et al. Differential use of importin-α isoforms governs cell tropism and host adaptation of influenza virus [J]. Nat Commun, 2011, 2: 156. |
| [12] | König R, Stertz S, Zhou Y, et al. Human host factors required for influenza virus replication [J]. Nature, 2010, 463: 813- 817. |
| [13] | Zhang J, Li G, Ye X. Cyclin T1/CDK9 interacts with influenza A virus polymerase and facilitates its association with cellular RNA polymerase II [J]. J Virol, 2010, 84: 12619- 12627. |
| [14] | Guan Z, Liu D, Mi S, et al. Interaction of Hsp40 with influenza virus M2 protein: implications for PKR signaling pathway [J]. Protein Cell, 2010, 1: 944-955. |
| [15] | Li G, Zhang J, Tong X, et al. Heat shock protein 70 inhibits the activity of influenza A virus ribonucleoprotein and blocks the replication of virus in vitro and in vivo [J]. PLoS One, 2011, 6: e16546. |
| [16] | Zhang C, Yang Y, Zhou X, et al. The NS1 protein of influenza A virus interacts with heat shock protein Hsp90 in human alveolar basal epithelial cells: implication for virus-induced apoptosis [J]. Virol J, 2011, 8: 181. |
| [17] | Kainov DE, Muller KH, Theisen LL, et al. Differential effects of NS1 proteins of human pandemic H1N1/2009, avian highly pathogenic H5N1, and low pathogenic H5N2 influenza A viruses on cellular pre-mRNA polyadenylation and mRNA translation [J]. J Biol Chem, 2011, 286: 7239-7247. |
| [18] | Boivin S, Hart DJ. Interaction of the influenza A virus polymerase PB2 C-terminal region with importin alpha isoforms provides insights into host adaptation and polymerase assembly [J]. J Biol Chem, 2011, 286: 10439-10448. |
| [19] | Kawaguchi A, Momose F, Nagata K. Replication-coupled and host factor-mediated encapsidation of the influenza virus genome by viral nucleoprotein [J]. J Virol, 2011, 85: 6197- 6204. |
| [20] | Jorba N, Coloma R, Ortin J. Genetic trans-complementation establishes a new model for influenza virus RNA transcription and replication [J]. PLoS Pathog, 2009, 5: e1000462. |
| [21] | Eisfeld AJ, Neumann G, Kawaoka Y. Human immunodeficiency virus rev-binding protein is essential for influenza a virus replication and promotes genome trafficking in late-stage infection [J]. J Virol, 2011, 85: 9588-9598. |
| [22] | Chen J, Huang S, Chen Z. Human cellular protein nucleoporin hNup98 interacts with influenza A virus NS2/nuclear export protein and overexpression of its GLFG repeat domain can inhibit virus propagation [J]. J Gen Virol, 2010, 91: 2474- 2484. |
| [23] | Watanabe K, Takizawa N, Noda S, et al. Hsc70 regulates the nuclear export but not the import of influenza viral RNP: a possible target for the development of anti-influenza virus drugs [J]. Drug Discov Ther, 2008, 2: 77-84. |
| [24] | Amorim MJ, Bruce EA, Read EK, et al. A Rab11-and microtubule-dependent mechanism for cytoplasmic transport of influenza A virus viral RNA [J]. J Virol, 2011, 85: 4143- 4156. |
| [25] | Bruce EA, Digard P, Stuart AD. The Rab11 pathway is required for influenza A virus budding and filament formation [J]. J Virol, 2010, 84: 5848-5859. |
| [26] | Dai X, Zhang L, Hong T. Host cellular signaling induced by influenza virus [J]. Sci China Life Sci, 2011, 54: 68-74. |
| [27] | Meliopoulos VA, Andersen LE, Birrer KF, et al. Host gene targets for novel influenza therapies elucidated by high-throughput RNA interference screens [J]. FASEB J, 2012, 26: 1372-1386. |
| [28] | Droebner K, Pleschka S, Ludwig S, et al. Antiviral activity of the MEK-inhibitor U0126 against pandemic H1N1v and highly pathogenic avian influenza virus in vitro and in vivo [J]. Antiviral Res, 2011, 92: 195-203. |
| [29] | Hayden MS, Ghosh S. NF-kappaB, the first quarter-century: remarkable progress and outstanding questions [J]. Genes Dev, 2012, 26: 203-234. |
| [30] | Pinto R, Herold S, Cakarova L, et al. Inhibition of influenza virus-induced NF-kappaB and Raf/MEK/ERK activation can reduce both virus titers and cytokine expression simultaneously in vitro and in vivo [J]. Antiviral Res, 2011, 92: 45-56. |
| [31] | Hsu MJ, Wu CY, Chiang HH, et al. PI3K/Akt signaling mediated apoptosis blockage and viral gene expression in oral epithelial cells during herpes simplex virus infection [J]. Virus Res, 2010, 153: 36-43. |
| [32] | Jackson D, Killip MJ, Galloway CS, et al. Loss of function of the influenza A virus NS1 protein promotes apoptosis but this is not due to a failure to activate phosphatidylinositol 3-kinase (PI3K) [J]. Virology, 2010, 396: 94-105. |
| [33] | Lu X, Masic A, Li Y, et al. The PI3K/Akt pathway inhibits influenza A virus-induced Bax-mediated apoptosis by negatively regulating the JNK pathway via ASK1 [J]. J Gen Virol, 2010, 91: 1439-1449. |
| [34] | Tripathi S, White MR, Hartshorn KL. The amazing innate immune response to influenza A virus infection [J]. Innate Immun, 2013, doi: 10.1177/1753425913508992. |
| [35] | Ng WC, Tate MD, Brooks AG, et al. Soluble host defense lectins in innate immunity to influenza virus [J]. J Biomed Biotechnol, 2012, doi: 10.1155/2012/732191. |
| [36] | Nicholls JM. The battle between influenza and the innate immune response in the human respiratory tract [J]. Infect Chemother, 2013, 45: 11-21. |
| [37] | Pang IK, Iwasaki A. Inflammasomes as mediators of immunity against influenza virus [J]. Trends Immunol, 2011, 32: 34-41. |
| [38] | van de Sandt CE, Kreijtz JH, Rimmelzwaan GF. Evasion of influenza A viruses from innate and adaptive immune responses [J]. Viruses, 2012, 4: 1438-1476. |
| [39] | Munoz-Fontela C, Pazos M, Delgado I, et al. p53 serves as a host antiviral factor that enhances innate and adaptive immune responses to influenza A virus [J]. J Immunol, 2011, 187: 6428-6436. |
| [40] | Paget C, Ivanov S, Fontaine J, et al. Interleukin-22 is produced by invariant natural killer T lymphocytes during influenza A virus infection: potential role in protection against lung epithelial damages [J]. J Biol Chem, 2012, 287: 8816- 8829. |
| [41] | Herold S, Ludwig S, Pleschka S, et al. Apoptosis signaling in influenza virus propagation, innate host defense, and lung injury [J]. J Leukoc Biol, 2012, 92: 75-82. |
| [42] | Lee SM, Gai WW, Cheung TK, et al. Antiviral effect of a selective COX-2 inhibitor on H5N1 infection in vitro [J]. Antiviral Res, 2011, 91: 330-334. |
| [43] | Bode C, Graler MH. Immune regulation by sphingosine 1-phosphate and its receptors [J]. Arch Immunol Ther Exp, 2012, 60: 3-12. |
| [44] | Graler MH. Targeting sphingosine 1-phosphate (S1P) levels and S1P receptor functions for therapeutic immune interventions [J]. Cell Physiol Biochem, 2010, 26: 79-86. |
| [45] | Lee SM,Yen HL. Targeting the host or the virus: current and novel concepts for antiviral approaches against influenza virus infection [J]. Antiviral Res, 2012, 96: 391-404. |
| [46] | Perdomo MC, Santos JE, Badinga L. Trans-10, cis-12 conjugated linoleic acid and the PPAR-γ agonist rosiglitazone attenuate lipopolysaccharide-induced TNF-α production by bovine immune cells [J]. Domest Anim Endocrinol, 2011, 41: 118-125. |
| [47] | Pisetsky DS, Gauley J, Ullal AJ. HMGB1 and microparticles as mediators of the immune response to cell death [J]. Antioxid Redox Signal, 2011, 15: 2209-2219. |
| [48] | Moisy D, Avilov SV, Jacob Y, et al. HMGB1 protein binds to influenza virus nucleoprotein and promotes viral replication [J]. J Virol, 2012, 86: 9122-9133. |
| [49] | Hreggvidsdóttir HS, Lundberg AM, Aveberger AC, et al. High mobility group box protein 1 (HMGB1)-partner molecule complexes enhance cytokine production by signaling through the partner molecule receptor [J]. Mol Med, 2012, 18: 224- 230. |
| [50] | Hsu AC, See HV, Hansbro PM, et al. Innate immunity to influenza in chronic airways diseases [J]. Respirology, 2012, 17: 1166-1175. |
| [51] | Sun H, Sun Y, Pu J, et al. Comparative virus replication and host innate responses in human cells infected with three prevalent clades (2.3.4, 2.3.2, and 7) of highly pathogenic avian influenza H5N1 viruses [J]. J Virol, 2014, 88: 725- 729. |
| [52] | Nguyen JT, Smee DF, Barnard DL, et al. Efficacy of combined therapy with amantadine, oseltamivir, and ribavirin in vivo against susceptible and amantadine-resistant influenza A viruses [J]. PLoS One, 2012, 7: e31006. |
 2014, Vol. 49
2014, Vol. 49


