据世界卫生组织统计,全球糖尿病患者已达3.47亿。随着糖尿病发病率日益升高,糖尿病并发症越来越受关注。糖尿病肾病为糖尿病的主要并发症之一,是终末期肾病的主要原因,因其较高的致死致残率给糖尿病患者和社会带来严重危害[1]。长期以来糖尿病肾病的治疗策略主要是针对高糖引起的非酶糖基化终末产物形成、蛋白激酶C信号通路激活、氧化应激反应、肾素-血管紧张素系统异常等病因,但研究显示控制血糖或血压并不能阻止糖尿病肾病的发生和发展。寻找新的糖尿病肾病治疗靶点现已成 为世界范围内的研究热点。SIRT1是一种高度保守 的去乙酰化酶,与细胞能量代谢和还原状态有着密切的关系。近十年来对SIRT1的理解已不仅局限于NAD+ (nicotinamide adenine dinucleotide) 依赖的组蛋白/非组蛋白去乙酰化酶,还发现其参与调节多种生物过程。研究表明,SIRT1与糖尿病肾病发病过程密切相关,是一个新的潜在糖尿病肾病治疗靶点[2,3]。本文就近年来SIRT1在糖尿病肾病防治中的作用进行综述。
1 SIRT1的生物学活性SIRT1即沉默信息调节因子 (silence information regulator 1),是Sir家族7种去乙酰化酶中研究最多的一种酶,广泛存在于机体的各种体细胞及生殖细胞中,在肾皮质和髓质均表达[4,5]。SIRT1的活性与NAD+ 浓度直接相关,作为一种NAD+ 依赖的去乙酰化酶,SIRT1可以根据细胞内的NAD+ 浓度感知细胞能量状态,通过去乙酰化特定的酶和转录因子调节能量代谢,使细胞能量水平维持稳态。
随着研究的深入,逐渐发现SIRT1不仅可以调节细胞能量代谢,还可以调控细胞对外界压力抵抗和细胞死亡阈值[6]。SIRT1去乙酰化FOXO (forkhead box) 家族转录因子,p53,TGF-β (translation growth factor-β) 等核转录因子以调控细胞氧化应激、内质网应激以及线粒体应激状态,维持细胞的压力稳态[3,5]。另有研究发现SIRT1可抑制压力介导的细胞凋亡,乙酰化NF-κB复合体中的成分,从而减少炎症。运用siRNA技术沉默SIRT1基因或使用SIRT1抑制剂烟酰胺可加快高糖引起的肾系膜细胞衰老[7]。SIRT1广泛的生物活性为其参与糖尿病肾病发病过程奠定了基础。
2 SIRT1在调节糖尿病肾病能量代谢稳态失衡中的作用肾脏内特别是系膜细胞在高糖环境下,不能随着外界环境葡萄糖含量变化而改变对葡萄糖的摄取,导致进入细胞内葡萄糖增多,能量堆积给细胞能量代谢平衡带来压力。SIRT1作为能量感应器对肾脏细胞代谢具有一定的调控作用,可促进细胞能量稳态的重建。SIRT1的这一功能主要是通过作用于PGC-1α (PPAR-γ co-activator-1α,PGC-1α) 多个赖氨酸位点去乙酰化实现。
研究发现高糖可导致细胞SIRT1活性下降,PGC1-α高度乙酰化,细胞发生能量消耗故障,导致能量稳态被破坏[8]。多项体内和体外实验证明激活SIRT1能改变PGC1-α的表达。糖尿病模型db/db小鼠口服SIRT1抑制剂尼克酰胺后,PGC-1α乙酰化显著增加,而口服SIRT1激活剂白藜芦醇则能够增加AMPK [adenosine 5'-monophosphate (AMP)-activated protein kinase] 磷酸化以及PGC-1α激活,并激活下 游效应因子PGC1-α-雌激素相关受体-1α (estrogen- related receptor,ERR-1α)-甾醇调节元件结合蛋白1 (sterol-regulatory element binding proteins 1,SREBP1),降低肾脏游离脂肪酸 (nonestesterified fatty acid,NEFA) 以及三酰甘油含量。研究结果显示,在肾脏系膜细胞中SIRT1-PGC-1α-ERR-1α-SREBP1通路激活后,可有效预防高糖介导的氧化应激压力以及细胞凋亡[9]。
Feige等[10]报道SIRT1对PGC-1α的激活可促进细胞对脂肪氧化从而增加细胞能量消耗。进一步研 究发现,SIRT1对PGC-1α激活后介导的对糖尿病肾病改善作用包括核呼吸因子Nrf1 (nuclear respiratory factor 1) 和Nrf2 (nuclear respiratory factor 2) 的转录,增加线粒体转录因子A的表达,并加强线粒体生物合成,增加线粒体内氧化磷酸化,从而减少氧化应激压力。此外,PGC-1α激活还可加强核受体转录因子PPAR (peroxisome proliferator-activated receptor)、视黄酸受体和甲状腺受体的表达,增加糖皮质激素受体、雌激素受体、ERR家族以及肌细胞增强因子-2,FOXO转录因子家族等多种因子的表达,最终实现促进细胞对能量的消耗和利用,缓解能量堆积状况,重建能量代谢稳态[11,12,13,14]。
3 SIRT1在改善糖尿病肾病氧化应激压力中的作用持续高血糖状态下葡萄糖诱导的线粒体过氧化物生成过多是糖尿病肾病的中心环节和病理生理机制,氧化应激可以激活几乎所有的信号通路,包括PKC通路、多元醇通路等,改善糖尿病肾病氧化应激状态至关重要。
3.1 SIRT1对氧化应激的抵抗作用研究发现肾髓质间质细胞以及肾髓质内部细胞有充分的SIRT1表达,可能发挥抗氧化应激的重要作用[15]。敲除SIRT1基因的小鼠肾髓质原代间质细胞对氧化应激的抵抗能力下降,应用SIRT1激活剂白藜芦醇或SRT2183则能改善细胞在氧化应激状态下的生存,说明SIRT1具有辅助细胞维持正常还原状态抵抗氧化应激的能力。分析认为,这种作用与SIRT1既可以抑制氧化应激的产生,又可以促进细胞内还原系统的激活抵抗氧化应激有关。
3.2 SIRT1抑制ROS的产生线粒体是高糖时细胞内活性氧簇 (reactive oxygen species,ROS) 的主要来源。在高糖环境下线粒体功能发生障碍时,过多的电子在呼吸链复合体I与复合体III辅酶Q连接处泄漏,形成ROS。Xu等[16]研究结果显示,SIRT1激活剂能够显著改善高糖环境下大鼠系膜细胞中损伤的线粒体复合体III活性,恢复线粒体膜电势,增 加ATP产生,减少线粒体内超氧化物的生成。SIRT1对线粒体的恢复作用可能与PGC-1α和Nrf因子相互作用调节呼吸链中蛋白合成,去乙酰化PGC-1α以加强其转录活性,调节线粒体蛋白合成,促进线粒体的功能正常化相关。
3.3 SIRT1减少肾脏细胞凋亡氧化应激介导的肾小球细胞凋亡是糖尿病肾病发展的一个重要因素,氧化应激所产生的ROS能够增加p53的乙酰化而发生肾系膜细胞凋亡。白藜芦醇或间歇性禁食上调SIRT1可特异性去乙酰化p53的K382残基而降低其转录活性,抑制细胞循环,以促进在氧化应激状态下损伤的DNA进行修复,减少细胞凋亡[17,18,19,20,21]。p66基因敲除的Akita小鼠肾脏中发现SIRT1表达上调,而p53乙酰化减少从而阻止p53促凋亡基因的转录[22]。但SIRT1与p53相互作用并不能完全抑制细胞凋亡,SIRT1与p53促进细胞DNA修复仍需其他辅助因子参与[17]。
叉头转录因子 (FOXO) 是细胞中调节代谢以及氧化应激的重要因子。根据不同的调节信号,FOXO能够调节细胞凋亡,启动与DNA修复有关的基因表达,同时FOXO能够通过转录调节下游多层次抗氧化系统控制细胞内ROS含量。有研究表明白藜芦醇可显著增加糖尿病动物肾脏细胞FOXO1的表达水平,促进PI3K-Akt和FOXO3a磷酸化,减少BAX (Bcl-2 associated X protein) 的表达,增加Bcl-2、SOD1和SOD2的产生,缓解肾脏细胞凋亡[9,23]。Chuang等[24]发现,足细胞中FOXO4乙酰化水平升高能够促进前凋亡基因Bim表达,并导致足细胞丢失,而在大鼠 足细胞中过表达SIRT1则能够改善糖基化终末产物 (advanced glycation end products,AGE) 所介导的细胞凋亡,并能够抑制db/db小鼠肾小球细胞中的FOXO4乙酰化,减少FOXO4所介导的凋亡。 Hasegawa等[25,26]实验结果证明,SIRT1去乙酰化FOXO3,清除ROS,保护氧化应激引起的肾小管上皮细胞凋亡和损伤。另外,有报道SIRT1去乙酰化Smad7的Lys60和Lys70位点,可加强泛素依赖的蛋白酶体降解,故与TGF-β介导的凋亡也有关系[27]。由上述可见,SIRT1可通过p53、FOXOs和TGF-β等多个途径,调节信号转导,改善肾脏细胞凋亡与坏死。
3.4 SIRT1促进肾脏细胞自噬自噬是一种降解和再循环大分子以及受损的细胞器以维持胞内稳态的催化途径。自噬对于肾脏中肾小球足细胞及肾近球小管细胞稳定和维持功能是一种必要的生存机制。近年研究表明自噬参与糖尿病肾病的发病过程[28,29]。糖尿病导致肾脏营养过剩而刺激下调自噬水平,长期的自噬失调最终加速肾脏细胞损伤以及衰老[5]。特异性敲除Atg5 (autophagy-related 5) 的小鼠发生肾小球疾病并伴随氧化及泛素化蛋白沉淀,内质网应激以及蛋白尿现象,并最终导致足细胞丢失和肾小球炎症[30]。Lee等[31]已证实SIRT1能显著调节自噬水平。在雄性糖尿病Wistar肥胖(fa/fa) 大鼠动物模型中,通过饮食控制恢复近球小管细胞内SIRT1水平,继而可以改善细胞自噬失调以及线粒体功能异常状态,通过促进细胞自噬发挥肾保护及抗蛋白尿作用[32]。
SIRT1发挥调解的机制主要表现在SIRT1去乙酰化自噬信号通路中的Atg8、Atg7和Atg5等自噬因 子,从而激活自噬小体的形成以促进细胞自噬[33]。此外FOXO3参与了SIRT1对近端肾小管细胞的自噬调控[5]。在Kume等[5]研究中,小鼠热量限制可增加衰老肾脏中SIRT1表达,使得FOXO3a去乙酰化增加,从而增加其下游Bnip3 (Bcl-2/adenovirus E1V 19-kDa interacting protein 3) 的表达,继而促进Bnip3介导的自噬。从热量限制小鼠获得的近球小管细胞中发现,增加SIRT1的表达也同样有相同促进自噬的作用,并提高细胞抵抗缺氧等慢性肾损伤因素的能力。
3.5 SIRT1对还原系统的激活在高糖介导的氧化应激压力下,Nrf2、下游调节酶γ-GCL (glutamate cysteine ligase)、μ-GST (glutathione-s-transferase) 以及HO-1 (hemeoxigenase 1) 在肾脏组织中表达显著降低。激活SIRT1可以促进Nrf2在核内的聚集,与DNA结合增加其转录活性,提高γ-GCL、μ-GST及HO-1的表达,进一步改善氧化应激状态[34]。当细胞内产生大量的ROS而处于氧化应激状态,上调SIRT1表达能够增加过氧化氢酶活性,辅助细胞催化H2O2等ROS的还原[26]。
4 SIRT1在糖尿病肾病炎症反应控制中的作用炎症是多种损伤机制对肾脏造成伤害的最终表现,NF-κB (nuclear factor kappa B) 信号通路在炎症过程中起到核心作用。近期研究显示,足细胞SIRT1水平降低则炎症反应升高[35],SIRT1能够干扰NF-κB信号通路,可以与其p65亚基相互作用,通过去乙酰化p65亚基的310位赖氨酸抑制其转录活性。在内皮细胞和巨噬细胞中,SIRT1也可去乙酰化NF-κB p65亚基下调炎症因子前体的表达[32,36]。激活SIRT1可抑制MMP-9、IL-1β和IL-6等产生,降低TNF-α介导的诱导型一氧化氮合酶 (inducible nitric oxide synthase,iNOS) 的表达[37]。WFRs大鼠(肥胖糖尿病大鼠模型) 控制饮食后肾脏SIRT1蛋白表达升高,去乙酰化的NF-κB p65亚基增加,ICAM-1、 VACAM-1和MCP-1等炎症因子基因表达水平也明显降低[32]。
AP-1 (activator protein-1) 是一种炎症因子表达的重要转录调节因子,主要由Jun (c-Jun、Jun B、Jun D) 以及Fos蛋白 (c-Fos、Fos B、Fra-1、Fra-2) 组成,SIRT1能够与c-Jun赖氨酸亚基作用导致AP-1转录活性被抑制[36,38],进一步抑制巨噬细胞COX-2的表达,减轻肾脏纤维化症状[4,39]。Liu等[40]研究显示,db/db小鼠足细胞敲除SIRT1基因后蛋白尿、肾脏损伤明显增加,足细胞AGEs引起p65和STAT3 (signal transducer and activator of transcription 3) 乙酰化,给予pyridoxamine (一种强效晚期糖化终产物抑制剂) 可激活SIRT1表达,减少p65和STAT3乙酰化。研究结果提示,SIRT1可通过去乙酰化组蛋白以及NF-κB和AP-1等重要转录因子,抑制下游相关炎症因子基因表达,从而改善糖尿病肾病炎症反应。
5 SIRT1对肾脏结构病变的改善糖尿病肾病最主要病理改变是肾脏的纤维 化[40,41]。细胞外基质纤连蛋白在受到高糖诱导的TGF-β等大量生长因子刺激下聚集,导致胞外基质过度分泌,造成肾脏的纤维化。TGF-β/Smad3信号通路在肾脏纤维化过程中发挥重要作用。
有报道系膜细胞中SIRT1表达激活后能显著地抑制TGF-β1和COX-2的表达,同时TGF-β刺激肾脏纤母细胞以及肾小管上皮细胞介导Smad3乙酰化和磷酸化[42]。Smad3乙酰化是肾脏间质纤维化的早期反应,并一直持续到肾脏严重纤维化的过程中。Li等[39]研究首次描述了SIRT1与Smad3的相互作用,研究表明激活SIRT1能够去乙酰化Smad3并抑制TGF-β所介导的对IV型胶原蛋白以及纤连蛋白mRNA的转录水平调节,敲除SIRT1则上述作用消失。同时,SIRT1能抑制Smad7以阻止TGF-β肾小球系膜细胞凋亡[42]。Huang等研究表明SIRT1过表达或给予白藜芦醇可促进肾小球系膜细胞Nrf2激活,上调Nrf2下游基因ARE等表达,可以提高细胞抗氧化能力。Nrf2激活会阻断肾小球系膜细胞肥大并抑制TGF-β转录,减少氧化损伤以及胞外基质的产生,减缓肾脏纤维化[18,43]。
6 SIRT1在糖尿病肾病防治中其他作用Miyazaki等[44]观察表明SIRT1过表达可减少血管平滑肌细胞内ANG II受体1 (AT1R) 的表达,而SIRT1抑制则增加AT1R表达。SIRT1调控AT1R从而进一步减缓RAS系统的紧张度,达到调节血压的效果,从而减轻糖尿病肾病进程。转录因子HIF-1α (hypoxia-inducible factor 1α) 能激发对缺氧低浓度 的适应性,缺氧状态下SIRT1可以活化HIF-2α引起Mn-SOD减轻肾损伤[45]。在链脲佐菌素诱导的糖尿病小鼠或db/db糖尿病小鼠模型中,在蛋白尿出现前,近端小管中的SIRT1表达已经明显下调。SIRT1可通过去乙酰化机制活化Dnmt1,调节Claudin1基因表达,减少白蛋白尿发生。结果表明,近端小管内SIRT1改变可诱导肾小球和足细胞的表型改变,影响肾小球功能[46]。
7 结语与展望SIRT1作为一种具有广泛去乙酰化的酶,可以通过多个信号通路调节在高糖环境下受损的肾脏细胞功能,促进其恢复能量稳态,并且调节损伤信号共同导致的纤维化与坏死,表现出肾保护作用 (图 1),已成为治疗糖尿病肾病新靶点,为延缓糖尿病肾病进程带来新希望。
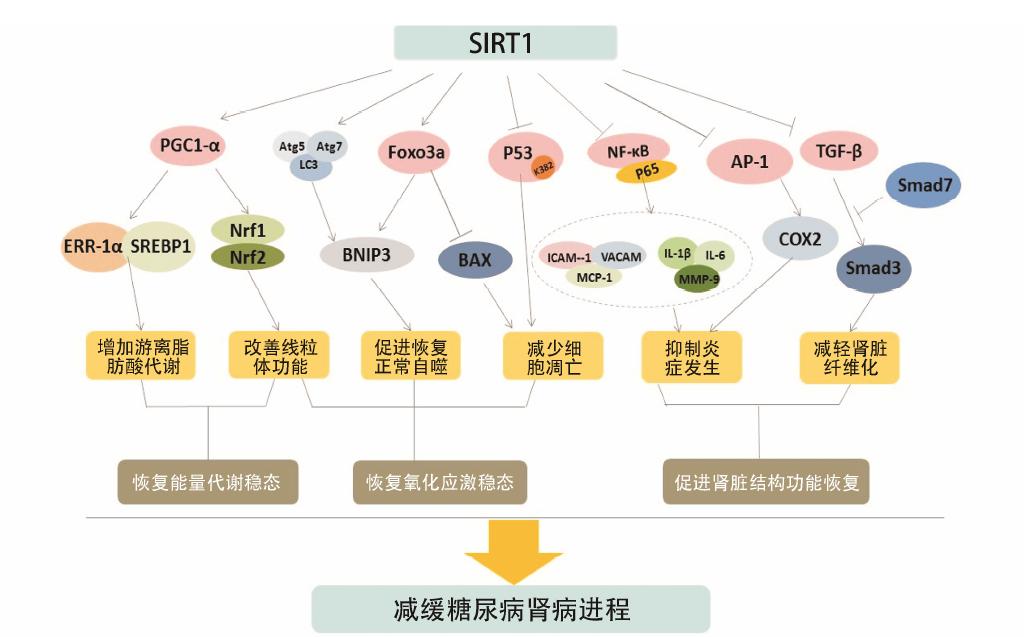 |
图 1 SIRT1在糖尿病肾病防治中发挥作用主要信号通路示意图 |
由于糖尿病肾病发病率逐年上升,因此开发以SIRT1为靶点的新药研究将有较好的应用前景。近年来虽然有多篇报道白藜芦醇、白藜芦醇衍生物和二苯乙烯葡萄糖苷等化合物显示出较强的激活SIRT1活性,在动物或细胞水平可显著减轻糖尿病肾病相关的症状[47,48,49],但多数尚处于早期开发阶段。寻找针对SIRT1为靶点的防治糖尿病肾病药物依然是研究热点。我国拥有丰富的天然产物资源,从天然产物中寻找作用于SIRT1的新药具有重要意义。本实验室目前致力于SIRT1激活剂的发现,已建立稳定的SIRT1激活剂筛选体系,并通过大规模筛选发现数个具有良好活性的先导物。
| [1] | Hsu CY, Iribarren C, McCulloch CE, et al. Risk factors for end-stage renal disease: 25-year follow-up [J]. Arch Intern Med, 2009, 169: 342-350. |
| [2] | Kitada M, Kume S, Takeda-Watanabe A, et al. Sirtuins and renal diseases: relationship with aging and diabetic nephropathy [J]. Clin Sci, 2013, 124: 153-164. |
| [3] | Dorota PJ, Krystyna LS, Leopold R, et al. Nephroprotective action of sirtuin 1 (SIRT1) [J]. J Physiol Biochem, 2013, 69: 957-961. |
| [4] | He W, Wang MZ, Zhang L, et al. Sirt1 activation protects the mouse renal medulla from oxidative injury [J]. J Clin Invest, 2010, 120: 1056-1068. |
| [5] | Kume S, Uzu T, Horiike M, et al. Calore restriction enhances cell adaptation to hypoxia through Sirt1-dependent mitochondrial autophagy in mouse aged kidney [J]. J Clin Invest, 2010, 120: 1043-1055. |
| [6] | Finkel T, Deng CX, Mostoslavsky R. Recent progress in the biology and physiology of sirtuins [J]. Nature, 2009, 460: 587-591. |
| [7] | Zhang S, Cai G, Fu B, et al. SIRT1 is required for the effects of rapamycin on high glucose-inducing mesangial cells senescence [J]. Mech Ageing Dev, 2012, 133: 387-400. |
| [8] | Nemoto S, Ferqusson MM, Finke T. SIRT1 functionally interacts with the metabolic regulator and transcriptional coactivator PGC-1(alpha) [J]. J Biol Chem, 2005, 280: 16456-16460. |
| [9] | Kim MY, Lim JH, Youn HH, et al. Resveratrol prevents renal lipotoxicity and inhibits mesangial cell glucotoxicity in a manner dependent on the AMPK-SIRT1-PGC1α axis in db/db mice [J]. Diabetologia, 2013, 56: 204-217. |
| [10] | Feige JN, Lagouge M, Canto C, et al. Specific SIRT1 activation mimics low energy levels and protects against diet-induced metabolic disorders by enhancing fat oxidation [J]. Cell Metab, 2008, 8: 347-358. |
| [11] | Tanaka Y, Kume S, Araki S, et al. Fenofibrate, a PPARα agonist, has renoprotective effects on mice by enhancing renal lipolysis [J]. Kidney Int, 2011, 79: 871-882. |
| [12] | Li X, Zhang S, Blander G, et al. SIRT1 deacetylates and positively regulates the nuclear receptor LXR [J]. Mol Cell, 2007, 28: 91-106. |
| [13] | Kemper JK, Xiao Z, Ponugoti B, et al. FXR acetylation is normally dynamically regulated by p300 and SIRT1 but constitutively elevated in metabolic disease states [J]. Cell Metab, 2009, 20: 392-404. |
| [14] | Cantó C, Auwerx J. PGC-1α, SIRT1 and AMPK, an energy sensing network that controls energy expenditure [J]. Curr Opin Lipidol, 2009, 20: 98-105. |
| [15] | Sapnier G, Xu H, Xia N, et al. Resveratrol reduces endothelial oxidative stress by modulating the gene expression of superoxide dismutase 1 (SOD1), glutathione peroxidase 1 (GPx1) and NADPH oxidase subunit (NOx4) [J]. J Physiol Pharmacol, 2009, 60: 111-116. |
| [16] | Xu Y, Nie L, Yin YG, et al. Resveratrol protects against hyperglycemia-induced oxidative damage to mitochondria by activating SIRT1 in rat mesangial cells [J]. Toxicol Appl Pharmacol, 2012, 259: 395-401. |
| [17] | Kim EJ, Kho JH, Kang MR, et al. Active regulator of SIRT1 cooperates with SIRT1 and facilitates suppression of p53 activity [J]. Mol Cell, 2007, 28: 277-290. |
| [18] | Kume S, Haneda M, Kanasaki K, et al. Silent information regulator 2 (SIRT1) attenuates oxidative stress-induced mesangial cell apoptosis via p53 deacetylation [J]. Free Radical Biol Med, 2006, 40: 2175-2182. |
| [19] | Tikoo K, Tripathi DN, Kabra DG, et al. Intermittent fasting prevents the progression of type I diabetic nephropathy in rats and changes the expression of Sir2 and p53 [J]. FEBS Lett, 2007, 581:1071-1078. |
| [20] | Tikoo K, Singh K, Kabra D, et al. Change in histone H3 phosphorylation, MAP kinase p38, SIR 2 and p53 expression by resveratrol in preventing streptozotocin induced type I diabetic nephropathy [J]. Free Radic Res, 2008, 42: 397- 404. |
| [21] | Kitada M, Kume S, Imaizumi N, et al. Resveratrol improves oxidative stress and protects against diabetic nephropathy through normalization of Mn-SOD dysfunction in AMPK/ SIRT1-independent pathway [J]. Diabetes, 2011, 60: 634- 643. |
| [22] | Vashistha H, Meggs L. Diabetic nephropathy: lessons from the mouse [J]. Ochsner J, 2013, 13: 140-146. |
| [23] | Wu L, Zhang Y, Ma X, et al. The effect of resveratrol on FoxO1 expression in kidneys of diabetic nephropathy rats [J]. Mol Biol Rep, 2012, 39: 9085-9093. |
| [24] | Chuang PY, Dai Y, Liu R, et al. Alteration of Forkhead Box O (Foxo4) acetylation mediates apoptosis of podocytes in diabetes mellitus [J]. PLoS One, 2011, 6: e23566. |
| [25] | Hasegawa K, Wakino S, Yoshioka K, et al. Kidney-specific overexpression of Sirt1 protects against acute kidney injury by retaining peroxisome function [J]. J Biol Chem, 2010, 285: 13045-13056. |
| [26] | Hasegawa K, Wakino S, Yoshioka K, et al. Sirt1 protects against oxidative stress-induced renal tubular cell apoptosis by the bidirectional regulation of catalase expression [J]. Biochem Biophys Res Commun, 2008, 372: 51-56. |
| [27] | Kume S, Haneda M, Kanasaki K, et al. SIRT1 inhibits transforming growth factor β-induced apoptosis in glomerular mesangial cells via Smad7 deacetylation [J]. J Biol Chem, 2007, 282: 151-158. |
| [28] | Tanaka Y, Kume S, Kitada M, et al. Autophagy as a therapeutic target in diabetic nephropathy [J]. Exp Diabetes Res, 2012, doi: 10.1155/2012/628978. |
| [29] | Kume S, Thomas MC, Koya D. Nutrient sensing, autophagy, and diabetic nephropathy [J]. Diabetes, 2012, 61: 23-29. |
| [30] | Hartleben B, Gödel M, Meyer-Schwesinger C, et al. Autophagy influences glomerular disease susceptibility and maintains podocyte homeostasis in aging mice [J]. J Clin Invest, 2010, 120: 1084-1096. |
| [31] | Lee IH, Cao L, Mostoslavsky R, et al. A role for the NAD-dependent deacetylase Sirt1 in the regulation of autophagy [J]. Proc Natl Acad Sci USA, 2008, 105: 3374-3379. |
| [32] | Kitada M, Takeda A, Nagai T, et al. Dietary restriction ameliorates diabetic nephropathy through anti-inflammatory effects and regulation of the autophagy via restoration of Sirt1 in diabetic Wistar fatty (fa/fa) rats: a model of type 2 diabetes [J]. Exp Diabetes Res, 2011, doi: 10.1155/2011/908185. |
| [33] | Salminen A, Kaarniranta K. SIRT1: regulation of longevity via autophagy [J]. Cell Signal, 2009, 21: 1356-1360. |
| [34] | Palsamy P, Subramanian S. Resveratrol protects diabetic kidney by attenuating hyperglycemia-mediated oxidative stress and renal inflammatory cytokines via Nrf2–Keap1 signaling [J]. Biochim Biophys Acta, 2011, 1812: 719-731. |
| [35] | Yoshizaki T, Milne JC, Imamura T, et al. SIRT1 exerts anti-inflammatory effects and improves insulin sensitivity in adipocytes [J]. Mol Cell Biol, 2009, 29: 1363-1374. |
| [36] | Xie J, Zhang X, Zhang L. Negative regulation of inflammation by SIRT1 [J]. Pharmacol Res, 2013, 67: 60-67. |
| [37] | Zhu X, Liu Q, Wang M, et al. Activation of Sirt1 by resveratrol inhibits TNF-α induced inflammation in fibroblasts [J]. PLoS One, 2011, 6: e27081. |
| [38] | Salminen A, Hyttinen JMT, Kaarniranta K. AMP-activated protein kinase inhibits NF-κB signaling and inflammation: impact on healthspan and lifespan [J]. J Mol Med, 2011, 89: 667-676. |
| [39] | Li J, Qu X, Richardo SD, et al. Resveratrol inhibits renal fibrosis in the obstructed kidney: potential role in deacetylation of Smad3 [J]. Am J Pathol, 2010, 177: 1065-1071. |
| [40] | Liu R, Zhong Y, Li X, et al. Role of transcription factor acetylation in diabetic kidney disease [J]. Diabetes, 2014, 63: 2440-2453. |
| [41] | Kanwar YS, Wada J, Sun L, et al. Diabetic nephropathy: mechanisms of renal disease progression [J]. Exp Biol Med, 2008, 233: 4-11. |
| [42] | Li C, Cai F, Yang Y, et al. Tetrahydroxystilbeneglucoside ameliorates diabetic nephropathy in rats: involvement of SIRT1 and TGF-β1 pathway [J]. Eur J Pharmacol, 2010, 649: 382-389. |
| [43] | Huang K, Huang J, Xie X, et al. Sirt1 resists advanced glycation end products-induced expressions of fibronectin and TGF-β1 by activating the Nrf2/ARE pathway in glomerular mesangial cells [J]. Free Radic Biol Med, 2013, 65: 528-540. |
| [44] | Miyazaki R, Ichiki T, Hashimoto T, et al. SIRT1, a longevity gene, downregulates angiotensin II type 1 receptor expression in vascular smooth muscle cells [J]. Arterioscler Thromb Vasc Biol, 2008, 28: 1263-1269. |
| [45] | Dioum EM, Chen R, Alexander MS, et al. Regulation of hypoxia-inducible factor 2α signaling by the stress-responsive deacetylasesirtuin 1 [J]. Science, 2009, 324: 1289-1293. |
| [46] | Hasegawa K, Wakino S, Simic P, et al. Renal tubular Sirt1 attenuates diabetic albuminuria by epigenetically suppressing Claudin-1 overexpression in podocytes [J]. Nat Med, 2013, 19: 1496-1504. |
| [47] | Kitada M, Koya D. Renal protective effects of resveratrol [J]. Oxid Med Cell Longev, 2013, doi: 10.1155/2013/568093. |
| [48] | Hoffmann E, Wald J, Lavu S, et al. Pharmacokinetics and tolerability of SRT2104, a first-in-class small molecule activator of SIRT1, after single and repeated oral administration in man [J]. Br J Clin Pharmacol, 2013, 75: 186-196. |
| [49] | Shang G, Gao P, Zhao Z, et al. 3, 5-Diiodo-l-thyronine ameliorates diabetic nephropathy in streptozotocin-induced diabetic rats [J]. Biochim Biophys Acta, 2013, 1832: 674-684. |
 2014, Vol. 49
2014, Vol. 49


