华蟾素注射液是中华大蟾蜍皮经过加工制成的水溶性制剂,具有解毒、消肿、止痛功能。体内外药理实验证明华蟾素注射液具显著抗肿瘤、镇痛及免疫增强作用,临床上多用于治疗原发性肝癌、肺癌、肠癌等疾病[1,2],为“国家基本药物目录”、“国家基本医疗保险目录”和中药保护品种。华蟾素注射液主要含蟾毒配基类、吲哚生物碱类、蟾蜍毒素类、多肽类、核酸类、氨基酸类等成分,其中蟾毒配基类成分被认为是主要抗肿瘤活性成分[3]。本研究对华蟾素注射液
中间体的氯仿部位进行了研究,从中分离得到6个蟾毒配基类化合物,其中化合物1、3为新化合物,化合物5、6为新天然产物,1、2和3、4分别为两对C-3羟基构型异构体。
化合物1白色粉末 (甲醇)。显示负的旋光性[[α]20D -16.0 (c 0.25,MeOH)]; 紫外最大吸收波长为298 nm。HR-ESI-MS给出其准分子离子峰m/z[M+H]+ 417.226 3 (Calcd. 417.227 2),确定分子式为C24H32O6。1H NMR (600 MHz,DMSO-d6) 谱中可见δ 7.54 (1H,d,J = 2.4 Hz,H-21)、7.67 (1H,dd,J = 9.6,2.4 Hz,H-22) 和6.24 (1H,d,J = 9.6 Hz,H-23) 3个烯氢信号 (表 1),结合13C NMR (150 MHz,DMSO-d6) 谱中δ161.2处内酯羰基碳信号和δ 150.8,148.1,119.9,113.3四个不饱和碳信号,提示化合物中存在α吡喃环结构。与假蟾毒精 (化合物2) 13C NMR谱数据比较,C-11位羰基取代,C-12 位α羟基取代,C-14位β羟基取代化学位移值一致。但C-1至C-5的数据不符,推测C-3位可能与假蟾毒精存在构型异构。与3-表-日蟾毒它灵 (化合物5) 13C NMR谱数据比较,C-1至C-5的数据基本一致,推测C-3位可能为α羟基取代。具体数据见表 2。同时进行了二维核磁共振相关谱的测定,结果如下: HSQC二维核磁共振相关谱中显示δH 3.42与δC 69.4直接相关,1H-1H COSY二维核磁共振相关谱中显示H-3 (δH 3.42) 与H-2 (δH 1.50)、H-4 (δH 1.02) 相关,HMBC二维核磁共振相关谱显示δC 69.4与δH 1.53 (H-1)、1.50 (H-2)、1.37 (H-5) 等氢信号存在远程相关,证明δC 69.4为C-3信号。又NOESY二维核磁共振相关谱中H-3 (δH 3.42) 与H-5 (δH 1.37)、H-19 (δH 0.95) 存在相关,说明H-3为β构型,即证明C-3为α羟基取代。命名为3-表-假蟾毒精 (图 1)。此外,在NOESY二维核磁共振相关谱中H-12和14-OH均显示与H-18存在相关,证明了C-12位为α羟基取代和C-14位为β羟基取代。
|
|
Table 1 NMR spectra data of compound 1 (in DMSO-d6) |
化合物3 白色粉末 (甲醇)。显示正的旋光性[[α]20D +80 (c 0.10,MeOH)]; 紫外最大吸收波长为298 nm。HR-ESI-MS: m/z [M+H]+ 417.226 0 (Calcd. 417.227 2),确定分子式为C24H32O6。核磁的波谱数 据 (DMSO-d6) (表 2) 与所分离得到的沙蟾毒精 (4) 比较,发现除C-1至C-5的数据有较大出入外,其他数据基本一致,同化合物1类似,推测化合物3为沙蟾毒精的构型异构体,C-3位羟基可能为α构型。经查阅文献,已有相同结构的报道[4],为比对方便,更换溶剂为CD3OD (表 3),但仍然存在较多差异。为确定结构,进行了二维核磁共振相关谱的测定,结果如下: HSQC (以下溶剂皆为CD3OD) 二维核磁共振相关谱中显示δH 3.58与δC 72.4直接相关,1H-1H COSY二维核磁共振相关谱中显示H-3 (δH 3.58) 与H-2 (δH 1.47)、H-4 (δH 1.66) 相关,HMBC二维核磁共振相 关谱显示δC 69.4与δH 1.03 (H-1)、1.50 (H-5)、1.66 (H-2和H-4) 等氢信号存在远程相关,证明δC 69.4 为C-3信号。又NOESY二维核磁共振相关谱中H-3 (δH 3.58) 与H-5 (δH 1.50)、H-19 (δH 1.15) 存在相关,说明H-3为β构型,即证明C-3所连羟基为α构型。命名为3-表-沙蟾毒精 (图 1)。
|
|
Table 2 13C NMR spectra data of compounds 2-6 (in DMSO-d6) |
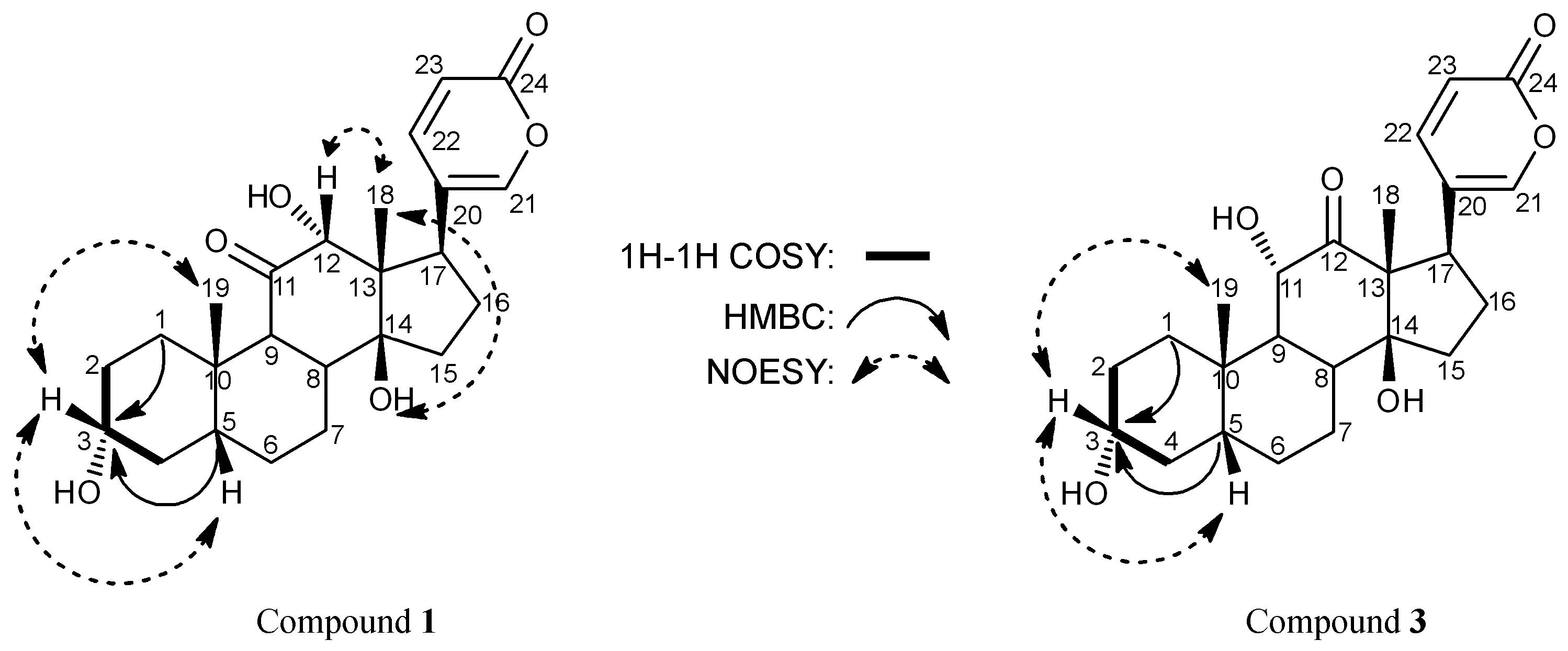 |
Figure 1 The main 1H-1H COSY,HMBC and NOE correlations of compounds 1 and 3 |
以DMSO为溶剂得到化合物3的波谱数据如下: 1H NMR (600 MHz,DMSO-d6) δ: 7.80 (1H,d,J = 2.4 Hz,H-21) ,7.57 (1H,dd,J = 9.6,2.4 Hz,H-22),6.32 (1H,d,J = 9.6 Hz,H-23),4.97 (1H,s,14-OH),4.54 (1H,d,J = 4.8 Hz,11-OH),4.36 (1H,d,J = 4.8 Hz,3-OH),4.26 (1H,dd,J = 11.4,4.8 Hz,H-11),3.96 (1H,m,H-17),3.39 (1H,m,H-3),1.04 (3H,s,H-19),0.79 (3H,s,H-18)。13C NMR谱数据见表 2。
化合物3虽有文献报道,但所报道的核磁数据与该化合物结构不符,本研究通过高分辨质谱及二维核磁实验,确定该化合物为3-表-沙蟾毒精,其波谱数据为首次报道。为方便比对,本研究同时报道3-表-沙蟾毒精以DMSO-d6作为溶剂的1H NMR和13C NMR波谱数据。通过两对C-3羟基构型异构体 (1和2、3和4) 13C NMR谱数据比较,发现C-3位由β-OH (2和4) 变为α-OH (1和3) 会导致C-1至C-5不同程度地向低场位移。 实验部分
华蟾素注射液中间体,批号: 120209/09-10 (安徽金蟾生化股份有限公司); 柱层析硅胶100~200目 (试剂级,青岛海洋化工厂); C18反相硅胶 (德国Merk公司); GF254薄层硅胶 (青岛海洋化工); Bruker AVIIIHD 600核磁共振波谱仪 (瑞士Bruker公司,1H NMR 600 MHz,13C NMR 150 MHz); LC3000型 高效液相色谱仪 (北京创新通恒有限公司); LTQ Orbitrap Velos pro液质联用仪,ESI离子源; 柱色谱硅胶板 (青岛海洋化工); Kromasil 100-5C18制备柱 (250 mm × 4.6 mm,E10025,瑞典NOBEL公司); 乙腈 (HPLC级,Fisher Scientific)。 1 提取与分离
取华蟾素注射液中间体1 L,3倍体积氯仿萃 取,得氯仿层和水层。氯仿层经C18柱色谱用10%、30% 和50% 甲醇洗脱,得到相应的洗脱物分别为Fr.1、Fr.2、Fr.3。取Fr.3部分经硅胶柱色谱分离,氯仿-甲醇溶液 (20∶1~2∶1) 梯度洗脱,得到8个组分 (Fr.3.1~3.8)。Fr.3.1经C18柱色谱及HPLC,得到了化合物6 (10.1 mg)。Fr.3.2经C18柱色谱及HPLC,得到了化合物1 (3.4 mg)、2 (5.0mg)、3(14.1 mg)、4 (15.0 mg)。Fr.3.3经C18柱色谱及HPLC,得到了化合物5 (14.5 mg)。 2 结构鉴定
化合物1 白色粉末 (甲醇)。[α] -16.0 (c 0.25,MEOH),HR-ESI-MS: m/z 417.226 3 [M+H]+。NMR数据见表 1。
化合物2 白色粉末 (甲醇)。HR-ESI-MS: m/z 417.226 3 [M+H]+ (Calcd. C24H33O6,417.227 2),确定分子式为C24H32O6。1H NMR (600 MHz,DMSO-d6) δ: 7.64 (1H,dd,J = 9.6,2.4 Hz,H-22),7.51 (1H,d,J = 2.4 Hz,H-21),6.21 (1H,d,J = 9.6 Hz,H-23),5.11 (1H,br s,12-OH),4.41 (1H,s,14-OH),4.22 (1H,d,J = 3.0 Hz,3-OH),3.92 (1H,d,J = 3.0 Hz,H-12),3.88 (1H,br s,H-3),0.93 (3H,s,H-19),0.79 (3H,s,H-18)。13C NMR谱数据见表 2。以上数据与文献[5]报道基本一致,鉴定化合物2为假蟾毒精。
化合物3 白色粉末 (甲醇)。[α] +80.0 (c 0.10,MEOH),HR-ESI-MS: m/z 417.226 0 [M+H]+。NMR数据见表 3。
|
|
Table 3 NMR spectra data of compound 3 (in CD3OD) |
化合物4 白色粉末 (甲醇)。HR-ESI-MS: m/z 417.226 4 [M+H]+ (Calcd. C24H33O6,417.227 2),确定分子式为C24H32O6。1H NMR (600 MHz,DMSO-d6) δ: 7.80 (1H,d,J = 2.4 Hz,H-21),7.57 (1H,dd,J = 9.6,2.4 Hz,H-22),6.31 (1H,d,J = 9.6 Hz,H-23),4.95 (1H,s,14-OH),4.46 (1H,d,J = 4.8 Hz,11-OH),4.25 (1H,dd,J = 11.4,4.8 Hz,H-11),4.13 (1H,d,J = 3.0 Hz,3-OH),3.97 (1H,m,H-17),3.84 (1H,br s,H-3),1.06 (3H,s,H-19),0.79 (3H,s,H-18)。13C NMR谱数据见表 2。以上数据与文献[5]报道基本一致,鉴定化合物4为沙蟾毒精。
化合物5 白色粉末 (甲醇)。HR-ESI-MS: m/z 403.247 8 [M+H]+ (Calcd. C24H35O5,403.247 9),确定分子式为C24H34O5。1H NMR (600 MHz,DMSO-d6) δ: 7.87 (1H,d,J = 2.4 Hz,H-21),7.53 (1H,dd,J = 9.6,2.4 Hz,H-22),6.27 (1H,d,J = 9.6 Hz,H-23),4.36 (1H,d,J = 4.8 Hz,3-OH),4.13 (1H,s,14-OH),4.05 (1H,d,J = 6.0 Hz,11-OH),3.48 (1H,m,H-11),3.38 (1H,m,H-3),0.92 (3H,s,H-19),0.60 (3H,s,H-18)。13C NMR谱数据见表 2。以上数据与文献[6]报道基本一致,鉴定化合物5为3-表-日蟾毒它灵。
化合物6 白色粉末 (甲醇)。HR-ESI-MS: m/z 415.211 7 [M+H]+ (Calcd. C24H31O6,415.211 5),确定分子式为C24H30O6。1H NMR (600 MHz,DMSO-d6) δ: 7.80 (1H,d,J = 2.4 Hz,H-21),7.56 (1H,dd,J = 9.6,2.4 Hz,H-22),6.30 (1H,d,J = 9.6 Hz,H-23),5.00 (1H,s,14-OH),4.64 (1H,d,J = 5.4 Hz,11-OH),4.34 (1H,dd,J = 11.4,4.8 Hz,H-11),1.11 (3H,s,H-19),0.80 (3H,s,H-18)。13C NMR谱数据见表 2。以上数据与文献[7]报道基本一致,鉴定化合物6为3-氧代-沙蟾毒精。
| [1] | Zuo XD, Cui YA, Qin SK, et al. Advancement on the anticancer study of clinical application of cinobufacini [J]. Chin J Clin Med Res(中国临床医药研究杂志), 2003, 8: 232-235. |
| [2] | Meng ZQ, Shen HH, Robert N, et al. Phase I study of huachansu in hepatocellular carcinoma, non-small cell lung cancer, and pancreatic cancer: a preliminary report [J]. Chin Oncol(中国癌症杂志), 2007, 17: 376-379. |
| [3] | Wang DL, Qi FH, Tang W, et al. Chemical constituents and bioactivities of the skin of Bufo bufo gaigarizan Cantor [J]. Chem Biodivers, 2011, 8: 559-567. |
| [4] | Liang MX, Liu YF, Zhang XL, et al. A space isomer compound of arenobufagin and its preparation and application: CN, 102101879 A [P]. 2011-06-22. |
| [5] | Ye M, Guo H, Guo HZ, et al. Simultaneous determination of cytotoxic bufadienolides in the Chinese medicine ChanSu by high-performance liquid chromatography coupled with photodiode array and mass spectrometry detections [J]. J Chromatogr B, 2006, 838: 86-95. |
| [6] | Zhang X, Ye M, Dong YH, et al. Biotransformation of bufadienolides by cell suspension cultures of Saussurea involucrate [J]. Phytochemistry, 2011, 72: 1779-1785. |
| [7] | Zhang X, Ye M, Dong YH, et al. Biotransformation of arenobufagin and cinobufotalin by Alternaria alternata [J]. Biocatal Biotransfor, 2011, 29: 96-101. |
 2014, Vol. 49
2014, Vol. 49


