2. 华侨大学 分子药物教育部工程研究中心, 福建 泉州 362021;
3. 山东省寿光市人民医院, 山东 寿光 262700
2. Engineering Researching Center of Molecular Medicine, Minisry of Education, Huaqiao University, Quanzhou 362021, China;
3. Shandong Provincial Shouguang People's Hospital, Shouguang 262700, China
eIF4E (eukaryotic translation initiation factor 4E)为真核细胞翻译起始因子,可以与mRNA 5' 端帽子结构结合,是蛋白合成翻译起始中的重要蛋白[1]。在哺乳动物中已经明确有eIF4E-1、eIF4E-2和elF4E-3三种不同家族成员,三者在结构标记、功能特征以及表达形式上都有所不同,eIF4E-1存在于真核生物,eIF4E-2限于后生动物,elF4E-3则仅见于脊索动物。三者均可与mRNA帽结构结合,从而介导蛋白合成翻译的起始[2,3]。通常所说的eIF4E即eIF4E1[4]。鉴于eIF4E在细胞内蛋白合成翻译起始中的重要作用,所以eIF4E在细胞内必然存在着多种调控[5,6,7]。已有研究表明,4E-BPs具有抑制eIF4E活性的功能,4E-BPs作为竞争性抑制者并不干涉eIF4E与5' 帽子结 构结合,而是阻止eIF4F的组装[8]。在生长因子与激素信号及其受体激活的数条信号通路中,最常研究的包括Grb2、SOS和Ras,其中Ras激活MAP激酶。激活的MAPK使得4E-BPs与eIF4E分离,增加游离的eIF4E,同时激活的MAPK激活MNk1和MNk2,使eIF4E第209号丝氨酸磷酸化,磷酸化eIF4E更容 易与mRNA 5' 帽子结构结合进而增加mRNA翻译[9]。鉴于eIF4E在细胞中的重要的生物功能,细胞内对eIF4E的蛋白量的调控一定是精密而严谨的。细胞内的蛋白稳定性的调控大多数通过泛素化调节。目前关于eIF4E的泛素化修饰等研究还很少,而介导eIF4E泛素化的E3连接酶目前还没有报道。作者研究的目的是希望通过酵母双杂交筛选得到能够介导eIF4E泛素化的E3连接酶。
近年来研究显示,在人类诸多恶性肿瘤中发现癌组织和癌旁组织中存在eIF4E的过度表达,并且与肿瘤的侵袭转移能力呈正相关[10]。eIF4E在肿瘤的整个演进过程中起重要作用。一方面eIF4E过表达改变了细胞形态,增强细胞增殖能力,并诱导细胞转化、肿瘤生成和转移[11,12]; 另一方面eIF4E通过多方面调控恶性肿瘤相关mRNAs的翻译,包含细胞有丝分裂过程、激活原癌基因、血管形成、增强自分泌、细胞存活、侵袭及与细胞外环境的交通[13]。
本文利用酵母双杂交系统从人cDNA文库筛选eIF4E蛋白相互作用蛋白质,并用免疫共沉淀验证这种相互作用。希望能筛选到与eIF4E蛋白有特异相互作用的蛋白质,为阐明eIF4E蛋白诱导肝癌的分子机制提供重要的线索和启示。
材料与方法 质粒、菌株、细胞和文库菌株AH109,质粒pGBKT7、pGAD、pCMV-HA、pCMV-Myc及人骨髓cDNA文库均购自Clontech公司。
酶和试剂各种限制性内切酶均购自TaKaRa和Promega公司; Myc单克隆抗体 (鼠源) HA多克隆抗体 (兔源) 和酵母用培养基均购自Clontech公司; Flag M2单克隆抗体 (鼠源) 及X-gal、PEG3350、3-AT、溶细胞酶 (lyticase) 和放线菌酮均购自Sigma公司; DMEM、LipofectAMINE转染试剂为Gibco BRL公司产品; 化学发光底物试剂为Pierce公司产品; 其他试剂均为国产试剂。
酵母双杂交筛选将eIF4E基因定向克隆至酵母双杂交系统中的诱饵载体pGBKT7,构建重组质 粒pGBKT7-eIF4E。采用LiAC方法将质粒pGBKT7- eIF4E转化至酵母菌株AH109,β-半乳糖苷酶活性显色反应鉴定转录激活活性。扩增人骨髓cDNA文库,采用LiAC法转化pGBKT7-eIF4E和文库质粒至酵 母菌株AH109,涂布于50块Leu-/Trp-/His-SD培养基 + 3AT平板上。30 ℃培养至菌落长出 (7~10天)。分析和证实假定的阳性克隆。阳性克隆序列分析,通过国际互联网络进行同源性分析,以美国国立生物信息中心 (NCBI) 的BLAST作为主要的检索工具,对比数据库主要NR库和ESTs库。检索主要程序采用BLASTn。
细胞免疫共沉淀实验① 将细胞接种到60 mm细胞培养皿,达到密度后转染相应质粒,36 h后吸净培养液,可用PBS小心漂洗1次。用裂解液400 µL裂解细胞。收集上清液。② 上清液中加入相应的抗体约1 µg,4 ℃孵育过夜。③ 然后往裂解液中再加入蛋白A/G 30 µL,4 ℃孵育1~4 h。④将免疫沉淀后的溶液于4 ℃、3 000 r·min-1离心3 min,去上清液,加入1×裂解缓冲液500 µL洗涤琼脂糖珠,于冷冻离心机4 ℃、3 000 r·min-1离心3 min,弃上清液,共洗涤3~5次。⑤ 最后一次洗涤完毕,弃上清液,管中只剩Beads,加入2×SDS样品缓冲液混合振荡,于100 ℃煮沸10 min,稍离心后上样到PAGE胶,进行电泳。
结果 1 酵母双杂交筛选及鉴定首先构建重组质粒pGBKT7-eIF4E,验证eIF4E诱饵质粒在AH109细胞中的表达,用标准醋酸锂法将pGBKT7-eIF4E转入AH109,待菌落长出后,裂解酵母提取蛋白质,用蛋白质免疫印迹法检测诱饵质粒pGBKT7-eIF4E是否表达及表达大小是否正确。图 1显示,用Myc抗体可以检测到诱饵质粒的表达,大小正确,可以进行酵母双杂交筛选。
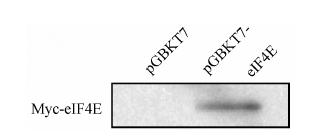 |
Figure 1 Expression of pGBKT7-P53 (73-393aa) in yeast |
转化pGBKT7-EIF4E至酵母菌株AH109,待菌落长出后,作β-半乳糖苷酶活性显色实验,结果为阴性无颜色反应,表明EIF4E蛋白在该酵母系统中无转录激活活性,可作为诱饵蛋白质利用酵母双杂交系统进行文库的筛选,经过文库筛选和验证 (图 2,3),得到多个与eIF4E蛋白有特异相互作用的克隆,核苷酸序列分析及同源性检索表明其中的一个克隆包含约0.4 kb的DNA插入片段与HUWE1基因高度同源 (图 4),即包含了HUWE1的4069-4374Aa编码序列。
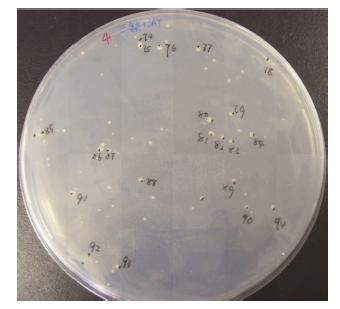 |
Figure 2 The growth condition of yeast colonies on SD/-Trp/ -Leu/-His/3-AT plate on the 10th day after transfection of cDNA library |
 |
Figure 3 The re-selection of yeast colonies on SD/-Ade/-His/ -Leu/-Trp plates and β-gal activity retests |
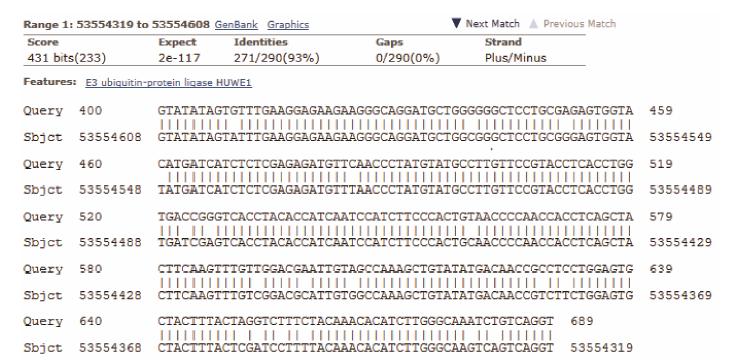 |
Figure 4 The blast results of HUWE1 clone |
为了进一步研究两者在哺乳动物细胞水平的 相互作用,构建pCMV-MYC-EIF4E和pCMV-Flag- HUWE1。利用LipofectAMINE (2 g·L-1) 将pCMV- MYC-eIF4E和pCMV-Flag-HUWE1两个质粒转染至293T细胞。48 h后收集裂解细胞,上清液用Flag M2单抗进行免疫沉淀。然后进行Western blotting检测。结果见图 5,表明eIF4E蛋白与HUWE1在哺乳动物水平也存在特异的相互作用。
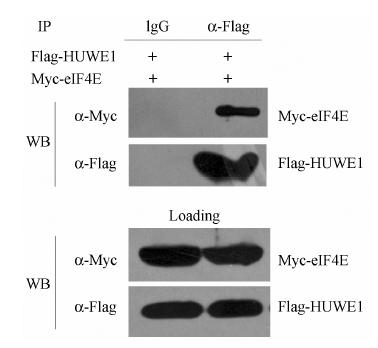 |
Figure 5 Co-immunoprecipitation of eIF4E and HUWE1 |
为了进一步研究两者在哺乳动物细胞中的作用位点,构建重组质粒pCMV-HA-HUWE1 (3 760~4 374 Aa) (含有HECT结构域)。将上述质粒与pCMV-MYC- eIF4E共转染293T细胞,用HA多抗沉淀,用MYC的单抗检测。结果见图 6, 结果表明HUWE1 (3 760~4 374 Aa) 可以与eIF4E蛋白相互作用。
 |
Figure 6 Co-immunoprecipitation of eIF4E and HUWE1 HECT domain |
利用酵母双杂交系统以凋亡蛋白为诱饵蛋白 从人骨髓cDNA文库中筛选到一个长0.4 kb左右与HUWE1基因高度同源的核酸序列。该序列包含部分HUWE1编码序列,蛋白质序列分析表明: 其在文库质粒中编码的蛋白质与HUWE1蛋白一致。直接将其与eIF4E蛋白免疫共沉淀并得到了证实,即二者在哺乳动物细胞水平也存在特异相互作用。相互作用位点实验表明,含有WWE和BH3结构域的突变体和含有HECT结构域的突变体都可以与EIF4E蛋白相互作用。
HUWE1是一个含有4 374个氨基酸的蛋白,其分子质量约为500 kD。HUWE1的羧基端有负责E3连接酶催化活性的HECT结构域。在其氨基端有两个ARLD结构域,关于HUWE1的此结构域的功能还不太清楚。有文献[14]报道,HECT结构域的E3连接 酶的氨基端负责底物的识别,其中间含有一个BH3结构域、UBA结构域和WWE结构域。BH3结构域负责与其底物MCL1结合,但HUWE1的BH3结构域与BCL-2家族的其他成员如BCL-2、BCL-xl和BAX都没有结合。在含HECT结构域的E3中,WWE结构域负责蛋白与蛋白的结合。在哺乳动物细胞中HUWE1是高度保守的。在人与鼠细胞中有大于90% 的相似度,而且所有的结构域都高度一致。作为E3连接酶,HUWE1的底物有p53、c-Myc、MCL-1等[15,16,17],最近有研究表明,在皮肤癌中,HUWE1作为肿瘤抑制因子能够通过抑制Myc/MIZ1复合体促进抑癌基因p21CDKN1A (p21) 和p15INK4B (p15) 的表达从而抑制肿瘤的形成[18,19]。而eIF4E在癌症的发生发展中也发挥了重要作用,HUWE1对eIF4E的调控及对肿瘤发生的调控是将来的研究重点。
| [1] | Martineau Y, Azar R, Bousquet C, et al. Anti-oncogenic potential of the eIF4E-binding proteins [J]. Oncogene, 2013, 32: 671-677. |
| [2] | Jia Y, Polunovsky V, Bitterman PB, et al. Cap-dependent translation initiation factor eIF4E: an emerging anticancer drug target [J]. Med Res Rev, 2012, 32: 786-814. |
| [3] | Wang A, Krishnaswamy S. Eukaryotic translation initiation factor 4E-mediated recessive resistance to plant viruses and its utility in crop improvement [J]. Mol Plant Pathol, 2012, 13: 795-803. |
| [4] | Lee T, Pelletier J. Eukaryotic initiation factor 4F: a vulnerability of tumor cells [J]. Future Med Chem, 2012, 4: 19-31. |
| [5] | Culjkovic B, Topisirovic I, Skrabanek L, et al. eIF4E is a central node of an RNA regulon that governs cellular proliferation [J]. J Cell Biol, 2006, 175: 415-426. |
| [6] | Graham PL, Yanowitz JL, Penn JKM, et al. The translation initiation factor eIF4E regulates the sex-specific expression of the master switch gene Sxl in Drosophila melanogaster [J]. PLoS Genet, 2011, 7: e1002185. |
| [7] | von der Haar T, Gross JD, Wagner G, et al. The mRNA cap- binding protein eIF4E in post-transcriptional gene expression [J]. Nat Struct Mol Biol, 2004, 11: 503-511. |
| [8] | Lukhele S, Bah A, Lin H, et al. Interaction of the eukaryotic initiation factor 4E with 4E-BP2 at a dynamic bipartite interface [J]. Structure, 2013, 21: 2186-2196. |
| [9] | Dobrikov M, Dobrikova E, Shveygert M, et al. Phosphorylation of eukaryotic translation initiation factor 4G1(eIF4G1)by protein kinase C{alpha} regulates eIF4G1 binding to Mnk1 [J]. Mol Cell Biol, 2011, 31: 2947-2959. |
| [10] | Fitzgerald KA, Evans JC, McCarthy J, et al. The role of transcription factors in prostate cancer and potential for future RNA interference therapy [J]. Expert Opin Ther Targets, 2014, 18: 633-649. |
| [11] | Carroll M, Borden KL. The oncogene eIF4E: using biochemical insights to target cancer [J]. J Interferon Cytokine Res, 2013, 33: 227-238. |
| [12] | Culjkovic-Kraljacic B, Baguet A, Volpon L, et al. The oncogene eIF4E reprograms the nuclear pore complex to promote mRNA export and oncogenic transformation [J]. Cell Rep, 2012, 2: 207-215. |
| [13] | Borden KL. Targeting the oncogene eIF4E in cancer: From the bench to clinical trials [J]. Clin Invest Med, 2011, 34: E315. |
| [14] | Pandya, RK; Partridge, JR; Love, KR, et al. A structural element within the HUWE1 HECT domain modulates self- ubiquitination and substrate ubiquitination activities [J]. J Biol Chem, 2010, 285: 5664-5673. |
| [15] | Chen D, Kon N, Li M, et al. ARF-BP1/Mule is a critical mediator of the ARF tumor suppressor [J]. Cell, 2005, 121: 1071-1083. |
| [16] | Zhong Q, Gao W, Du F, et al. Mule/ARF-BP1, a BH3-only E3 ubiquitin ligase, catalyzes the polyubiquitination of Mcl-1 and regulates apoptosis [J]. Cell, 2005, 121: 1085-1095. |
| [17] | Zhao X, Heng JI, Guardavaccaro D, et al. The HECT-domain ubiquitin ligase Huwe1 controls neural differentiation and proliferation by destabilizing the N-Myc oncoprotein [J]. Nat Cell Biol, 2008, 10: 643-653. |
| [18] | Inoue S, Hao Z, Elia AJ, et al. Mule/Huwe1/Arf-BP1 suppresses Ras-driven tumorigenesis by preventing c-Myc/ Miz1-mediated down-regulation of p21 and p15 [J]. Genes Dev, 2013, 27: 1101-1114. |
| [19] | No authors listed. The MULE/HUWE1 E3 ubiquitin ligase is a tumor suppressor [J]. Cancer Discov, 2013, 3: OF32. |
 2014, Vol. 49
2014, Vol. 49


