2. 中国中医科学院中药研究所, 北京 100700;
3. 北京大学生命科学学院, 北京 100871;
4. 重庆市药物种植研究所, 重庆 408435
2. Institute of Chinese Materia Medica, Chinese Academy of Chinese Medical Science, Beijing 100700, China;
3. School of Life Sciences, Peking University, Beijing 100871, China;
4. Chongqing Institute ofMedicinal Plant Cultivation, Chongqing 408435, China
2008年,《Science》杂志上报道Velvet蛋白家族 (VeA和VelB) 与LaeA (Loss of aflR expression A) 全局调控因子在构巢曲霉 (Aspergillus nidulans) 中形成异源三聚体协同调控其生长发育与次生代谢[1]。早在半个世纪之前,VeA蛋白就被发现[2],随后Velvet与LaeA蛋白协同调控真菌发育与次生代谢的研究 被广泛关注,调控机制也逐渐被阐明,为Velvet与LaeA蛋白调控药用真菌发育及其活性成分合成的研究提供了依据。
药用真菌能产生与人类健康密切相关的活性成分,一般分为大分子的生物活性多糖和小分子的次生代谢产物两大类。次生代谢产物包括非核糖体多肽类、聚酮类、萜类、吲哚生物碱类和氧化脂类等[3,4]。例如,从灵芝发酵液中提取的多糖及三萜类物质具有抗肿瘤作用[5]。我国药用真菌大约有400多种,其中担子菌亚门和子囊菌亚门占多数。多数药用真菌受环境因素等限制仍未能人工驯化栽培,只有少数重要的药用真菌如灵芝、香菇和茯苓等栽培成功。药用真菌菌丝体发酵工艺的优化一定程度上解决了药用真菌资源稀缺及活性成分少的问题[6],但是其发酵工艺设备昂贵,技术难度高,可操作性差。因此,利用生物技术手段调控或合成药用真菌活性成分将成为药用真菌资源保护与可持续发展的新途径,次生代谢产物的生物合成及调控机制的研究已成为药用真菌研究领域中的核心内容。药用真菌的次生代谢产 物虽然种类繁多,但是其合成途径及调控机制具有一定的保守性[7,8,9]。例如,真菌特异的Velvet蛋白及LaeA调控蛋白在多种真菌中都具有调控次生代谢和生长发育的功能。
真菌次生代谢产物的调控与真菌生殖发育有协同关系。真菌生殖过程包括营养菌丝向无性孢子转变的无性生殖,及营养菌丝向有性子实体 (闭囊壳) 转变的有性生殖[10]。真菌的生殖过程对外界环境非常敏感,如温度、光照、pH值、氧供应、营养利用能力、真菌信息素等[11]。例如,模式真菌A. nidulans在光照下容易形成无性孢子 (分生孢子),而在黑暗下优先进行有性生殖[12]。外界环境不仅影响真菌的生殖发育,而且能够改变真菌的次生代谢产物。次生代谢在营养获取、真菌保护和与外界环境联系中也发挥作用,而且发育障碍常常与次生代谢的功能缺失相关。例如,A. nidulans形成子实体的能力发生障碍,与其次生代谢产物黄曲霉毒素的前体 (杂色曲霉素) 的缺失相关[13]。
近年来,真菌中 (主要在子囊菌中) Velvet蛋白家族及LaeA全局调控因子的发现及其功能研究表明,它们在协同调控真菌的次生代谢及生长发育中发挥重要作用[14-16]。Velvet与LaeA蛋白的相互作用机制在子囊菌模式真菌A. nidulans中研究比较深入,但仍未完全被阐明。本文主要阐述Velvet蛋白与LaeA全局调控因子协同调控真菌次生代谢和发育的分子机制,并对药用真菌Velvet与LaeA蛋白的研究进展及研究意义进行综述与展望。
1 Velvet蛋白家族与LaeA蛋白调控作用分子机制 1.1 Velvet蛋白家族结构与功能Velvet蛋白家族是一类真菌特异的具有Velvet结构域的蛋白,最早发现于模式真菌A. nidulans中,根据突变株形态似绒状命名为“Velvet”[2],已发现VeA (Velvet)、VelB (Velvet like B)、VosA (viability of spores A) 和VelC (Velvet like C) 4个成员 (表 1)。在A. nidulans中,VeA和VelB蛋白定位在第VIII号染色体,而VosA和VelC定位在第VII号染色体上[17]。Velvet结构域大约包括150个氨基酸。A. nidulans的VeA蛋白大小为573个氨基酸,蛋白N端包括一个核定位信号 (NLS) 和一个核输出信号 (NES),C端存在一个不稳定的富含脯氨酸、谷氨酸、丝氨酸和苏氨酸的PEST域。VelB在A. nidulans中只有369个氨基酸,是Velvet家族中最 小的蛋白,但VelB却是唯一具有两个Velvet结构域的蛋白,分别定位在蛋白的N端及C端。A. nidulans中的VosA蛋白有430个氨基酸,在N端有Velvet结构域。VelC的Velvet结构域在蛋白的C端。Velvet蛋白多存在于丝状的子囊菌及担子菌中[18],在低等的接合菌纲 (Zygomycetes) 或壶菌纲 (Chytridiomycetes) 中也发现Velvet结构域存在,如青蛙病原壶菌 (Batrachochytrium dendrobatidis) 有4个Velvet结构蛋白,因此推测Velvet蛋白家族起源较为古老[19]。 此外,哺乳动物类转录因子NF-κB具有RHD (Rel homology domain) 结构域能够调控动物的炎症、免疫系统和生长发育,晶体结构分析显示VosA的Velvet结构域与RHD结构域有一定的相似度,此研究从另一个角度证实真菌与动物具有共同祖先的论点[20]。
|
|
表 1 子囊菌纲及担子菌纲已报道及预测的LaeA和Velvet蛋白. ‘√’: 存在; ‘×’: 不存在; ‘+’: 预测存在。加框标注为药用真菌 |
Velvet蛋白家族的功能主要调控真菌发育与次生代谢,并且受到光、温度等环境因素影响。VeA是最早被发现的Velvet蛋白[21]。VeA蛋白的核定位受核定位信号NLS控制,也与光照相关。在A. nidulans 中,α输入蛋白KapA与VeA的NLS相互作用介导VeA蛋白的核定位,同时VeA蛋白 N端敲除导致VeA蛋白往细胞核的转运减少[22]。而光照时,细胞质中VeA蛋白多; 黑暗时,VeA细胞核中积累多,并且N端删除的VeA1突变体在细胞中的定位显示其对光照不敏感[23]。VeA蛋白在有性生殖过程中起正调节作用,而在无性生殖中起负调节功能。A. nidulans的VeAΔ突变菌株与野生型菌株相比,分生孢子数目增多且子实体形成减少; 过表达VeA的A. nidulans不论在光照或黑暗条件下都可以进行有性生殖形成子实体[21]。Kato等研究发现VeAΔ突变体不能产生杂 色曲霉素 (致癌物质) 或青霉素 (抗生素),并且合成这些次生代谢产物的基因表达沉默[9,24],此发现建立了真菌次生代谢产物与生长发育之间的联系,并且认为VeA编码的蛋白是关键调控因子。VeA同源 基因在其他子囊菌中的角色并不完全相同,但是都与生长发育和次生代谢相关[25]。产毒素的寄生曲霉 (Aspergillus parasiticus) 或黄曲霉 (Aspergillus flavus) 的VeAΔ突变体导致黄曲霉毒素或杂色曲霉素的缺失,并导致闭囊壳的发育障碍[24, 26]。
VelB与其他Velvet成员形成聚合物来调控发育和次生代谢的过程。VelB蛋白缺少核定位信号位点,因此VelB核转运时需要VeA蛋白协同运输[27,28]。A. nidulans的VelB突变体中褐色色素的积累提高,分生孢子产量减少; VelB过表达后分生孢子的数量增加。
VosA蛋白的C端具有转录激活结构域,功能类似于转录因子。VosA有核定位信号,但是不支持VelB蛋白的核转运。VosA在A. nidulans中被鉴定为高拷贝基因,VosA抑制分生孢子萌发,并且促进孢子中海藻糖的积累[14]。海藻糖是生物体抵抗不同的环境压力的一种保护剂。由于海藻糖的缺失,VosAΔ突变体孢子的胞质成分和核酸快速消耗,易受高温及氧化作用的影响,从而失去长期生存的能力[29]。
VelC蛋白对真菌的有性生殖起正调控作用。VelC在A. nidulans的有性发育初期表达量升高,VelC敲除发现分生孢子数量增加且闭囊壳数量减少,而过表达VelC后A. nidulans的有性生殖能力增加[30]。Velvet蛋白结构及功能的研究证明具有真菌特异性,同时也确立VeA蛋白在调控真菌发育与次生代谢过程中的关键性地位。
1.2 LaeA全局调控因子的结构与功能2004年,LaeA (Loss of aflR expression A) 作为全局调控因子在A. nidulans被发现[31]。在LaeA基因的启动子区有AflR (aflatoxin biosynthetic pathway regulatory gene) 转录因子的结合位点,AflR转录因子在曲霉中可以正调控次生代谢基因簇 (杂色曲霉素) 的合成。LaeA蛋白的N端有NLS核定位信号及SAM (S-adenosylmethionine) 结合域,蛋白中间部位存在SAM依赖的MTD (methyltransferase domain) 结构域。LaeA 蛋白N端的SAM结合域决定其功能,SAM结合域位点突变与ΔlaeA突变显示相同表型[32]。
LaeA作为全局调控因子,不仅仅调控次生代谢,在生长发育过程中也发挥关键作用。A. nidulans的LaeA基因的敲除阻碍次生代谢基因簇的表达,包括杂色曲霉素、青霉素及洛伐他丁 (预防心脑血管疾病) 合成的基因簇[33]。LaeA可以通过调控及修饰Velvet家族蛋白协同调控生长发育。在光照下,LaeA抑制VelB和VosA的表达导致分生孢子数量增多; 而LaeA敲除后,VelB和VosA的蛋白表达水平显著升高,并且分生孢子的产生减少。LaeA的功能同时需要VeA蛋白的存在,LaeA的缺失导致VeA的高度磷酸化[14]。
真菌中也发现LaeA的类似蛋白。2013年,Palmer 等[34]利用反向遗传学手段在A. nidulans中发现LlmF (LaeA-like methyltransferases) 蛋白,对次生代谢产物杂色曲霉素和有性发育起负调控作用,LimF蛋白与VeA蛋白在细胞质中相互作用并影响VeA蛋白的转运定位,过表达突变体的VeA蛋白主要在细胞质中积累,LimF的敲除突变体的VeA蛋白在细胞核中积累更多。因此可以推断VeA蛋白在细胞质与细胞核中的定位对真菌发育与次生代谢的调控起决定性作用。
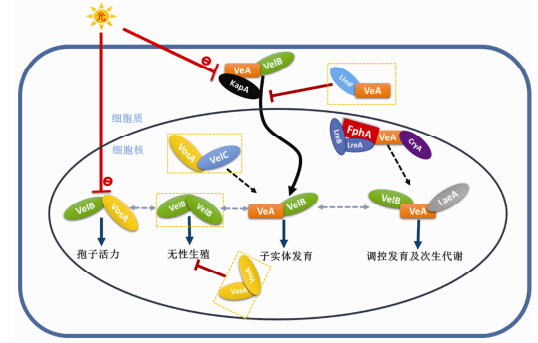
1.3 Velvet蛋白与LaeA全局调控因子之间的相互作用 Velvet蛋白之间在生物体内可以形成同源或异源二聚体复合物调控真菌的生长发育及次生代谢 (图 1)[14]。VelB的核转运需要VeA的参与,VelB与VeA二聚体被认为是A. nidulans的次生代谢和生长发育的基本调控单元。VelB与VeA分别敲除导致A. nidulans产生相似但不相同的表型。水稻恶苗病菌 (Fusarium fujikuroi) 的Ffvel2 (VelB) 的突变株也显示与Ffvel1 (VeA) 突变相似的缺陷; 两个基因同时敲除减少了F. fujikuroi对宿主植物侵害的毒性[35]。VosA-VelB在黑暗条件下可以相互作用形成二聚体,而光照下,VosA或VelB的表达很难被检测到。VosA-VelB提供支持有性孢子和无性孢子生存所需的海藻糖[14]。Velvet家族的VosA和VelB相关蛋白在不同的真菌中发挥不同的功能,并且与不同的环境因素相关。例如,A. nidulans的Velvet蛋白响应光信号[21],荚膜组织胞浆菌 (Histoplasma capsulatum) Velvet蛋白对温度敏感[36]。而最新研究报道,VelC与VosA可相互作用增加VelB与VeA异源二聚体的形成[30],VosA-VosA同源二聚体在菌丝期抑制A. nidulans的无性生殖,而VelB-VelB的同源二聚体促进A.nidulans的无性生殖 (图 1)[28]。
|
图 1 构巢曲霉 (A. nidulans) |
LaeA蛋白和两个Velvet家族VeA、VelB蛋白以三聚复合物形式存在,并协同调控真菌的次生代谢及生长发育过程 (图 1)[21]。在真菌体内VeA以桥梁形式分别连接VelB和LaeA,但是LaeA与VelB之间不能相互作用。VelB-VeA二聚体在细胞质中形成,而后转运进入细胞核; VelB/VeA/LaeA三聚复合物定位在细胞核中,并且在细胞核内不是均匀分布,而是聚集在一个特定的位置,但是三聚复合物的定位跟次生代谢调控相关与否仍未知。VelB/VeA/LaeA三聚复合物调控次生代谢及发育可能与光信号相关[27,37]。在光照条件下,VelB/VeA/LaeA三聚复合物的数量明显减少,并且子实体发育及杂色曲霉素产量被抑制。因为光照导致VeA合成减少,或者稳定性降低,也或者是VeA转运进入核的功能损伤,所以光照限制了VeA与VelB的相互作用。VeA在细胞核中与红光色素受体蛋白FphA相互作用,FphA又与蓝光受体LreA和LreB有关联[38]。紫外光受体CryA也可以影响VeA蛋白的表达。上述研究表明,Velvet与LaeA蛋白通过自身蛋白之间及与其他光受体蛋白之间形成复杂的聚合物协同调控真菌发育与次生代谢。
2 Velvet与LaeA蛋白在调控药用真菌活性成分与发育中的应用 2.1 具有药用价值子囊菌的Velvet与LaeA蛋白药用真菌大部分属于担子菌类 (灵芝、茯苓、香菇以及木耳等),少部分为子囊菌类 (产黄青霉菌等)。Velvet与LaeA蛋白的研究主要在子囊菌中进行 (表 1)。青霉素的工业生产菌株产黄青霉菌 (Penicillium chrysogenum) 的PcvelA基因在青霉素的生物合成中起调控作用,并且PcvelAΔ突变体产生更多的光不敏感的分生孢子[39,40]。P. chrysogenum的LaeA基因敲除引起分生孢子严重的损伤[41]。头孢菌素C的工业中LaeA蛋白与Velvet蛋白之间的相互作用网络图。黑暗条件下,KapA蛋白帮助VeA和VelB二聚体进入细胞核,光照时此功能受到抑制。VelB与VeA二聚体在细胞核中与A. nidulans子实体的发育相关。VeB-VeA-LaeA三聚体协同调控A. nidulans的发育与次生代谢过程。黑暗条件下,VelB与VosA二聚体促进海藻糖的生物合成,并且抑制分生孢子的萌发。FphA是红光受体,LreA及LreB是蓝光受体。LimF抑制VeA蛋白从细胞质往细胞核的转运。菌丝期,VelB-VelB形成二聚体正调控无性生殖,而VosA-VosA二聚体抑制无性生殖。黄色虚线为最新研究进展生产菌株产黄头孢酶 (Acremonium chrysogenum) 的AcVeA敲除导致头孢菌素合成相关基因表达大幅降低,头孢菌素合成减少80%[42]。模式真菌粗糙脉胞菌 (Neurospora crassa) 的NcveAΔ突变体无性孢子产生增加而类胡萝卜素的生物合成降低[43]。研究显示,不同子囊菌中的VeA的分子功能非常保守。A. nidulans 的VeA可以被N. crassa的NcveA替换,NcveA也可以恢复A. nidulans的VeAΔ的突变体表型; PcvelA转化至F. fujikuroi的Ffvel1突变体中或者Ffvel1转化 至P. chrysogenum的PcvelA突变体中,其突变表型 都能得到恢复[36,39]。LaeA与Velvet蛋白家族类似,在大多数丝状真菌 (除酵母类真菌) 中被发现。LaeA 在P. chrysogenum中可以调控次生代谢产物青霉素的合成[41]。
2.2 具有药用价值担子菌的Velvet与LaeA蛋白药用担子菌类的Velvet与LaeA蛋白的研究较少 (表 1)。玉米黑粉菌 (Ustilago maydis) 是一种具有药用价值的植物病原菌,其菌瘿具益气养阴、补气安神等功效,同时也是第一个验证Velvet蛋白功能的担子菌[44]。U. maydis基因组中预测到3个Velvet蛋白成员umv1、umv2和umv3,结构域及进化树研究表明umv1与 A. nidulans的VosA基因聚为一枝为同源序列,umv2、umv3与VelB为同源基因,其同源性分别为58%、63% 和53%。umv1的敲除突变体Δumv1在玉米上无法诱导产生菌瘿和冬孢子; Δumv2虽能产生菌瘿和冬孢 子,但对玉米的毒性降低; Δumv3突变体未发现与野生型在孢子产生及侵染玉米毒性方面的不同。其他担子菌类如灰盖鬼伞 (Coprinopsis cinerea)、双色蜡蘑 (Laccaria bicolor)、赤芝 (Ganoderma lucidum)、紫芝 (Ganoderma sinensis) 和茯苓 (Poria cocos) 等根据基因组数据预测均存在Velvet蛋白,但功能未鉴定。灵芝在我国已有两千多年的药用历史,同时也是目前研究最深入的药用真菌之一。灵芝拥有复杂的次 生代谢调控网络,能够编码多种次生代谢合成途径,是研究药用真菌次生代谢理想的模式真菌[45,46]。灵芝主要的活性成分为灵芝三萜及灵芝多糖,其生长发育历经担孢子、菌丝、原基及子实体阶段,具有明显的形态分化。研究证明原基期次生代谢产物灵芝 三萜的含量明显高于其他时期,这同时也反映灵芝的发育与次生代谢具有相关性[45]。基于基因组及转录组数据,灵芝中发现4个具有Velvet结构域的蛋 白(GL19230,GL21819,GL23472和GL24416),其与A. nidulans的Velvet蛋白同源分析如图 2,同时还发现13个候选的具有甲基转移酶结构域的LaeA基因。研究证实灵芝中Velvet基因的表达与灵芝三萜积累及三萜合成关键基因表达呈正相关[46]。灵芝中Velvet和LaeA蛋白的发现为其在发育与次生代谢调控的研究提供思路,但是这些蛋白质在灵芝发育与次生代谢调控中的作用机制仍需进一步研究。药用模式真菌灵芝中Velvet和LaeA蛋白作用机制的揭示将为担子菌类药用真菌的次生代谢和发育调控的研究奠定基础。

|
图 2 灵芝 (G. lucidum) 中预测的Velvet蛋白的结构及序列进化分析[45]。A: 灵芝基因组中预测的具有Velvet结构域的基因,GL24416和GL23472都有两个velvet结构域。B: Velvet家族成员的系统进化分析。Umv1、Umv2和Umv3是U. maydis的Velvet基因; VeA、VelB、VelC和VosA是A. nidulans的Velvet基因 |
药用真菌在传统医药及保健食品中的应用受到全世界的关注,药用真菌规模化生产、活性成分分离纯化及药理研究等需求更为迫切。不同种类药用真菌具有不同活性成分和药效,但是药用真菌次生代谢产物的合成及调控具有一定相似性,因此,从分子生物学和遗传学角度研究药用真菌次生代谢具有重要意义。以构巢曲霉 (A. nidulans) 作为模式真菌研究真菌次生代谢及发育的调控机制取得了显著成果,如Velvet蛋白及LaeA全局调控因子的发现及功能探索,随后在其他子囊菌类真菌中Velvet和LaeA蛋白协同调控发育与次生代谢的功能也陆续被证实。但是其 复杂的网络调控机制仍有很多疑惑未被解析。例如,Velvet蛋白在担子菌与子囊菌中均存在,其作用机制有何异同?LaeA调控Velvet蛋白的表达及对其修饰是否保守?VelB/VeA/LaeA三聚体复合物在细胞中的定位与其对次生代谢的调控是否相关?随着对科学问题的理解越来越深入,相信Velvet和LaeA蛋白在不同真菌中调控机制及作用差异的研究将逐步完善。
担子菌在传统药用真菌中占重要地位,野生资源及人工栽培产品已无法满足人们日益增长的需求,因此利用生物技术手段提高药用真菌活性成分的产量是解决这一问题的关键。然而,一些重要的药用真菌如香菇、灵芝、茯苓和木耳等,其发育与次生代谢调控研究较少。药用真菌中大多存在与次生代谢及发育相关的Velvet和LaeA蛋白,但是由于物种遗传背景少及遗传转化困难等问题,功能研究较少。构巢曲霉的Velvet与LaeA的研究证实其协同调控发育与次生代谢的功能,为药用真菌中的相关研究提供了理论依据。药用真菌基因组及转录组数据的陆续公布和遗传转化体系的建立,也将有助于利用反向遗传学策略研究药用真菌Velvet和LaeA蛋白的功能,进而揭示药用真菌发育与次生代谢协同作用的分子机制。协同调控次生代谢与生长发育分子机制的阐明将对药用真菌培育及活性成分生产具有重要意义。
| [1] | Bayram O, Krappmann S, Ni M, et al. VelB/VeA/LaeA complex coordinates light signal with fungal development and secondary metabolism [J]. Science, 2008, 320: 1504-1506. |
| [2] | Käfer E. Origins of translocations in Aspergillus nidulans [J]. Genetics, 1965, 52: 217-232. |
| [3] | Pietra F. Secondary metabolites from marine microorganisms: bacteria, protozoa, algae and fungi. Achievements and prospects [J]. Nat Prod Rep, 1997, 14: 453-464. |
| [4] | Patakova P. Monascus secondary metabolites: production and biological activity [J]. J Ind Microbiol Biotechnol, 2013, 40: 169-181. |
| [5] | Alves MJ, Ferreira IC, Dias J, et al. A review on antimicrobial activity of mushroom(Basidiomycetes)extracts and isolated compounds [J]. Planta Med, 2012, 78: 1707-1718. |
| [6] | Craney A, Ahmed S, Nodwell J. Towards a new science of secondary metabolism [J]. J Antibiot(Tokyo), 2013, 66: 387-400. |
| [7] | Brakhage AA, Schroeckh V. Fungal secondary metabolites- strategies to activate silent gene clusters [J]. Fungal Genet Biol, 2011, 48: 15-22. |
| [8] | Niehaus EM, Von Bargen KW, Espino JJ, et al. Characterization of the fusaric acid gene cluster in Fusarium fujikuroi [J]. Appl Microbiol Biotechnol, 2014, 98: 1749-1762. |
| [9] | Ochi K, Hosaka T. New strategies for drug discovery: activation of silent or weakly expressed microbial gene clusters [J]. Appl Microbiol Biotechnol, 2013, 97: 87-98. |
| [10] | Harris SD, Turner G, Meyer V, et al. Morphology and development in Aspergillus nidulans: a complex puzzle [J]. Fungal Genet Biol, 2009, 46: S82-S92. |
| [11] | Dyer PS, O'gorman CM. Sexual development and cryptic sexuality in fungi: insights from Aspergillus species [J]. FEMS Microbiol Rev, 2012, 36: 165-192. |
| [12] | Adams TH, Yu JH. Coordinate control of secondary metabolite production and asexual sporulation in Aspergillus nidulans [J]. Curr Opin Microbiol, 1998, 1: 674-677. |
| [13] | Kato N, Brooks W, Calvo AM. The expression of sterigmatocystin and penicillin genes in Aspergillus nidulans is controlled by veA, a gene required for sexual development [J]. Eukaryot Cell, 2003, 2: 1178-1186. |
| [14] | Atoui A, Kastner C, Larey CM, et al. Cross-talk between light and glucose regulation controls toxin production and morphogenesis in Aspergillus nidulans [J]. Fungal Genet Biol, 2010, 47: 962-972. |
| [15] | Chettri P, Calvo AM, Cary JW, et al. The veA gene of the pine needle pathogen Dothistroma septosporum regulates sporulation and secondary metabolism [J]. Fungal Genet Biol, 2012, 49: 141-151. |
| [16] | Sarikaya Bayram O, Bayram O, Valerius O, et al. LaeA control of velvet family regulatory proteins for light-dependent development and fungal cell-type specificity [J]. PLoS Genet, 2010, 6: e1001226. |
| [17] | David H, Ozcelik IS, Hofmann G, et al. Analysis of Aspergillus nidulans metabolism at the genome-scale [J]. BMC Genomics, 2008, 9: 163-178. |
| [18] | Park HS, Bayram O, Braus GH, et al. Characterization of the velvet regulators in Aspergillus fumigatus [J]. Mol Microbiol, 2012, 86: 937-953. |
| [19] | Bayram O, Braus GH. Coordination of secondary metabolism and development in fungi: the velvet family of regulatory proteins [J]. FEMS Microbiol Rev, 2012, 36: 1-24. |
| [20] | Ahmed YL, Gerke J, Park HS, et al. The Velvet family of fungal regulators contains a DNA-binding domain structurally similar to NF-κB [J]. PLoS Biol, 2013, 11: e1001750. |
| [21] | Mooney JL, Hassett DE, Yager LN. Genetic analysis of suppressors of the veA1 mutation in Aspergillus nidulans [J]. Genetics, 1990, 126: 869-874. |
| [22] | Stinnett SM, Espeso EA, Cobeno L, et al. Aspergillus nidulans VeA subcellular localization is dependent on the importin alpha carrier and on light [J]. Mol Microbiol, 2007, 63: 242-255. |
| [23] | Sprote P, Brakhage AA. The light-dependent regulator velvet A of Aspergillus nidulans acts as a repressor of the penicillin biosynthesis [J]. Arch Microbiol, 2007, 188: 69-79. |
| [24] | Calvo AM, Bok J, Brooks W, et al. veA is required for toxin and sclerotial production in Aspergillus parasiticus [J]. Appl Environ Microbiol, 2004, 70: 4733-4739. |
| [25] | Amaike S, Keller NP. Distinct roles for VeA and LaeA in development and pathogenesis of Aspergillus flavus [J]. Eukaryot Cell, 2009, 8: 1051-1060. |
| [26] | Duran RM, Cary JW, Calvo AM. Production of cyclopiazonic acid, aflatrem, and aflatoxin by Aspergillus flavus is regulated by veA, a gene necessary for sclerotial formation [J]. Appl Microbiol Biotechnol, 2007, 73: 1158-1168. |
| [27] | Chang PK, Scharfenstein LL, Li P, et al. Aspergillus flavus VelB acts distinctly from VeA in conidiation and may coordinate with FluG to modulate sclerotial production [J]. Fungal Genet Biol, 2013, 58: 71-79. |
| [28] | Park HS, Ni M, Jeong KC, et al. The role, interaction and regulation of the velvet regulator VelB in Aspergillus nidulans [J]. PLoS One, 2012, 7: e45935. |
| [29] | Ni M, Yu JH. A novel regulator couples sporogenesis and trehalose biogenesis in Aspergillus nidulans [J]. PLoS One, 2007, 2: e970. |
| [30] | Park HS, Nam TY, Han KH, et al. VelC positively controls sexual development in Aspergillus nidulans [J]. PLoS One, 2014, 9: e89883. |
| [31] | Bok JW, Keller NP. LaeA, a regulator of secondary metabolism in Aspergillus spp [J]. Eukaryot Cell, 2004, 3: 527-535. |
| [32] | Bok JW, Noordermeer D, Kale SP, et al. Secondary metabolic gene cluster silencing in Aspergillus nidulans [J]. Mol Microbiol, 2006, 61: 1636-1645. |
| [33] | Bouhired S, Weber M, Kempf-Sontag A, et al. Accurate prediction of the Aspergillus nidulans terrequinone gene cluster boundaries using the transcriptional regulator LaeA [J]. Fungal Genet Biol, 2007, 44: 1134-1145. |
| [34] | Palmer JM, Theisen JM, Duran RM, et al. Secondary metabolism and development is mediated by LlmF control of VeA subcellular localization in Aspergillus nidulans [J]. PLoS Genet, 2013, 9: e1003193. |
| [35] | Wiemann P, Brown DW, Kleigrewe K, et al. FfVel1 and FfLae1, components of a velvet-like complex in Fusarium fujikuroi, affect differentiation, secondary metabolism and virulence [J]. Mol Microbiol, 2010, 4: 972-944. |
| [36] | Webster RH, Sil A. Conserved factors Ryp2 and Ryp3 control cell morphology and infectious spore formation in the fungal pathogen Histoplasma capsulatum [J]. Proc Natl Acad Sci USA, 2008, 105: 14573-14578. |
| [37] | Bayram O, Braus GH, Fischer R, et al. Spotlight on Aspergillus nidulans photosensory systems [J]. Fungal Genet Biol, 2010, 47: 900-908. |
| [38] | Purschwitz J, Müller S, Fischer R. Mapping the interaction sites of Aspergillus nidulans phytochrome FphA with the global regulator VeA and the White Collar protein LreB [J]. Mol Genet Genomics, 2009, 281: 35-42. |
| [39] | Hoff B, Kamerewerd J, Sigl C, et al. Two components of a velvet-like complex control hyphal morphogenesis, conidiophore development, and penicillin biosynthesis in Penicillium chrysogenum [J]. Eukaryot Cell, 2010, 9: 1236-1250. |
| [40] | Kopke K, Hoff B, Bloemendal S, et al. Members of the Penicillium chrysogenum velvet complex play functionally opposing roles in the regulation of penicillin biosynthesis and conidiation [J]. Eukaryot Cell, 2013, 12: 299-310. |
| [41] | Martin J, Garcia-Estrada C, Kosalkova K, et al. The inducers 1, 3-diaminopropane and spermidine produce a drastic increase in the expression of the penicillin biosynthetic genes for prolonged time, mediated by the laeA regulator [J]. Fungal Genet Biol, 2012, 49: 1004-1013. |
| [42] | Dreyer J, Eichhorn H, Friedlin E, et al. A homologue of the Aspergillus velvet gene regulates both cephalosporin C biosynthesis and hyphal fragmentation in Acremonium chrysogenum [J]. Appl Environ Microbiol, 2007, 73: 3412- 3422. |
| [43] | Bayram O, Krappmann S, Seiler S, et al. Neurospora crassa ve-1 affects asexual conidiation [J]. Fungal Genet Biol, 2008, 45: 127-138. |
| [44] | Karakkat BB, Gold SE, Covert SF. Two members of the Ustilago maydis velvet family influence teliospore development and virulence on maize seedlings [J]. Fungal Genet Biol, 2013, 61: 111-119. |
| [45] | Chen SL, Xu J, Liu C, et al. Genome sequence of the model medicinal mushroom Ganoderma lucidum [J]. Nat Commun, 2012, 3: 913-921. |
| [46] | Sun C, Hu YL, Xu J, et al. Ganoderma lucidum: an emerging medicinal model fungus for study of the biosynthesis of natural medicines [J]. Sci Sin C(中国科学: 生命科学), 2013, 43: 447-456. |
| [47] | Shaaban MI, Bok JW, Lauer C, et al. Suppressor mutagenesis identifies a velvet complex remediator of Aspergillus nidulans secondary metabolism [J]. Eukaryot Cell, 2010, 9: 1816- 1824. |
| [48] | Park HS, Bayram O, Braus GH, et al. Characterization of the velvet regulators in Aspergillus fumigatus [J]. Mol Microbiol, 2012, 86: 937-953. |
| [49] | Crespo-Sempere A, Marin S, Sanchis V, et al. VeA and LaeA transcriptional factors regulate ochratoxin A biosynthesis in Aspergillus carbonarius [J]. Int J Food Microbiol, 2013, 166: 479-486. |
| [50] | Li S, Myung K, Guse D, et al. FvVE1 regulates filamentous growth, the ratio of microconidia to macroconidia and cell wall formation in Fusarium verticillioides [J]. Mol Microbiol, 2006, 62: 1418-1432. |
 2014, Vol. 49
2014, Vol. 49


