量子点 (quantum dots,QDs) 是近年来发展的一类新型的无机纳米荧光探针,由II-VI或III-V族元素组成,其粒径约为1~50 nm,具有激发光谱宽,发射波长可“调谐”且对称,光稳定性高,荧光寿命长等优点。这些优势使量子点在生命科学领域,尤其在体内成像[1, 2]、药物传输[3, 4, 5]、生物标记[6, 7, 8, 9]、以及纳米医学[10, 11, 12, 13, 14]等方面显示出巨大的应用价值。尽管量子点在荧光探针和细胞标记成像领域已有报道,但应用并不广泛,主要原因在于量子点在合成和应用中存在的一些急需改进的问题。目前,有机相合成法是比较成熟完善的量子点制备方法,但用此法合成的量子点表面含有大量的氧化三辛基膦和三辛基膦等有机配体,用于荧光探针和细胞成像时,需要通过包壳或配体交换方式进行转相,过程操作烦琐费时,还容易导致量子点荧光性能的减弱,限制了量子点的使用。而水相法合成量子点虽然适用于生物学研究,但水溶性量子点常用的配体如巯基乙酸、巯基丙酸和巯基乙胺等,毒性都很大,因此也不太适合直接应用于生物医学领域[15, 16]。
QDs与生物相容性好的高分子材料的连接是QDs应用于生物医学领域的一个关键步骤,由于生物材料的特殊结构和自组装功能已被用于辅助合成复杂的纳米材料,利用高分子材料的特殊结构和性质修饰量子点拓宽了量子点在生物领域的应用,制备得到的量子点具有很好的生物兼容性,可直接用于生物体系的分析测试[17, 18, 19, 20],而表面修饰的量子点探针在生物成像领域更显示出较大的优越性。
本文采用水热法合成N-乙酰-L-半胱氨酸稳定的碲化镉量子点 (CdTe quantum dots,CdTe QDs),进一步与生物高分子材料通过配体交换制备,其中生物高分子材料主要由聚乙二醇 (polyethylene glycol,PEG) 与穿膜肽9聚精氨酸 (9-poly-D-arginine,9R) 通过L-赖氨酸连接,并对PEG的一端进行D-氨基葡萄糖 (2-amino-2-deoxy-D-glucose,DG) 靶向修饰,得到的高分子材料表面修饰的CdTe QDs复合物可望用于肿瘤的靶向诊断。
材料与方法 药品与试剂氯化镉 (CdCl2,99.0%)、碲粉 (Te,99.99%)、硼氢化钠 (NaBH4,98.0%)、α-硫辛酸 (lipoic acid,LA,99.0%) 等购于中国医药集团上海化学试剂公司。N-乙酰-L-半胱氨酸 (N-acety-L-cysteine,NAC,99.0%)、二环己基碳二亚胺 (dicyclohexylcarbodiimide,DCC,99.0%)、N-羟基琥珀酰亚胺 (n-hydroxy-succinamide,NHS,99.0%)、Boc-L-赖氨酸 (Boc-L-lysine,Boc-Lys-OH,98.0%)、D-氨基葡萄糖 (DG ,98.0%) 等购于阿拉丁试剂 (上海) 有限公司。聚乙二醇 (PEG ,98.6%) 购于上海怡炎生物科技有限公司、9-聚精氨酸 (9R,98.0%) 购于吉尔生化 (上海) 有限公司。其余试剂均为市售分析纯或化学纯。细胞培养所用的RPMI 1640培养基、新生小牛血清、胰酶、溴化3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑购于上海碧云天生物技术有限公司。实验所用人肿瘤细胞株均购于中国科学院生化细胞研究所。
仪器754PC紫外可见分光度计 (上海菁华科技仪器有限公司); RF-5301PC荧光分光光度计 (日本岛津公司); Tecnai G2 F20 S-TWIN透射电镜 (飞利浦公司); 傅立叶变换红外光谱仪Nicolet ECO 2000 (赛默飞世尔科技); 核磁共振仪Bruker AV-500 NMR Spectrometer (布鲁克仪器有限公司) ; BX60荧光倒置显微镜 (日本奥林巴斯株式会社)。
CdTe量子点的制备分别称取碲粉50 mg和硼氢化钠80 mg (碲粉和硼氢化钠摩尔比为1∶5) 溶于3.5 mL乙醇中,通入氮气保护。然后,向溶液中加入去离子水1.5 mL,在60 ℃搅拌下反应30 min; 向上述溶液中加入0.5 mol·L-1硫酸5.5 mL,产生碲化氢气体。将碲化氢用0.2 mol·L-1 NaOH溶液0.75 mL吸收,制成特定浓度的NaHTe溶液。
称取NAC 147 mg溶于33 mL去离子水,用 0.2 mol·L-1 NaOH调节溶液pH至8~9,再加入0.1 mol·L-1氯化镉溶液3 mL搅拌。在氮气保护下,将新制成的NaHTe溶液加入到已制备好的镉溶液中,反应40 min,形成CdTe前体,100 ℃回流,得到NAC稳定的CdTe量子点。
量子点表面配体的制备硫辛酸-赖氨酸复合物 (LA-Lys) 的制备 将硫辛酸(LA) 100 mg溶于5 mL富马酸二甲脂 (DMF) 溶液中,加入二环己基碳二亚胺 (DCC),搅拌15 min后加入N-羟基琥珀酰亚胺 (NHS) (硫辛酸∶DCC∶NHS的摩尔比为1∶1.2∶1.5),室温搅拌过夜,除去副产物得到硫辛酸活化酯,再加入Boc-L-赖氨酸 (Boc- Lys-OH) 140 mg室温搅拌过夜,即得硫辛酸与Boc- L-赖氨酸的连接产物。之后将硫辛酸与Boc-L-赖氨 酸的连接产物溶于二氯甲烷/三氟乙酸体积比为7∶3的体系,室温搅拌过夜,脱去L-赖氨酸氨基上的Boc保护,制备得到LA-Lys复合物。
硫辛酸-赖氨酸-9R (LA-Lys-9R) 的制备 将氨基端Fmoc保护的9R 1 mg溶于5 mL DMF溶液中,搅拌5 min后加入1-乙基-(3-二甲基氨基丙基) 碳酰二亚胺 (EDC)、NHS (9R∶EDC∶NHS = 1∶1.2∶1.5),常温搅拌4 h,活化9R一端的羧基,再加入脱掉Boc的硫辛酸-赖氨酸 (9R与硫辛酸-赖氨酸的摩尔比为1∶1.5),常温搅拌4 h,与脱Boc保护后的硫辛酸-赖氨酸的氨基连接,最后经透析处理后备用。LA-Lys- 9R的合成路线见图 1。

|
Figure 1 Synthetic scheme of compound of lipoic acid,lysine,and 9-poly-D-arginine (LA-Lys-9R) |
D-氨基葡萄糖与聚乙二醇复合物 (DG-PEG) 的制备 将氨基端Boc保护的NH2-PEG-COOH 100 mg溶于5 mLDMF溶液中,加入DCC、NHS (PEG∶DCC∶NHS = 1∶1.2∶1.5),室温条件下搅拌过夜,去除副产物,得到羧基端活化的PEG。D-氨基葡萄糖 (DG) 15 mg溶于2 mL DMF溶液中,搅拌5 min后加入三乙胺40 mg,搅拌15 min后滴加到羧基端活化的PEG溶液中,常温反应4 h,形成DG-PEG复合物。
DG-PEG与硫辛酸-赖氨酸-9R复合物 (DG-PEG- LA-Lys-9R) 的合成 将DG-PEG 174 mg溶于5 mL二氯甲烷-三氟乙酸7∶3的体系,室温搅拌过夜,脱去PEG氨基端上的Boc保护。然后, 将硫辛酸-赖氨酸-9R 100 mg溶于5 mL DMF溶液中,搅拌5 min后加入EDC、NHS (硫辛酸-赖氨酸-9R∶EDC∶NHS = 1∶1.2∶1.5),常温搅拌4 h,将硫辛酸-赖氨酸-9R中赖氨酸上的羧基活化,再加入DG-PEG的DMF溶液,常温搅拌4 h,与DG-PEG的氨基端反应 (硫辛酸-赖氨酸-9R与DG-PEG的摩尔比为1∶1)。最后将上述合成产物溶于DMF中,搅拌5 min后加入20% 哌啶,DMF与哌啶体积比为5∶1,室温反应30 min,脱去9R上氨基保护的Fmoc。DG-PEG-LA-Lys-9R的合成路线见图 2。
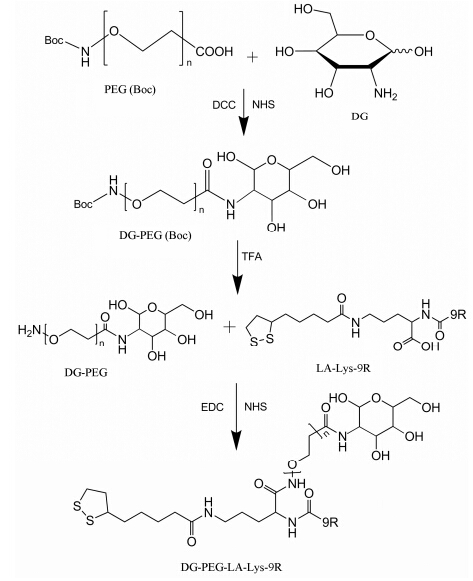
|
Figure 2 Synthetic scheme of compound of 2-amino-2-deoxy- D-glucose,polyethylene glycol,lipoic acid,lysine,and 9-poly- D-arginine (DG-PEG-LA-Lys-9R) |
通过配体置换制备量子点复合纳米粒 将上述制备得到的配体0.05 mmol溶于无水乙醇/水体积比1∶1的体系中,加入0.75 mmol 硼氢化钠还原配体中硫辛酸上的二硫键,4 h后将0.04 mmol CdTe量子点滴加到所合成配体的乙醇/水溶液中,60 ℃恒温水浴中避光搅拌12 h,通过配体置换即得以DG-PEG与硫辛酸-赖氨酸-9R复合物为配体的量子点复合纳米粒 (9R/DG-coated CdTe QDs)。见图 3。
量子点复合纳米粒的性质表征先将制得的表面配体冻干粉末采用KBr制片,然后采用傅里叶红 外光谱 (fourier transform infrared,FTIR) 分析。使用核磁共振仪测定表面配体的核磁波谱 (proton nuclear magnetic resonance,1H NMR)。质谱分析采用高效液相-质谱联用 (liquid chromatography-mass spectrometer,LC-MS) 分析。使用聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE) 进一步考察量子点表面配体共价偶联的结构特征。紫外、荧光光谱分析将制得的9R/DG-coated CdTe QDs纳米粒溶于磷酸盐缓冲溶液 (phosphate buffer solution,PBS) 中,然后用紫外-可见分光光度计和荧光分光光度计分别测定紫外吸收光谱和荧光发射光谱。
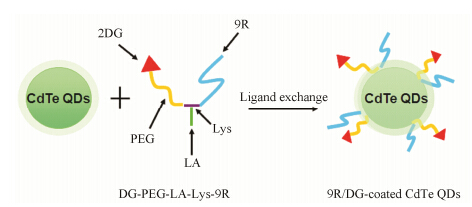
|
Figure 3 The schematic of the synthesis of tumor targeted CdTe quantum dots modified with functional polymer |
制得的QDs复合纳米材料的粒径、形貌及分布通过透射电镜 (transmission electron micrographs,TEM) 来观察,在PBS溶液中分散均匀的纳米粒悬液滴在涂有碳支持膜的铜网上,充分干燥后在加速电压为80 kV的透射电镜下观察纳米粒形态大小。
细胞毒性实验采用甲基噻唑基四唑盐 (methyl thiazolyl tetrazolium,MTT) 比色法进行检测,选用人胶质母细胞瘤 (U87)、人肝癌细胞系 (HEPG2)、人胃癌细胞系 (SGC-7901)、人乳腺癌细胞系 (MCF-7) 和人脐静脉内皮细胞株 (EaHy926)。按细胞数 (5×103/ mL) 200 μL接种于96孔板,RPMI 1640培养基培养,并在37 ℃、二氧化碳浓度为5% 和加湿空气环境下孵育。随后,每孔中的培养基用含有不同浓度 (0.01、0.1、1、10、100和1 000 μmol·L-1) 纳米载体的新鲜RPMI 1640培养基替换,继续孵育48 h。不含纳米载体的新鲜培养基替换原有孔中的培养基,作为空白对照组。48 h后,所用孔中的培养基用180 μL新鲜RPMI 1640和20 μL MTT溶液(5 mg·mL-1) 替换,继续培养4 h。最后,将所有孔中的培养基倒出,每孔加入DMSO 200 μL,并在室温下轻轻振摇。每孔中的溶液在490 nm处的吸光值可用酶标仪进行测定。各组的细胞相对存活率可通过如下公式进行计算: 存活率 (%) = (ODtreated/ODcontrol) × 100%,其中ODtreated 表示加入一定浓度壳聚糖胶束样品的实验组吸光值,而ODcontrol表示空白组 (未加入壳聚糖胶束样品) 的吸光值。
细胞摄取实验逆转录聚合酶链式反应 (reverse transcriptase-polymerase chain reaction,RT-PCR) 检测肿瘤细胞表面葡萄糖转运体1 (glucose transporter type 1,GLUT1) 受体的表达在37 ℃、二氧化碳浓度为5% 和加湿空气环境下培养U87 MG (DMEM培养基)、HEPG2、SGC-7901和MCF-7 (RPMI 1640培养基) 4种细胞系。用总RNA提取试剂盒 (Rneasy Total RNA Kit) 提取两种肿瘤细胞中的总RNA,然后用SuperScriptTM III逆转录试剂盒将3 μg RNA逆转录成cDNA,以β-actin作为内参,取cDNA 1 μL进行PCR循环,扩增GLUT1基因。PCR扩增条件为: 95 ℃预变性10 min → 94 ℃ 45 s → 60 ℃ 45 s → 72 ℃ 1 min (循环30次) → 72 ℃延伸5 min。GLUT1引物序列为: 上游引物: 5'-CAACCGCAACGAGGAGAAC-3',下游引物: 5'-ACAGCGACACGACAGTGAAG-3',产物长度为329 bp。内参β-actin的引物序列为: 上游引 物: 5'-AGCGAGCATCCCCCAAAGTT-3',下游引物: 5'-GGGCACGAAGGCTCATCATT-3',产物长度为285 bp。取5 μL扩增产物用于1.2% (w/v) 琼脂糖凝胶电泳分析。
肿瘤细胞靶向摄取实验24孔培养板的每个孔中加入0.5 mL RPMI 1640或DMEM培养基培养的U87、HEPG2、SGC-7901和MCF-7细胞系 (5×105 cells·mL-1)。在37 ℃、二氧化碳浓度为5% 和加湿空气环境下孵育24 h。然后在每孔中换入0.5 mL含有 量子点复合纳米粒的RPMI 1640培养基。继续孵育30 min后将培养基去除,用PBS溶液清洗3遍,最后用荧光倒置显微镜观察细胞内纳米粒的摄取情况。
结果与讨论 1 表面配体的合成及鉴定量子点表面修饰配体的合成,即首先通过化学合成的方法制备得到硫辛酸-赖氨酸复合物,然后将9R的羧基端与LA-Lys中赖氨酸上的氨基反应,并进一步与预先合成的DG-PEG复合物结合,最终形成硫辛酸-赖氨酸与DG-PEG及9R连接的量子点表面的配体复合物。
纯化后的硫辛酸-赖氨酸复合物采用LC-MS分析,质谱检测得到的硫辛酸-赖氨酸 (Boc) 分子量 (m/z 433 [M-H]-) 与理论分子量完全一致 (434)。
DG-PEG及DG-PEG-LA-Lys-9R两种复合物则使用FTIR及1H NMR检测。FTIR光谱显示: DG-PEG (Boc): 1 045 cm-1,1 110 cm-1为C-O-C伸缩振动峰; 1 400 cm-1为酰胺上的C-N伸缩振动峰; 1 640 cm-1为酰胺中的C=O伸缩振动峰; 2 850 cm-1为CH3的对称伸缩振动; 2 934 cm-1为CH2的伸缩振动峰; 3 445 cm-1为DG上的O-H与PEG上N-H的伸缩振动吸收峰 的重叠峰。DG-PEG-LA-Lys-9R: 3 442 cm-1为DG上的O-H与PEG上N-H的伸缩振动吸收峰的重叠峰; 2 360 cm-1为CO2峰; 1 651 cm-1为酰胺中的C=O伸缩振动峰加强; 1 400 cm-1为酰胺上的C-N伸缩振动峰; 1 092 cm-1为C-O-C的伸缩振动峰。
DG-PEG (Boc) 的1H NMR归属如下: 1.26~1.45归属为Boc上的甲基峰; 2.54~2.73归属为酰胺上的亚甲基峰CH2; 3.66归属为PEG上的亚甲基峰; 3.44~3.90,4.16归属为DG; 7.28~7.44为氘代氯仿 (CDCl3) 溶剂峰。DG-PEG-LA-Lys-9R的1H NMR归属如下: 1.40~2.60归属为L-赖氨酸上的亚甲基峰; 3.49为PEG上的亚甲基峰; 2.50左右为DMSO的溶剂峰; 3.50左右为H2O峰; 3.44~3.90归属为DG; 1.25~2.61归属为硫辛酸上的亚甲基峰。
用纯化后的LA-Lys-9R与DG-PEG-LA-Lys-9R化合物进行SDS-PAGE凝胶电泳分析 (图 4),以9R作为对照,LA-Lys-9R的电泳条带与9R几乎在同一条直线上,说明用9R与LA-Lys相连后,并没有显著影响9R的分子质量,这是因为9R (Fmoc) 的相对分子质量为1 549,与LA-Lys相连后得到的LA-Lys-9R (Fmoc) 的相对分子质量为1 865,故可以忽略不计。而DG-PEG-LA-Lys-9R (Fmoc) 复合物的相对分子质量达到3 994,与9R相比明显增加。因此,在SDS- PAGE凝胶电泳上DG-PEG与DG-PEG-LA-Lys-9R (Fmoc) 复合物的电泳条带明显落后于9R电泳条带,进一步证明了DG-PEG与LA-Lys-9R通过共价键成功地偶联。

|
Figure 4 SDS-PAGE of 9R,LA-Lys-9R,and DG-PEG-LA- Lys-9R |
采用紫外和荧光光谱分别测定CdTe QDs、9R修饰的CdTe QDs (9R-coated CdTe QDs)、DG修饰的CdTe QDs (DG-coated CdTe QDs) 及9R和DG共同修饰的CdTe QDs (9R/DG-coated CdTe QDs),结果如图 5所示。9R/DG与CdTe QDs表面的有机配体发 生交换后,形成9R/DG修饰的CdSe/ZnS QDs的紫外吸收峰和荧光发射峰与原始CdTe QDs比较发生了 少量红移,吸收峰从480 nm移至510 nm,发射峰从627 nm移至659 nm,峰的宽度几乎没有变化。一般来说,QDs尺寸的增加会引起吸收峰和发射峰发生红移,9R/DG的表面修饰使得QDs的尺寸增加,进而导致紫外吸收峰和荧光发射峰都发生红移。

|
Figure 5 Absorption and PL spectra of CdTe QDs,9R-coated CdTe QDs,DG-coated CdTe QDs,and 9R/DG-coated CdTe QDs |
高分辨透射电镜照片 (图 6) 显示,CdTe QDs、9R修饰的CdTe QDs、DG修饰的CdTe QDs以及9R/DG共同修饰的CdTe QDs均呈球形,尺寸均一,分散性较好。其中,CdTe QDs平均粒径约为3 nm; 9R修饰的CdTe量子点平均粒径为4~5 nm; DG修饰的CdTe量子点平均粒径为6~7 nm; 9R/DG共同修饰的CdTe QDs的平均粒径为8~10 nm。这些进一步证明了量子点荧光发射波长与其粒径尺寸相关。TEM图片中粒子的粒径可能小于纳米粒在水相中的粒径,这是因为量子点表面的生物材料具有一定的溶胀性。在TEM点样过程中,随着水分的蒸发,粒子出现了一定程度的收缩[21, 22]。

|
Figure 6 TEM of CdTe QDs (A),9R-coated CdTe QDs (B),DG-coated CdTe QDs (C),and 9R/DG-coated CdTe QDs (D) |
为了研究量子点的细胞毒性、细胞摄取能力与 细胞表面GLUT1受体表达高低之间的相互关系,采用PT-PCR技术检测U87 MG、HEPG2、SGC-7901和MCF-7细胞表面GLUT1受体的表达 (图 7),结果表明,HEPG2、SGC-7901细胞表面GLUT1受体高表 达,然而在U87 MG和MCF-7细胞表面却几乎没有GLUT1受体的表达。

|
Figure 7 GLUT1 receptor expression levels of MCF-7,SGC- 7901,U87 MG,and HEPG2 cells by Reverse Transcriptase PCR |
选用U87 MG、HEPG2、SGC-7901、MCF-7和EaHy926细胞观察量子点的体外细胞毒性。QDs在生物方面的应用取决于其对细胞功能及细胞活性的影响。QDs在体内应用中遇到的最大问题是其毒性,因为QDs本身会释放Cd2+离子。QDs的毒性不仅取决于自由Cd2+离子的浓度,还与Cd2+离子是否被细胞吸收及粒子在细胞内分布的位置密切相关[23]。已有研究证明,用生物分子包覆QDs,可以减少其表面 自由Cd2+离子的释放,进而减少QDs的毒性[24, 25]。采用U87 MG、HEPG2、SGC-7901、MCF-7肿瘤细胞和EaHy926人脐静脉内皮细胞的成活率测试9R/DG共同修饰的CdTe QDs的细胞毒性。结果表明,9R/ DG-coated CdTe QDs的生物毒性很小,在最高浓度 (1 000 μmol·L-1) 下,5种细胞的相对活力未见明显下降 (图 8)。与CdTe QDs相比,9R/DG修饰的CdTe QDs对正常细胞的成活率影响不大。在最高浓度下,EaHy926细胞的存活率依然达到97% 以上。U87 MG和MCF-7是两种GLUT1低表达的肿瘤细胞,而HEPG2和SGC-7901细胞分别是GLUT1高表达的人肝癌细胞和人胃癌细胞。9R/DG修饰的CdTe QDs对4种肿瘤细胞存活率比单纯CdTe QDs也有明显的提高,这可能是修饰的CdTe QDs在生物体中比较稳定、向溶液中释放的Cd2+离子比较少。其中,9R/DG修饰的CdTe QDs对HEPG2和SGC-7901细胞的毒性明显高于U87 MG、MCF-7细胞。这可能与9R/DG修饰的CdTe QDs对GLUT1受体高表达的癌细胞具有比较高的识别能力,进入HEPG2和SGC-7901细胞中的量比较大有关。本研究结果基本验证了9R/DG-coated CdTe QDs具有无毒、安全性好的特点。
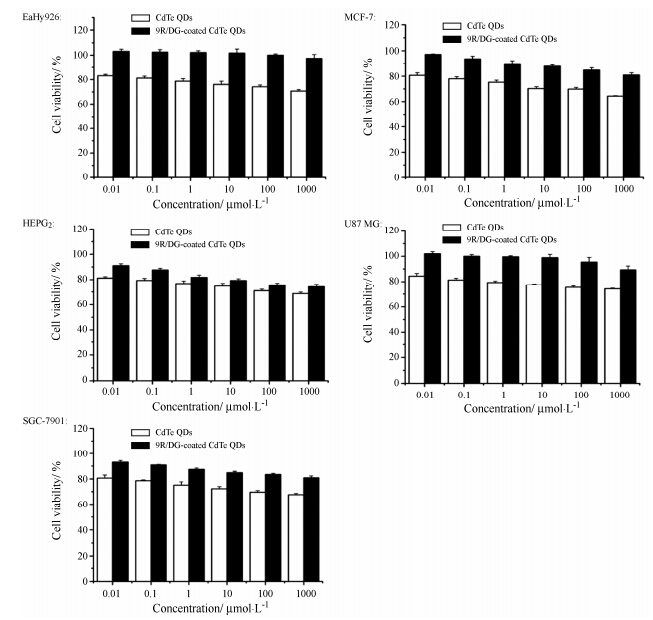
|
Figure 8 Cytotoxicity study of CdTe QDs and 9R/DG-coated CdTe QDs |
荧光显微镜成像技术被用于研究各组量子点纳米粒的细胞摄取,结果见图 9。CdTe QDs与肿瘤细胞共同孵育后,CdTe QDs几乎都不能被这4种肿瘤细胞摄取; 9R修饰的CdTe QDs在4种细胞内均发出红色荧光; DG修饰的CdTe QDs与肿瘤细胞共同孵育后,U87 MG和MCF-7细胞内几乎未见显著荧光,而HEPG2和SGC-7901细胞内可见大量红色荧光; 9R/DG共同修饰的CdTe QDs同样也在HEPG2和SGC-7901肿瘤细胞内发出强烈的红色荧光,但其他两种肿瘤细胞内少见红色荧光。
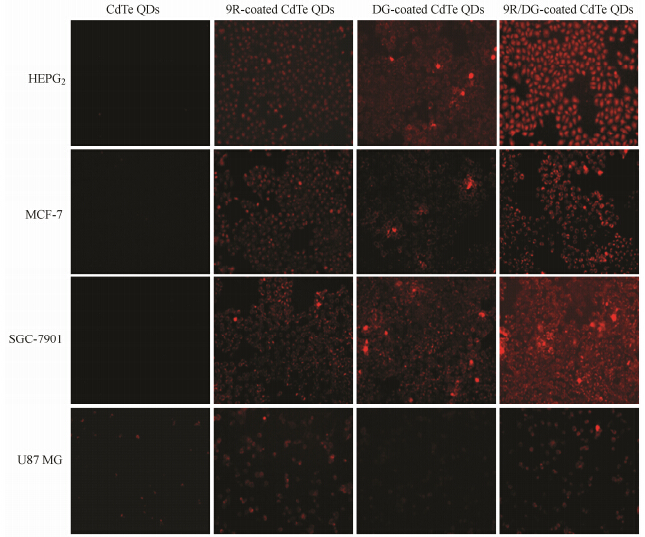
|
Figure 9 Fluorescence microscopy images of MCF-7,SGC-7901,U87 MG ,and HEPG2 cells incubation for 30 min with CdTe QDs,9R-coated CdTe QDs,DG-coated CdTe QDs,and 9R/DG-coated CdTe QDs |
Warburg等[26, 27, 28]发现肿瘤局部在有氧环境中存在异常旺盛的无氧葡萄糖酵解现象,尤其在乏氧条件下,肿瘤细胞的代谢途径发生了改变,从对氧气消耗较多的氧化磷酸化更多地转向可以在无氧条件下进行糖酵解,由此乏氧肿瘤细胞表面的葡萄糖转运体表达异常增加,以摄取大量的葡萄糖。已有研究证实将葡萄糖的衍生物DG与药物或纳米粒连接后,与肿瘤细胞表面高表达的葡萄糖转运体结合,可实现肿瘤的靶向传输[29]。细胞穿膜肽是具有穿膜能力的一种多肽,能够运载生物大分子跨越细胞膜进入细胞[30]。目前研究最为活跃的当属富含精氨酸的细胞穿膜肽。当连接精氨酸数目在5~11个之间时,多肽分子即可表现出穿膜性能,而由9个D-精氨酸组成的多肽9R被证实具有最好的穿膜效果[31, 32]。
本实验结果证实DG靶向修饰的CdTe QDs可以通过GLUT1受体介导的吞噬途径进入GLUT1受体高表达的HEPG2和SGC-7901细胞。U87 MG和MCF-7细胞表面GLUT1受体的表达非常低,因此,DG修饰的CdTe QDs被U87 MG和MCF-7细胞摄取的能力很弱。但9R对细胞缺乏选择性,虽然9R修饰的CdTe QDs可以穿透4种肿瘤细胞的细胞膜进入细胞浆中,由于缺乏DG的靶向修饰,单纯9R修饰的CdTe QDs对肿瘤细胞缺乏靶向性,不能很好地识别及靶向肿瘤细胞。而9R/DG共同修饰的CdTe QDs可以通过DG的靶向识别作用被GLUT1受体高表达的HEPG2和SGC-7901细胞摄取,然后通过9R的穿膜作用将CdTe QDs纳米粒有效地输送到肿瘤细胞 内,从而进一步增加肿瘤细胞的摄取率。
结论本研究制备的9R/DG-coated CdTe QDs复合纳米粒不但具有较好的形貌特征、光学性能,还能进一步改善量子点的生物相容性。尤其该复合纳米载体提高了GLUT1受体高表达的肿瘤细胞的靶向性,同时增加了量子点穿过细胞膜进入细胞浆的作用。9R/DG- coated CdTe QDs复合纳米粒可望用于肿瘤的靶向诊断或靶向治疗。
| [1] | Clarke SJ, Hollmann CA, Zhang Z, et al. Photophysics of dopamine-modified quantum dots and effects on biological systems [J]. Nat Mater, 2006, 5: 409-417. |
| [2] | Smith AM, Duan HW, Mohs AM, et al. Bioconjugated quantum dots for in vivo molecular and cellular imaging [J]. Adv Drug Deliv Rev, 2008, 60: 1226-1240. |
| [3] | Ding RM, He H, Li J. Research progress of polyami-doamine dendrimer in targeting drug delivery system [J]. Acta Pharm Sin (药学学报), 2011, 46: 493-501. |
| [4] | Hashim Z, Howes P, Green M. Luminescent quantum-dot sized conjugated polymer nanoparticles-nanoparticle formation in a miniemulsion system [J]. J Mater Chem, 2011, 21: 1797-1803. |
| [5] | Shi DL, Bedford NM, Cho HS. Engineered multifunctional nanocarriers for cancer diagnosis and therapeutics [J]. Small, 2011, 7: 2549-2567. |
| [6] | Bruchez M Jr, Moronne M, Gin P, et al. Semiconductor nanocrystals as fluorescent biological labels [J]. Science, 1998, 281: 2013-2016. |
| [7] | Chan WC, Nie S. Quantum dot bioconjugates for ultrasensitive nonisotopic detection [J]. Science, 1998, 281: 2016-2018. |
| [8] | Biju V, Itoh T, Ishikawa M. Delivering quantum dots to cells: bioconjugated quantum dots for targeted and nonspecific extracellular and intracellular imaging [J]. Chem Soc Rev, 2010, 39: 3031-3056. |
| [9] | Su HP, Xu HY, Gao S, et al. Microwave synthesis of nearly monodisperse core/multishell quantum dots with cell imaging applications [J]. Nanoscale Res Lett, 2010, 5: 625-630. |
| [10] | Sun DP, Yang K, Zheng G, et al. Study on effect of pep-tide-conjugated near-infrared fluorescent quantum dots on the clone formation, proliferation, apoptosis, and tumorigenicity ability of human buccal squamous cell carcinoma cell line BcaCD885 [J]. Int J Nanomed, 2010, 5: 401-405. |
| [11] | Giljohann DA, Mirkin CA. Drivers of biodiagnostic development [J]. Nature, 2009, 462: 461-464. |
| [12] | Zeng QH, Zhang YL, Liu XM, et al. Multiple homogene-ous immunoassays based on a quantum dots-gold nanorods FRET nanoplatform [J]. Chem Commun (Camb), 2012, 48: 1781-1783. |
| [13] | Chen C, Sun SR, Gong YP, et al. Quantum dots-based molecular classification of breast cancer by quantitative spectroanalysis of hormone receptors and HER2 [J]. Biomaterials, 2011, 32: 7592-7599. |
| [14] | Jang EJ, Kim SY, Koh WG. Microfluidic bioassaysystem based on microarrays of hydrogel sensing elements entrapping quantum dot-enzyme conjugates [J]. Biosens Bioelectron, 2012, 31: 529-536. |
| [15] | Liu L, Zhang J, Su X, et al. In vitro and In vivo assess-ment of CdTe and CdHgTe toxicity and clearance [J]. J Biomed Nanotechnol, 2008, 4: 524-528. |
| [16] | Choi SJ, Oh JM, Choy JH. Toxicological effects of inor-ganic nanoparticles on human lung cancerA549 cells [J]. J Inorg Biochem, 2009, 103: 463-471. |
| [17] | Zhao MX, Xia Q, Feng XD, et al. Synthesis, biocompatibility and cell labeling of L-arginine-functional β-cyclodextrin-modified quantum dot probes [J]. Biomaterials, 2010, 31: 4401-4408. |
| [18] | Biju V, Mundayoor S, Omkumar RV, et al. Bioconjugated quantum dots for cancer research: present status, prospects and remaining issues [J]. Biotechnol Adv, 2010, 28: 199-213. |
| [19] | Shuhendler AJ, Prasad P, Chan HK, et al. Hybrid quantum dot-fatty ester stealth nanoparticles: toward clinically relevant in vivo optical imaging of deep tissue [J]. ACS Nano, 2011, 5: 1958-1966. |
| [20] | Gérard VA, Maguire CM, Bazou D, et al. Folic acid modi-fied gelatine coated quantum dots as potential reagents for in vitro cancer diagnostics [J]. J Nanobiotechnol, 2011, 9: 50-56. |
| [21] | Giacomelli C, Schmidt V, Borsali R. Nanocontainers formed by self-assembly of poly(ethyleneoxide)-b-poly(glycerol mono-methacrylate)-drug conjugates [J]. Macromolecules, 2007, 40: 2148-2157. |
| [22] | Morita T, Horikiri Y, Suzuki T, et al. Preparation of gelatin microparticles by co-lyophilization with poly(ethylene glycol): characterization and application to entrapment into biodegradable microspheres [J]. Int J Pharm, 2001, 219: 127-137. |
| [23] | Lovrić J, Bazzi HS, Cuie Y, et al. Differences in subcellu-lar distribution and toxicity of green and red emitting CdTe quantum dots [J]. J Mol Med, 2005, 83: 377-385. |
| [24] | Pinaud F, King D, Moore HP, et al. Bioactivation and cell targeting of semiconductor CdSe/ZnS nanocrystals with phytochelatin-related peptides [J]. J Am Chem Soc, 2004, 126: 6115-6123. |
| [25] | Yao T, Zhao Q, Qiao Z, et al. Chemical synthesis, struc-tural characterization, optical properties, and photocatalytic activity of ultrathin ZnSe nanorods [J]. Chem Eur J, 2011, 17: 8663-8670. |
| [26] | Warburg O. On the origin of cancer cells [J]. Science, 1956, 123: 309-314. |
| [27] | Ganapathy V, Thangaraju M, Prasad PD. Nutrient transporters in cancer: relevance to Warburg hypothesis and beyond [J]. Pharmacol Ther, 2009, 121: 29-40. |
| [28] | Nijsten MW, Van-dam GM. Hypothesis: using the War-burg effect against cancer by reducing glucose and providing lactate [J]. Med Hypotheses, 2009, 73: 48-51. |
| [29] | Chen J, Chen HY, Cui SS, et al. Glucosamine derivative modified nanostructured lipid carriers for targeted tumor delivery [J]. J Mater Chem, 2012, 22: 5770-5783. |
| [30] | Lindgren M, Hällbrink M, Prochiantz A, et al. Cell-penetrating peptides [J]. Trends Pharmacol Sci, 2000, 21: 99-103. |
| [31] | Kumar P, Wu H, McBride JL, et al. Transvascular delivery of small interfering RNA to the central nervous system [J]. Nature, 2007, 448: 39-43. |
| [32] | Fuchs SM, Raines RT. Internalization of cationic peptides: the road less (or more?) traveled [J]. Cell Mol Life Sci, 2006, 63: 1819-1822. |
 2014, Vol. 49
2014, Vol. 49


