2. 中国药科大学中药学院, 江苏 南京 210009
2. School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 210009, China
麦冬为百合科 (Liliaceae) 多年生草本植物沿阶草属植物麦冬 (Ophiopogon japonicas (Lf) Ker Gawl) 的干燥块根。性微寒,味甘,微苦。具有养阴润肺、益胃生津、清心除烦的功效[1]。麦冬主产于浙江杭州和四川三台,称为杭麦冬和川麦冬[2]。本草考证认为杭麦冬质量好于川麦冬,为道地药材。杭麦冬和川麦冬属于同一种属不同产地的药材,其化学成分大体相同,但在有效成分的含量上有所差异。而现代药理学及临床研究表明麦冬具有抗肿瘤、耐缺氧、抗心律失常、降血糖及抗衰老等作用[3, 4],本研究尝试从整体水平比较杭、川麦冬的药效差异,为后期麦冬道地性的研究及其质量控制奠定基础。
代谢组学能够反映机体整体水平的代谢状况,其整体观与动态性与中医的整体辩证息息相关,将人或动物作为一个整体来研究[5], 现已广泛应用于中医药领域[6]。代谢组学的方法能灵敏检测区分不同产地的中药含量和提取方法,可有效地用于检测中药道地性品质及加工水平,也能对中药制剂工艺实行质量控制[7]。本研究采用基于液质联用技术的代谢组学方法评价麦冬药材不同产区药效的差异性,为中药材质量控制和优选种质资源可持续发展提供科学依据。
材料与方法 实验动物SPF级雄性SD大鼠56只,体重 (200 ± 20) g,购自北京维通利华实验动物技术有限公司 (许可证号: SCXK (京) 2012-0001),于SPF级动物房饲养。动物房温度 (21 ± 2) ℃,光照时间12 h,给药期间大鼠正常饮食。
药材麦冬,采自浙江慈溪 (杭麦冬) 和四川绵阳 (川麦冬) 栽培基地,经鉴定为百合科植物麦冬。在2010版中国药典一部记载麦冬最大安全剂量为12 g,换算成大鼠的剂量为1.224 g·kg-1,此剂量作为大鼠灌胃的低剂量,中剂量为2.448 g·kg-1,高剂量为4.896 g· kg-1。
麦冬水提物制备称取一定量的杭麦冬和川麦冬,粉碎,过40目筛,加入8倍量的蒸馏水浸泡60 min,加热至沸,提取20 min,过滤; 残渣再加入6倍量的蒸馏水,加热至沸,提取15 min,过滤。合并两次滤液,65 ℃减压浓缩至浓度为0.050 4 g·mL-1,作为高剂量水提液,中剂量水提液浓度为0.025 2 g·mL-1,低剂量水提液浓度为0.012 6 g·mL-1。
试剂甲醇(色谱级,美国Honeywell公司); 乙腈(色谱级,德国Fisher公司); 甲酸(色谱级,天津市光复精细化工研究所); 超纯水 (Milli-Q系统,法国Millipore公司); 亮氨酸-脑啡肽标准品 (美国Sigma公司)。
动物实验及血浆样品的采集56只雄性SD大鼠随机分为空白对照组、川麦冬低、中、高剂量组,杭麦冬低、中、高剂量组,每组8只,给药组灌胃10 mL·kg-1不同浓度的麦冬水提液,对照组灌胃蒸馏水10 mL·kg-1,分笼饲养; 给药28天后眼眶静脉取血,每只取血0.6 mL,置于含肝素钠的EP管中,3 000 r·min-1离心15 min,取上层血浆置于 -80 ℃贮存待用。
血浆样品的前处理血浆样品的前处理参照有关文献[8, 9]并进行实验确证,血浆样品4 ℃解冻,乙腈于4 ℃预冷24 h,取血浆200 μL,加入3倍体积 的乙腈600 μL,涡旋混合30 s,4 ℃静置15 min,以15 000 r·min-1离心15 min,取上清液,过0.22 μm微孔滤膜,转移至进样小瓶; 质量控制样品的制备: 分别从每个样品中吸取10 μL合并,加入3倍体积的乙腈沉淀蛋白,其余同样品的制备。最后转移到进样小瓶供UPLC-TOF/MS分析。
分析条件色谱柱: ACQUITYTM UPLC BEH C18 色谱柱: 2.1 mm × 50 mm,1.7 µm (Waters Corp.,Milford,USA),流速0.35 mL·min-1,柱温40 ℃,样品室温度保持在4 ℃。流动相A液为(水 + 0.1% 甲酸) 溶液,B液为乙腈,进样量5 μL,样品不经紫外检测器直接导入质谱检测系统,梯度洗脱: 0~0.5 min,5% B; 0.5~2 min,5%~30% B; 2~5 min,30%~60% B; 5~8 min,60%~80% B; 8~11 min,80%~100% B; 11~13 min ,100%~5% B; 13~15 min,5% B平衡2 min,共洗脱15 min。
质谱为Waters公司SYNAPT G2 HDMS系统,ESI离子源,采用正离子模式扫描,校正的质谱数据在Centroid模式下采集,其质谱条件为: 毛细管电压3 kV (ESI+),样本锥孔电压40 V,利用干燥氮气作为载气,脱溶剂温度450 ℃,离子源温度120 ℃,脱溶剂气流600 L·h-1,锥孔气流50 L·h-1,采集频率0.15 s,延迟时间0.02 s,碰撞能量6.0 V,质量扫描范围50~ 1 500 Da。质量锁定采用亮氨酸脑啡肽 (m/z 556.277 1),浓度为0.5 μg·mL-1,流速为5 μL·min-1。
仪器的精密度和方法的重复性考察为验证方法的重复性,取6个用同一方法制备的质控样品,从基峰离子流图中提取出10个色谱峰,对其保留时间和峰面积进行重复性考察,计算其相对标准偏差。取质控样品连续进样6次考察仪器精密度。
多元数据处理及分析将得到的样品数据导入Waters Masslynx 4.1软件中,在MarkerLynx applications manager Version 4.1编辑处理,对色谱峰进行峰提取、峰匹配、峰识别以及归一化处理,得到的数据矩阵再导入SIMCA-P 11.5 (Umetrics AB,Umeå/Malmö,瑞典) 软件中进行主成分分析 (PCA)、正交信号校正偏最小二乘法判别分析 (OPLS-DA)[10, 11]。在建立模型分析前先对数据进行Pareto标度化处理。选取对分类贡献大的变量 (VIP > 2) 作为候选标志物,再对这些变量进行独立样本的t检验,多组间比较采用单因素的方差分析 (P < 0.05,有统计学意义),最终确定为可能的潜在生物标记物。
结果 1 仪器的精密度和方法的重复性验证从图 1中的基峰离子流图的指纹图谱中可知,连续6次进样,基峰离子流图基本上完全重叠在一起,表明仪器的精密度良好。各个色谱峰的保留时间和峰面积 (均为平均值) 的RSD均小于15%,其保留时间的RSD在0~0.11%,峰面积的RSD在5.88%~13.28%,表明方法的重复性良好,适合样品的高通量分析。
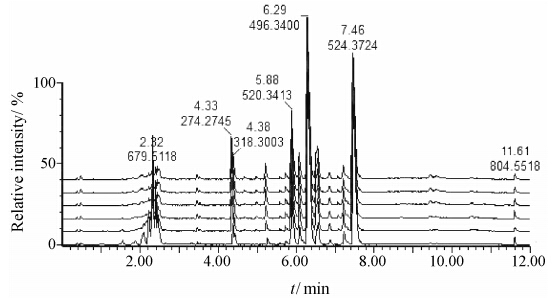
|
Figure 1 Comparative study on fingerprints of quality control sample in positive ion mode |
为比较大鼠给予不同产地的麦冬水提物后,其内源性代谢产物是否发生变化,对模型组和对照组的UPLC-MS采集的数据进行PCA模型分析 (一种无监督模式识别) 和OPLS-DA模型分析 (有监督模式识别),图 2a为对照组和模型组组间离散的PCA得分图,图 2b为经过正交校正后的OPLS得分图,能够减小个体之间存在的差异,对模型的分类更为准确可靠。
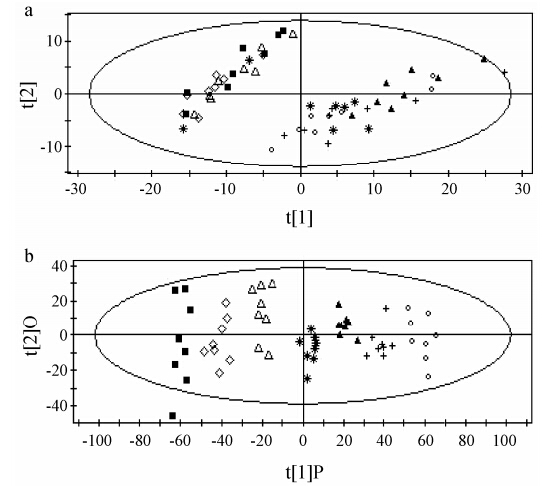
|
Figure 2 PCA score plots of plasma samples collected from control group and medicated groups of rats in positive mode (a); Orthogonal Signal Correction Partial Least Square (OPLS) score plots of the control group and medicated groups (b); ■,PN (control group); ◇,PCL (low dose group of Chuanmaidong); △,PCM (medium dose group of Chuanmaidong); â,PCH (high dose group of Chuanmaidong); ▲,PZL (low dose group of Hangmaidong); +,PZM (middle dose group of Hangmaidong); ○,PZH (high dose group of Hangmaidong) |
从得分图 2a [R2X (cum) = 0.502; Q2 (cum) = 0.447] 上可以看出川麦冬低剂量组和中剂量组与对照组在一个区域,川麦冬高剂量组和杭麦冬低、中、高剂量组基本上在一个区域。采用有监督的模式识别方法,以类别作为Y变量,并对数据矩阵进行正交信号校正,从OPLS的得分图 2b可以看出 [R2X = 0.591; R2Y = 0.991; Q2 (cum) = 0.988],该模型能够解释99.1% 的变量,模型的预测能力达到98.8%,说明此模型可靠性高。将这7组样品再进行分类比较,建立OPLS模型,见图 3,图中各组均能明显区分开,模型建立可靠。
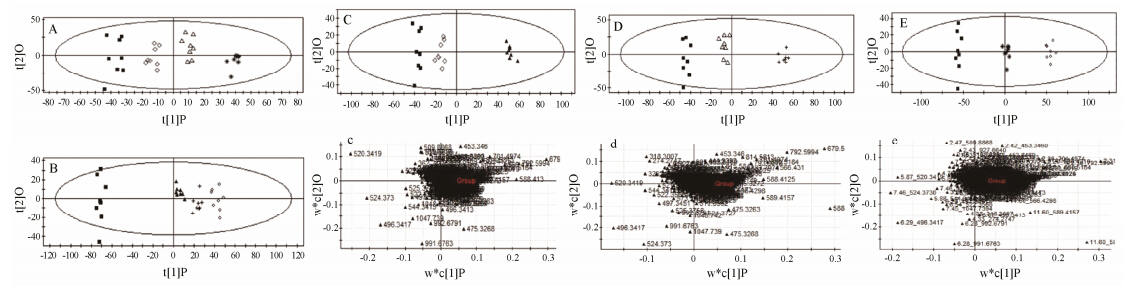
|
Figure 3 OPLS score plots of the control group and the groups of PCL,PCM and PCH (A,R2X = 0.46,R2Y = 0.931,Q2 (cum) = 0.638); OPLS score plots of the control group and the groups of PZL,PZM and PZH (B,R2X = 0.52,R2Y = 0.963,Q2 (cum) = 0.769); OPLS score plots and loading plots of the control group and the groups of PCL and PZL (C and c,R2X = 0.523,R2Y = 0.963,Q2 (cum) = 0.769); OPLS score plots and loading plots of the control group and the groups of PCM and PZM (D and d,R2X = 0.476,R2Y = 0.929,Q2 (cum) = 0.842); OPLS score plots and loading plots of the control group and the groups of PCH and PZH (E and e,R2X =0.536,R2Y = 0.972,Q2 (cum) = 0.909). The symbols represent the same as those in Figure 2 |
图 3A,B的得分图可观察到随剂量的增加川麦冬各组离对照组越来越远,差异显著; 杭麦冬组的变化趋势与川麦冬组一致,但其离对照组更远,差异更显著。图 3C,D,E的得分图分别将相同剂量的两个产地的麦冬与对照组比较,可看出,与杭麦冬高、中、低剂量组比较,川麦冬高、中、低剂量组与对照组更接近,差异没有杭麦冬给药组明显。图 3c,3d,3e为其对应的载荷图,反映了变量对样品分类的贡献程度,再对载荷图中远离原点的变量进行显著性的差异比较后,利用SPSS软件对这些变量进行系统聚类分析,结果见图 4。

|
Figure 4 The dendrogram of SPSS clustering analysis |
从图 4聚类分析结果可看出: 给药组与对照组基本上可归为3类,川麦冬低、中剂量组与对照组归为一类,杭麦冬低剂量为一类,川麦冬高剂量组与杭麦冬中剂量组、杭麦冬高剂量组为一类。
综上所述,其聚类结果与主成分分析的得分图和正交信号校正偏最小二乘法判别分析的各个得分图结果一致。表明灌胃麦冬后,大鼠血浆的内源性代谢产物发生了变化,且杭麦冬对正常大鼠的干预作用强于川麦冬,剂量越大干预作用越强。
3 潜在生物标志物的鉴定利用多元数据处理方法筛选出潜在的生物标志物后,再通过Human Metabolome Database (HMDB)、METLIN数据库、ChemSpider以及MS/MS二级碎片结构以及结合有关文献[12, 13]鉴定出潜在标志物的可能结构,表 1中包含了潜在生物标志物的保留时间、质荷比、加合物离子、代谢物的可能结构、代谢途径以及这些标志物在杭麦冬组和川麦冬组的含量变化趋势。
|
|
Table 1 Variation change tendency of plasma endogenous metabolites in positive mode during high dose of Hangmaidong group and Chuanmaidong group. LPC: Lysophosphatidylcholine; PC: Phosphatidylcholine; PE: Phosphatidyl ethanolamine. ↑ and ↓ represent higher and lower level in model group which compared with normal control group,P < 0.05,**P < 0.01 (n = 8) |
从表中可得知,这些生物标志物主要涉及脂类代谢。与对照组相比,代谢物LPC (18∶0)、LPC (18∶1)、LPC (18∶2)、LPC (16∶0) 在川麦冬和杭麦冬组含量下降,在杭麦冬组含量下降更为显著; 而代谢物PC (16∶0/22∶6)、MG (0∶0/22∶0/0∶0),PE (P-18∶1 (9Z)/22∶2 (13Z,16Z) )、PC (20∶1 (11Z)/15∶0) 的含量在川麦冬和杭麦冬组呈上升趋势。结果显示,给药后大鼠体内的一些代谢物发生了变化。
4 代谢通路分析结合人类代谢数据库中生化代谢途径分析,灌胃麦冬后大鼠血浆内源性生物标志物的生化代谢途径主要涉及脂类代谢,其代谢产物对人类的心血管系统、内皮细胞及凝血系统有一定的作用[14, 15],磷脂酰胆碱由胆碱和磷脂酸合成,具有控制肝脂类代谢,防止脂肪肝形成的作用,参与细胞和蛋白质信号传导,也是细胞膜的主要组成成分,是重要的生理活性物质[16]。溶血磷脂酰胆碱是磷脂的降解产物,也是氧化型低密度脂蛋白的主要活性成分,溶血磷脂酰胆碱可由磷脂经磷脂酶水解,也可通过氧化型低密度脂蛋白氧化得到,具有广泛的生物学效应: 对内皮细胞的舒张功能、通透性和多种细胞因子的分泌和凝血系统方面都有影响,尤其对心血管系统有显著影响[14],还具有心肌细胞毒性等,为重要的代谢中间产物,被人们所重视[17]。溶血磷脂酰胆碱是区分代谢良性和恶性非酒精性脂肪肝的生物标志物[18],也是氧化型低密度脂蛋白的主要活性成分,而氧化型低密度脂蛋白在动脉粥样硬化的发生发展中起着非常重要的作用[19]。溶血磷脂酰胆碱类物质有利于保护肝组织,预防动脉粥样硬化,对心血管系统有着重要的作用。
讨论前人对杭、川麦冬差异性的比较多集中在两者的有效成分及含量[20]、粉末显微鉴别[21]、理化鉴别[22]以及DNA分子鉴定[23]等方面,对这两种麦冬功效差异的研究很少报道,而用动物造模的方法进行麦冬药材的药效评价难以反映麦冬的整体功效,具有一定的局限性。因此本研究通过建立正常健康动物模 型,观察给药后大鼠内源性代谢产物的变化,进而采用代谢组学的方法对不同产地麦冬的药效差异进行评价。实验结果也得出了杭麦冬与川麦冬在药效学上具有显著差异,说明利用健康大鼠研究不同产地麦冬的功效差异具有一定的可行性。
本实验所采用的超高效液相-四级杆飞行时间质谱分析技术具有准确、重复性高、灵敏度高特点,适合样品的高通量分析,采集信息快,缩短实验周期,可有效的用于评价生物体内多种组分的含量、组成及其变化。代谢组学这种客观地反映整体变化的特性,对于中医中药多靶点、多系统的整体研究具有一定的可行性[24]。但本研究只是利用健康大鼠血液内源性代谢产物变化来比较不同产地麦冬药材药效差异,仍具有一定的局限性,下一步将结合造模后的药效数据来探讨以及验证杭、川麦冬功效上的差异性。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. Part 1. Beijing: China Medical Science Press, 2010: 144. |
| [2] | Guo HL, Liu JX, Hang YY. Research advances of Ophiopogon japonicus [J]. Chinese Wild Plant Resources (中国野生植物资源), 2003, 22: 1-4. |
| [3] | Lin Q, Zhou QF, Xu DS. Pharmacological effects progress of Ophiopogon japonicus [J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2004, 38: 59-61. |
| [4] | Tian YQ, Yu BY, Kou JP. Pharmacological effects progress of Ophiopogon japonicus [J]. Chin Acad Med Mag Org (中国医学生物应用技术杂志), 2004, 2: 1-5. |
| [5] | Qi LW, Li P, Zhao J, et al. Metabonomics and modernization of traditional Chinese medicine [J]. Mod Tradit Chin Med Mater -World Sci Technol (世界科学技术: 中医药现代化), 2007, 8: 79-86. |
| [6] | Liu CX. Significance of metabonomics in modern research of Chinese materia medica [J]. Chin Tradit Herb Drugs (中 草药), 2004, 35: 601-605. |
| [7] | Su T, Lu TL, Mao CQ, et al. Metabonomics and modern study of traditional Chinese medicine [J]. Chin J Exp Tradit Med Formulae (中国实验方剂学), 2011, 17: 247-250. |
| [8] | Bruce SJ, Tavazzi I, Parisod V, et al. Investigation of human blood plasma sample preparation for performing metabolomics using ultrahigh performance liquid chromatography/mass spectrometry [J]. Anal Chem, 2009, 81: 3285-3296. |
| [9] | Zou ZJ, Xie YY, Gong MJ, et al. Urine metabonomic study of intervention effects of Morinda officinalis How on ‘Kidney-yang deficiency syndrome' [J]. Acta Pharm Sin (药学学报), 2013, 48: 1733-1737. |
| [10] | Bylesjö M, Rantalainen M, Cloarec O, et al. OPLS discriminant analysis: combining the strengths of PLS-DA and SIMCA classification [J]. J Chemometrics, 2006, 20: 341-351. |
| [11] | Lu X, Zhao X, Bai C, et al. LC-MS-based metabonomics analysis [J]. J Chromatogr B, 2008, 866: 64-76. |
| [12] | Liu Y, Jia H, Chang X, et al. Metabolic pathways involved in Xin-Ke-Shu protecting against myocardial infarction in rats using ultra high-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry [J]. J Pharm Biomed Anal, 2014, 90: 35-44. |
| [13] | Li N, Wen J, Sun Y, et al. Metabonomic study on the anti-liver injury effect of Si-Ni-San on rats by using UPLC-MS/ MS [J]. Acta Pharm Sin (药学学报), 2014, 49: 368-373. |
| [14] | Kang AC, Huo Y, Qi LT. Effects of lysophosphatidylcholine in the pathogenesis of atherosclerosis [J]. Chin J Arterioscler (中国动脉硬化杂志), 2006, 12: 1083-1086. |
| [15] | Jiang FR. Study on n-Butanol Extract from Ophiopogon japonicus on Singnal Transduction of HUVEC Damage (麦 冬正丁醇提取部位对损伤HUVEC信号转导通路的研究) [D]. Nanjing: Nanjing University of Chinese Medicine, 2007. |
| [16] | Zhou AR, Zha XL. Biological Chemistry (生物化学) [M]. Ed 5. Beijing: People's Medical Publishing House, 2000, 123-128 |
| [17] | Zhang CF, Zhong WF, Li W, et al. Effect of vitamine C on ischemia reperfusion-like effect of exogenous lysophosphati-dylcholine on isolated working rat hearts [J]. Chin J Microcirc (微循环学杂志), 2000, 10: 22-24. |
| [18] | Lehmann R, Franken H, Dammeier S, et al. Circulating lysophosphatidylcholines are markers of a metabolically benign nonalcoholic fatty liver [J]. Diabetes Care, 2013, 36: 2331-2338. |
| [19] | Ylä-Herttuala S, Palinski W, Rosenfeld ME, et al. Evidence for the presence of oxidatively modified low density lipoprotein in atherosclerotic lesions of rabbit and man [J]. J Clin Invest, 1989, 84: 1086-1095. |
| [20] | Mo JX. Comparative identification on Ophiopogon japonicus which are commonly used [J]. J Chin Med Mater (中药材), 2010, 33: 1074-1076. |
| [21] | Yu BY, Liu HJ, Xu LS, et al. Microscopic identification of the powder of the Chinese drug Mai-Dong (Radix Ophiopognis) [J]. J China Pharm Univ (中国药科大学学报), 1992, 23: 5-10. |
| [22] | Lin Y, Zhu D, Qi J, et al. Characterization of homoisoflavonoids in different cultivation regions of Ophiopogon japonicus and related antioxidant activity [J]. J Pharm Biomed Anal, 2010, 52: 757-762. |
| [23] | Xu K. Genetic Diversity in O. japonicus (L.f.) Ker-GawL. Based on RAPD Analysis and Filtration of Difrerential Marker (麦冬遗传多样性的RAPD分析及特异标记的筛选) [D]. Chengdu: Sichuan University, 2003. |
| [24] | Jia W. Medical Metabonomics (医学代谢组学) [M]. Shanghai: Shanghai Science and Technology Press, 2011, 1: 24-40. |
 2014, Vol. 49
2014, Vol. 49


