2. 苏州大学附属第一医院 心血管内科, 江苏 苏州 215006
2. Department of Cardiology, The First Affiliated Hospital of Soochow University, Suzhou 215006, China
急性冠脉综合征 (acute coronary syndrome,ACS) 是一组由急性心肌缺血引起的临床综合征,血小板的激活在ACS发生中起着重要作用。氯吡格雷为血小板二磷酸腺苷 (ADP) 受体拮抗剂,本身没有活性,是一前体药物,85% 在肝脏中经羧酸酯酶1 (CES1) 代谢生成无活性的羧酸代谢产物,其余的15% 先经CYP1A2、CYP2B6和CYP2C19代谢成2-氧-氯吡格雷,再经CYP2A6、CYP2C9、CYP2C19、CYP3A4、CYP3A5和PON1转化为有活性的硫醇代谢产物 (MP-AM)[1]。氯吡格雷联合阿司匹林是指南[2,3,4,5]中抗血小板治疗的金标准,但部分患者尽管长期服用常规剂量的氯吡格雷,其血小板聚集能力仍不能被有效地抑制。对氯吡格雷疗效 个体差异机制的研究以及对氯吡格雷进行个体化治疗的需求是目前的研究热点。影响氯吡格雷药动学和药效学的因素包括人口学特征、病生理状态、合并用药和遗传因素等。群体药动学-药效学能定量考察上述协变量对氯吡格雷在ACS患者体内药动学和药效学的影响。最新文献[6]报道了氯吡格雷的群体药动学-药效学模型,该研究的目标人群为韩国健康人群和卒中患者,研究者选择了体内大量存在的氯吡格雷无活性羧酸代谢产物为其药动学指标,以比浊法检测的ADP诱导的血小板聚集率为其药效学指标,但是羧酸代谢产物的血药浓度与血小板聚集率之间没有必然的联系,因此该模型存在一定的局限性。鉴于此,本研究尝试以MP-AM和血小板VASP磷酸化水平作为其药动学和药效学指标,建立ACS患者氯吡格雷群体药动学-药效学模型,为临床实现个体化治疗提供参考。 材料与方法 病例资料
收集2011年11月至2012年7月入住我院心血管内科行急诊PCI或择期PCI的ACS患者59例。排除标准为: ① 入院前2周内服用华法林者; ② 近3个月内发生过脑血管意外者; ③ 酗酒或药物滥用者; ④ 合并严重感染、血液学疾病、自身免疫性疾病、肿瘤、心脏瓣膜病者。查阅患者病史,收集以下信息: ① 氯吡格雷的给药时间、给药剂量和采血时间; ② 人口学特征,包括性别、年龄、体重、身高和吸烟史; ③ 血常规指标,包括白细胞计数 (WBC)、红细胞计数 (RBC)、血红蛋白含量 (HGB)、血小板计数 (PLT)、血小板比积 (PCT)、平均血小板体积 (MPV) 和血小板分布宽度 (PDW); ④生化指标,包括谷丙转氨酶 (ALT)、谷草转氨酶 (AST)、胆固醇 (TC)、甘油三酯 (TG)、低密度脂蛋白 (LDL-C)、高密度脂蛋白 (HDL-C)、血肌酐 (Cr-S)、超敏C反应蛋白 (HSCRP) 和血糖 (GLU); ⑤血凝指标,包括凝血酶原时间 (PT) 和国际标准化比值 (INR); ⑥ 心超,包括左室射血分 数(EF); ⑦ 冠脉病变情况,包括病变部位及狭窄程度; ⑧ 合并用药,包括抗血小板药、β受体阻滞剂、血管紧张素转换酶抑制剂 (ACEI)、血管紧张素受体拮抗剂 (ARB)、醛固酮受体拮抗剂、他汀类、硝酸酯类、质子泵抑制剂 (PPI)、H2受体阻滞剂和口服降糖药。本研究经我院医学伦理委员会批准并经患者知情同意。59例患者的基本情况见表 1。
|
|
Table 1 Features of the study patients. n = 59,x± s |
药动学部分血样本在急性冠脉综合征患者服用氯吡格雷负荷剂量300 mg或600 mg后4 h内和维持剂量75 mg后2 h内任意时间采集,血样采集后立即加入衍生化试剂 (3'-甲氧苯丙甲胺溴化物,500 mmol·L-1) 25 μL,颠倒混匀,分离血浆,-70 ℃保存备用,共81个样本; 药效学部分血样本在患者服用氯吡格雷负荷剂量300 mg或600 mg和维 持剂量75 mg 5天后任意时间采集,枸橼酸抗凝,室温放置,4 h内检测血小板功能,进行VASP磷酸化水平检测,共83个样本。 血药浓度测定
取血浆200 μL~2 mL于离心 管中,加入内标液 (氯雷他定200 ng·mL-1) 10 μL,加入乙醚1.2 mL,涡旋振荡1 min,在4 ℃条件下 6 000 r·min-1离心3 min,取上清液1~1.5 mL离心管中,吹干乙醚,流动相200 μL复溶,涡旋振荡1 min,在4 ℃条件下14 000 r·min-1离心3 min,转移上清液100 μL至进样瓶中,7.5 μL进样。
色谱条件 色谱柱为Acquity BEH C8柱 (50 mm × 2.1 mm,1.7 μm,美国Waters公司),流动相由乙腈-甲酸铵溶液 (10 mmol·L-1,0.1% 甲酸) = 7∶3组成,流速为0.2 mL·min-1,柱温为40 ℃&,自动进样器温度4 ℃。
质谱条件 检测方法: 正离子模式; MP-AM扫描方法: 多反应监测 (MRM); 离子选择通道: MP-AM,[M+H]+,m/z 503.6 → 353.8; 内标,[M+H]+,m/z 382.8 → 336.9; 毛细管电压: 3.5 kV; 锥孔电压: 35 V; 去溶剂气: N2; 去溶剂气温度: 350 ℃; 离子源温度: 120 ℃; 去溶剂气流速: 650 L·h-1; 锥孔气流速: 50 L·h-1; 碰撞室气: Ar; 碰撞诱导解离电压: 25 eV。 标准曲线、精密度、准确度与绝对回收率
本法血浆MP-AM的标准曲线回归方程为Y = 12.591X - 19.365 (R2 = 0.997 7),线性范围为1~200 ng·mL-1。MP-AM的精密度、准确度和绝对回收率结果见表 2。
|
|
Table 2 Results of assay technology of MP-AM (%). n = 5 |
药效指标血小板功能采用PLT VASP/P2Y12试剂盒 (BioCytex,Marseille,France) 检测,按照说明书操作,计算血小板活性指数 (PRI,%)[7]。
基因型检测 患者外周静脉血经EDTA-Na2抗凝后提取DNA,采用PCR-RFLP法测定CYP2C19 *2/*3,PON1 Q192R,ABCB1 C3435T基因型,采用突变敏感性分子开关法测定CES1A2 A(-816)C基因型[8]。 数据分析
用NONMEM软件(Version7.2.0,double precision; ICON development solutions) 对数据进行分析,采用序贯法 (sequential analysis) 拟合药动学-药效学模型,药动学模型调用ADVAN 5子程序,药效学调用ADVAN 13子程序。 药动学与药效学模型建立
药动学基础模型 参考文献[9]报道,氯吡格雷在体内的药动学变化原理如图 1所示,基础药动学模型以此为基础,调用NONMEM软件中的ADVAN 5子程序估算氯吡格雷药动学参数。
 |
Figure 1 Pharmacokinetic structural model for clopidogrel. K12: Rate of clopidogrel to its inactive precursor; K23: Rate of clopidogrel inactive precursor distribution to peripheral compartment; K32: Rate of clopidogrel inactive precursor return from the peripheral compartment; K24: Rate of clopidogrel inactive precursor to its active metabolite; K40: Elimination rate of clopidogrel active metabolite |
药效学基础模型 根据氯吡格雷在体内发挥抗凝作用机制,药效学模型选择间接效应模型:
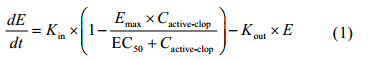
统计学模型包括个体间变异和个体内变异的统计学模型。药动学-药效学的个体间变异统计学模型均选择指数模型表示,即Pij = TVPj × exp (ηij)。其中,P为第i个体第j个参数,TVPj为该参数的群体典型值,ηij为个体间变异参数,服从均值为0、方差为ω2的正态分布。药动学-药效学的个体内变异统计学模型均选择比例模型表示,即Y = IPRED × (1 + ε)。其中,Y为药动学或药效学观测值,IPRED为药动学或药效学模型个体预测值,ε为个体内变异参数,服从均值为0、方差为σ2的正态分布。 协变量模型
协变量模型通过NONMEM软件进行分析。首先将协变量逐一引入基础模型中,通过比较引入协变量模型后目标函数与基础模型目标函数差值 (ΔOFV),ΔOFV服从F分布,近似χ2分布,若ΔOFV绝对值大于3.84,认为有统计学意义,即 P < 0.05,初步筛选出有统计学意义的协变量。然后通过有序递加法 (stepwise) 将初步筛选出的协变量按照ΔOFV绝对值从大到小依次引入到基础模型,定显著性水平为α = 0.05,自由度df = 1,若ΔOFV > 3.84,则引入该协变量,建立全量回归模型。最后通过向后剔除法 (backward elimination) 逐一剔除全量回归模型中的协变量,定显著性水平为α = 0.01,自由度df = 1,若剔除协变量后模型目标函数与全量回归模型目标函数差值绝对值大于6.64,则保留该协变量在模型中,否则,从模型中剔除该协变量,建立最终回归模型。
协变量包括连续变量和分类变量,连续变量包括年龄、身高、体重、体表面积、生化血液指标等,分类变量包括性别、基因型等,在协变量分析过程中,一些连续变量可根据生理意义作为分类变量考虑,如肝肾功能将实验室检查结果分为正常和不正常两类。在连续变量分析过程中,将连续变量按如下等式引入模型中:

分类变量按如下等式引入模型中:
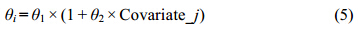
其中,Covariate_j为第j个协变量,Covariate_mean为协变量平均值。θi为药动学参数,式2~4中θ1为药动学或药效学参数群体典型值,式5中θ1为协变量Covariate_j = 0时的药动学或药效学参数,式2,3和5中θ2为协变量系数,式4中θ2为协变量指数。
模型评价 在群体药动学-药效学研究过程中,有必要对所建立模型进行评价,模型评价的方法有内部数据评价和外部数据评价[10,11,12]。在研究样本量较小时,模型评价采用内部评价法较好,本研究为评价所建立模型的稳定性和可信度,采用Bootstrap对模型进行验证评价。本研究中Bootstrap法是利用Wings for NONMEM软件完成的 (n= 1 000)。 结果 1 基因型分布
59例患者基因型分布情况见表 3。
|
|
Table 3 Genetic analysis of the study patients |
在确定了基础药动学模型和统计学模型之后,对协变量进行考察和筛选,用有序递加法和向后剔除法确定最终模型。最终模型中仅有CYP2C19基因多态性对药动学模型中原药到MP-AM前体转化参数K12有影响,即K12 = 0.259 × (1 - 0.656×CYP)。当CYP2C19为EM时,CYP = 0; 当CYP2C19为IM或PM时,CYP = 1。 3 药效学最终模型
根据氯吡格雷在体内作用机制,药动学-药效学模型链接是通过MP-AM浓度,在药动学最终模型建立后,将药动学模型中拟合预测的MP-AM个体预测浓度 (Cactive-clop) 值引入药效学建模的数据文件中。药效学模型建立过程同上述药动学模型建立,最终未发现影响药效参数的协变量。 4 模型评价 4.1 药动学模型
MP-AM药动学浓度观测值 (observed concentration) 与模型群体预测值 (pred) 相关性见图 2a,浓度观测值 (observed concentration) 与模型个体预测值 (IPRED) 相关性见图 2b。
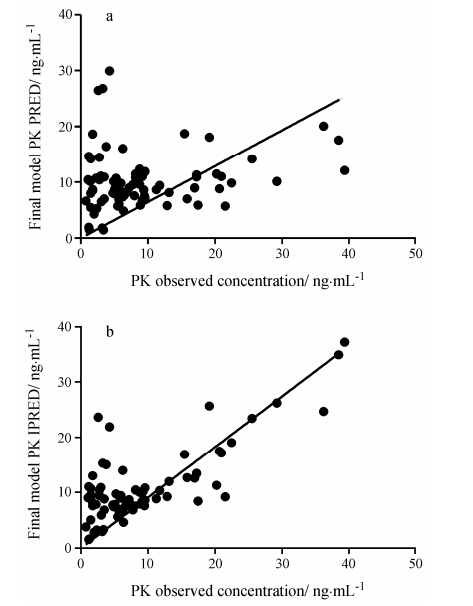 |
Figure 2 The scatterplot of pharmacokinetics observed concentration and prediction concentration of clopidogrel active metabolite. a: Observed concentration vs population prediction concentration; b: Observed concentration vs individual prediction concentration |
氯吡格雷药效学效应观测值 (observed value) 与模型群体预测值 (PRED) 相关性见图 3a,效应观测值 (observed value) 与模型个体预测值 (IPRED) 相关性见图 3b。
 |
Figure 3 The scatterplot of pharmacodynamics observed value and prediction value. a: Observed value vs population prediction value; b: Observed value vs individual prediction value |
最终模型参数用Bootstrap评价结果见表 4。
|
|
Table 4 Pharmacokinetic parameter estimates in the final pharmacokinetic model. ALAG1: The absorption lag time of clopidogrel |
本研究前瞻性入组59例ACS患者,通过测定MP-AM和血小板VASP磷酸化水平并收集相关资料,运用NONMEM软件进行统计分析,初步建立了ACS患者氯吡格雷的群体药动学-药效学模型。在药动学模型拟合过程中,为使模型便于拟合,本研究估算了氯吡格雷原药代谢到MP-AM前体过程参数K12及MP-AM清除率CL和分布容积V的个体间变异参数,其余参数假设不存在个体间变异。结果显示,该药动学模型所估算的MP-AM表观清除率 (CL/F) 和表观分布容积 (V/F) 的群体典型值分别为179 L·h-1和632 L,比文献[9]报道低,一方面可能是由于文献报道的研究人群体重明显高于本研究,另一方面可能是由于氯吡格雷原药及其代谢产物的蛋白结合率均很高,而不同种族人群对蛋白结合率高的药物存在明显的药代动力学参数差异。目前尚无中国汉族人群氯吡格雷活性代谢产物的药代动力学研究。
Lee等[6]以卒中患者和健康受试者为研究对象,分别以氯吡格雷非活性羧酸代谢产物和ADP诱导血小板聚集率作为药动学和药效学指标建立群体药动学-药效学模型,结果发现卒中患者与健康受试者氯吡格雷非活性羧酸代谢产物的清除率存在差异,同时肌酐清除率对氯吡格雷非活性羧酸代谢产物的清除有影响。Ernest等[9]以冠心病患者为研究对象,选择MP-AM为药动学指标,药效学指标同文献[6],最终未发现影响MP-AM药动学-药效学参数的协变量。上述两项研究[6,9]均未考察CYP2C19基因多态性的影响,且都是以比浊法检测ADP诱导的血小板聚集率为药效学指标,而比浊法易受多种因素的影响,重复性和特异性较差。本研究采用的血小板VASP磷酸化检测可以特异性反映MP-AM阻断P2Y12受体的活性,排除阿司匹林的抗血小板作用。因此,本研究选择了直接发挥药效的MP-AM作为药动学指标,选择特异性较强的血小板VASP磷酸化水平作为药效学指标,同时考虑了基因多态性的影响。
本研究最终药动学-药效学模型结果显示CYP2C19基因型为中代谢型 (IM) 或慢代谢型 (PM) 患者氯吡格雷原药到MP-AM前体转化参数K12比快代谢型 (EM) 患者约低65.6%,这与携带CYP2C19突变基因患者其MP-AM量明显减少有关。虽本研究结果未发现影响药效学参数的协变量,但该研究药动学-药效学模型链接是通过MP-AM浓度,故CYP2C19基因型可间接的影响氯吡格雷的药效。CYP2C19突变可导致氯吡格雷低抵抗血小板活性和主要心血管不良事件及支架内血栓形成的发生率增加,是氯吡格雷抵抗的独立预测因子[13,14,15,16]。因此,FDA于2010年3月发出警告[17],称抗凝血药波立维 (氯吡格雷) 对代谢不佳人群效果有限,必须在药品标签上添加黑框警告,着重强调CYP2C19基因型对氯吡格雷药动学和药效学以及临床反应的影响。《2013年ACCF/AHA ST段抬高型心肌梗死指南》[5]指出,氯吡格雷的抗血小板效应与CYP2C19多态性有关,大约有25%~30% 的患者可能因CYP2C19等位基因突变而表现出抗血小板活性降低。而中国汉 族人群CYP2C19*2/*3突变频率远高于欧美人群,因此中国人群氯吡格雷的个体化抗血小板治疗应更加受到重视。
本研究初步建立了ACS患者氯吡格雷群体药动学-药效学模型,发现CYP2C19基因多态性可影响氯吡格雷的药动学过程和药效学结果,对临床合理使用氯吡格雷具有一定的参考意义。但本研究仍存在一些不足,如入组患者数及采血点数相对较少等,因此还有待于进一步研究和完善。
| [1] | Sangkuhl K, Klein TE, Altman RB. Clopidogrel pathway [J]. Pharmacogenet Genomics, 2010, 20: 463-465. |
| [2] | Chinese Society of Cardiology. Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation [J]. Chin J Cardiol (中华心血管病杂志), 2012, 40: 353-367. |
| [3] | Chinese Society of Cardiology. Guidelines for the management of percutaneous coronary intervention [J]. Chin J Cardiol (中华心血管病杂志), 2012, 40: 271-278. |
| [4] | Steg PG, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation [J]. Eur Heart J, 2012, 33: 2569-2619. |
| [5] | O'Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction [J]. J Am Coll Cardiol, 2013, 61: 78-140. |
| [6] | Lee J, Hwang YH, Kang WK, et al. Population pharmacokinetic/ pharmacodynamic modeling of clopidogrel in Korean healthy volunteers and stroke patients [J]. J Clin Pharmacol, 2012, 52: 985-995. |
| [7] | Aleil B, Ravanat C, Cazenave JP, et al. Flow cytometric analysis of intraplatelet VASP phosphorylation for the detection of clopidogrel resistance in patients with ischemic cardiovascular diseases [J]. J Thromb Haemost, 2005, 3: 85-92. |
| [8] | Ding XL, Deng YL, Zhang J, et al. Mutation-sensitive molecular switch method to detect CES1A2 mutation in the Chinese Han and Yao populations [J]. Genet Test Mol Biomarkers, 2011, 15: 659-662. |
| [9] | Ernest II CS, Small DS, Rohatagi S, et al. Population pharmacokinetics and pharmacodynamics of prasugrel and clopidogrel in aspirin-treated patients with stable coronary artery disease [J]. J Pharmacokinet Pharmacodyn, 2008, 35: 593-618. |
| [10] | Ette EI, Williams PJ, Lane JR. Population pharmacokinetics III: design, analysis, and application of population pharmacokinetic studies [J]. Ann Pharmacother, 2004, 38: 2136-2144. |
| [11] | Brendel K, Dartois C, Comets E, et al. Are population pharmacokinetic and/or pharmacodynamic models adequately evaluated? A survey of the literature from 2002 to 2004 [J]. Clin Pharmacokinet, 2007, 46: 221-234. |
| [12] | Xue L, Rui JZ, Zhang Y, et al. Population pharmacokinetic study of tacrolimus in patients with hematopoietic stem cell transplant [J]. Acta Pharm Sin (药学学报), 2009, 44: 1145-1151. |
| [13] | Mega JL, Close SL, Wiviott SD, et al. Cytochrome p-450 polymorphisms and response to clopidogrel [J]. N Engl J Med, 2009, 360: 354-362. |
| [14] | Collet JP, Hulot JS, Pena A, et al. Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study [J]. Lancet, 2009, 373: 309-317. |
| [15] | Sibbing D, Stegherr J, Latz W, et al. Cytochrome P450 2C19 loss-of-function polymorphism and stent thrombosis following percutaneous coronary intervention [J]. Eur Heart J, 2009, 30: 916-922. |
| [16] | Giusti B, Gori AM, Marcucci R, et al. Relation of cytochrome P450 2C19 loss-of-function polymorphism to occurrence of drug-eluting coronary stent thrombosis [J]. Am J Cardiol, 2009, 103: 806-811. |
| [17] | Holmes DR Jr, Dehmer GJ, Kaul S, et al. ACCF/AHA clopidogrel clinical alert: approaches to the FDA “boxed warning”: a report of the American college of cardiology foundation task force on clinical expert consensus documents and the American heart association [J]. Circulation, 2010, 122: 537-557. |
 2014, Vol. 49
2014, Vol. 49


