2. 中南大学湘雅二医院临床药学研究所, 湖南 长沙 410011;
3. 中南大学湘雅二医院检验科, 湖南 长沙 410011;
4. 中国中医科学院, 北京 100700
2. Institute of Clinical Pharmacy, The Second Xiangya Hospital of Central South University, Changsha 410011, China;
3. Clinical Laboratory, The Second Xiangya Hospital of Central South University, Changsha 410011, China;
4. China Academy of Traditional Chinese Medicine, Beijing 100700, China
葛根为豆科植物野葛 (Pueraria lobata (Willd.) Ohwi) 的干燥根,临床上葛根素注射液常用来治疗和预防冠心病、心绞痛、心肌梗死等多种心脑血管疾病[1]。前期研究结果表明,在缺血再灌注损伤模型大鼠上,PEG化葛根素中、高剂量组的药效明显强于葛根素注射液组[2]。从药代动力学结果分析,PEG化葛根素组释药缓慢,最初的血药浓度甚至低于葛根素注射液组[3],推测PEG化葛根素很有可能在缺血模型大鼠的心肌组织部位有蓄积,为了论证该假说,笔者首次设计了PEG化葛根素在急性心肌缺血模型大鼠和正常大鼠组织分布的对比实验,探索PEG化葛根素在模型大鼠组织器官中药物分布方面的特点。
材料与方法 仪器LC-20A高效液相色谱仪 (日本岛津公司),SPD-20A紫外检测器 (日本岛津公司),TTL- DCII型多功能氮吹仪 (北京同泰联科技发展有限公司)。
主要药物与试剂葛根素对照品 (批号: 110752- 200811,供含量测定用,纯度≥98%,中国食品药物检定研究院); 鸢尾苷内标物 (批号: 611-40-5,供含量测定用,纯度≥98%,上海诗丹德生物技术有限公司); PEG化葛根素 (葛根素的质量分数为4.1%,纯度: 97%~98%,分子质量约为10 kDa,本院临床药学研究所合成); 甲醇、乙腈 (色谱纯,美国Fisher试剂公司); 乙酸(分析纯≥9 9.5%,北京化学试剂公司); 其他试剂均为分析纯。
实验动物雄性SD大鼠,购于中南大学湘雅二医院实验动物中心,实验动物使用许可证: SYXK (湘) 2011-0013。
色谱条件[4]Agilent C18柱 (250 nm× 4.6 nm,5 μm); 以乙腈和0.2% 磷酸水为混合流动相进行梯度洗脱。洗脱程序为: 0~8 min,乙腈: 11% → 25%,0.2%磷酸水: 89% → 75%; 8~17 min,乙腈: 25% → 11%,0.2% 磷酸: 75% → 89%; 柱温: 30 ℃; 检测波长: 250 nm; 流速: 1.0 mL·min-1; 进样体积: 40 μL。
溶液的配制精密称取葛根素对照品5 mg于25 mL量瓶中,用甲醇稀释至刻度,摇匀,即得浓度为200 μg·mL-1的葛根素甲醇储备液,精密量取上述葛根素储备液适量,分别置于10 mL量瓶中,用甲醇稀释至刻度,摇匀,配制成葛根素质量浓度分别为0.4、1. 0、2.0、5.0、10.0、15.0和20. 0 μg·mL-1系列标准溶液,置4 ℃冰箱中保存。
精密称取鸢尾苷7.5 mg于10 mL量瓶中,用甲醇稀释至刻度,再精密吸取1 mL于100 mL量瓶中,用甲醇稀释至刻度,摇匀,即得浓度为7.5 μg·mL-1鸢尾苷的内标溶液,以上溶液均置于4 ℃冰箱中保存备用。
样品的处理各组织样品按实际称取重量,以质量体积比1∶2加入生理盐水,制成组织匀浆液。精密移取组织匀浆液500 μL,置于5 mL洁净EP离心管中,添加12% 乙酸溶液40 μL,再加入鸢尾苷内标液 (7.5 μg·mL-1) 40 μL,涡旋混匀1 min,再加入色谱甲醇1 mL,涡旋混合5 min,15 000 r·min-1离心 5 min,吸取上清液转移至10 mL具塞离心管中,置于40 ℃水浴氮气流下吹干,残留物加入丙二醇-醋酸缓冲液 (pH 4.8,50∶50,v/v) 100 μL溶解并混匀,取40 μL进样[5]。
方法专属性取大鼠空白肝组织匀浆,除不加内标溶液外,其余按“样品的处理”项下操作,获得空白样品色谱图; 将一定浓度的葛根素标准溶液和内标溶液加入大鼠空白肝组织匀浆,同法操作,获得相应色谱图。取大鼠给药后30 min的肝组织匀浆样品,同法操作得到给药后大鼠肝组织样品色谱图。
标准曲线的制备取大鼠空白组织匀浆各500 μL,加入葛根素系列标准溶液50 μL,配制成相当于葛根素组织浓度为0.04、0.10、0.20、0.50、1.0、2.0和4.0 μg·g-1样品,按“样品的处理”进行操作,进样40 μL,记录色谱图。以葛根素的浓度为横坐标,葛根素与内标物的峰面积比值为纵坐标,按加权 (W = l/C2) 最小二乘法进行线性回归,求得的回归方程即为标准曲线。
精密度和准确度取空白肝组织匀浆及葛根素储备液适量,按“样品的处理”进行操作,配制0.08、0.8和2 μg·g-1 3种不同浓度的质控 (QC) 样品,各浓度平行制备6份,连续测定3天,并与标准曲线同时进行。计算QC样品的测得浓度,与配制浓度对照,求得组织样品测定方法的准确度与精密度。
提取回收率按“样品的处理”方法制备葛根素的肝组织匀浆低、中、高3个浓度的QC样品,各浓度平行制备5份,以提取后的色谱峰面积与未经提取直接进样获得的色谱峰面积之比,考察样品的提取回收率。
稳定性考察按“样品的处理”方法制备葛根素的肝组织匀浆低、中、高3个浓度的QC样品,考察匀浆样品在室温放置12 h、处理后4 ℃放置24 h、反复冻融3次以及于 -70 ℃环境中放置2周的稳定性。
其余组织样本的方法专属性、精密度、准确度、回收率和稳定性与肝组织匀浆处理方法类似。
大鼠体内的组织分布研究取雄性SD大鼠60只,随机分成两组,每组30只,给药前禁食12 h,自由饮水,采用尾静脉注射给予PEG化葛根素,给药剂量为488 mg·kg-1,给药5 min后,其中一组大鼠采用50 mg·kg-1异丙肾上腺素腹腔注射给予造成急性心肌缺血模型,另外一组为正常大鼠,分别于给药后30、60、90、120、150和180 min处死动物,取部分大鼠脏器: 心、肝、脾、肺、肾和脑,采用生理盐水洗净表面浮血,滤纸吸干,置 -70 ℃冷冻保存。测定前取出组织样本,解冻,称质量,剪碎,加入2倍量生理盐水在冰浴中制成组织匀浆。将得到的大鼠组织匀浆样品按“样品的处理”项下处理后分析测定。
数据处理应用SPSS 13.0统计软件进行数据分析,计量资料以± s表示,组间比较采用t检验,以P < 0.05为差异有显著性。
结果 1 方法学考察 1.1 方法专属性肝脏组织样品色谱图中葛根素与内标物的保留时间分别约为8.2和14.3 min (图 1)。同法考察其他组织匀浆的专属性,结果显示葛根素与内标物的色谱峰均与相邻色谱峰分离良好,组织中内源性物质及代谢物不干扰葛根素和内标物的测定,方法专属性较好。
 |
Figure 1 HPLC Chromatograms of puerarin: blank liver tissue (a); blank liver tissue spiked with puerarin (8.2 min) and tectoridin (14.3 min) (b); liver tissue sample after administration of PEGylated puerarin (c) |
葛根素质量浓度在0.04~4.0 μg·g-1内,各组织的线性关系良好 (表 1),方法的定量下限为0.04 μg·g-1,可以满足生物样品中葛根素的测定。
|
|
Table 1 Calibration curves of puerarin in biological samples |
大鼠肝组织中葛根素3个浓度的QC样品的日内RSD分别为3.9%、9.8%、7.6%,日间RSD分别为6.8%、7.5%、8.9%; 准确度在87.9%~110.5% 之间,各样品的精密度和准确度良 好,符合方法学的测定要求,可以进行生物样品中葛根素的测定。
1.4 提取回收率葛根素肝组织匀浆低、中、高3个浓度QC样品的提取回收率分别为 (82.1 ± 7.6) %、(87.7 ± 6.4) % 和 (88.5 ± 7.0) %; 同法考察内标的提取回收率为 (78.6 ± 6.1) %。结果表明,该提取方法回收率较好,可用于生物样品中葛根素的提取。
1.5 稳定性实验葛根素肝组织QC样品的测定浓度与理论浓度的RE在10% 内,表明大鼠肝组织样品在室温放置12 h、处理后4 ℃放置24 h、反复冻融3次以及于 -70 ℃环境中放置2周后 ,葛根素较为稳定,各种储存条件不影响样本浓度的准确测定。
2 组织分布研究给药后不同时间点大鼠组织中葛根素分布如图 2所示,主要分布于肝、心、肾等脏器,其中在肝组织中90 min后药物浓度基本上高于2.0 μg·g-1,对于急性心肌缺血模型大鼠而言,PEG化葛根素更容易在心脏部位蓄积,给药120 min后药物浓度达到顶峰,之后呈快速消除的趋势,具有明显的心脏内停留的特性。采用DAS 2.0软件计算各组织主要药动学参 数,结果见表 2。从表中可见,PEG化葛根素在正常大鼠脏器中的AUC大小顺序为肝 > 肾 > 心 ≈ 脾 > 肺 > 脑,而在急性心肌缺血模型大鼠中的AUC大小顺序为肝 ≈ 心 > 肾 > 肺 ≈ 脾 > 脑,其中,在模型大鼠心脏中的AUC为正常大鼠心脏中的1.7倍,与正常大鼠比较存在显著性差异 (P < 0.05)。由此得出,PEG化葛根素在心肌梗死早期区域具有较好的选择靶向性,可以将药物蓄积于缺血心肌。
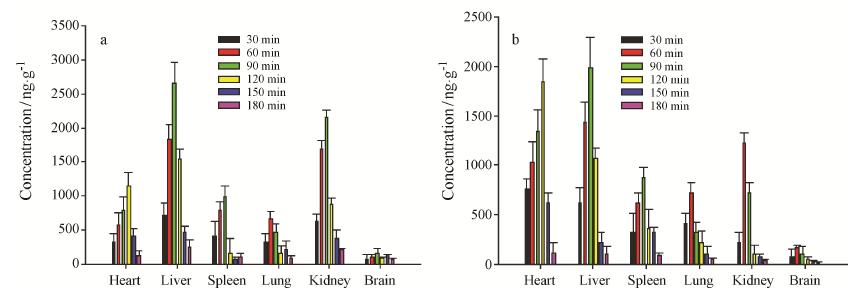 |
Figure 2 Tissue distribution profiles of PEGylated puerarin in normal rats (a) and acute myocardial ischemia model rats (b) at a dose of 488 mg·kg-1. n = 5,± s |
|
|
Table 2 Pharmacokinetic parameters of tissue distribution profiles of PEGylated puerarin in normal rats and acute myocardial ischemia model rats. P < 0.05 vs normal rats |
PEG化葛根素进入体内后存在两种形式,葛根素原型和PEG化葛根素,其中后者可以起一个药物储库的作用,通过不断的降解聚氧乙烯大分子单体,缓慢释放药物,故进入体内后的PEG化葛根素与最初形式存在较大的区别,只能通过葛根素的检测间接反应PEG化葛根素大分子的降解过程,所以本文只考虑检测葛根素在体内组织中的药物浓度。
PEG已是FDA认可使用的极少数能作为体内注射药用的高分子聚合物,具有良好的生物相容性和安全性。前期研究结果证实,葛根素经PEG修饰后,
水溶解性增强约13倍,半衰期延长5.2倍,药效方面略有增强,红细胞溶血现象明显减少[6]。本研究发现,PEG化葛根素对急性缺血心肌的靶向选择性明显增强,可以将药物蓄积于缺血心肌,与文献[7,8]报道基本一致。Sun等[7]采用荧光标记20 kDa和40 kDa的PEG高分子分别对心肌缺血模型小鼠和正常小鼠注射给药,结果发现两者在心肌缺血模型小鼠心脏中的分布分别为正常小鼠的1.47和1.92倍。Lin等[8]研究了PEG20K化麦冬多糖的体内组织分布,结果发现,PEG20K化麦冬多糖在心肌缺血模型小鼠的脏器分布AUC大小顺序为心 ≈ 肺 ≈ 肾 > 肝 > 脑,在正常小鼠的脏器分布AUC大小顺序为肾 > 肺 > 心 > 肝 > 脑; 且PEG20K化麦冬多糖在模型小鼠上的心脏分布AUC为正常小鼠的1.6倍。
现代研究发现缺血所致的心血管具有以下病理特征[9]: ① 心肌缺血时会引起脂肪酸β氧化受阻,游离脂肪酸、脂酰辅酶A及脂酰肉毒碱等迅速增加,导致血管内膜通透性异常升高; ② 缺血缺氧会导致血管内皮生长因子 (vascular endothelial growth factor,VEGF) 及其受体的表达成倍增加,使毛细血管内皮细胞膜的通透性也增加; ③ 由于缺血时内皮细胞的胞质和线粒体内均出现Ca2+ 过载,膜磷脂酶在Ca2+ 介导下被激活,引起膜磷脂被降解而导致血管内皮细胞膜功能出现紊乱; ④ 缺血区血流量较慢,使得药物在缺血区的滞留时间延长。故PEG高分子在缺血心肌部位具有较好的透过增强与滞留(enhanced permeability and retention,EPR) 效应; 而正常组织血管壁细胞排列紧密,且结构完整,PEG高分子载药系统在血液循环过程中几乎不会渗出,故PEG可以将大部分药物蓄积于梗死早期心肌细胞,实现心血管药物的被动靶向[10]。所以,PEG化葛根素在急性缺血心肌大鼠模型上能够提高药物的选择性,可有效地靶向病变部位的心肌组织,释放药 物,发挥疗效,为研制心血管药物的靶向性制剂进行了有益探索。
| [1] | Wu J, Xie JD, Fu Q. Clinical observation of puerarin injec-tion in treatment of 152 cases of coronary artery disease angina [J]. China Mod Med (中国当代医药), 2013, 20: 87-88. |
| [2] | Liu XY, Li JR, Zhang LY, et al. Optimization of synthetic process of PEGylated puerarin by orthogonal test with multi-index [J]. Chin Tradit Herb Drugs (中草药), 2011, 42: 1528-1531. |
| [3] | Liu XY, Zhi HY, Du F, et al. A HPLC-UV method for the determination of puerarin in rat plasma after intravenous administration of PEGylated puerarin conjugate [J]. J Chromatogr B, 2010, 878: 3297-3302. |
| [4] | Liao DH, Liu XY, Dai W, et al. N-trimethyl chitosan (TMC)-modified microemulsions for improved oral bioavailability of puerarin: preparation and evaluation [J]. Drug Deliv, doi: 10.3109/10717544.2013.879398. |
| [5] | Liu XY, Yu BY, Wang NJ, et al. A validated stability-indicating HPLC method for the determination of PEGylated puerarin in aqueous solutions [J]. J Chromatogr B, 2010, 878: 2061-2066. |
| [6] | Liu XY, Li JR, Wang NJ, et al. Alleviation of PEGylated puerarin on erythrocyte hemolysis induced by puerarin in glucose-6-phosphate dehydrogenase-deficient rats [J]. Chin Herb Med, 2013, 5: 47-52. |
| [7] | Sun GL, Lin X, Hong Y, et al. PEGylation for drug delivery to ischemic myocardium: pharmacokinetics and cardiac distribution of poly(ethylene glycol)s in mice with normal and ischemic myocardium [J]. Eur J Pharm Sci, 2012, 46: 545-552. |
| [8] | Lin X, Wang ZJ, Wang S, et al. Comparison of tissue distribution of a PEGylated Radix Ophiopogonis polysaccharide in mice with normal and ischemic myocardium [J]. Eur J Pharm Biopharm, 2011, 79: 621-626. |
| [9] | Sun GL, Lin X. Mechanisms and strategies for targeting drugs to myocardial ischemic regions [J]. Acta Pharm Sin (药学学报), 2010, 45: 827-832. |
| [10] | Formiga FR, Garbayo E, Díaz-Herráez P, et al. Biodegrada-tion and heart retention of polymeric microparticles in a rat model of myocardial ischemia [J]. Eur J Pharm Biopharm, 2013, 85: 665-672. |
 2014, Vol. 49
2014, Vol. 49


