2. 中国中医科学院西苑医院, 北京 100091
2. Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China
血管内皮细胞是血管壁的主要屏障,其功能失调和损伤是动脉粥样硬化 (atherosclerosis,AS) 的始动环节[1]。17β-雌二醇 (17β-estradiol,17β-E2) 作为一种激素替代疗法防治绝经后女性AS曾在国内外有一定应用,但因其不良后果如生殖系统肿瘤、静脉血栓栓塞等限制了其推广应用[2]。近年来,流行病学研究、大量人群试验与动物实验均证实,植物性雌激素具有心血管保护作用,且未出现明显的毒副作用,其对雌激素受体的选择性激活作用表现出对绝经后女性冠状动脉性心脏病患者更具心血管保护作用[3]。西洋参茎叶总皂苷 (Panax qu inquefolius Saponin of stem and leaf,PQS) 是从西洋参茎叶中提取分离的有效组分。课题组对绝经后女性冠心病患者的临床研究与对去势ApoE-/-动脉粥样硬化雌性小鼠的实验研究显示,PQS具有抗过氧化损伤、抑制炎症反应、调节血管舒缩及血脂代谢等类雌激素样血管保护作用[4]。PQS的药效物质基础研究发现,人参皂苷Rb3 (ginsenoside Rb3,GRb3) 是PQS的主要入血成分之一,进一步采用快速识别药物作用靶点的计算模拟方法,发现GRb3与雌激素受体 (estrogen receptor,ER) 强势结合,推测其可能发挥雌激素效应,为此,课题组利用转基因细胞株建立实验体系,将重组雌激素受体效应片段 (EREs) 和荧光素酶报告基因的质粒稳转进人卵巢癌细胞株(BG1),并用药物暴露细胞,通过检测荧光素酶的活性来检测药物的雌激素受体活性,结果表明,GRb3有显著的ER活性,1×10-6 mol·L-1诱导ER的活性可达到1×10-9 mol·L-1 17β-E2的100%[5]。推测GRb3为PQS发挥类雌激素样心血管保护作用的药效物质基础之一。
GRb3是否具有类雌激素样血管内皮细胞保护 效应,目前尚未见报道。本研究建立体外氧化低密度脂蛋白 (oxidized-low density lipoprotein,ox-LDL) 诱导内皮细胞损伤的AS模型,观察GRb3对内皮细胞过氧化损伤与功能障碍的影响,探索其效应机制,为PQS在防治心血管疾病方面的临床应用提供实验依据。
材料与方法 药物和试剂人参皂苷Rb3 (GRb3,纯度98%) 购自天津一方科技有限公司; 17β-雌二醇为德国Dr公司生产; ox-LDL (MDA: 47 nmol·mL-1) 由北京协生生物有限公司制备; ICI186780 (ICI) 由英国Tocris公司生产。
M199培养基 (Medium 199)、胎牛血清 (fetal bovine serum,FBS)、LSGS (low serum growth supplement) 均购自GIBCO公司; 胶原酶Ⅰ、明胶、DMSO、MTT (Sigma-Aldrich公司,美国); 0.25% 猪胰蛋白酶 (Hyclone公司); 100×青链霉素混合液 (北京索莱宝科技有限公司); PBS磷酸盐缓冲剂 (北京鼎国生物有限公司); 肝素、NaHCO3、台盼蓝等均为国产分析纯。细胞裂解液(北京普利莱基因技术有限公司); 蛋白酶抑制剂 (苯甲基磺酰氟,上海索莱宝公司)。BCA蛋白定量试剂盒 (PIERCE公司,美国); 超氧化物歧化酶 (SOD) 测定试剂盒、丙二醛 (MDA) 测定试剂盒及总一氧化氮合酶 (NOS) 测定试剂盒均为南京建成生物工程研究所产品。人一氧化氮 (NO)、人内皮素-1 (ET-1) ELISA试剂盒 (R&D公司,美国); M-MLV反转录试剂盒 (Takara公司,日本); real-time PCR扩增试剂盒 (北京中原领先科技有限公司)。Akt为兔来源的单克隆抗体,由美国CST公司生产。
实验仪器CO2培养箱 (Thermo 3111美国); DMIRB型倒置相差显微镜 (莱卡公司,德国); Milli-Q超纯水/Elix纯水系统 (MilliPORE公司,美国); 核酸紫外分光光度计 (Biophotometer,德国); MULTISKAN MK3全自动酶标仪 (Thermo,美国); Real-Time PCR仪 (ABI 7500,美国); 稳压稳流电泳仪、垂直电泳槽及半干转电转印仪 (Bio-Rad,美国); 数码凝胶成像系统 (北京宾达英创科技有限公司)。
人脐静脉内皮细胞的培养人脐静脉内皮细胞 (human umbilical vein endothelial cells,HUVECs) 的分离与培养在Jaffe法[6]的基础上进行改进。无菌条件下收集健康产妇正常分娩的新生儿脐带,0.1% 胶原酶Ⅰ消化收集细胞,5% CO2、37 ℃条件下用含8% 胎牛血清、2% LSGS并含青霉素100 u·mL-1、链霉素100 μg·mL-1的M199培养液培养 。倒置相差显微镜下观察细胞形态,采用间接免疫荧光染色方法显示细胞Ⅷ因子相关抗原表达阳性,确定所培养细胞为内皮细胞。实验用第3~4代细胞。
分组及给药方法以100 μg·mL-1 ox-LDL刺激HUVECs建立内皮细胞损伤模型,以17β-E2为阳性药物对照,GRb3取低、中、高3个剂量,并应用雌激 素受体抑制剂ICI182780。共设8个组: 正常对照组 (NOR)、模型组 (MOD)、E2组 (17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1)、E2I组 (ICI 1 μmol·L-1 + 17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1)、RL组(GRb3 1 μmol·L-1 + ox-LDL 100 μg·mL-1)、RM组(GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1)、RH组(GRb3 100 μmol·L-1 + ox-LDL 100 μg·mL-1)、RMI组(ICI 1 μmol·L-1 + GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1)。其中,ICI182780在给予17β-E2或GRb3 前加入以预处理1 h,且在17β-E2或GRb3干预后1 h再给予ox-LDL刺激,各组细胞在37 ℃、5% CO2条件下培养24 h后进行下一步检测。
细胞SOD、NOS活性与MDA含量的测定采用台盼蓝染色进行细胞计数,调整细胞数为1.5×105/mL,按2 mL/孔接种于6孔板中,取对数生长期细胞按上述方法分组。干预后,弃细胞培养上清液,PBS清洗3遍,于冰上借助含蛋白酶抑制剂的裂解液裂解细胞,采用BCA法进行细胞蛋白质定量,进一步严格按照NOS、SOD、MDA试剂盒说明书进行检测与计算,根据NOS催化L-精氨酸和分子氧反应生成NO,NO与亲核性物质生成有色化合物的原理检测NOS活性,黄嘌呤氧化酶法检测SOD活性,硫代巴比妥酸法检测MDA含量。
细胞培养上清液ET-1与NO含量的测定取各组细胞培养上清液,采用ELISA法检测NO、ET-1浓度,严格按照试剂盒说明书进行各步骤操作。设浓度值为横坐标,测得的各标准孔OD值为纵坐标,采用Curve Expert1.38软件绘制标准曲线。
Real time RT-PCR检测eNOS、iNOS转录水平干预后,弃25 cm2培养瓶中上清液,PBS清洗3遍,采用Trizol法提取培养瓶中细胞总RNA,测定总RNA浓度及纯度,RNA样品于 -80 ℃冰箱保存备 用。参照M-MLV反转录试剂盒说明书将RNA逆转录为cDNA,所得cDNA保存于 -20 ℃。以看家基因GAPDH作为内参照,eNOS、iNOS、GAPDH基因序列源自GenBank,由生工生物 (上海) 有限公司设计引物,基因引物序列: GAPDH (内参): 扩增片段长度为136 bp,上游引物5'-GGGTGTGAACCATGAGAA GT-3',下游引物5'-GACTGTGGTCATGAGTCCT-3'; eNOS: 扩增片段长度为200 bp,上游引物5'-GGAG TGGAAGTGGTTCCG-3',下游引物5'-GCCCATCCT GAGTCCTGTAT-3'; iNOS: 扩增片段长度为112 bp,上游引物5'-GCCAAGCTGAAATTGAATGA-3',下游引物5'-TCTTCGCCTCGTAAGGAAAT-3'。参照Real-time RT-PCR扩增试剂盒说明书操作,同一标 本扩增eNOS、iNOS和GAPDH,采用相同的cDNA上样量和反应参数,反应条件: 94 ℃预变性2 min,94 ℃变性15 s,60 ℃退火60 s,50个循环,72 ℃延 伸10 min。反应在荧光定量PCR仪中进行,实验结束,记录每个反应管中荧光信号到达设定阈值时所经历的Ct值。用相对定量2-ΔΔCt法分析结果,用各个样本的目的基因的Ct值减去各个样本的看家基因 (GAPDH) 的Ct值,得到ΔCt; 用ΔCt减去对照组的均值,得到ΔΔCt。用2-ΔΔCt计算各个样本目的基因的表达变化。
Western blotting检测Akt蛋白的磷酸化水平用细胞刮刀刮取各组培养瓶中细胞,4 ℃预冷的细胞裂解液裂解细胞,经BCA法测定蛋白含量后,进行聚丙烯酰胺凝胶电泳 (SDS-PAGE)。电泳后将蛋白转印至PVDF膜上,5% 脱脂奶粉封闭后,加入一抗 (Akt、p-Akt均为1∶500稀释),4 ℃孵育过夜,再加入辣根过氧化物酶标记的二抗 (Akt为1∶2 000、p-Akt为1∶1 000稀释),37 ℃振荡60 min,ECL化学发光试剂盒显色,X光片显影,用IPP (Image-Pro Plus Analysis Software) 软件对扫描的目的条带图像进行灰度分析。
统计学分析实验数据均采用SPSS 13.0软件 进行统计,以± s表示。多个样本均数的比较用ANOVA单因素方差分析,组间比较用LSD检验。
结果 1 GRb3对ox-LDL诱导HUVECs的SOD活性、MDA含量的影响与正常组相比,模型组细胞SOD活力明显降低 (P < 0.01),MDA含量明显增多 (P < 0.01); 与模型组比较,17β-E2和GRb3低、中、高剂量组细胞SOD活力明显升高 (P < 0.01或P < 0.05),MDA含量明显降低 (P < 0.01); 与17β-E2组相比,17β-E2 + ICI182780组的细胞SOD活力明显降低 (P < 0.05),MDA合成明显增多 (P < 0.01); 与GRb3中剂量组相比,GRb3中剂量+ ICI182780组的细胞 SOD活力明显降低 (P < 0.05),MDA合成明显增多 (P < 0.01)。见表 1。
|
|
Table 1 Effects of ginsenoside Rb3 (GRb3) on antioxidant ability of HUVECs induced by ox-LDL. NOR: Normal; MOD: Model; E2: 17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1; E2I: ICI 1 μmol·L-1 + 17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1; RL: GRb3 1 μmol·L-1 + ox-LDL 100 μg·mL-1; RM: GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1; RH: GRb3 100 μmol·L-1 + ox-LDL 100 μg·mL-1; RMI: ICI 1 μmol·L-1 + GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1. n = 6,± s. **P < 0.01 vs NOR group; △P < 0.05,△△P < 0.01 vs MOD group; #P < 0.05,##P < 0.01 vs E2 group; ▲P < 0.05,▲▲P < 0.01 vs RM group |
与正常组相比,模型组细胞NOS活性和细胞培养上清液NO、ET-1含量均明显增多 (P < 0.01); 与模型组比较,17β-E2和GRb3低、中、高剂量组细胞NOS活性和细胞培养上清液NO、ET-1含量均明显降低 (P < 0.01); 与17β-E2组相比,17β-E2 + ICI182780组的细胞NOS活性和细胞培养上清液NO、ET-1含量均显著增高 (P < 0.01); 与GRb3中剂量组相比,GRb3中剂量 + ICI182780组细胞NOS活性和细胞培养上 清液NO、ET-1含量均明显增高 (P < 0.01或P < 0.05)。见表 2。
|
|
Table 2 Effects of ginsenoside Rb3 (GRb3) on the activity of NOS of HUVECs and the content of NO,ET-1 of HUVEC proliferation induced by ox-LDL. NOR: Normal; MOD: Model; E2: 17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1; E2I: ICI 1 μmol·L-1 + 17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1; RL: GRb3 1 μmol·L-1 + ox-LDL 100 μg·mL-1; RM: GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1; RH: GRb3 100 μmol·L-1 + ox-LDL 100 μg·mL-1; RMI: ICI 1 μmol·L-1 + GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1. n = 6,± s. **P < 0.01 vs NOR group; △△P < 0.01 vs MOD group; ##P < 0.01 vs E2 group; ▲P < 0.05,▲▲P < 0.01 vs RM group |
与正常组相比,模型组细胞eNOS mRNA表达显著降低 (P < 0.01),iNOS mRNA表达显著升高 (P < 0.01); 与模型组比较,17β-E2和GRb3低、中、高剂量组细胞的eNOS mRNA表达显著升高 (P < 0.01),iNOS mRNA表达显著降低 (P < 0.01); 与17β-E2组 相比,17β-E2 + ICI182780组细胞的eNOS mRNA表 达显著降低 (P < 0.05),iNOS mRNA表达显著升高 (P < 0.01); 与GRb3中剂量组相比,GRb3中剂量 + ICI182780组细胞eNOS mRNA表达显著降低 (P < 0.01),iNOS mRNA表达显著升高 (P < 0.01)。见图 1。
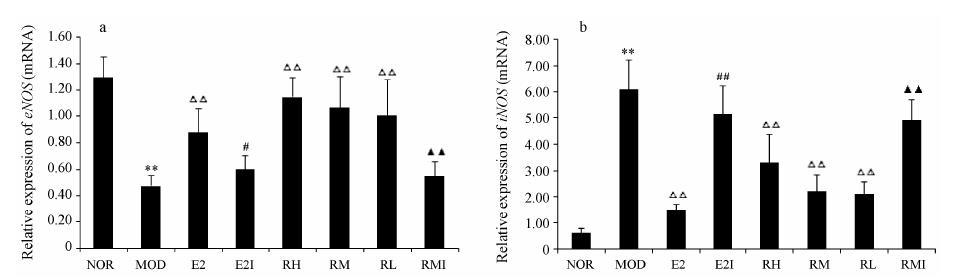 |
Figure 1 Effects of ginsenoside Rb3 (GRb3) on eNOS mRNA (a) and iNOS mRNA (b) expression induced by ox-LDL in HUVECs. NOR: Normal; MOD: Model; E2: 17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1; E2I: ICI 1 μmol·L-1 + 17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1; RL: GRb3 1 μmol·L-1 + ox-LDL 100 μg·mL-1; RM: GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1; RH: GRb3 100 μmol·L-1 + ox-LDL 100 μg·mL-1; RMI: ICI 1 μmol·L-1 + GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1. n = 4,± s. **P < 0.01 vs NOR group; △△P < 0.01 vs MOD group; #P < 0.05,##P < 0.01 vs E2 group; ▲▲P < 0.01 vs RM group |
与正常组相比,模型组细胞Akt蛋白磷酸化水平明显增高 (P < 0.01); 与模型组比较,17β-E2和GRb3中、高剂量组细胞的Akt蛋白磷酸化水平均明显降低(P < 0.05),GRb3低剂量组细胞Akt蛋白磷酸化水平 也呈降低趋势,但差异无统计学意义; 与17β-E2组相比,17β-E2 + ICI182780组细胞Akt蛋白磷酸化水平明显增高 (P < 0.01); 与GRb3中剂量组相比,GRb3中剂量 + ICI182780组细胞的Akt蛋白磷酸化水平明显增高 (P < 0.05)。见图 2。
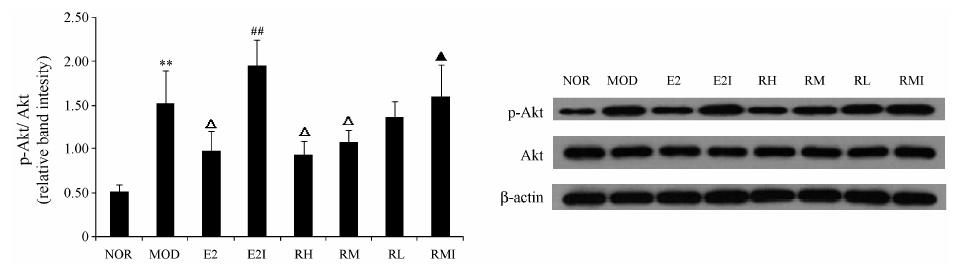 |
Figure 2 Effects of ginsenoside Rb3 (GRb3) on phosphorylation of Akt in cultured HUVECs determined by Western blotting. NOR: Normal; MOD: Model; E2: 17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1; E2I: ICI 1 μmol·L-1 + 17β-E2 0.01 μmol·L-1 + ox-LDL 100 μg·mL-1; RL: GRb3 1 μmol·L-1 + ox-LDL 100 μg·mL-1; RM: GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1; RH: GRb3 100 μmol·L-1 + ox-LDL 100 μg·mL-1; RMI: ICI 1 μmol·L-1 + GRb3 10 μmol·L-1 + ox-LDL 100 μg·mL-1. n = 4,± s. **P < 0.01 vs NOR group; △P < 0.05 vs MOD group; ##P < 0.01 vs E2 group; ▲P < 0.05 vs RM group |
ox-LDL对内皮细胞的损伤是AS发生和发展的重要因素[7]。ox-LDL可通过增高ROS含量、促进脂质过氧化反应产物MDA的产生及降低抗氧化酶SOD活性而导致血管内皮细胞氧化损伤[8,9]。雌激素可抑制ox-LDL诱导内皮细胞产生ROS,降低脂质过氧化损伤[10]。本研究检测内皮细胞MDA含量及SOD活力评价氧化应激损伤程度。实验结果显示,ox-LDL刺激24 h后细胞内 SOD活力降低,MDA含量明显增多,造成内皮细胞过氧化损伤,17β-E2可抑制此氧化损伤作用,与既往研究结果一致。GRb3低、中、高剂量组与模型组相比,细胞内SOD活力升高,MDA含量降低,表明GRb3具有抗氧化损伤作用,减少了ox-LDL对细胞的毒性,此作用与17β-E2相似。
ET-1和NO作为一对重要的内皮依赖性缩血管因子和舒血管因子,其含量的变化可间接反映血管内皮细胞功能,血管内皮释放的ET-1和NO平衡失调与AS的形成及发展密切相关。关于ox-LDL对血管内皮细胞释放ET-1的作用,结果尚不一致。Jougasaki等[11]研究显示,ox-LDL作用于体外培养的猪主动脉内皮细胞或HUVEC,可呈浓度依赖性地抑制血管内皮细胞合成ET-1,且作用与ox-LDL中的溶血卵磷脂相关。但同一时期,Boulanger等[12]发现,当ox-LDL作用于体外培养的人或猪主动脉内皮细胞和完整的猪主动脉,均可促进血管内皮细胞ET-1 mRNA的表达与ET-1的释放。进而,Horio等[13]的研究显示ox-LDL可促进体外培养的HUVECs释放ET-1,He等[14]研究发现不同氧化程度的LDL对内皮素的产生有不同的影响。Xu等[15]研究了ox-LDL促进体外培养的HUVECs释放ET-1的机制,认为与ox-LDL干预后ROS聚集进而刺激ERK信号蛋白的磷酸化相关。综合分析不同的研究结果,与ox-LDL制备时氧化程度及实验条件等有一定相关。并且,大量对病变血管的临床研究证明,内皮素是高脂血症所致血管功能紊乱的早期标志并参与AS的进程,在AS的炎症阶段及斑块形成的早期ET-1的表达增高更加明显[16,17,18]。本研究所用的MDA含量为47 nmol·mL-1 ox-LDL作用HUVECs 24 h后明显促进ET-1的释放,造成内皮细胞功能紊乱,与大多研究结果一致,与临床研究相符。血管内皮细胞分布有eNOS和iNOS,生理条件 下,eNOS产生低浓度的NO,具有多重抗AS的作用,当ox-LDL或炎症因子等刺激内皮细胞时,iNOS表达增高,产生高浓度NO,NO与超氧化物反应生成过氧亚硝基阴离子,损伤细胞。同时,过氧亚硝基阴离子可氧化NOS的辅助因子四氢生物蝶呤,使其不足而促进eNOS解偶联,解偶联的eNOS产生超氧化物 而不是NO,而存在超氧化物时,又可使NO迅速失活生成过氧亚硝基阴离子,形成恶性循环加重细胞损伤[19,20,21]。本研究结果显示,ox-LDL刺激后促使内皮细胞NO合成显著增多,细胞内总NOS活性增高,且HUVECs细胞eNOS mRNA表达显著降低,iNOS mRNA表达显著升高,NO的含量高低与iNOS mRNA的表达水平一致,提示ox-LDL诱导iNOS mRNA表达使NO的过量产生而损伤内皮细胞,与Lee等[22]研究结果一致。17β-E2预处理后, 可抑制ET-1的释放、降低iNOS mRNA表达、升高eNOS mRNA表达、降低细胞内总NOS活性和减少NO的过度产生,发挥保护血管内皮功能的作用,与既往报道一致[23,24,25]。且实验结果显示,GRb3预处理组,对上述指标的影响与17-E2相似,从而维持血管内皮释放ET-1和NO的平衡,改善血管内皮功能。
丝/苏氨酸蛋白激酶 Akt (又名蛋白激酶B) 信号通路在调节细胞的迁移和分化、糖代谢、蛋白质合成及抗凋亡作用等发挥重要作用,其磷酸化后可以活化内皮细胞eNOS活性而促进NO释放[26],且Akt及其下游分子参与雌激素的血管保护作用[27]。本研究显示,ox-LDL刺激内皮细胞24 h后能够显著增高内Akt的磷酸化水平,与Dong等[28,29]研究结果一致,但Ou等[30]用130 μg·mL-1 ox-LDL刺激人脐静脉内皮细胞 1 h后,细胞内磷酸化的Akt和eNOS蛋白表达水平均明显下降。考虑可能与不同研究中ox-LDL的作用浓度及干预时间等有关,以及ox-LDL刺激后高表达的iNOS mRNA生成大量的NO,NO与超氧化物反应生成的大量过氧亚硝基阴离子可激活AMPK,进而激活PI3K/Akt信号通路[31]相关。本研究显示GRb3高、中剂量组细胞Akt磷酸化水平均明显降 低,GRb3低剂量组呈降低趋势,差异无统计学意义。提示GRb3可通过改变Akt的磷酸化水平发挥保护 效应,但存在作用浓度偏高的问题。
雌激素抗 AS的效应主要是通过ER结合途径实现的。为了进一步明确GRb3是否通过与雌激素受体相结合而发挥与雌激素相似的保护作用,本实验应用了雌激素受体阻断剂ICI182780。结果显示,给予ICI182780预处理后,可阻断17β-E2和GRb3升高细胞SOD活力、降低MDA含量、降低ET-1的合成与释放、抑制NO的过量产生及降低Akt磷酸化水平的作用 (P < 0.05或P < 0.01),表明ER介导了GRb3血管内皮保护效应,与前期GRb3具有ER激活作用的研究结果相符。
综上所述,本研究表明,ox-LDL刺激24 h后内皮细胞 SOD活力降低,MDA含量明显增多,ET-1和NO合成均显著增多,细胞内总NOS活性增高,且HUVECs细胞eNOS mRNA表达显著降低,iNOS mRNA表达显著升高,造成了内皮细胞过氧化损伤及功能障碍。GRb3通过ER的介导发挥抗内皮细胞过氧化损伤及功能障碍的作用,为PQS的临床应用提供了一定的实验基础。但GRb3作用效应强度弱于17β-E2,其对内皮细胞ER是否直接发挥激活作用和有选择性激动效应尚不明确,需进一步研究。实验证明GRb3能调节Akt的磷酸化水平发挥保护作用,为下一步研究提供了可能的方向。
| [1] | Li DY, Chen HJ, Staples ED, et al. Oxidized low-density lipoprotein receptor LOX-1 and apoptosis in human atherosclerotic lesions [J]. J Cardiovasc Pharmacol Ther, 2002, 7: 147-153. |
| [2] | Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women's Health Initiative randomized controlled trial [J]. JAMA, 2002, 288: 321-333. |
| [3] | Cruz MN, Agewall S, Schenck-Gustafsson K, et al. Acute dilatation to phytoestrogens and estrogen receptor subtypes expression in small arteries from women with coronary heart disease [J]. Atherosclerosis, 2008, 196: 49-58. |
| [4] | Zhang Y. Vascular Protective Effects and Mechanism Research of PQS on Postmenopausal Women with Coronary Heart Disease (西洋参茎叶总皂苷对绝经后女性冠心病患者的血管保护效应及机制研究) [D]. Beijing: China Academy of Chinese Medical Sciences, 2013. |
| [5] | Hu Q, Xie QH, Yin HJ, et al. Proceeding of the 6th National Conference on Environmental Chemistry (第六届全国环境 化学学术大会论文集) [C]. Shanghai: Chinese Chemical Society and Chinese Environmental Sciences Association Press, 2011: 858. |
| [6] | Jaffe EA, Nachman RL, Becker CG, et al. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria [J]. J Clin Invest, 1973, 52: 2745-2756. |
| [7] | Shinozaki K, Kashiwagi A, Masada M, et al. Stress and vascular responses: oxidative stress and endothelial dysfunction in the insulin-resistant state [J]. J Pharmacol Sci, 2003, 91: 187-191. |
| [8] | Santanam N, Ramachandran S, Parthasarathy S. Oxygen radicals, antioxidants, and lipid peroxidation [J]. Semin Reprod Endocrinol, 1998, 16: 275-280. |
| [9] | Pan YT, Guo CY, Ma XJ, et al. The mechanisms of oxidized low density lipoprotein-induced endothelial dysfunction and the protective effects of estrogen [J]. Chin J Geriatr Cardiovasc Cerebrovasc Dis (中华老年心脑血管病志), 2014, 16: 103-106. |
| [10] | Yen CH, Hsieh CC, Chou SY, et al. 17Beta-estradiol inhibits oxidized low density lipoprotein-induced generation of reactive oxygen species in endothelial cells [J]. Life Sci, 2001, 70: 403-413. |
| [11] | Jougasaki M, Kugiyama K, Saito Y, et al. Suppression of endothelin-1 secretion by lysophosphatidylcholine in oxidized low density lipoprotein in cultured vascular endothelial cells [J]. Circ Res, 1992, 71: 614-619. |
| [12] | Boulanger CM, Tanner FC, Bea ML, et al. Oxidized low density lipoproteins induce mRNA expression and release of endothelin from human and porcine endothelium [J]. Circ Res, 1992, 70: 1191-1197. |
| [13] | Horio T, Kohno M, Yasunari K, et al. Stimulation of endothelin-1 release by low density and very low density lipoproteins in cultured human endothelial cells [J]. Atherosclerosis, 1993, 101: 185-190. |
| [14] | He Y, Kwan WC, Steinbrecher UP. Effects of oxidized low density lipoprotein on endothelin secretion by cultured endothelial cells and macrophages [J]. Atherosclerosis, 1996, 119: 107-118. |
| [15] | Xu H, Duan J, Wang W, et al. Reactive oxygen species mediate oxidized low-density lipoprotein-induced endothelin-1 gene expression via extracellular signal-regulated kinase in vascular endothelial cells [J]. J Hypertens, 2008, 26: 956-963. |
| [16] | Xu HS, Duan J, Dai S, et al. Phytoestrogen alpha-zearalanol antagonizes oxidized LDL-induced inhibition of nitric oxide production and stimulation of endothelin-1 release in human umbilical vein endothelial cells [J]. Endocrine, 2004, 25: 235-245. |
| [17] | Lerman A, Webster MW, Chesebro JH, et al. Circulating and tissue endothelin immunoreactivity in hypercholesterolemic pigs [J]. Circulation, 1993, 88: 2923-2928. |
| [18] | Ihling C, Szombathy T, Bohrmann B, et al. Coexpression of endothelin-converting enzyme-1 and endothelin-1 in different stages of human atherosclerosis [J]. Circulation, 2001, 104: 864-869. |
| [19] | Mitra S, Goyal T, Mehta JL. Oxidized LDL, LOX-1 and atherosclerosis [J]. Cardiovasc Drugs Ther, 2011, 25: 419-429. |
| [20] | Gielis JF, Lin JY, Wingler K, et al. Pathogenetic role of eNOS uncoupling in cardiopulmonary disorders [J]. Free Radic Biol Med, 2011, 50: 765-776. |
| [21] | Moncada S, Higgs EA. The discovery of nitric oxide and its role in vascular biology [J]. Br J Pharmacol, 2006, 147: S193-S201. |
| [22] | Lee WJ, Ou HC, Hsu WC, et al. Ellagic acid inhibits oxidized LDL-mediated LOX-1 expression, ROS generation, and inflammation in human endothelial cells [J]. J Vasc Surg, 2010, 52: 1290-1300. |
| [23] | Tostes RC, Nigro D, Fortes ZB, et al. Effects of estrogen on the vascular system [J]. Braz J Med Biol Res, 2003, 36: 1143-1158. |
| [24] | Kauser K, Sonnenberg D, Diel P, et al. Effect of 17beta-oestradiol on cytokine-induced nitric oxide production in rat isolated aorta [J]. Br J Pharmacol, 1998, 123: 1089-1096. |
| [25] | Duan J, Dai S, Fang CX, et al. Phytoestrogen alpha-zearalanol antagonizes homocysteine-induced imbalance of nitric oxide/ endothelin-1 and apoptosis in human umbilical vein endothelial cells [J]. Cell Biochem Biophys, 2006, 45: 137-145. |
| [26] | Shiojima I. Role of Akt signaling in vascular homeostasis and angiogenesis [J]. Circ Res, 2002, 90: 1243-1250. |
| [27] | Bernelot Moens SJ, Schnitzler GR, Nickerson M, et al. Rapid estrogen receptor signaling is essential for the protective effects of estrogen against vascular injury [J]. Circulation, 2012, 126: 1993-2004. |
| [28] | Dong S, Furutani Y, Suto Y, et al. Estrogen-like activity and dual roles in cell signaling of an Agaricus blazei Murrill mycelia-dikaryon extract [J]. Microbiol Res, 2012, 167: 231-237. |
| [29] | Lin ZW. Mechanism of Oxidized Low-Density Lipoprotein Activating ERK and PI3K/AKT Signal Pathway (氧化低密度脂蛋白影响细胞信号通路ERK和PI3K/Akt的研究) [D]. Dalian: Dalian Medical University, 2011. |
| [30] | Ou HC, Hsieh YL, Yang NC, et al. Ginkgo biloba extract attenuates oxLDL-induced endothelial dysfunction via an AMPK-dependent mechanism [J]. J Appl Physiol (1985), 2013, 114: 274-285. |
| [31] | Hardie DG, Scott JW, Pan DA, et al. Management of cellular energy by the AMP-activated protein kinase system [J]. FEBS Lett, 2003, 546: 113-120. |
 2014, Vol. 49
2014, Vol. 49


