2. 宁波大学应用海洋生物技术教育部重点实验室, 浙江 宁波 315211
2. Key Laboratory of Applied Marine Biotechnology, Ministry of Education, Ningbo University, Ningbo 315211, China
子痫前期 (preeclampsia,PE) 是一种常见的妊娠并发症,是目前导致孕产妇及围产儿死亡的主要病因,其临床表现为高血压、高尿蛋白及其他多系统异常[1]。近年来的研究显示,子痫前期发病的中心环节为广泛的血管内皮损伤造成的胎盘灌注减少,而造成损伤的首要因素是氧化应激和炎症反应[2,3]。目前,子痫前期尚不能预防,临床治疗长期以“对症治疗结合终止妊娠”为主,如控制血压、解痉和补充白蛋白,这些手段对症不对本,治疗效果差。因此,从病因的角度考虑如何预防发病对于子痫前期的临床治疗有重大意义。
鉴于子痫前期氧化应激作用的增强,Harma等[4]研究显示补充抗氧化剂可以使高危孕妇的子痫前期发病率降低2/3,说明了抗氧化剂作为子痫前期预防药物的可行性。虾青素 (astaxanthin) 为3,3'-二羟基- 4,4'-二酮基-β,β'-胡萝卜素,广泛存在于水生生物界,其最典型的特征是极强的抗氧化活性,它的活性超过维生素E 100~550倍,因此被誉为“超级抗氧化剂”[5]。目前已报道的虾青素的生物活性涉及清除细胞内的ROS、缓解氧化应激、抗炎作用、降低高血压小鼠的血压及提高NO的生物利用度等[6]。因此,虾青素的抗氧化、降血压以及抗炎的功效能针对子痫前期的病因,它的应用将为子痫前期的预防和治疗提供新的选择。本研究通过建立L-亚硝酸左旋精氨酸甲酯 (L-NAME) 诱导的子痫前期模型,考察虾青素对子痫前期疾病的作用。
材料与方法实验材料 丙二醛 (MDA)、超氧化物歧化酶 (SOD)、一氧化氮 (NO) 和一氧化氮合酶 (NOS) 试剂盒 (南京建成生物工程研究所); 大鼠内皮素ELISA试剂盒 (Life Science Inc.); HO-1一抗 (Bioss 公司); ROCK II和Caspase3一抗(博士德生物公司); NF-κB一抗 (Santa Cruz公司); 虾青素、L-NAME (Sigma公司)。
实验动物 以性成熟的SD (Spraque-Dawley) 大鼠为实验动物,雌性体重250~260 g,雄性体重 (300 ± 25) g,购自浙江省实验动物中心,许可证编号为SCXK (浙) 2008-0033。动物饲养于温湿度相对恒定 (温度: 20~25 ℃,相对湿度: 60%~70% ) 且通风良好的清洁级动物房,自由饮水和进食、每日12 h光照。
子痫前期大鼠模型 选择处于动情周期的大鼠,于晚上18∶00按雄雌1∶3合笼交配,阴道栓脱落日定为妊娠第1天。孕鼠随机分为3组: 空白组、建模组和虾青素组,每组10只。自第5天起,虾青素组灌胃给予虾青素 (25 mg·kg-1·d-1·bw-1),直至结束; 自第10天,建模组和虾青素组每天皮下注射L-NAME 125 mg·kg-1·d-1·bw-1; 空白组注射等量的生理盐水,应用大鼠血压测量仪测量第18天大鼠尾动脉收缩压,并用标准代谢笼收集孕鼠尿液,测尿蛋白变化,若建模组和虾青素组的血压和尿蛋白增加,表明建模成功[7]。在第21天时,股动脉放血处死,收集各组大鼠腹主动脉血液,同时取胎盘组织。
血液中氧化指标的变化 离心分离血清,血清中的脂质过氧化物 (MDA) 的含量,超氧化物歧化酶 (SOD)、一氧化氮 (NO)、一氧化氮合酶 (NOS) 的活性和内皮素含量测定按照试剂盒说明书进行。
虾青素对子痫前期大鼠的各病理指标的影响 剖宫取胎盘组织,于无菌纱布上尽量吸干血迹,置于4% 多聚甲醛中固定24 h,石蜡包埋,切片(4 μm),通过HE染色对胎盘组织进行组织病理学检查。
虾青素对子痫前期大鼠胎盘组织中相关蛋白的表达影响 将胎盘组织置于4% 多聚甲醛中固定,石蜡包埋、切片 (4 μm)。采用免疫组化ABC法测定胎盘组织中NF-κB、HO-1、ROCK II和Caspase3蛋白表达。一抗NF-κB (1∶100)、HO-1 (1∶200)、ROCK II (1∶200)、Caspase 3 (1∶100) 4 ℃过夜,操作步骤参照免疫组化试剂盒说明书。以PBS代替一抗作阴性对照。DAB染色,苏木精复染,水溶性树胶封片 镜检,呈棕黄色颗粒为阳性,采用Image Pro Plus6.0图像分析系统软件分析图像中的阳性区域面积比以及光密度值 (optical density,OD)。免疫组化阳性指 数 = (阳性面积/总面积) × OD
数据处理 数据以± s表示,应用SPSS 13.0统计软件进行多标本间均数比较。各组的数据间差异性分析采用one-way ANOVA方法。
结果 1 虾青素对孕鼠血压和尿蛋白的影响L-NAME是常用的建立高血压模型的药物。孕 鼠经灌喂L-NAME后,第18天,其收缩压和舒张压都升高,其中收缩压增高25.75% (P < 0.05),舒张压增加23.00%。同时尿蛋白随血压的上升也出现增高。而灌喂虾青素后,尿蛋白和血压都下降,其中血压显著下降,收缩压比L-NAME建模组下降38.09%,舒张压下降57.80%,两者甚至显著低于空白组的数值 (表 1)。说明虾青素能改善子痫前期孕鼠的高血压和高蛋白尿两个典型特征。
|
|
Table 1 Effect of astaxanthin on blood pressure and proteinuria of rats. n = 10,± s. **P < 0.01 vs L-NAME group; #P < 0.05,##P < 0.01 vs blank group |
L-NAME处理过的建模组大鼠血清中的各指标都出现了相应的变化 (表 2),其中NO和NOS出现下降,NO下降24.40% (P < 0.05)。氧化指标中,MDA出现上升,但差异无统计学意义,而SOD出现显著下降,降至 (16.52 ± 2.77) U·mL-1 (P < 0.01)。而妊娠第5天开始灌胃虾青素,15天后各项指标都得到改 善,特别是两个氧化相关指标出现显著变化,MDA较L-NAME处理的建模组降低 (P < 0.05),甚至显著低于正常妊娠组,而SOD活性较建模组显著增高 (P < 0.05),同样显著高于正常妊娠组 (P < 0.05)。NO和NOS也相应升高,但差异无统计学意义 (P > 0.05)。
|
|
Table 2 Effect of astaxanthin on NO,MDA contents and NOS,SOD activity in rat serum. n = 10,± s. P < 0.05 vs L-NAME group; #P < 0.05 vs blank group |
在经L-NAME处理的建模组大鼠胎盘组织中可见数个螺旋动脉 (图 1B2),且螺旋动脉管腔增大,管壁变薄; 此外,胎盘组织基膜不规则增厚,细胞结节增多 (图 1B1)。而虾青素组 (图 1C2) 中偶见少量螺旋动脉,螺旋动脉周围呈少量的滋养细胞。与建模组比较螺旋动脉明显减少,可见服用虾青素后病理改变出现明显改善。
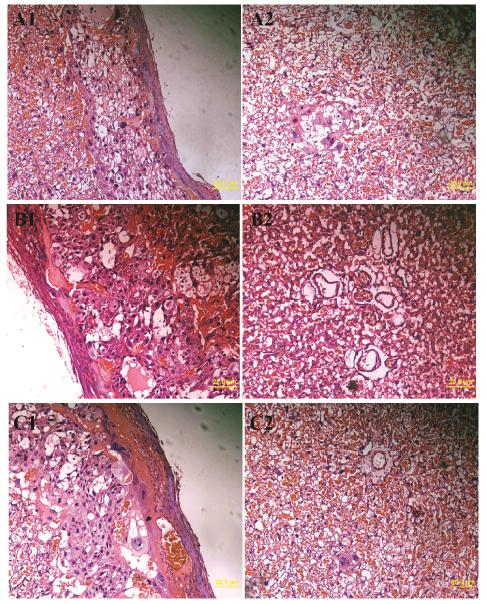 |
Figure 1 Effect of astaxanthin on the pathological changes in placenta of the preeclampsia rats detected with HE stain. A: Blank group; B: L-NAME (125 mg·kg-1·d-1·bw-1) group; C: Astaxanthin (25 mg·kg-1·d-1·bw-1) group |
利用免疫组化方法分析大鼠中与子痫前期发病密切相关的几种蛋白的表达 (图 2,表 3)。其中,ROCK II蛋白在建模组和虾青素组胎盘的细胞滋养细胞、合体滋养层细胞、内皮细胞和一些基质细胞的胞质中均有表达,但主要表达在滋养细胞的胞浆中 (图 2A)。建模组和虾青素组ROCK II蛋白表达均显著高于空白组 (P < 0.01),但光密度分析显示虾青素组表达明显低于建模组 (P < 0.05)。
 |
Figure 2 Effect of astaxanthin on the protein expression in the placenta of the rats. A: ROCK II protein; B: HO-1 protein; C: Caspase 3 protein; D: NF-κB protein. 1: Blank group; 2: L-NAME (125 mg·kg-1·d-1·bw-1) group; 3: Astaxanthin (25 mg·kg-1·d-1·bw-1) group |
|
|
Table 3 Effect of astaxanthin on the related-protein contents in the placenta of the rats. n = 10,± s. P < 0.05,**P < 0.01 vs L-NAME group; #P < 0.05,##P < 0.01 vs blank group |
HO-1 (血红素氧和酶) 在胎盘组织中均为胞浆表达,主要表达于绒毛合体滋养细胞及血管内皮细胞,间质有少量表达 (图 2B)。HO-1蛋白在3组中均有表达,其中空白组表达明显,而建模组胎盘组织中的阳性细胞率显著低于空白组 (P < 0.01),经虾青素预灌胃后的孕鼠胎盘组织中的HO-1表达量低于空白组,但高于建模组,两者存在显著性差异 ( P < 0.01)。
Caspase 3在胎盘滋养层细胞的细胞膜、细胞浆中表达见图 2C。在3个组中,建模组胎盘组织中的Caspase 3蛋白表达最高 (P < 0.01)。虾青素组尽管高于空白组 (P < 0.05),但与建模组相比有所减少,差异没有统计学意义。
NF-κB主要存在于胎盘组织的细胞滋养细胞,绒毛间质细胞也可见少量表达。免疫组化显示,NF-κB在建模组滋养细胞中可见大量棕黄色颗粒的阳性表达,并部分出现核染色现象 (P < 0.01),空白组内仅可见少量阳性表达 (图 2D),而虾青素组的阳性率高于空白组,但明显低于建模组 (P < 0.05)。
讨论子痫前期是妊娠期特发性高血压疾病,其发病机制复杂。近年来研究提出妊娠期孕妇体内异常的氧化应激是诱发子痫前期的重要因素[8],鉴于此,国内外学者提出了抗氧化应激的治疗方案。Serdar等[9]研究发现重度子痫前期妇女中维生素E和胡萝卜素明显比正常妊娠妇女低,由此提出早期补充抗氧化剂对于预防子痫前期的发生有益。Rumbold等[10]采用 双盲法进行大样本研究发现,补充抗氧化剂如维生素E和C的妊娠妇女发生子痫前期的危险度明显比对照组和安慰剂组低。因此抗氧化剂治疗将为子痫 前期提供有效而安全的预防方案[11]。虾青素是一种 超级抗氧化剂,它用于子痫前期的预防还未见报道,但从目前的报道来看,虾青素的作用恰好能应对子痫前期的病因。首先,虾青素对细胞的抗氧化作用已得到共识; 其次,虾青素有明显的抗炎作用[12]; 此外,Monroy-Ruiz等[6]报道,虾青素能够降低高血压小鼠的血压。因此,从抗炎、抗氧化和降血压三方面来看,虾青素都能很好的针对子痫前期的病因。
在本研究中,首先从对血压和尿蛋白的调节效果来看,虾青素在灌胃18~21天都能够高效地降血压和尿蛋白,并且第18天的降血压效果非常显著 (P < 0.01),甚至低于正常妊娠大鼠的血压值,这与Monroy-Ruiz等[6]报道是一致的。当然,虾青素是否会造成低血压还需要进一步评价。从大鼠血清的几个指标来看,出现最显著变化的是对氧化指标的影响,脂质过氧化物产物 (MDA) 的含量被显著降低 (P < 0.05),并且远低于正常妊娠大鼠的值,而抗氧化酶SOD的活性则显著提高 (P < 0.05),同样高于正常妊娠组。验证了 虾青素对子痫前期疾病的主要功能体现在抗氧化方面。另外,从降血压的机制来看,由于NO是一种强烈的血管舒张因子,在调节妊娠期血管张力和维持血液动力起着重要的作用[13]。在本研究中,L-NAME建模组孕鼠的NO和NOS出现相应减少,而经虾青素处理组尽管统计学意义不明显,但是NO的含量出现了少量增高,特别是NOS酶活性的增加不仅高于L-NAME建模组,甚至高于正常妊娠大鼠的酶活性。Monroy-Ruiz等[6]也指出,虾青素能够提高NO的生物利用度,说明虾青素能够在一定程度上通过控制NO的合成,参与调节血压。
研究中采用免疫组化方法对几个与子痫前期发病密切相关的蛋白和细胞因子进行了胎盘组织中的表达分析。首先,NF-κB参与启动并调节机体免疫和炎症反应[14]。重度子痫前期患者胎盘组织中NF-κB表达增强,它的表达异常可能影响滋养细胞的浸润能力或参与内皮细胞受损,导致炎性介质的释放[15]。结果显示,经虾青素灌喂处理的大鼠胎盘组织中的NF-κB的表达明显低于建模组,说明虾青素能够通过抑制由L-NAME引起的NF-κB过度表达,控制炎性因子的释放和细胞损伤。Rho/Rock信号转导通路在调节滋养细胞增殖、凋亡及侵袭等方面发挥重要作用,其中ROCK II是目前研究最清楚的Rho蛋白下游靶效应分子。重症子痫前期患者的ROCK II的水平显著上调,可能参与其发病过程[16]。本研究中,L-NAME处理过的大鼠胎盘组织中ROCK II高表达,但是虾青素预喂食后,胎盘组织中的ROCK II的表达显著下降,说明虾青素可能通过减少ROCK II的表达来控制滋养细胞的侵袭,从而减缓子痫前期的发病。另外,HO-1作为血红素降解的起始酶和限速酶,能够通过清除血红素蛋白和产生胆红素 (一种强抗氧化剂) 保护合体滋养细胞和血管内皮免于氧化损伤,同时它还能产生具有血管舒张活性的CO[17]。妊高症患者的HO-1表达强度较正常晚孕组显著减弱,本研究中,L-NAME建模组的HO-1表达也下降,但是经虾青素处理后HO-1得到增强,可能起到降解衰老的血红蛋白、抗氧化损伤,并通过促进CO的产生,降低血压的作用。此外,氧化应激和炎症反应都会导致滋养细胞和血管内皮细胞的凋亡。本研究观察到孕鼠经灌胃L-NAME后,执行凋亡的关键酶Caspase 3的表达显著增加,而虾青素能减少其表达,说明细胞的凋亡现象得到改善。
本研究只检测了虾青素 (25 mg·d-1·kg-1·bw-1) 对子痫前期的预防效果,原因在于虾青素是一种低极性脂溶性化合物,它的抗氧化作用是通过多不饱和共轭多烯烃结构掺入到生物膜的双层结构中,以“质子泵”的形式影响线粒体内膜两侧H+ 浓度[5]。因此,虾青素的这种低极性特征使它进入细胞非常困难,有文献[18]报道,当以1 μmol·L-1浓度处理细胞48 h,仅有1/10进入到细胞内。作者也发现虾青素几乎不会进入细胞,并且不同处理批次,进入的量差异也非常大。而动物实验也有类似的问题,虾青素的吸收和进入细胞都需要脂类物质的携带。因此,即使选择多剂量,但吸收和发挥作用的量与剂量并不一定呈浓度相关性。于是很多关于虾青素的动物实验都是选择了单剂量进行研究。
综上所述,在早期应用虾青素能有效改善L-NAME所致的子痫前期孕鼠的血压、蛋白尿水平,胎盘的氧化应激状态,并减少胎盘的炎症和细胞凋亡,从而减少血管损伤,明显改善子痫前期的症状。但虾青素应用于妊娠期的安全性问题尚需进行深入研究。
| [1] | Sibai B, Dekker G, KuPerminc M. Pre-eclampsia [J]. Lancet, 2005, 365: 785-799. |
| [2] | Vanderlelie J, Gude N, Perkins AV. Antioxidant gene expression in preeclamptic placentae: a preliminary investigation [J]. Placenta, 2008, 29: 519-522. |
| [3] | Germain SJ, Sacks GP, Sooranna SR, et al. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles [J]. J Immunol, 2007, 178: 5949-5956. |
| [4] | Harma M, Erel O. Oxidative stress in women with preeclampsia [J]. Am J Obstet Gynecol, 2005, 192: 656-657. |
| [5] | Ma J, Chen HM, Yan XJ, et al. Astaxanthin inhibits sodium azide-induced cytotoxicity in hepatocyte L-02 cells probably by H+ transferring function [J]. Acta Pharm Sin (药学学报), 2011, 46: 521-526. |
| [6] | Monroy-Ruiz J, Sevilla M, Carrón R, et al. Astaxanthin-enriched-diet reduces blood pressure and improves cardiovascular parameters in spontaneously hypertensive rats [J]. Pharm Res, 2011, 63: 44-50. |
| [7] | Zhu XJ, Song JH, Zhang XG. Expression of IFN-γ induc-ible protein 10 in rats models of preeclampsia [J]. Prog Obstet Gynecol Apr (现代妇产科进展), 1997, 17: 67-70. |
| [8] | Ouyang YQ. The Study of Oxidative Stress and Inflammatory Reaction in Preeclampsia (氧化应激和炎症反应在子痫前 期中的作用及其相互关系的研究) [D]. Wuhan: Huazhong University of Science & Technology, 2007. |
| [9] | Serdar Z, Gur E, Colakoethullary M, et al. Lipid and pro-tein [10] Rumbold A, Duley L, Crowther C, et al. Antioxidants for preventing pre-eclampsia [J]. Cochrane Database Syst Rev, 2005, 19: 422-427. |
| [10] | Sibai BM. Preeclampsia: an inflammatory syndrome [J]. Am J Obstet Gynecol, 2004, 191: 1061-1062. |
| [11] | Bhuvaneswari S, Yogalakshmi B, Sreeja S, et al. Astaxan-thin reduces hepatic endoplasmic reticulum stress and nuclear factor-κB-mediated inflammation in high fructose and high fat diet-fed mice [J]. Cell Stress Chaperon, 2014, 19: 183-191. |
| [12] | Hu HM, Ma Y. Relationship between sFlt-1 mRNA expression and plasma NO level in placental tissue of patients with hypertensive disorder complicating pregnancy and the significances [J]. Matern Child Health Care China (中国妇幼保健), 2014, 29: 1414-1416. |
| [13] | Wei ZQ, Yan L, Deng JG, et al. Mangiferin protects rats against chronic bronchitis via regulating NF-κB (P65) and IκBα expression in mononuclear cells [J]. Acta Pharm Sin (药学学报), 2014, 49: 596-601. |
| [14] | Shah TJ, Walsh SW. Activation of NF-κB and expression of COX-2 in association with neutrophil infiltration in systemic vascular tissue of women with preeclampsia [J]. Am J Obstet Gynecol, 2007, 196: 48.e1-48.e8. |
| [15] | Ark M, Yilmaz N, Yazici G, et al. Rho-associated protein kinase II (rock II) expression in normal and preeclamptic human placentas [J]. Placenta, 2005, 26: 81-84. |
| [16] | Appleton SD, Lash GE, Marks GS, et al. Effect of glucose and oxygenase deprivation on heme oxygenase expression in human chorionic villi explants and immortalized trophoblast cells [J]. Am J Physiol Regul Integr Comp Physiol, 2003, 285: R1453-R1460. |
| [17] | Chew W, Mathison BD, Kimble LL, et al. Astaxanthin decreases inflammatory biomarkers associated with cardio-vascular disease in human umbilical vein endothelial cells [J]. Am J Adv Food Sci Technol, 2013, 1: 1-17. |
 2014, Vol. 49
2014, Vol. 49


