塞来昔布(celecoxib)是1,5-二芳基取代吡唑类化合物,化学名为4-[5-(4-甲基苯基)-3-(三氟甲基)-1H-吡唑-1-基]苯磺酰胺,目前市售的塞来昔布胶囊制剂是由辉瑞制药有限公司包装生产的[1]。塞来昔布是首个新一代高选择性环氧合酶-2(COX-2)抑制剂,能阻止炎性前列腺素类物质生成,达到抗炎镇痛及退热的作用[2];还能安全、有效治疗骨关节炎和类风湿性关节炎[3]。此外,国内外研究表明,塞来昔布可有效抑制消化道肿瘤细胞的增殖,诱导癌细胞凋亡[4-8]。
有关物质的考察贯穿于整个药品研究的始终。原料药中的有关物质是否能得到合理、有效的控制,直接关系到其制剂质量的可控性与安全性。根据塞来昔布的化学性质、合成路线及降解途径,并参考强制降解试验结果,确定了本品可能存在的杂质有6个,包括对甲基苯乙酮(化合物A)、4,4,4-三氟-1-(4-甲基苯基)-1,3-丁二酮(化合物B)、4-{2-[1-(对甲苯基)亚乙基]肼基}苯磺酰胺(化合物C)、4-[3-(4-甲基苯基)-5-(三氟甲基)-1H-吡唑-1-基]苯磺酰胺(化合物D)、4-[5-(3-甲基苯基)-3-(三氟甲基)-1H-吡唑-1-基]苯磺酰胺(化合物E)、4-[5-(2-甲基苯基)-3-(三氟甲基)-1H-吡唑-1-基]苯磺酰胺(化合物F)。其中,化合物D、E在美国药典(USP 40)和欧洲药典(EP 9.0)中作为已知杂质进行测定,但是未对化合物A、B、C、F进行控制。本试验则系统地考察了塞来昔布原料药中包括起始原料、合成中间体及副产物共6个可能存在的有关物质,建立了专属性强,准确度高的HPLC检查方法,可有效控制塞来昔布原料药的质量。
1 仪器与试药 1.1 仪器岛津公司LC-2010AHT高效液相色谱仪,LC solution色谱工作站;北京赛多利斯仪器有限公司BP211D型分析天平;Elma公司Elmasonic S150实验室应用型超声波清洗器。
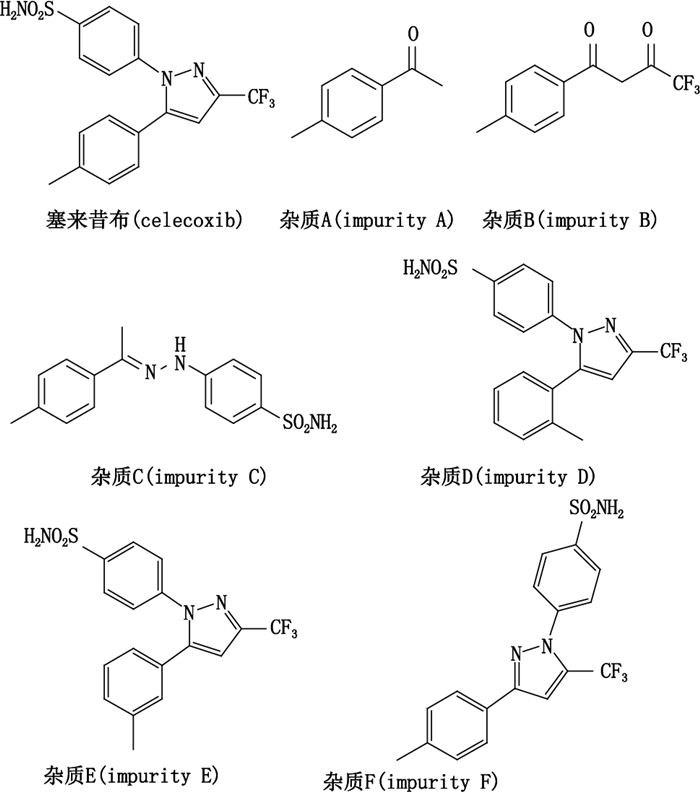
1.2 试药塞来昔布原料药(批号S1301-1、S1301-2、S1301-3)、塞来昔布对照品(批号D1301,由原料药精制而得,经紫外、红外、质谱和核磁共振分析确证,纯度为99.6%)以及杂质对照品A、B、C、D、E、F均由高瑞耀业(北京)科技有限公司提供,各杂质对照品纯度均大于99.0%,化学结构见图 1。甲醇、乙腈为色谱纯;磷酸二氢钾、磷酸为分析纯;水为自制超纯水。
|
图 1 塞来昔布及其各杂质成分的化学结构式 Figure 1 Structures of celecoxib and its impurities |
色谱柱:SUPELCOSIL LC-DP(4.6 mm×250 mm,5 μm);流动相:磷酸盐缓冲液(取磷酸二氢钾2.7 g,加水1 000 mL溶解,用磷酸调节pH至3.0)-甲醇-乙腈(60:30:10);流速:1.5 mL·min-1;检测波长:215 nm;柱温:60 ℃;进样量:20 μL。
2.2 溶液的制备稀释剂:甲醇-水(3:1)。
供试品溶液:取样品适量,精密称定,用稀释剂制成每1 mL中约含塞来昔布0.5 mg的溶液,即得。
对照品溶液:取塞来昔布对照品适量,精密称定,用稀释剂制成每1 mL中含塞来昔布1 mg的溶液,即得。
杂质储备液:分别取各杂质对照品适量,精密称定,用稀释剂分别制成每1 mL中含各杂质0.1 mg的溶液,即得。
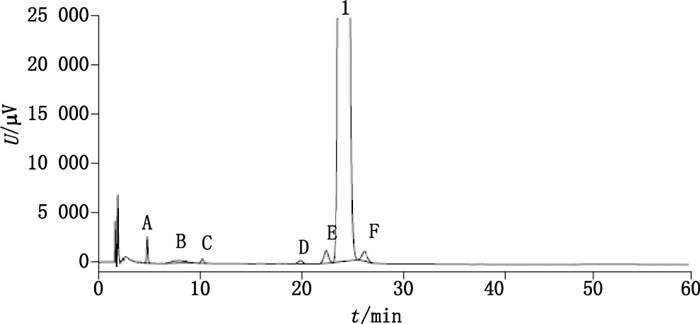
2.3 系统适用性试验取对照品溶液和杂质A~F的储备液适量,加稀释剂制成每1 mL中含塞来昔布0.5 mg及各杂质均为2.5 μg的混合溶液,取20 μL注入液相色谱仪,记录色谱图,结果见表 1及图 2。本试验实现了塞来昔布与6个杂质的基线分离。其中杂质E、F是主成分的同分异构体,为主要杂质,且分别与主峰相邻。因此,将杂质E、F与主峰的分离度作为系统适用性的考察指标(分离度大于1.5)。
|
1.塞来昔布(celecoxib)A.杂质A(impurity A)B.杂质B(impurity B)C.杂质C(impurity C)D.杂质D(impurity D)E.杂质E(impurity E)F.杂质F(impurity F) 图 2 系统适用性色谱图 Figure 2 Chromatogram of system suitability |
|
|
表 1 系统适用性试验结果 Table 1 Results of system suitability test |
取塞来昔布对照品溶液及杂质E、F储备液适量,加稀释剂制成质量浓度分别为0.1、0.2、0.5、1.0、1.5、2.0 μg·mL-1的单一成分溶液,取上述溶液各20 μL,分别注入液相色谱仪,记录色谱图,以质量浓度X(μg·mL-1)为横坐标,峰面积Y为纵坐标,绘制标准曲线,并按照斜率法计算各杂质的相对校正因子,试验数据见表 2。结果显示,塞来昔布及杂质E、F的质量浓度与峰面积呈良好的线性关系。
|
|
表 2 回归方程、线性范围及相对校正因子 Table 2 Regression equations, linear ranges, and relative correction factors |
取塞来昔布对照品溶液适量,加稀释剂制成适当浓度的溶液,取20 μL进样分析。以信噪比S/N=3为指标,重复进样6次,进样浓度为9.968 ng·mL-1,即检测下限为0.20 ng(0.002%),RSD为4.4%;以信噪比S/N=10为指标,重复进样6次,进样浓度为19.936 ng·mL-1,即定量下限为0.40 ng(0.004%),RSD为3.7%。
2.6 稳定性考察取供试品溶液,按“2.1”项下的色谱条件,分别于室温(25 ℃)下放置0、1、2、4、8、12 h,进样20 μL,杂质含量按面积归一化计算。结果见表 3,可知各已知杂质含量较少,且供试品溶液在12 h内稳定性良好。
|
|
表 3 稳定性考察结果 Table 3 Results of stability investigation |
按“2.2”项下的供试品溶液制备方法,平行制备6份供试品溶液,并按“2.1”项下的色谱条件进样分析,以峰面积计算其RSD。杂质F峰面积的RSD为4.6%,杂质A~E均未检出,最大未知杂质和总杂质峰面积的RSD分别为4.3%和3.1%,表明本方法重复性良好。
2.8 精密度试验进样精密度:取供试品溶液,按“2.1”项下的色谱条件,连续进样6次,按峰面积计算其RSD。塞来昔布与杂质F峰面积的RSD分别为0.034%和8.2%,杂质A~E均未检出,最大未知杂质和总杂质峰面积的RSD分别为4.9%和3.4%,表明本方法重现性良好。
中间精密度:分别以不同人员(3人)、不同时间(8:00、12:00、16:00,连续3 d)、不同仪器(岛津LC-2010AHT高效液相色谱仪;Waters 2695高效液相色谱仪)按重复性试验项下方法进行分析。结果显示,塞来昔布与杂质F峰面积的RSD均小于4.0%,杂质A~E均未检出,最大未知杂质和总杂质峰面积的RSD均小于5.0%。表明本方法精密度良好。
2.9 耐用性考察取供试品溶液,通过改变“2.1”项下的色谱条件,包括流速、柱温、色谱柱、检测波长和流动相配比,考察对有关物质测定结果的影响,结果见表 4。其中杂质F、最大未知杂质和总杂质含量的RSD范围分别为5.5%~15.7%、2.7%~9.9%和1.8%~13.1%;杂质A~E均未检出。试验数据表明,当某些色谱条件发生变化时(如流速,检测波长及流动相配比等),杂质F及未知杂质的测量值波动较大。原因在于,本试验旨在控制有关物质在塞来昔布原料药中的限量,而在色谱条件改变时,痕量物质的测定值波动对RSD值的影响则更为明显。因此本试验需严格控制色谱条件,才可保证方法重现性良好。
|
|
表 4 耐用性考察结果 Table 4 Results of robustness investigation |
取供试品溶液及稀释剂各20 μL,按“2.1”项下色谱条件进样分析,记录色谱图。结果显示,流动相及空白溶剂均在5.0 min前出峰,因此不影响本方法对有关物质的测定。
2.10.2 破坏性试验酸破坏试验溶液:取样品约12.5 mg,置25 mL量瓶中,加入3 mol·L-1的盐酸1 mL,于80 ℃破坏1 h后,加入3 mol·L-1的氢氧化钠溶液中和,用稀释剂定容至刻度,即得。碱破坏试验溶液:取样品约12.5 mg,置25 mL量瓶中,加入3 mol·L-1的氢氧化钠溶液1 mL,于80 ℃破坏1 h后,用3 mol·L-1的盐酸中和,用稀释剂定容至刻度,即得。氧化破坏试验溶液:取样品约12.5 mg,置25 mL量瓶中,加入30%的过氧化氢溶液1 mL,分别于80 ℃条件下放置2 h后,用稀释剂定容至刻度,即得。高温破坏试验溶液:取样品适量,分别于100 ℃放置1、2、3、4 h后,精密称定,用稀释剂溶解制成每1 mL含塞来昔布0.5 mg的溶液,即得。湿破坏试验:取相对湿度90 %条件下破坏5、10 d的样品约12.5 mg,置25 mL量瓶中,用稀释剂溶解并定容至刻度,即得。光照破坏试验溶液:取照度为4 500 lx条件下破坏5、10 d的样品约12.5 mg,置25 mL量瓶中,用稀释剂定容至刻度,即得。
精密量取上述各破坏试验溶液20 μL,分别注入液相色谱仪,记录色谱图,以面积归一化计算。结果显示,塞来昔布主峰均占99.9%以上,各杂质均未发生明显变化。即该物质耐酸碱,不易被氧化,且在高温、高湿等条件下稳定。强制破坏试验后各杂质与主成分的分离度均符合要求,表明该色谱方法专属性高。同时,对样品进行物料平衡的计算(以未经破坏样品的主峰为100%),结果表明,各破坏后样品的主峰与杂质峰面积总和,均在95%~105%范围内,物料基本守恒。试验数据见表 5。
|
|
表 5 物料守恒数据 Table 5 Mass balance data |
另外,在研究过程中,将破坏样品进行了DAD检测,对主峰的纯度进行考察。结果显示,各破坏条件下的主峰纯度及阈值均大于0.999 9。样品经破坏后,没有产生与主峰保留时间一致的杂质。
2.11 样品检测精密量取供试品溶液适量,加稀释剂制成每1 mL中约含0.5 μg的溶液,取20 μL注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%~20%。再精密量取各供试品溶液20 μL,分别注入液相色谱仪,记录色谱图。结果见表 6。在3批试制样品中,杂质F含量均小于0.01%,其他5个已知杂质均未检出,最大未知单杂均小于0.005%,总杂小于0.05%,表明本产品的杂质少,终产品质量高。
|
|
表 6 样品检验结果 Table 6 Results of sample test |
试验初期,分别采用反相C18、C8和苯基色谱柱进行分离试验,结果表明苯基色谱柱的分离效果最好,试验结果符合色谱分离的相似相溶原理。
在流动相筛选试验中,分别考察了水-甲醇、水-乙腈洗脱体系,由于6个杂质的化学性质相差较大,采用水-甲醇/乙腈的二元溶剂系统不能将主峰与杂质F峰基线分离,通过试验发现以一定比例混合甲醇和乙腈,具有较好的分离效果。通过调节有机相与水相的比例,可以改变流动相的洗脱能力,最终确定了缓冲液-甲醇-乙腈的三元溶剂系统,以等度洗脱的方式,实现了主成分与6个杂质的基线分离,避免了采用梯度洗脱方式带来的梯度峰对杂质检测的影响。此外,还考察了缓冲液对分离的影响。磷酸盐的效果优于有机酸,且离子强度越大,峰形越好。方法学验证[9-11]结果表明:本试验建立的方法分离效果好,快速准确,并具有良好的耐用性,能满足有关物质检测的各项要求。
3.2 检测波长的选择采用岛津LC-2010AHT高效液相色谱仪配置的UV-VIS检测器,测得塞来昔布与其中3个杂质在215 nm波长处有最大吸收,个别杂质在233、261 nm波长处有较强吸收,综合考虑,选用215 nm作为塞来昔布有关物质的检测波长。
3.3 色谱运行时间的确定通过实际样品的检测,发现在3倍主峰保留时间以后,没有杂质峰出现,且破坏性试验主要降解产物为杂质F(保留时间为27.059 min)。为提高试验效率,将有关物质检查的运行时间定为60 min,同时保证了测定结果的可靠性。
3.4 杂质分析及控制塞来昔布主要是以对甲基苯乙酮为起始原料,在甲醇钠的作用下与三氟乙酸乙酯进行Claisen缩合,得到中间体4,4,4-三氟-1-(4-甲基苯基)-1,3-丁二酮,再与对氨基磺酰基苯肼盐酸盐环合制得[12-13]。杂质A(对甲基苯乙酮),由样品的合成起始原料反应不完全而引入;杂质B(4,4,4-三氟-1-(4-甲基苯基)-1,3-丁二酮)为合成中间体;杂质C(4-{2-[1-(对甲苯基)亚乙基]肼基}苯磺酰胺),由杂质A与合成原料(4-肼基苯磺酰胺)反应产生;杂质D(4-[3-(4-甲基苯基)-5-(三氟甲基)-1H-吡唑-1-基]苯磺酰胺),为邻甲基苯乙酮发生环合反应生成的副产物;杂质E(4-[5-(3-甲基苯基)-3-(三氟甲基)-1H-吡唑-1-基]苯磺酰胺),为间甲基苯乙酮发生环合反应生成的副产物,是本品的主要杂质之一。通过多次HPLC检测表明,通过重结晶得到的终产品中杂质E仍然存在,因此,将其作为本品的已知杂质进行控制。杂质F(4-[5-(2-甲基苯基)-3-(三氟甲基)-1H-吡唑-1-基]苯磺酰胺),为杂质B与合成原料(4-肼基苯磺酰胺)在环合过程中产生的主成分异构体。该杂质通过重结晶可有效去除,但产生和引入仍不可避免。因此,将其作为本品的已知杂质进行研究。各杂质化学结构如图 1所示。
杂质E、F为主成分的异构体,其相对校正因子均在0.9~1.1范围内,可采用自身对照法[14]进行控制;而杂质A、B、C、D在本产品中均未检出,为方便起见,将这4个杂质作为非特异杂质,不再对其分别控制;同时也可保证杂质检测的可靠性。
4 结论本试验建立了一种有效检测塞来昔布原料药中有关物质的高效液相色谱法,并对方法的有效性和检出能力进行了评价。结果表明,该方法简便、准确,可有效分离6个杂质并应用于批量检测。为本品的质量控制奠定了基础,也为该药制剂的质量研究提供参考。
| [1] |
姚世宁, 徐畅, 张青青, 等. 塞来昔布的合成、药理作用和临床应用研究进展[J]. 中国医药指南, 2013, 11(28): 51. YAO SN, XU C, ZHANG QQ, et al. Development in the synthesis, pharmacology, clinical applications of celecoxib[J]. Guide China Med, 2013, 11(28): 51. DOI:10.3969/j.issn.1671-8194.2013.28.033 |
| [2] |
DERRY S, MOORE RA. Single dose oral celecoxib for acute postoperative pain in adults[J]. Cochrane Database Syst Rev, 2012(3): CD004233. |
| [3] |
吕双丛, 曹瑞丽. 塞来昔布治疗风湿性关节炎和骨关节炎的疗效观察[J]. 中国医院用药评价与分析, 2015, 15(10): 1296. S C, CAO RL. Efficacy observation of celecoxib in treatment of patients with rheumatoid arthritis and osteoarthritis[J]. Eval Anal Drug Use Hosp China, 2015, 15(10): 1296. |
| [4] |
赵军艳, 李轩, 谢立群, 等. 环氧合酶-2抑制剂塞来昔布诱导人肝癌细胞凋亡及其机制[J]. 中国肿瘤生物治疗杂志, 2010, 17(3): 322. ZHAO JY, LI X, XIE LQ, et al. COX-2 inhibitor celecoxib induces apoptosis of hepatoma carcinoma SMMC-7721 cell line and its mechanism[J]. Chin J Cancer Biother, 2010, 17(3): 322. DOI:10.3872/j.issn.1007-385X.2010.03.015 |
| [5] |
JENDROSSEK V. Targeting apoptosis pathways by celecoxib in cancer[J]. Cancer Lett, 2013, 332(2): 313. DOI:10.1016/j.canlet.2011.01.012 |
| [6] |
XU B, WANG Y, YANG J, et al. Celecoxib induces apoptosis but up regulates VEGF via endoplasmic reticulum stress in human colorectal cancer in vitro and in vivo[J]. Cancer Lett, 2016, 77(4): 1. |
| [7] |
VENÈ R, TOSETTI F, MINGHELLI S, et al. Celecoxib increases EGF signaling in colon tumor associated fibroblasts, modulating EGFR expression and degradation[J]. Oncotarget, 2015, 6(14): 12310. |
| [8] |
高洁, 曹光, 张晓东, 等. HPLC法测定塞来昔布胶囊中有关物质[J]. 现代药物与临床, 2013, 28(2): 182. GAO J, CAO G, ZHANG XD, et al. Determination of related substances in celecoxib capsule by HPLC[J]. Drugs Clin, 2013, 28(2): 182. |
| [9] |
中华人民共和国药典2015年版.四部[S]. 2015: 374 ChP 2015. Vol Ⅳ[S]. 2015: 374 |
| [10] |
Guidance on Validation of Analytical Procedures: Text and Methodology[EB/OL]. (2003)[2015-01-18]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002662.pdf
|
| [11] |
许明哲, 黄宝斌, 杨青云, 等. 分析方法验证、转移和确认概念解析[J]. 药物分析杂志, 2015, 35(1): 169. XU MZ, HUANG BB, YANG QY, et al. Elaboration on the concepts of analytical method validation, transfer and verification[J]. Chin J Pharm Anal, 2015, 35(1): 169. |
| [12] |
张士英, 何春桃, 吴达俊. 2型环氧酶抑制剂赛来昔布的合成[J]. 合成化学, 2002, 10(3): 260. ZHANG SY, HE CT, WU DJ. Synthesis of COX-2 inhibitor celecoxib[J]. Chin J Synth Chem, 2002, 10(3): 260. DOI:10.3969/j.issn.1005-1511.2002.03.020 |
| [13] |
黄萍, 王胜鹏, 高虎, 等. 塞来昔布有关物质的合成[J]. 中国药物化学杂志, 2012, 22(6): 503. HUANG P, WANG SP, GAO H, et al. Synthesis of the related compounds of celecoxib[J]. Chin J Med Chem, 2012, 22(6): 503. |
| [14] |
余振喜, 庾莉菊, 黄海伟, 等. 浅谈HPLC法测定有关物质时已知杂质的计算方法[J]. 中国药品标准, 2010, 11(4): 278. YU ZX, YU LJ, HUANG HW, et al. Discussion on the calculation methods of the known impurities in related substances determined by HPLC[J]. Drug Stand China, 2010, 11(4): 278. DOI:10.3969/j.issn.1009-3656.2010.04.015 |
 2019, Vol. 39
2019, Vol. 39 
