2. 复旦大学药学院药剂学教研室, 上海 201203
2. Department of Pharmaceutics, School of Pharmacy, Fudan University, Shanghai 201203, China
一枝蒿(Artemisia rupestris L.)为菊科(Compositae)蒿属(Artemisia L.)植物,是新疆地产药材,为维吾尔医常用药材,具有抗病毒,抗过敏,保肝降酶的作用,临床上常用于感冒、肝炎、扁桃体炎、咽炎、荨麻疹等疾病的治疗[1-2],是目前很具开发前景的新疆地产药材。课题组前期研究表明一枝蒿提取物中可能存在抗病毒活性强的黄酮类化学成分[3],50%乙醇洗脱物有抗HBV的作用,由此洗脱物中推测出的5种主要化合物可能在抗HBV中起到重要的作用[4]。6-去甲氧基-4′-O-甲基茵陈色原酮(DM)为本课题组前期从一枝蒿中分离出的主要黄酮类成分。
Caco-2细胞来源于人类结肠癌细胞,其结构和生理、生化作用类似人体小肠上皮细胞,具有微绒毛结构,能表达各种蛋白载体和酶,是近年来国内外广泛采用的一种研究药物小肠吸收的体外模型。具有操作相对简单及重复性较好的特点,大量应用于药物吸收评价和吸收机制的研究,已成为一种预测药物人体小肠吸收以及研究药物转运机制的标准体外筛选工具[5]。本实验采用Caco-2单层细胞研究DM的双向转运,并考察DM细胞转运的影响因素。国内外未见相关文献报道,通过本项研究,以期为一枝蒿的口服制剂研发提供一定的科学依据。
1 仪器与试药 1.1 仪器Agilent高效液相色谱系统,包括四元梯度泵、自动进样器、柱温箱和色谱分析工作站(Agilent公司);Millicell-ERS电阻仪(Millipore公司);CO2恒温培养箱(Thermo公司)。
1.2 药品与试剂DM对照品(由新疆维吾尔自治区药物研究所提供,纯度96%);DMEM培养基、胎牛血清、胰酶、非必须氨基酸、丙酮酸钠、谷氨酰胺、青-链霉素、胰蛋白酶(HyClone公司);甲醇、乙腈为色谱级(Fisher公司);冰醋酸、磷酸盐为分析级(国药试剂集团公司)。
1.3 细胞Caco-2细胞株,购自美国菌种保藏中心(American Type Culture Collection,ATCC)。
2 方法与结果 2.1 细胞转运样品中DM的HPLC分析方法建立[6-9] 2.1.1 色谱条件色谱柱:Agilent Eclipse XDB-C18柱(150 mm×4.6 mm,5 μm);流动相:乙腈-0.1%醋酸溶液(70:30);流速:1.0 mL·min-1;检测器:DAD检测器;柱温:25℃;检测波长:280 nm;进样量:20 μL。
2.1.2 对照品储备液的配制精密称取DM对照品适量,以DMSO配制成10 mg·mL-1的对照品储备液,摇匀,置于4 ℃冰箱避光保存。
2.1.3 专属性试验精密吸取对照品储备液适量,用pH 7.4空白HBSS(Hank′s Balanced Salt Solution—Hank′s平衡盐溶液)稀释成10 μg·mL-1的对照品溶液。取pH 7.4空白HBSS、DM对照品溶液,按照上述色谱条件下进样测定,结果见图 1。从图中可以看出,DM具有较好的分离度,空白介质无干扰。
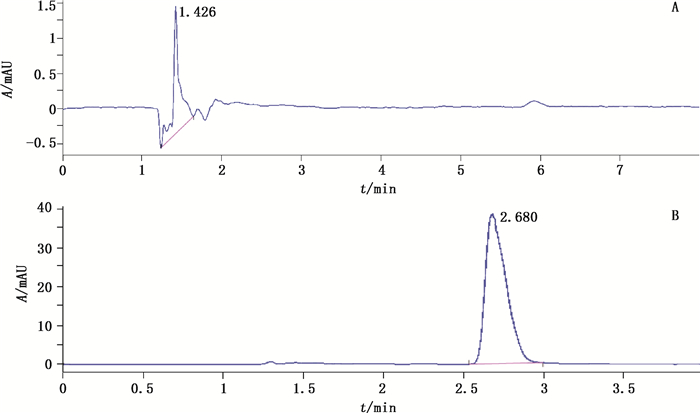
|
图 1 pH 7.4空白HBSS(A)、DM对照品(B)的HPLC图 Figure 1 HPLC chromatograms of pH 7.4 blank HBSS(A)and DM reference substance(B) |
精密量取对照品储备液适量,以pH 7.4空白HBSS配制成100 μg·mL-1的溶液,再精密吸取10、50、100、500、2 500 μL,分别置10 mL量瓶中,以pH 7.4空白HBSS配制成0.1~25 μg·mL-1的系列对照品溶液,按“2.1.1”项下条件进样测定。以峰面积为纵坐标,对照品溶液浓度为横坐标,进行线性回归,回归方程:
| $A = 139.92C - 6.862{\rm{\;\;\;\;}}\mathit{r = }{\rm{0}}{\rm{.999\;9}} $ |
结果表明,在上述色谱条件下,DM质量浓度在0.1~25 μg·mL-1范围内具有良好的线性关系。
2.1.5 精密度试验取对照品储备液适量,用pH 7.4空白HBSS配制质量浓度为0.1、5.0和25 μg·mL-1的对照品溶液各5份,按“2.1.1”项下色谱条件,于1 d内连续进样测定,根据回归方程计算DM质量浓度并算得日内RSD;每日配制高、中、低浓度的对照品溶液,连续测定3 d,测定浓度,计算日间RSD。结果表明,DM各浓度日内精密度RSD(n=5)为1.0%~3.0%,日间精密度RSD(n=5)为0.63%~3.22%,表明该方法精密度良好。
2.1.6 准确度试验取对照品储备液适量,用pH 7.4空白HBSS配制质量浓度为0.1、5.0和25 μg·mL-1的对照品溶液各5份,按“2.1.1”项色谱条件进行测定,根据回归方程计算浓度并求算得回收率。结果DM回收率为95.2%~101.0%,RSD小于6.3%,表明该测定方法准确性较好。
2.1.7 检测下限的测定取对照品溶液逐级稀释,按“2.1.1”项下色谱条件下进样测定,以3倍基线噪音计算该方法的检测下限,结果DM的检测下限为0.25 ng(S/N > 3)。
2.2 DM的细胞转运试验[10-13] 2.2.1 Caco-2细胞模型的建立与评价将Caco-2细胞按一定密度(1×106个·cm-2)接种到75 cm2卡氏培养瓶中,以高糖DMEM培养基为培养液(包括10%胎牛血清、1%非必须氨基酸、1%丙酮酸钠、1%谷氨酰胺和1%青-链霉素),置于37 ℃培养箱中,通入5%CO2(相对湿度90%),每天换液1次。当细胞汇合程度达到80%时,将细胞按50 000个·cm-2接种到MillicellTM膜顶(apical side,AP)侧,接种后每2天换液1次,1周后每日换液,培养至21 d。分别于接种的第7、14和21天测定MillicellTM膜的跨膜电阻值(TEER)。细胞培养至第21天时,TEER大于350 Ω·cm2,满足药物细胞转运实验要求。
2.2.2 浓度、方向对DM细胞转运影响取符合转运条件且细胞生长形态完好的MillicellTM膜,试验前用pH 7.4空白HBSS 37 ℃培养20 min后,以pH 7.4空白HBSS清洗3遍,洗去细胞单分子层表面的杂质。以pH 7.4空白HBSS为介质,稀释对照品储备液,将其分别配制成质量浓度为6.25~75.0 μg·mL-1的供试液,考察药物的细胞吸收和分泌。顶侧(apical side,简称AP)→底侧(basolateral side,简称BL)转运:将0.4 mL供试液加到AP作为供给液,同时BL加入0.6 mL pH 7.4空白HBSS作为接收液;BL→AP转运:将0.6 mL供试液加到BL作为供给液,0.4 mL pH 7.4空白HBSS加到AL作为接收液。将MillicellTM膜置转速为50 r·min-1的37 ℃恒温振荡摇床中,分别在30、60、90、120 min吸取0.3 mL接收液,同时补加0.3 mL 37 ℃ pH 7.4空白HBSS,每组平行3份;10 000 r·min-1离心10 min,取上清液20 μL进样(图 2),测定DM浓度。
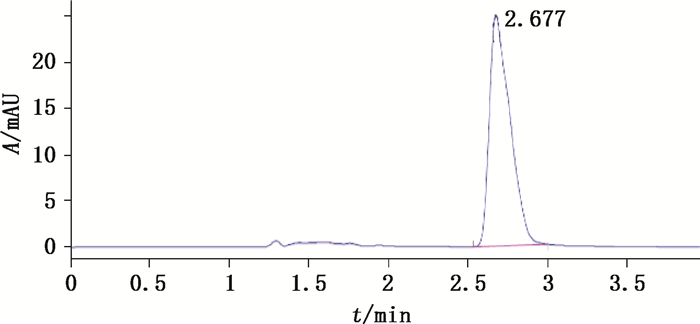
|
图 2 细胞转运样品中DM色谱图 Figure 2 Chromatograms of DM in cell transport samples |
不同浓度DM细胞转运累积吸收和分泌过程中的表观渗透系数Papp[Papp=(dQ/dt)/(A×C0),其中dQ/dt为单位时间药物转运量(μg·min-1),A为转运膜的面积(此时A为0.6 cm2),C0为药物的初始浓度(μg·mL-1)]。结果见表 1~3、图 3。
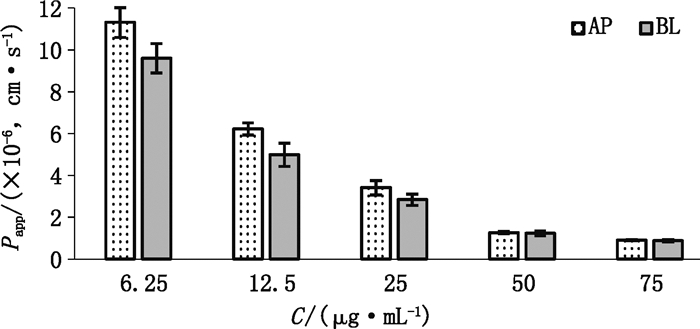
|
图 3 不同浓度DM对Papp的影响 Figure 3 Effect of different concentrations of DM on Papp |
|
|
表 1 DM在Caco-2细胞2 h时累积吸收量 Table 1 The accumulative absorption of DM in Caco-2 cells model at 2 h |
|
|
表 2 DM在Caco-2细胞2 h时累积分泌量 Table 2 The accumulative secretion of DM in Caco-2 cells model at 2 h |
|
|
表 3 不同浓度DM对Papp的影响(均值±SD,n=3) Table 3 Effect of different concentrations of DM on Papp(mean±SD, n=3) |
由表 1~3、图 2结果表明,随着其浓度的增加,AP→BL方向的细胞吸收转运量和BL→AP方向的分泌转运量无统计学意义(P > 0.05)。实验结果说明DM细胞转运方式可能是主动载体介导的转运方式;DM在吸收和分泌过程Papp均呈现浓度依赖性的特征,随着浓度的增加,Papp逐渐降低,表明药物可能主要以载体介导的主动转运方式转运。通过计算AP→BL和BL→AP的Papp的比值,表明在所考察的药物浓度范围内,DM的该比值趋向于1,推测主动转运载体可能不涉及外排蛋白载体。
2.2.3 温度对DM细胞转运的影响取符合转运条件且细胞生长形态完好的MillicellTM膜,试验前用pH 7.4空白HBSS于4 ℃培养20 min后,以pH 7.4空白HBSS清洗3遍,洗去细胞单分子层表面的杂质。将0.4 mL供试液(质量浓度为25 μg·mL-1)加到AP侧作为供给液,同时BL加入0.6 mL pH 7.4空白HBSS作为接收液;BL→AP侧转运:将0.6 mL供试液(质量浓度为25 μg·mL-1)加到BL作为供给液,0.4 mL pH 7.4空白HBSS加到AL作为接收液。将MillicellTM膜置转速为50 r·min-1的4 ℃恒温振荡摇床中,其他步骤同“2.2.2”项。结果见表 4、图 4。
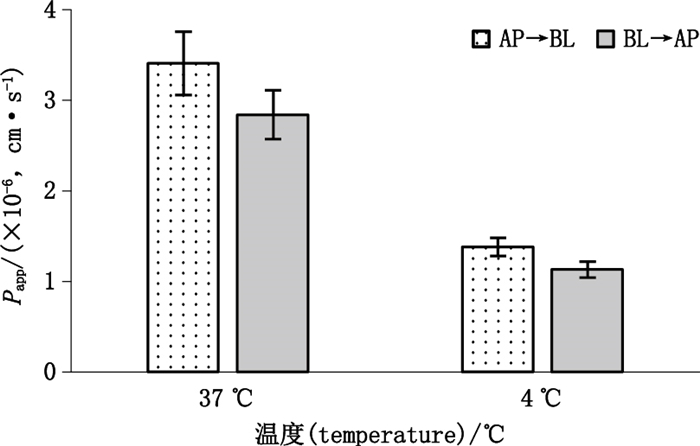
|
图 4 温度对DM的Papp的影响(n=3) Figure 4 Effect of temperature on Papp of DM |
|
|
表 4 不同温度下DM的累积吸收和分泌结果(n=3) Table 4 Accumulative absorption and secretion results of DM at different temperatures |
实验结果表明,低温条件下DM的细胞累积吸收和分泌量显著性降低(P < 0.05);药物在细胞模型2个方向转运的Papp值均显著性降低(P < 0.05),进一步证实了该药物的细胞转运过程主要以主动转运载体介导的方式,受温度影响;不同温度的Papp值无明显变化,在一定程度上反映出该药物的细胞转运过程中主动转运载体在细胞模型的浆膜侧和基膜侧均有分布,没有方向依赖性的特点和可能不涉及外排蛋白转运载体。
3 讨论 3.1 药物吸收机制模型的选择研究中药药效物质基础在消化道的生物转化及其转运吸收是评价中药药效的一个重要步骤。Caco-2细胞模型进行药物吸收机制研究是一种较好的模拟肠管真实生理环境的离体实验,作为研究药物吸收的快速筛选工具,能够在细胞水平提供关于药物分子通过小肠黏膜的吸收、代谢、转运的信息,有重现性好,易于操作,与人体不存在种属差异等优点,是国内外公认的目前研究药物肠吸收的较理想的体外模型,已被列入到CFDA颁布的仿制药一致性评价工作的评价药物渗透性的指导原则中[13]。
3.2 药物生物利用度的预测文献报道[14-15],Papp < 1.0×10-6 cm·s-1为吸收不良药物,吸收率在0~20%;1.0×10-6 cm·s-1 < Papp < 10×10-6 cm·s-1为中等吸收药物,吸收率为20%~70%;Papp > 10×10-6 cm·s-1为吸收良好药物,吸收率为70%~100%。本实验结果表明DM的细胞转运吸收和分泌的Papp平均值分别为4.63×10-6 cm·s-1和3.91×10-6 cm·s-1,表明该药物吸收不完全,预测该药物口服生物利用度不高。
3.3 小结DM的细胞累积吸收、分泌量和细胞模型2个方向转运的Papp值在低温条件下均显著性降低,证实了DM的细胞转运过程主要以主动转运载体介导的方式,且没有方向依赖性的特点和可能不涉及外排蛋白转运载体。该药物的理化性质如溶解性、脂溶性及稳定性对药物细胞模型吸收与分泌的影响应进一步开展系统化的研究。
| [1] |
吉腾飞, 杨建波, 宋卫霞, 等. 新疆一枝蒿化学成分研究Ⅱ[J]. 中国中药杂志, 2007, 32(12): 1181. JI TF, YANG JB, SONG WX, et al. Studies on chemical constituents of Artemisia rupestris(Ⅱ)[J]. China J Chin Mater Med, 2007, 32(12): 1181. |
| [2] |
肖威, 斯拉甫·艾白. 新疆一枝蒿研究进展[J]. 中国民族医药杂志, 2008, 14(7): 61. XIAO W, SILAFU·AIBAI. Research progress of Artemisia rupestris L[J]. J Med Pharm Chin Minorities, 2008, 14(7): 61. DOI:10.3969/j.issn.1006-6810.2008.07.035 |
| [3] |
秦子茹, 贺金华, 顾政一, 等. 一枝蒿不同溶剂提取物抗病毒作用的谱效关系研究[J]. 中国药房, 2015, 26(7): 889. QIN ZR, HE JH, GU ZY, et al. Study on the spectrum-effect relationship of anti-virus effect of Artemisia rupestris extracts from different solvents[J]. China Pharm, 2015, 26(7): 889. |
| [4] |
杨璐, 张素挽, 刘中奇, 等. 一枝蒿黄酮类提取物体内抗乙肝病毒活性及化学成分研究[J]. 新疆医科大学学报, 2016, 39(5): 578. YANG L, ZHANG SW, LIU ZQ, et al. Study on in vivo anti-hepatitis B virus activity and chemical constituents analysis of flavonoids from Artemisia rupestris L[J]. J Xinjiang Med Univ, 2016, 39(5): 578. DOI:10.3969/j.issn.1009-5551.2016.05.013 |
| [5] |
黄海智, 陈健乐, 程焕, 等. Caco-2细胞模型预测活性物质吸收代谢的研究进展[J]. 中国食品学报, 2015, 15(1): 164. HUANG HZ, CHEN JL, CHENG H, et al. Research progress of Caco-2 models in absorption and metabolism of active substance[J]. J Chin Inst Food Sci Technol, 2015, 15(1): 164. |
| [6] |
中华人民共和国药典2015年版.四部[S].2015: 363 ChP 2015.Vol Ⅳ[S].2015: 363 |
| [7] |
田莉, 谢莉, 张慧慧, 等. 基于Caco-2细胞单层模型研究鞣花酸的转运特性[J]. 新疆医科大学学报, 2016, 39(2): 135. TIAN L, XIE L, ZHANG HH, et al. Transport characteristics of ellagic acid across Caco-2 cell monolayer model[J]. J Xinjiang Med Univ, 2016, 39(2): 135. DOI:10.3969/j.issn.1009-5551.2016.02.002 |
| [8] |
胡杰, 侯佳, 李月婷, 等. 灯盏细辛提取物中3种活性成分在Caco-2细胞模型吸收机制的研究[J]. 中国药理学通报, 2016, 32(3): 373. HU J, HOU J, LI YT, et al. In vitro absorption mechanism of Erigeron breviscapus extract in Caco-2 cell monolayer model[J]. Chin Pharmacol Bull, 2016, 32(3): 373. DOI:10.3969/j.issn.1001-1978.2016.03.015 |
| [9] |
袁紫朔, 张婷婷, 金波, 等. 异丹叶大黄素在Caco-2细胞模型上转运机制的研究[J]. 中国中药杂志, 2017, 42(3): 587. YUAN ZS, ZHANG TT, JIN B, et al. Transport mechanism of isorhapontigenin based on human intestinal Caco-2 cells[J]. China J Chin Mater Med, 2017, 42(3): 587. |
| [10] |
王付荣, 杨秀伟. 通脉方中异黄酮类化合物在人源肠Caco-2细胞模型的吸收转运[J]. 中国中药杂志, 2017, 42(16): 3206. WANG FR, YANG XW. Absorption and transport of isoflavonoid compounds from Tongmai formula across human intestinal epithelial (Caco-2)cells in vitro[J]. China J Chin Mater Med, 2017, 42(16): 3206. |
| [11] |
兰燕宇, 刘跃, 曹旭, 等. 杜仲提取物中4种主要成分在Caco-2细胞的摄取特性研究[J]. 中国药理学通报, 2014, 30(9): 1306. LAN YY, LIU Y, CAO X, et al. Uptake of Eucommia ulmoides extract in Caco-2 cell monolayer[J]. Chin Pharmacol Bull, 2014, 30(9): 1306. DOI:10.3969/j.issn.1001-1978.2014.09.026 |
| [12] |
杨秀伟, 郭洁, 徐嵬, 等. 芍药苷类化合物在人源肠Caco-2细胞单层模型中的吸收转运研究[J]. 中草药, 2013, 44(15): 2097. YANG XW, GUO J, XU W, et al. Absorption and transport characteristic of paeoniflorin and its derivatives in model of Caco-2 cell monolayers[J]. Chin Tradit Herb Drugs, 2013, 44(15): 2097. |
| [13] |
杨秀伟, 杨晓达, 王莹, 等. 中药化学成分肠吸收研究中Caco-2细胞模型和标准操作规程的建立[J]. 中西医结合学报, 2007, 6(6): 634. YANG XW, YANG XD, WANG Y, et al. Establishment of Caco-2 cell monolayer model and standard operation procedure for assessing intestinal absorption of chemical components of traditional Chinese medicine[J]. J Chin Integr Med, 2007, 6(6): 634. |
| [14] |
张焕滨.穿心莲内酯自乳化释药系统的研制及其在Caco-2细胞模型的转运机制研究[D].广州: 广东药学院, 2015 ZHANG HB.Study on Andrographolide Self-microemulsifying Drug Delivery System and Its Absorption Mechanism in Caco-2 Cell Model[D].Guangzhou: Guangzhou Pharmaceutical University, 2015 |
| [15] |
马丽.基于脂质体超滤技术的板蓝根活性成分研究[D].贵阳: 贵阳医学院, 2015 MA L.The Active Constituents of Radix Isatidis on the Basis of Liposome Ultrafiltration[D].Guiyang: Guiyang Medical University, 2015 |
 2019, Vol. 39
2019, Vol. 39 
