2. 成都中医药大学临床医学院, 成都 610075
2. School of Clinical Medicine, Chengdu University of Traditional Chinese Medicine, Chengdu 610075, China
补肾活血方是由地黄、丹参、人参、葛根4味药材配伍而成。其化学成分复杂,水煎液主要包括环烯醚萜、丹参总酚酸、异黄酮以及人参皂苷4大类活性成分。前期临床和药理学实验均表明[1-6]补肾活血方在防治糖尿病性视网膜病变(diabetic retinopathy,DR)及视神经病变均显示良好的效果。但针对补肾活血方防治DR作用物质基础的研究还比较薄弱。为进一步探讨补肾活血方防治DR的药效物质基础,本文在前期实验基础上,采用UPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱仪联用技术,对补肾活血方化学成分进行快速识别及鉴定。
1 仪器与材料UPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱(赛默飞世尔科技公司);Ultimate 3000超高效液相色谱系统(黛安公司);ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm,沃特世科技有限公司);BS124S电子天平(赛多利斯科学仪器(北京)有限公司)。
地黄、丹参、人参、葛根购自成都市荷花池药材市场,经成都中医药大学中药资源与鉴定系裴瑾教授鉴定,分别为玄参科植物地黄Rehmannia glutinosa Libosch.的干燥块根,唇形科植物丹参Salvia miltiorrhiza Bge.的干燥根,五加科植物人参Panax ginseng C. A. Mey.的干燥细支根或须根及豆科植物野葛Pueraria lobata(Wilid.)Ohwi.的干燥根。对照品毛蕊花糖苷(MUST-14110712,含量为99.88%)、丹酚酸B(MUST-16040702,纯度为99.41%)、人参皂苷Rg1(MUST-13041301,纯度≥98.0%)、人参皂苷Rb1(MUST-12102301,纯度为98.62%)、人参皂苷Re(MUST-12041201,纯度≥98%)、葛根素(MUST-12101113,纯度为99.71%)、人参皂苷Rc(MUST-16031902,纯度为99.11%)、人参皂苷Rh1(MUST-16030717,纯度为98.49%)、人参皂苷Rf(MUST-16041002,纯度为99.62%)、人参皂苷Rd(MUST-16012503,纯度为98.55%)、人参皂苷Rb2(MUST-16032211,纯度为98.24%)、原儿茶醛(MUST-14110712,纯度为99.88%)均购自成都曼思特生物科技有限公司,大豆苷(PS0060-0010,纯度 > 98.0%)、大豆苷元(PS0278-0020,纯度 > 98.5%)、丹参素(PS121224-01,纯度为98.00%)均购于成都普思生物科技有限公司。
2 方法 2.1 溶液制备 2.1.1 供试品溶液取地黄、丹参、葛根、人参(2:2:2:1)粉末7 g,分别加8倍与6倍量的水各煎煮60 min,合并煎煮液,滤过,60 ℃减压干燥制成复方粉末。取复方粉末0.2 g,加甲醇5 mL,超声(功率500 W,频率40 kHz)10 min溶解,3 000 r·min-1离心(10 min),取上清液,过0.22 μm微孔滤膜,即得。
2.1.2 混合对照品溶液称取对照品葛根素、大豆苷元、大豆苷适量,称取对照品原儿茶醛、丹参素、迷迭香酸适量,称取对照品人参皂苷Rg1、人参皂苷Re、人参皂苷Rc、人参皂苷Rb1适量,称取对照品人参皂苷Rh1、人参皂苷Rf、人参皂苷Rd、人参皂苷Rb2适量,分别加入甲醇超声(功率500 W,频率40 kHz)10 min溶解并稀释,制得40~50μg·mL-1的4组混合溶液,过0.22 μm微孔滤膜,备用。
2.2 分析条件 2.2.1 色谱条件采用ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),以乙腈(A)-0.1%的甲酸水(B)为流动相,梯度洗脱(0~6 min,5%A→12%A;6~25 min,12%A→28%A;25~29 min,28%A→38%A;29~35 min,38%A→80%A),进样量2 μL。
2.2.2 质谱条件采用离子源为HESI源,负离子检测模式,鞘气压力206.84 kPa,辅助气体流量8 L·min-1,喷雾电压2.00 kV,离子传输管温度320 ℃,扫描模式为Full MS/dd-MS2,Full MS分辨率70 000,dd-MS2分辨率17 500,扫描范围m/z 80~1 200,MS/MS模式[8]。
2.3 数据处理使用Xcalibur 3.0软件(赛默飞科技有限公司)进行质谱数据处理。根据实验所得结果,结合中医药资料库、对照品质谱数据及相关文献报道[9-11],构建补肾活血方化学成分相关信息数据库。
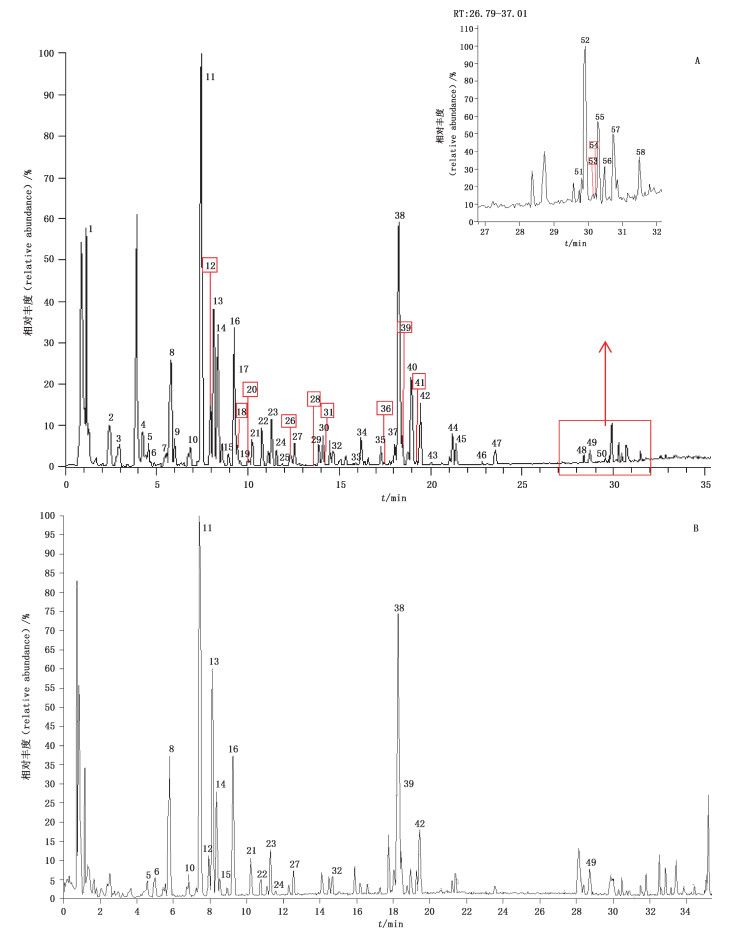
3 结果与分析取供试品溶液及混合对照品溶液,按“2.2”项分析条件进样测定;结合化合物的一级、二级质谱数据及补肾活血方中主要化学成分的裂解规律进行分析和鉴别。负离子模式下,补肾活血方的质谱图见图 1,已鉴定的各化学成分的tR、m/z等见表 1。
|
|
表 1 UPLC-Q-Exactive质谱联用对补肾活血方化学成分的鉴定分析 Table 1 Identification and analysis on chemical constituents from Bushen Huoxue prescription |
|
1~58.同表 1(same as Tab. 1) 图 1 补肾活血方负离子模式(A)和正离子模式(B)下的总离子流图 Figure 1 Total ion chromatograms in negative ion (A)and positive ion (B)mode for extract from Bushun Huoxue prescription |
补肾活血方成分复杂,主要有酚酸、异黄酮、人参皂苷及少量环烯醚萜等类成分,分析如下。
3.1 酚酸类化合物的鉴定酚酸类化学成分是丹参中一大类水溶性化合物,其主要含单聚酚酸类和多聚酚酸类。酚酸类成分在负离子模式下都能产生较高丰度的准分子离子峰[M-H]-,而在二级质谱中,由于酚酸类成分含有羟基、羧基和特征基团,因此能产生丰度较高的[M-H-H2O]–、[M-H-CO]–、[M-H-C9H10O5]–等碎片离子。咖啡酸、丹参素、原儿茶醛为单聚酚酸类化合物,准分子离子峰分别为m/z 179、197、137,在结构上均含有羧基,且都会在羧基位置发生断裂失去CO2,分别形成m/z 135、135、109的[M-H-CO2]–、[M-H-H2O-CO2]–、[M-H-CO2]–碎片离子。其中丹参素和咖啡酸在结构上只差一分子水,因此丹参素易脱去一分子水形成咖啡酸后再失去一分子CO2。在补肾活血方中,化合物2准分子离子峰[M-H]–的m/z为197.044 82,二级质谱中m/z 179.03、135.04分别为[M-H-H2O]-、[M-H-H2O-CO2]-的碎片离子,推测化合物2为丹参素。化合物4准分子离子峰[M-H]-的m/z为137.023 21,二级质谱中m/z 109.03为[M-H-H2O]-的碎片离子,推测化合物4为原儿茶醛。化合物9准分子离子峰[M-H]-的m/z为179.034 09,二级质谱中m/z 135.04为[M-H-CO2]-的碎片离子,推测化合物9为咖啡酸。
化合物18、29、33、34、35、36、40、41、43、47为多聚酚酸类成分,一级质谱中能形成较高丰度的准分子离子峰,在二级质谱图中,则易失去丹参素或(和)咖啡酸。
化合物34的tR为16.19 min,准分子离子峰[M-H]-的m/z为359.077 58,推测其元素组成为C9H10O5。进一步锁定一级质谱信息进行二级质谱扫描。在二级质谱图中,获得MS/MS碎片,其m/z分别为197.05、179.03、161.02。推测化合物34失去H+形成m/z 359.07的[M-H]-离子峰。二级质谱中[M-H]-失去一分子丹参素形成m/z 161.02的[M-H-C9H10O5]-碎片离子,[M-H]-失去一分子咖啡酸形成m/z 179.03的[M-H-C9H8O4]-碎片离子峰;通过对整个裂解过程进行分析,初步鉴定化合物34为迷迭香酸。
化合物40,推测其元素组成为C36H30O16,在二级质谱图中进行靶向筛选,获得MS/MS碎片, m/z 519.09、339.05、321.04、295.06、197.05、179.03的碎片离子分别为[M-H-C9H10O5]-、[M-H-C9H10O5-C9H8O4]-、[M-H-C9H10O5-C9H10O5]-、[M-H-C9H10O5-C9H8O4-CO2]-、[C9H10O5-H]-、[C9H8O4-H]-,其中m/z 197.05和179.03的离子为丹参素和咖啡酸失去H+形成的碎片离子。通过对整个裂解过程进行分析,初步推测化合物40为丹酚酸B。
化合物47,推测其元素组成为C26H20O10。在二级质谱图中进行靶向筛选,获得MS/MS碎片,m/z 311.06、293.05、197.05、179.03、135.04的碎片离子分别为[M-H-C9H8O4]-、[M-H-C9H10O5]-、[C9H10O5-H]-、[C9H8O4-H]-、[C9H10O5-H-CO2]-,其中m/z 197.05和179.03的碎片离子为丹参素和咖啡酸失去H+(1)形成,丹参素失去一分子羧酸或咖啡酸失去一分子CO2均可形成m/z为135.04的碎片离子。通过对整个裂解过程进行分析,初步推测化合物47为丹酚酸C。
3.2 人参皂苷类化合物的鉴定在最佳液相色谱和质谱条件下,从人参中获得了12个化学成分,依据文献报道[17-20]和对照品的准分子离子峰进行初步匹配,再依据碎片离子信息确认其成分。人参皂苷类成分相对分子质量较大(> 600),因此在质谱图中能很快地鉴别出皂苷类成分。人参皂苷根据皂苷元的结构,主要可分为3种:原人参二醇型(Ⅰ)、原人参三醇型(Ⅱ)和齐墩果酸型人参皂苷(Ⅲ)。人参二醇型是人参皂苷中包含最多的化合物如人参皂苷Ra2、Rb2、Ra1、Rc、Rd、Rb1、Rg3、Rh2,而人参皂苷Rg1、Re、Rf、Rg2、F3、Rh1为人参三醇型,人参皂苷Ro则为齐墩果酸型。根据各自的碎裂规律,三者失去所有糖基后分别生成m/z 459、475、455的特征离子。因此化合物52、53、55、57、58为人参二醇型,化合物44、45、48、50、51、54为人参三醇型,化合物56为齐墩果酸型。
3.2.1 人参二醇型化合物53的tR为30.11 min,准分子离子峰[M-H]-的m/z为1 193.599 37,推测其元素组成为C57H94O26。进一步锁定一级质谱信息进行二级质谱扫描,在二级质谱图中进行靶向筛选,获得MS/MS碎片,其m/z分别为1 107.60、945.54、783.49、621.44、459.38、323.10,推测分子离子化合物中失去H+(1)产生m/z 1 193.60[M-H]-离子峰,二级质谱中m/z 1 193.599 37的离子失去丙二酰基后形成m/z 1 107的[M-malonyl-H]-碎片离子,m/z 945.54碎片离子则是由[M-H]-脱去丙二酰基和一分子葡萄糖形成,相继脱去一分子葡萄糖基形成m/z 783.49、621.44、459.38等碎片离子,其中m/z 459.38碎片离子为人参二醇型的特征离子,通过对整个裂解过程进行分析,初步推测化合物53为丙二酰基人参皂苷Rb1。
化合物58,准分子离子峰[M-H+HCOOH]-的m/z为991.550 54,推测其元素组成为C48H82O18。在二级质谱图中进行靶向筛选,获得MS/MS碎片,m/z 945.54、783.49、621.44、459.38的碎片离子分别为[M-H]-、[M-H-Glc]-、[M-H-Glc-Glc]-、[M-H-Glc-Glc-Glc]-,其中m/z 459.38的碎片离子为人参二醇型的特征离子,通过对整个裂解过程进行分析,并与人参皂苷Rd对照品质谱比对,鉴定化合物58为人参皂苷Rd。
3.2.2 人参三醇型化合物45的tR为21.40 min,准分子离子峰[M-H+HCOOH]-的m/z为991.550 23,推测其元素组成为C48H82O18。进一步锁定一级质谱信息进行二级质谱扫描,在二级质谱图中进行靶向筛选,获得MS/MS碎片,其m/z分别为945.55、799.49、783.49、637.43、475.38,推测分子离子化合物中失去H+产生m/z 945.54[M-H]-离子峰,二级质谱中失去一分子鼠李糖基形成碎片离子m/z 799.49[M-H-Rha]-,m/z 945.54[M-H]-离子失去一分子葡萄糖基形成m/z 783.49[M-H-Glc]-碎片离子,再失去一分子鼠李糖基形成m/z 637.43[M-H-Glc-Rha]-碎片离子,又失去一分子葡萄糖基形成m/z 475.38[M-H-Glc-Rha-Glc]-碎片离子,即为人参三醇型的特征离子,通过对整个裂解过程进行分析,并与人参皂苷Re对照品质谱比对,鉴定化合物45为人参皂苷Re。
化合物51,准分子离子峰[M-H+HCOOH]-的m/z为829.497 44,推测其元素组成为C48H82O18。在二级质谱图中进行靶向筛选,获得MS/MS碎片,m/z783.49、637.43、475.38的碎片离子分别为[M-H]-、[M-H-Rha]-、[M-H-Rha-Glc]-,其中m/z 475.38为人参三醇型的特征离子,通过对整个裂解过程进行分析,初步推测化合物51为人参皂苷Rg2。
3.2.3 齐墩果酸型化合物56的tR为30.48 min,准分子离子峰[M-H]-的m/z为955.491 52,推测其元素组成为C48H76O19。进一步锁定一级质谱信息进行二级质谱扫描,在二级质谱图中进行靶向筛选,获得MS/MS碎片,分别为m/z 793.44、569.39、455.35,推测分子离子化合物中失去H+产生m/z 955.49[M-H]-离子,二级质谱中失去一分子葡萄糖基形成m/z 793.44[M-H-Glc]-碎片离子后,相继失去一分子葡萄糖基、一分子H2O和一分子CO2形成m/z 569.39[M-H-2Glc-H2O-CO2]-碎片离子,m/z 955.49[M-H]-失去所有糖基后形成m/z 455.35碎片离子,即为齐墩果酸型特征离子,通过对整个裂解过程进行分析,初步推测化合物56为人参皂苷Ro。
3.3 异黄酮类化合物的鉴定异黄酮类是葛根中最主要的化学成分,母核结构是以C6-C3-C6为骨架的2-苯基色原酮,其主要以游离黄酮苷元、与糖基结合的黄酮苷2种形式存在。根据葡萄糖基与苷元的连接方式不同,又可分为C-异黄酮葡萄糖苷(通过C原子与苷元进行连接)和O-异黄酮葡萄糖苷(通过O原子与苷元连接)。而C-C键的作用力要比C-O键的作用力大很多,因此O-异黄酮葡萄糖苷易中性丢失葡萄糖基,C-异黄酮葡萄糖苷易丢失C4H8O4。[M+H]+失去一分子CO,也是主要的裂解方式之一。
3.3.1 C-异黄酮葡萄糖苷化合物5的tR为4.44 min,负离子模式下准分子离子峰[M-H]-的m/z为577.156 80,推测其元素组成为C27H30O14。由二级质谱图可知,m/z 457.12[M-H-C4H8O4]-碎片离子由糖环的交叉环切除裂解产生,推测化合物5为葛根素-4′-O-葡萄糖苷。化合物15,推测其元素组成为C27H30O14。由二级质谱图可知,m/z 577.156 98[M-H]-离子失去一分子木糖基形成m/z 445.11的[M-H-Xyl]-碎片离子,再失去C4H8O4形成m/z 325.07的[M-H-Xyl-C4H8O4]-碎片离子,再直接失去一CH3形成m/z 310.05碎片离子或先失去一CO形成m/z 297.08后再失去一CH3形成m/z 282.05碎片离子。推测化合物15为3′-甲氧基葛根素木糖苷。
3.3.2 O-异黄酮葡萄糖苷化合物21的tR为10.10 min,负离子模式下准分子离子峰[M+CHOOH-H]-的m/z为491.120 00,推测其元素组成为C22H22O10。由二级质谱可知,分子离子化合物中失去H+产生m/z 445.12[M-H]-离子峰,再失去一分子葡萄糖基形成m/z 283.06[M-H-Glc]-碎片离子,推测化合物21为3′-甲氧基大豆苷。化合物39,负离子模式下准分子离子峰[M+CHOOH-H]-的m/z 475.124 88,推测其元素组成为C22H22O9。由二级质谱可知,[M-H]-失去一葡萄糖基形成m/z 267.07[M-H-Glc]-碎片离子,再失去一CH3形成m/z 252.04[M-H-Glc-CH3]-碎片离子,通过对整个裂解过程进行分析与文献[12]一致,推测化合物39为芒柄花苷。
4 讨论 4.1 液相色谱条件由于中药复方化学成分复杂,因此采用梯度洗脱分离被测化合物。本实验考察甲醇-水、乙腈-水,发现甲醇-水所得的色谱峰基线不平,而乙腈-水可使补肾活血方中各色谱峰得到较好的分离,并且离子响应较高。当流动相中加入甲酸后,可提高待测物质的离子化,提高信号的响应强度,改善峰形和增加检测的灵敏度;可产生[M-H+HCOOH]-,进一步确认准分子离子峰[M-H]-。此外,在此条件下乙酰基人参皂苷与丙二酰基人参皂苷不能产生[M-H+HCOOH]-,因此可以区分人参皂苷与酰基取代的人参皂苷。
4.2 Q-Exactive质谱联用技术近年来,中药化学成分分析使用了多种高分辨液质联用技术,如UPLC-TOF-MS、UPLC-Q-TOF-MS及UPLC-Q-Exactive-MS等[21-22],其中UPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱联用因其具有更高灵敏度、高质量精度、高分辨率等特点,已逐渐成为中药化学成分研究重要的检测方法之一[23-24]。与传统的三重四极杆质谱相比,Q-Exactive质谱仪具有高分辨扫描功能,能进行大规模的目标物或非目标物的筛查、识别和鉴定[25]。Q-Exactive质谱仪采用正负离子切换模式和全扫描进行测定,通过正负离子模式下精确质量数进行定性研究,再根据二级质谱数据提高准确性。与正离子模式相比,在负离子模式下,补肾活血方可以获得较高的灵敏度和准确率,从而更容易检测低丰度的化合物,并鉴别出更多的分子离子峰,因此本实验选取负离子模式进行监测。
补肾活血方防治DR疗效显著,课题组对其防治DR作用机制已进行了较为深入的研究,取得多项研究成果[26-30]。对补肾活血方各单味药(丹参、人参、葛根等)防治DR药效物质基础已进行了初步研究,通过研究人参及丹参提取物HPLC指纹图谱与调节糖基化终末产物干预下视网膜Müller细胞低氧诱导因子-1α活性表达之间的关系,筛选出人参及丹参防治DR的多个潜在活性成分[31-32]。通过对复方制剂给药血浆的研究,发现了4个来自于葛根的移行成分[33]。在此基础上,本实验采用HPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱联用技术对补肾活血方的化学成分进行分析,表征了总离子流图中的大部分色谱峰。基于化合物相关数据库、参考文献和精确相对分子质量,鉴别出58个化合物,其中鉴别出地黄中化学成分5个,丹参中化学成分13个,人参中化学成分12个,葛根中化学成分28个。本实验在构建补肾活血方化学成分组分库的同时,为进一步研究补肾活血方入血移行成分及确定其防治DR药效成分提供了依据。
| [1] |
LI X, GUO HJ, WEN XX, et al. Influence of Bushenhuoxue on primary visual cortex's Nissl bodies damage in rat model of chronic elevated intraocular pressure[J]. Int J Ophthalmol, 2012, 12(12): 2256. |
| [2] |
秦伟, 谢学军, 何宇, 等. 补肾活血中药复方对实验性糖尿病大鼠视路神经元病理损害的影响及机理探讨[J]. 辽宁中医杂志, 2012, 39(8): 1614. QIN W, XIE XJ, HE Y, et al. Research on the impact of Chinese medicine for Bushenhuoxue on the pathologic damages of visual pathway in experimental diabetid rats its mechanism[J]. Liaoning J Tradit Chin Med, 2012, 39(8): 1614. |
| [3] |
谢学军, 李翔, 肖丹, 等. 补肾活血中药对糖尿病大鼠视网膜神经节细胞的影响[J]. 中国中医眼科杂志, 2000, 10(4): 195. XIE XJ, LI X, XIAO D, et al. An observation of influence of tradition Chinese medicine for Bushenhuoxue therapy on retinal ganglion cells in experimental diabetic rats[J]. J Tradit Chin Ophthalmol, 2000, 10(4): 195. DOI:10.3969/j.issn.1002-4379.2000.04.003 |
| [4] |
谢学军, 宋明霞, 张梅, 等. 补肾活血中药复方对高糖及糖基化终末产物条件下视网膜Müller细胞的影响[J]. 中国中西医结合杂志, 2015, 35(6): 735. XIE XJ, SONG MX, ZHANG M, et al. Effect of Bushenhuoxue compound on retinal Müller cells in high glucose or AGEs conditions[J]. Chin J Integr Tradit West Med, 2015, 35(6): 735. |
| [5] |
秦伟, 谢学军, 何宇, 等. 补肾活血中药对糖尿病大鼠视路Nissl小体和Bcl-2的影响[J]. 江西中医学院学报, 2011, 23(6): 65. QIN W, XIE XJ, HE Y, et al. The effect of Chinese medicine of Bushenhuoxue therapy on Nissl bodies and B cell lymphoma/leukemia-2 in the visual pathway of experimental diabetic rats[J]. J Jiangxi Univ TCM, 2011, 23(6): 65. DOI:10.3969/j.issn.1005-9431.2011.06.024 |
| [6] |
马荣, 谢学军, 万李, 等. 补肾活血中药血清对高糖条件下纯化培养的视网膜神经节细胞Glu释放量的影响[J]. 中国中西医结合杂志, 2010, 30(8): 875. MA R, XIE XJ, WAN L, et al. Effect of drug-serum with Chinese drugs for nourishing Shen and activating blood on glutamate release in purified retinal ganglion cells cultured in high-glucose conditions[J]. Chin J Integr Tradit West Med, 2010, 30(8): 875. |
| [7] |
谢学军, 张梅, 王明芳.一种中药组合物及其制备方法: 中国, CN200910308470.3[P].2010-03-03 XIE XJ, ZHANG M, WANG MF.A Kind of Traditional Chinese Medicine Combination and Its Preparation Method: China, 200910308470.3[P].2010-03-03 |
| [8] |
董红娇, 陈晓虎, 曾锐. UPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱联用快速分析民族药小大黄的化学成分[J]. 中草药, 2016, 47(14): 2428. DONG HJ, CHEN XH, ZENG R. Rapid analysis on chemical constituents in roots of Rheum punilum by UPLC coupled with hybrid quadrupole-orbit trap MS[J]. Chin Tradit Herb Drugs, 2016, 47(14): 2428. DOI:10.7501/j.issn.0253-2670.2016.14.006 |
| [9] |
LIU AH, LIN YH, YANG M, et al. Development of the fingerprints for the quality of the roots of Salvia miltiorrhiza and its related preparations by HPLC-DAD and LC-MSn[J]. J Chromatogr B, 2007, 846(1-2): 32. DOI:10.1016/j.jchromb.2006.08.002 |
| [10] |
LIU M, LI YG, ZHANG F, et al. Chromatographic fingerprinting analysis of Danshen root(Salviae Miltiorrhizae Radix et Rhizoma)and its preparations using high performance liquid chromatography with diode array detection and electrospray mass spectrometry(HPLC-DAD-ESI/MS)[J]. J Sep Sci, 2007, 30(14): 2256. DOI:10.1002/(ISSN)1615-9314 |
| [11] |
赵新峰, 李平, 孙毓庆. 熟地黄的高效液相色谱/电喷雾电离-质谱分析[J]. 药物分析杂志, 2007, 27(6): 874. ZHAO XF, LI P, SUN YQ. HPLC/ESI-MS analysis of the Radix Rehmanniae Praeprata[J]. Chin J Pharm Anal, 2007, 27(6): 874. |
| [12] |
陈慧贞, 李云飞, 钟敬华, 等. 脑得生片物质基础的HPLC-DAD-MSn分析[J]. 浙江大学学报(医学版), 2012, 41(1): 32. CHEN HZ, LI YF, ZHONG JH, et al. Identification of major component of traditional Chinese medicine Naodesheng tablets by HPLC-DAD-MSn[J]. J Zhejiang Univ(Med Sci), 2012, 41(1): 32. DOI:10.3785/j.issn.1008-9292.2012.01.006 |
| [13] |
孙冬梅, 董玉娟, 胥爱丽, 等. 葛根枳椇软胶囊中黄酮类化合物UPLC/Q-TOF-MS快速分析[J]. 中草药, 2015, 46(7): 970. SUN DM, DONG YJ, XU AL, et al. Rapid analysis on flavonoids in Gegen Zhiju soft capsules by UPLC/Q-TOF-MS[J]. Chin Tradit Herb Drugs, 2015, 46(7): 970. |
| [14] |
容悦莹, 冯素香, 刘冬云, 等. HPLC-MS/MS法鉴定脑脉通中的化学成分[J]. 中成药, 2016, 38(7): 1544. RONG YY, FENG SX, LIU DY, et al. Identification of chemical constituents in Naomaitong decoction by HPLC-MS/MS[J]. Chin Tradit Pat Med, 2016, 38(7): 1544. |
| [15] |
张波泳, 江振作, 王跃飞, 等. UPLC/ESI-Q-TOF MS法分析鲜地黄、生地黄、熟地黄的化学成分[J]. 中成药, 2016, 38(5): 1104. ZHANG BY, JIANG ZZ, WANG YF, et al. Analysis of chemical constituents in fresh, dried and prepared Rehmanniae Radix by UPLC/ESI-Q-TOF MS[J]. Chin Tradit Pat Med, 2016, 38(5): 1104. |
| [16] |
陈瑞雪, 焦玉娇, 朱彦, 等. 基于UPLC-DAD/EsI-Q-TOF MS技术的丹红注射液指纹图谱的构建[J]. 药物分析杂志, 2016, 36(3): 457. CHEN RX, JIAO YJ, ZHU Y, et al. Establishment of chromatographic fingerprint of Danhong injection by UPLC-DAD/ESI-Q-TOF MS[J]. Chin J Pharm Anal, 2016, 36(3): 457. |
| [17] |
TAWAB MA, BAHR U, KARAS M, et al. Degradation of ginsenosides in humans after oral administration[J]. Drug Metab Dispos, 2003, 31(8): 1065. DOI:10.1124/dmd.31.8.1065 |
| [18] |
TANSAKUL P, SHIBUYA M, KUSHIRO T, et al. Dammarenediol-Ⅱ synthase, the first dedicated enzyme for ginsenoside biosynthesis, in Panax ginseng[J]. FEBS Lett, 2006, 580(22): 5143. DOI:10.1016/j.febslet.2006.08.044 |
| [19] |
SUN BS, XU MY, LI Z, et al. UPLC-Q-TOF-MS/MS analysis for steaming times-dependent profiling of steamed Panax quinquefolius and its ginsenosides transformations induced by repetitious steaming[J]. J Ginseng Res, 2012, 36(3): 277. DOI:10.5142/jgr.2012.36.3.277 |
| [20] |
周思思, 马增春, 梁乾德, 等. 基于UPLC-TOF-MS分析人参麦冬配伍后人参皂苷类成分的变化[J]. 质谱学报, 2013, 34(2): 88. ZHOU SS, MA ZC, LIANG QD, et al. UPLC-TOF-MS based profiling approach to evaluate ginsenoside composition in combination of Ginseng and Radix Ophiopogonis[J]. J Chin Mass Spectrom Soc, 2013, 34(2): 88. |
| [21] |
周永峰, 李瑞煜, 张定堃, 等. 基于UPLC-Q-TOF/MS的五味子不同部位化学成分研究[J]. 中草药, 2017, 48(6): 1087. ZHOU YF, LI RY, ZHANG DK, et al. Chemical constituents in different parts of Schisandrae Fructus based on UPLC-Q-TOF/MS[J]. Chin Tradit Herb Drugs, 2017, 48(6): 1087. |
| [22] |
何瑶, 王丽娟, 刘婷婷, 等. 基于代谢组学技术分析四物汤治疗原发性痛经证的作用机制[J]. 中国实验方剂学杂志, 2017, 23(12): 82. HE Y, WANG LJ, LIU TT, et al. Analysis of therapeutic mechanism of Siwutang in primary dysmenorrhea syndrome based on metabolomics technique[J]. Chin J Exp Tradit Med Form, 2017, 23(12): 82. |
| [23] |
周秀娟, 李燕芳, 陈莹, 等. 基于UPLC-Q Exactive四极杆-轨道阱液质联用法快速建立清热灵颗粒中潜在中药质量标志物(Q-Marker)成分库[J]. 中草药, 2017, 48(1): 67. ZHOU XJ, LI YF, CHEN Y, et al. Rapid establishment of Q-Marker database for Qingreling granules with UPLC coupled with hybrid quadrupole-Orbitrap mass spectrometery[J]. Chin Tradit Herb Drugs, 2017, 48(1): 67. |
| [24] |
王长生, 董红娇, 包雅婷, 等. UPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱联用快速分析粗茎秦艽化学成分[J]. 中草药, 2016, 47(18): 3175. WANG CS, DONG HJ, BAO YT, et al. Rapid analysis on chemical constituents from roots of Gentiana crasicaulis by ultra-high performance liquid chromatography coupled with hybrid quadrupole-Orbitrap mass spectrometry[J]. Chin Tradit Herb Drugs, 2016, 47(18): 3175. DOI:10.7501/j.issn.0253-2670.2016.18.006 |
| [25] |
王勇为. 确证定量分析新工具-Thermo Scientific Q-Exactive台式四极杆-轨道阱高分辨质谱[J]. 现代科学仪器, 2011(5): 138. WANG YW. New tool for confirmation quantitative analysis-Thermo Scientific Q-Exactive coupled with hybrid quadrupole-Orbitrap mass spectrometery[J]. Mod Sci Instrum, 2011(5): 138. |
| [26] |
谢学军, 王毅, 秦伟, 等. 补肾活血中药对糖尿病大鼠视路NT-3和Nissl小体的影响[J]. 中国中医眼科杂志, 2007, 17(1): 23. XIE XJ, WANG Y, QIN W, et al. An effect of Chinese medicine for Bushenhuoxue therapy on neurotrophic-3 and Nissl bodies in the visual pathway of experimental diabetic rats[J]. J Tradit Chin Ophthalmol, 2007, 17(1): 23. DOI:10.3969/j.issn.1002-4379.2007.01.007 |
| [27] |
马殿伟, 谢学军, 李晓微, 等. TGF-β2干预的缺氧状态下补肾活血剂对Müller细胞及谷氨酰胺合成酶活性的影响[J]. 眼科研究, 2010, 28(5): 407. MA DW, XIE XJ, LI XW, et al. Effects of Bushenhuoxue on activities of glutamine synthetase and retinal Müller cells under TGF-β2 intervene hypoxic condition[J]. Chin Ophthalmic Res, 2010, 28(5): 407. DOI:10.3969/j.issn.1003-0808.2010.05.008 |
| [28] |
马荣, 谢学军, 万李, 等. 补肾活血中药血清对高糖状态下纯化培养的视网膜神经节细胞活力的影响[J]. 中国中西医结合杂志, 2009, 29(10): 892. MA R, XIE XJ, WAN L, et al. Effect of serum contained Chinese drugs for nourishing Shen and activating blood on activity of purified retinal ganglion cells cultured in high glucose medium[J]. Chin J Integr Tradit West Med, 2009, 29(10): 892. DOI:10.3321/j.issn:1003-5370.2009.10.008 |
| [29] |
马殿伟, 谢学军, 张梅, 等. 补肾活血剂对高糖和(或)缺氧状态下共同培养视网膜神经节细胞和Müller细胞谷氨酸代谢的影响[J]. 眼科新进展, 2015, 35(5): 419. MA DW, XIE XJ, ZHANG M, et al. Effect of Bushenhuoxue decoction on glutamate metabolism in retinal ganglion cells and Müller cells co-cultured in high glucose concentration or (and)hypoxic conditions[J]. Rec Adv Ophthalmol, 2015, 35(5): 419. |
| [30] |
马殿伟, 谢学军, 张梅, 等. 补肾活血剂对高糖和(或)缺氧状态下视网膜神经节活力及谷氨酰胺合成酶活性的影响[J]. 眼科新进展, 2014, 34(6): 510. MA DW, XIE XJ, ZHANG M, et al. Effects of Bushenhuoxue decoction on activities of glutamine synthetase and RGC cultured in high glucose concentration or/and hypoxic conditions[J]. Rec Adv Ophthalmol, 2014, 34(6): 510. |
| [31] |
王紫燕, 李杨, 姚红娥, 等. 基于视网膜Müller细胞的人参皂苷类成分调节糖基化终末产物干预下HIF-1α表达的谱效关系研究[J]. 中药药理与临床, 2017, 33(2): 91. WANG ZY, LI Y, YAO HE, et al. Study on the spectrum-effect relationship of ginsenoside regulating expression of HIF-1α under AGEs base on retinal Müller cells[J]. Chin Med Pharmacol Clin, 2017, 33(2): 91. |
| [32] |
李杨, 徐秒, 陈换飞, 等. 丹参提取物对糖基化终末产物/缺氧条件下视网膜Müller细胞低氧诱导因子-1α作用的谱效关系研究[J]. 中草药, 2017, 48(11): 2231. LI Y, XU M, CHEN HF, et al. Study on spectrum-effect relationship of extract from Salvia miltiorrhiza Bge.effectting the HIF-1α of retinal Müller cells in the AGEs or hypoxia[J]. Chin Tradit Herb Drugs, 2017, 48(11): 2231. |
| [33] |
张梅, 刘静, 刘军, 等. LC-MS/MS分析含葛根复方制剂给药血浆中来自葛根的移行成分[J]. 中华中医药杂志, 2011, 26(9): 1954. ZHANG M, LIU J, LIU J, et al. LC-MS/MS analysis of constituents absorbed into blood in plasma samples obtained after administration of medicinal preparation containing Pueraria[J]. China J Tradit Chin Med Pharm, 2011, 26(9): 1954. |
 2019, Vol. 39
2019, Vol. 39 
