2. 解放军第306医院放疗科, 北京 100101;
3. 中国食品药品检定研究院 单克隆抗体产品室 卫生部生物技术产品检定方法及标准化重点实验室, 北京 102629
2. Department of Radiation Oncology, PLA No. 306 Hospital, Beijing 100101, China;
3. Division of Monoclonal Antibody, National Institutes for Food and Drug Control, Key Laboratory of the Ministry of Health for Research on Quality and Standardization of Biotech Products, Beijing 102629, China
自从1986年美国食品药品监督管理局批准抗CD3单抗以来,已经有超过70种治疗性单克隆抗体及其衍生物获得批准上市,其中单克隆抗体衍生物包括抗体的结合片段、Fc融合蛋白、放射免疫复合物、抗体偶联药物以及双功能抗体[1],其被广泛地应用到人类的疾病治疗过程中,包括肿瘤、风湿、感染、高血压以及高血脂等[2-5]。与小分子药物所不同,单抗类药物是高分子量的蛋白质,虽然具有较高的异质性,但又被广泛地应用,这是因为它们的异质性具有可控性,功能具有特异性,并且具有较长的半衰期。
抗体融合蛋白一般都具有1.00×105~1.50×105的高相对分子质量,且含有非常复杂的翻译后修饰[6]。这些复杂的翻译后修饰,糖基化修饰无疑是其中最为重要的一种。糖基化修饰可以改变蛋白质的性质,如药代动力学、功能、免疫原性、溶解性以及稳定性等[7]。以往研究表明,表达系统、蛋白质的空间构象以及发酵条件等都可以影响糖基化修饰。诸多的影响因素不但可以导致糖谱的改变,而且可以改变糖基化修饰位点[8]。糖基化修饰过程在细胞内是一个复杂的酶联反应过程,这一过程受到多种因素的影响,包括可以获得的前体糖单元、辅助因子以及酶的活性水平等,所有的这些决定了最终蛋白上所修饰的糖结构[9]。综上所述,糖基化修饰对于糖蛋白来说非常重要。
类风湿性关节炎是一种常见的疾病,在美国发病率大约有1%[10],我国发病率略低,大约0.42%[11]。T细胞在类风湿关节炎(RA)的发生和发展过程中起到重要的作用,如Th17的激活可以诱导抗瓜氨酸蛋白的抗体,从而对骨和关节产生损伤[12]。抗原提呈细胞(APC)通过主要组织相容性复合体(MHC)和免疫共刺激分子双信号激活T细胞,通过信号级联反应促进多种细胞因子,从而导致骨等组织的损伤。治疗RA常用的抗体类药物包括阿达木单抗(ADA)等单抗药物,以及融合蛋白阿巴西普(ABT)。这些药物的主要作用机理分为两类:其一,针对级联反应终末期的细胞因子,阻断其发挥生物学功能,从而减少骨等组织的损伤;其二,针对反应的启动阶段,阻止T细胞的激活,从而在源头阻断免疫级联反应的发生,其典型代表为ABT。2005年FDA批准ABT用于治疗顽固性RA,经过十多年的应用,给RA患者带来了福音[13]。
ABT是一种融合蛋白,由两部分组成:人CTLA4的胞外段和人γ1型免疫球蛋白的Fc段(铰链区,CH2和CH3结构域)。其作用机理是通过高亲和力与APC表面分子CD80或者CD86结合,从而阻断其与T细胞表面的CD28结合,使T细胞丧失第二活化信号,以阻断T细胞的活化。CTLA4-Ig被批准用于急性复发性RA的病人,以减轻关节炎症和疼痛,从而减少关节损伤[14]。但是,蛋白类药物都是在哺乳动物细胞内表达,分子量大,结构复杂、含大量翻译后修饰。大量研究发现翻译后修饰对蛋白质的结构和功能具有重要的影响。而CTLA4-Ig作为融合蛋白既有可结晶片段部分,也有CTLA-4胞外段,这两部分都存在复杂的糖基化修饰。在以前的研究中发现,此融合蛋白含有6个N-糖基化位点,每个位点的糖基化种类与普通单抗药物类似,但糖结构更加复杂,且含有较高比例的末端唾液酸,与此同时,在铰链区T8-9肽段的2、8、11和20位的丝氨酸上存在O-糖基化修饰[15]。虽然FDA在2005年就已批准用于临床,但是对其糖基化修饰研究报道很少,并且其还存在复杂的O-糖基化修饰;再者糖基化修饰对其结构和稳定性影响的研究未见报道。各种糖苷酶的商业化,为糖蛋白的糖基化修饰研究提供了很好的基础,例如本文所应用的4种酶,N-糖苷酶F可以将天冬酰胺上的N-糖完全酶切掉,但是同时将天冬酰胺转化为天冬氨酸;内切糖苷酶F2是在2个N-乙酰葡萄糖胺间进行酶切,将1个N-乙酰葡萄糖胺残基保留在蛋白质上;唾液酸酶可以切除N-糖和O-糖末端的唾液酸;O-糖苷酶则可以切除不含唾液酸的O-糖残基[15]。本研究详细探讨了CTLA4-Ig的糖基化修饰与其稳定性的关系,为CTLA4-Ig的质量控制提供参考,同时为CTLA4-Ig生物类似药研究打下基础。
1 实验材料 1.1 试剂超纯水(Millipore公司Milli-Q制水系统制备),磷酸二氢钾、氢氧化钾、氯化钠、二水合磷酸二氢钠、十二水合磷酸氢二钠、浓盐酸、乙酸铵、无水氯化钙、碳酸氢铵均为分析纯(国药集团化学试剂有限公司),N-糖苷酶(PNGase F)、O-糖苷酶(O-glycosidase)、唾液酸酶(neuraminidase),内切糖苷酶F2(EndoF2)(上海张江生物技术有限公司),Protein Thermal Shift Dye Kit(Applied Biosystems公司),Decon 90清洗剂(英国迪康公司)。
1.2 样品CTLA4-Ig融合(中国食品药品检定研究院留样)。
1.3 主要仪器设备及耗材超高压液相色谱仪H-class Bio系统(Waters公司),Acquity UPLC BEH200 SEC色谱柱(4.6 mm×150 mm,1.7 μm;Waters公司),7500 Fast Real-Time PCR系统(Applied Biosystems公司),DSC系统(Malvern公司),电泳仪(Bio-Rad公司),GS 800校准型光密度仪(Bio-Rad公司)。
2 试验方法 2.1 SEC测定不同酶切时间处理前后样品纯度 2.1.1 样品的酶切处理① N-糖苷酶F酶切:取样品30 mg,加入N-糖苷酶F300 μL,补充酶切缓冲液至4.5 mL,37 ℃水浴酶切,即得N-糖苷酶F酶切组;同时设立对照组,不加酶。②内切糖苷酶F2酶切:取样品30 mg,加入内切糖苷酶F2酶0.6 mg,补充酶切缓冲液至7.5 mL,37 ℃水浴酶切,即得内切糖苷酶F2酶切组;同时设立对照组,不加酶。③唾液酸酶酶切:取样品60 mg,加入唾液酸酶1.5 mL,补充酶切缓冲液至15 mL,37 ℃水浴酶切,即得唾液酸酶酶切组;同时设立对照组,不加酶。④O-糖苷酶酶切:取③中唾液酸酶酶切后的样品30 mg,应用50 kDa超滤离心管置换缓冲液至O-糖苷酶酶切缓冲液,并去除掉唾液酸酶后,加入O-糖苷酶450 μL,补充酶切缓冲液至35 mL,37 ℃水浴酶切,即得O-糖苷酶酶切组;同时设立对照组,不加酶。
在0、2、4、6、8、12、16、20、22、24和26 h分别取以上各酶切组及其对照组的蛋白质2 mg,应用50 kDa超滤离心管,将其置换到2 mL PBS缓冲液中,在此过程中同时去除了酶切体系中的酶,以进行后续的实验研究。
2.1.2 液相色谱条件采用Acquity UPLC BEH200 SEC(4.6 mm×150 mm,1.7 μm)色谱柱,柱温25 ℃,流动相(0.2 mol·L-1磷酸二氢钾,0.9%氯化钠,pH 6.8),流速0.2 mL·min-1,检测波长280 nm,运行时间12 min,进样量10.0 μg。
2.2 DSF测定不同酶切时间处理前后在完整蛋白水平热力学参数变化 2.2.1 样品的配切处理同“2.1.1”项下方法。
2.2.2 DSF条件起始温度25 ℃,最终温度99 ℃,温度变化速率1%,进样量12.5 μg。
2.3 DSC测定不同酶切时间处理前后各结构域热力学参数变化 2.3.1 样品的配切处理同“2.1.1”项下方法。
2.3.2 DSC条件起始温度20 ℃,最终温度110 ℃,温度变化速率90 ℃·h-1,进样量400 μg。
2.4 加速试验 2.4.1 样品的配切处理同“2.1.1”项下方法。
2.4.2 加速处理将样品分装于无菌EP管内,然后置于45 ℃条件下的水浴锅内进行孵育,在0、1、3、5、7、9、11和12周分别取出100 μg进行SEC检测。
2.5 聚丙烯酰胺凝胶电泳(SDS-PAGE)检测酶切效果 2.5.1 样品的配切处理同“2.1.1”项下方法。
2.5.2 SDS-PAGE条件浓缩电压(80 V,电泳时间15 min),分离电压(120 V,电泳时间70 min),染色(过夜),脱色(0.5 h,4次),上样量8.0 μg。
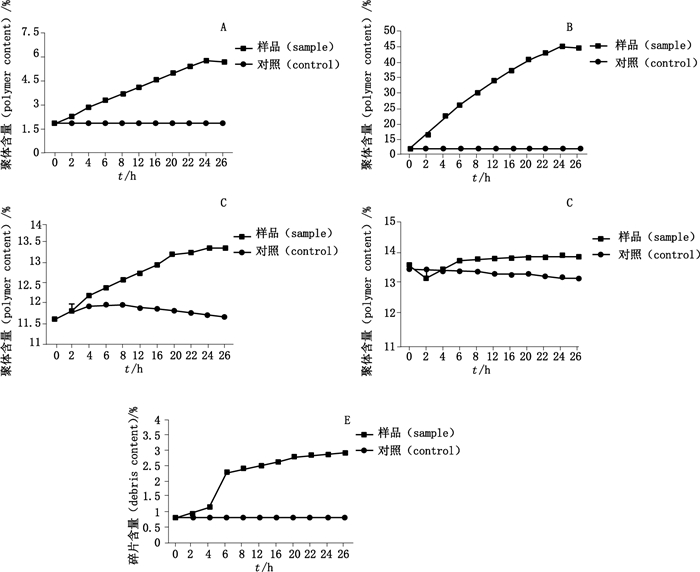
3 试验结果 3.1 SEC测定不同酶切时间处理前后样品纯度应用多种酶(N-糖苷酶F、内切糖苷酶F2、唾液酸酶和O-糖苷酶)对样品进行处理,在不同的时间点取样,进行SEC纯度检测。如图 1-A所示,应用N-糖苷酶F将N-糖逐渐切除后,CTLA4-Ig的聚体含量逐渐增加,聚体的比例由酶切前的1.8%增加到5.6%。因N-糖苷酶F将N-糖逐渐切除后,糖基化位点处的氨基酸(天冬酰胺)变为天冬氨酸,为进一步证明是由N-糖修饰,而不是因氨基酸变化所引起的,选择内切糖苷酶F2对样品进行处理。内切糖苷酶F2在去除N-糖基化修饰时,只是破坏了糖的结构,并没有导致氨基酸序列的变化。结果如图 1-B所示,随着内切糖苷酶F2酶切时间的延长,CTLA4-Ig的聚体含量也逐渐增加,聚体的比例由酶切前的12%增加到45%。
|
A. N-糖苷酶F酶切后聚体变化情况(the changes of polymers in PNGase F digested group)B.内切糖苷酶F2酶切后聚体变化情况(the changes of polymers in EndoF2 digested group)C.唾液酸酶酶切后聚体变化情况(the changes of polymers in neuraminidase digested group)D. O-糖苷酶酶切后聚体变化情况(the changes of polymers in O-glycosidase digested group)E. O-糖苷酶酶切后碎片变化情况(the debris changed in O-glycosidase digested group) 图 1 不同时间点酶切样品SEC纯度分析 Figure 1 SEC purity analysis of enzymatic digestion samples at different time points |
为进一步研究唾液酸与CTLA4-Ig的稳定性相关,应用唾液酸酶将末端的唾液酸去除。结果如图 1-C所示,随着唾液酸酶酶切时间的延长,CTLA4-Ig的聚体含量也略有增加,聚体的比例由酶切前的11.5%增加到13.4%。同时研究了O-糖修饰与稳定性的关系,结果如图 1-D、E所示,随着O-糖苷酶酶切时间的延长,CTLA4-Ig的聚体并没有发生明显变化,然而碎片的含量却有所增加,碎片的比例由酶切前的0.8%增加到2.8%,证明O-糖修饰也与CTLA4-Ig的稳定性密切相关。
3.2 DSF测定不同酶切时间处理前后在完整蛋白水平热力学参数变化不同酶切处理后的样品经SEC检测发现,糖基化修饰与CTLA4-Ig的稳定性有着密切的关系。进一步在热动力学方面进行了研究,DSF通过对样品进行缓慢地加热,在加热的过程中,检测荧光物质与结构发生改变的蛋白相结合的量,以研究蛋白质的热稳定。如图 2所示,与未经酶切处理的样品相比,N-糖苷酶F酶切后的样品Tm值逐渐由55.5 ℃下降到51.5 ℃左右;内切糖苷酶F2酶切后的样品Tm值逐渐由56 ℃下降到51.5 ℃左右;唾液酸酶酶切的样品Tm值基本维持在56 ℃左右;O-糖苷酶酶切的样品Tm值基本维持在56.5 ℃左右。

|
A. N-糖苷酶F酶切后稳定性(Tm)变化情况(the melting temperature(Tm)in PNGase F digested group)B.内切糖苷酶F2酶切后稳定性(Tm)变化情况(the melting temperature(Tm)in EndoF2 digested group)C.唾液酸酶酶切后稳定性(Tm)变化情况(the melting temperature(Tm)in neuraminidase digested group)D. O-糖苷酶酶切后稳定性(Tm)变化情况(the melting temperature(Tm)in O-glycosidase digested group) 图 2 不同时间点酶切样品DSF稳定性分析 Figure 2 SEC stability analysis of enzymatic digestion samples at different time points |
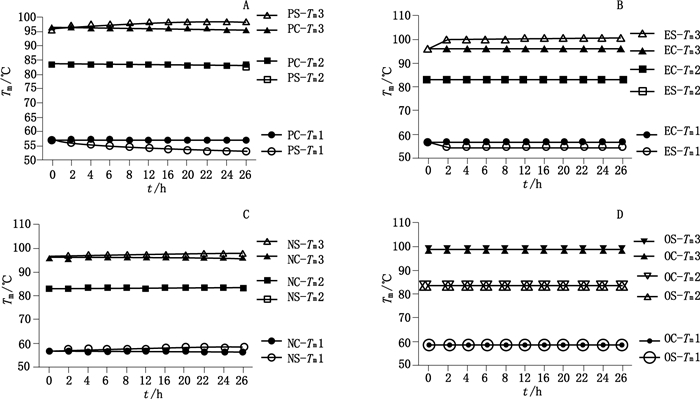
不同酶切处理后的样品经SEC和DSF检测均发现,糖基化修饰与CTLA4-Ig的稳定性有着密切的关系,进一步在热动力学方面进行了研究。DSC通过对样品进行缓慢地加热,检测蛋白质结构发生改变时热量的变化,来研究蛋白质的热稳定。DSC是一种非常精密的量热仪器,可以反映不同结构域的微量热变化。如图 3-A(图中PS表示N-糖苷酶F酶切后,PC表示酶切前)所示,随着N-糖苷酶F酶切的进行,Tm1由56.7 ℃逐渐下降到52.7 ℃左右,Tm2基本维持在83.4 ℃左右,Tm3却由96 ℃逐渐上升到98 ℃左右;如图 3-B(图中ES表示内切糖苷酶F2酶切后,EC表示酶切前)所示,内切糖苷酶F2酶切样品的变化趋势与PNGase F酶处理基本一致;如图 3-C(图中NS表示唾液酸酶酶切后,NC表示酶切前)所示,随着唾液酸酶酶切的进行,Tm1和Tm2都略微有所上升,Tm2基本维持在83.4 ℃左右;如图 3-D(图中OS表示O-糖苷酶酶切后,OC表示酶切前)所示,随着O-糖苷酶酶切的进行,Tm1、Tm2和Tm3都基本保持不变,Tm1维持在58.5 ℃左右,Tm2维持在83.4 ℃左右,Tm3维持在98.8 ℃左右。
|
A. N-糖苷酶F酶切后稳定性(Tm)变化情况(The melting temperature(Tm)in PNGase F digested group)B.内切糖苷酶F2酶切后稳定性(Tm)变化情况(The melting temperature(Tm)in EndoF2 digested group)C.唾液酸酶酶切后稳定性(Tm)变化情况(The melting temperature(Tm)in neuraminidase digested group)D. O-糖苷酶酶切后稳定性(Tm)变化情况(the melting temperature(Tm)in O-glycosidase digested group) 图 3 不同时间点酶切样品DSC分析各结构域稳定性 Figure 3 DSC analysis of stability of domains in enzymatic digestion samples at different time points |
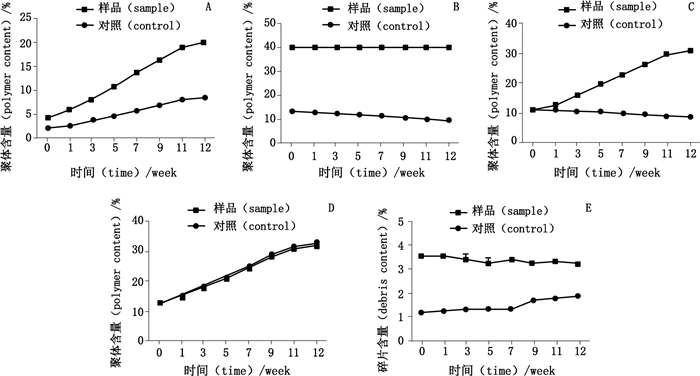
不同酶切处理后的样品经SEC、DSF和DSC检测均发现,糖基化修饰与CTLA4-Ig的稳定性有着密切的关系。为了在自然的条件下进一步观察这些修饰与CTLA4-Ig的稳定性间的关系,采用加速试验来进一步验证。将不同酶切处理的CTLA4-Ig置于45 ℃条件下,观察多聚体和碎片的含量随加热时间的变化情况。各个条件下的结果变化如图 4所示。图 4-A为N-糖苷酶F处理样品的加速试验,从第0周到第12周,样品组的聚体由4%上升到20%左右,而对照组只上升到8%左右;图 4-B为内切糖苷酶F2处理样品的加速试验,从第0周到第12周,样品组的聚体基本维持在40%左右,而对照组却维持于9%~11%;图 4-C为唾液酸酶处理样品的加速试验,从第0周到第12周,样品组的聚体由11%上升到31%左右,而对照组却维持于9%~10%;图 4-D、E为O-糖苷酶处理样品的加速试验,从第0周到第12周,样品组和对照品组的聚体基本一致,样品组的碎片基本维持在3.5%左右,而对照组却只上升到1.5%左右。
|
A. N-糖苷酶F酶切后聚体变化情况(the changes of polymers in PNGase F digested group)B.内切糖苷酶F2酶切后聚体变化情况(the changes of polymers in EndoF2 digested group)C.唾液酸酶酶切后聚体变化情况(the changes of polymers in neuraminidase digested group)D. O-糖苷酶酶切后聚体变化情况(the changes of polymers in O-glycosidase digested group)E. O-糖苷酶酶切后碎片变化情况(the debris changes in O-glycosidase digested group) 图 4 不同酶切样品加速试验分析 Figure 4 Accelerated experimental analysis of different enzymatic digestion samples |
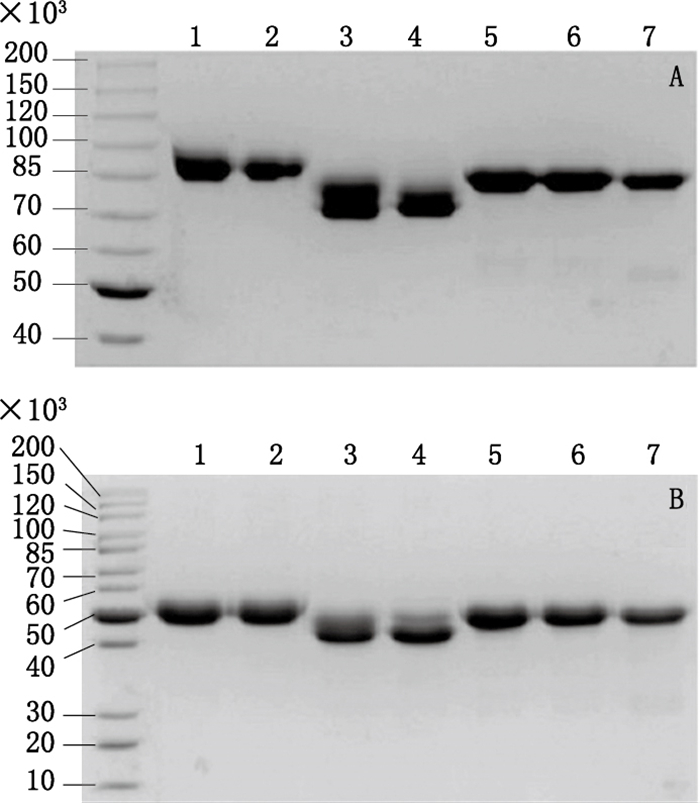
通过非还原型和还原型SDS-PAGE,可对比酶切前后相对分子质量的变化,借以评估酶切效果。如图 5-A和5-B所示,无论是非还原型,还是还原型SDS-PAGE,与N-糖苷酶F酶切前(第1泳道)和内切糖苷酶F2酶切前(第2泳道)相比,N-糖苷酶F酶切后(第3泳道)和内切糖苷酶F2酶切后(第4泳道)的相对分子质量显著降低,证明此2种酶酶切比较充分;与唾液酸酶酶切前(第2泳道)和O-糖苷酶酶切前(第6泳道)相比,唾液酸酶酶切后(第5泳道)和O-糖苷酶酶切后(第7泳道)的相对分子质量改变较小,因2种酶切除基团较小,但也可见相对分子质量的改变,也可体现此2种酶酶切效果。本研究也通过毛细管电泳和质谱技术进行了进一步验证,均证明4种酶可以有效地将糖基化修饰切除[15]。
|
1. N-糖苷酶F酶切前(before PNGaseF digestion)2.内切糖苷酶F2和唾液酸酶酶切前(before EndoF2 and neuraminidase digestion)3. N-糖苷酶F酶切后(after PNGaseF digestion)4.内切糖苷酶F2EndoF2酶切后(after EndoF2 digestion)5.唾液酸酶Neuraminidase酶切后(after neuraminidase digestion)6. O-糖苷酶酶切前(before O-glycosidase digestion)7. O-糖苷酶酶切后(after O-glycosidase digestion) A.非还原型SDS-PAGE测定酶切前后相对分子质量变化情况(determination of relative molecular mass change before and after enzymatic digestion by non-reductive SDS-PAGE)B.还原型SDS-PAGE测定酶切前后相对分子质量变化情况(determination of relative molecular mass change before and after enzymatic digestion by reductive SDS-PAGE) 图 5 SDS-PAGE检测酶切效果 Figure 5 Detection of the digestion efficiency by SDS-PAGE |
SEC-HPLC方法常常被用来确定蛋白质的单体含量和多聚体含量,因其操作简单,定量准确,在蛋白质药物纯度分析过程中常用。由本实验的结果可以看到,无论是应用N-糖苷酶F将N-糖修饰完全切除,还是应用内切糖苷酶F2或者唾液酸酶将N-糖修饰部分切除,都可以导致CTLA4-Ig的聚体显著增加;而应用O-糖苷酶将O-糖修饰去除以后,虽然CTLA4-Ig的聚体没有变化,但是其碎片显著增加,以上结果可以看出糖基化修饰对于CTLA4-Ig的稳定性有显著性的影响。
DSF作为一种分析蛋白质热稳定性的分析手段,其方法简单,效率高。实验过程中研究发现,应用不同的糖苷酶(N-糖苷酶F、内切糖苷酶F、唾液酸酶和O-糖苷酶)将糖基化修饰破坏以后,CTLA4-Ig在完整蛋白水平上的Tm都有所改变,也就是说经过酶切破坏糖基化修饰以后,在更低的温度下就能使CTLA4-Ig的结构发生改变,说明糖基化修饰对于CTLA4-Ig的稳定性有重要的影响。虽然DSF在分析蛋白质热稳定性方面具有显著的优点,但也有缺点,分辨率比较低,只能反映整体蛋白质的Tm变化,而不能体现是哪些蛋白质结构域发生了改变。后续实验应用DSC技术,进一步进行交互验证。
DSC作为一种分析蛋白质热稳定性的分析手段,分辨率高,效率高,可以高通量地对蛋白质的热稳定进行测定。本实验研究发现,应用糖苷酶将N-糖基化修饰去除以后,CTLA4-Ig的不同结构域的Tm改变不同,也就是说经过酶切破坏糖基化修饰以后,在不同的温度下就能使CTLA4-Ig的不同结构域发生改变,证实糖基化修饰对于CTLA4-Ig的稳定性有重要的影响。通过加速试验研究发现,酶切破坏N-糖基化修饰的样品更容易产生聚体,而破坏O-糖基化修饰以后,聚体基本上一致,但碎片的比例有所增加。加速试验进一步证明了糖基化修饰与CTLA4-Ig融合蛋白的稳定性密切相关。
本研究通过多种酶切处理和检测手段探究了糖基化修饰对CTLA4-Ig稳定性的影响。后续还需通过基因工程手段,以及晶体结构等研究方法对其机理进行进一步的阐述,以期更加深入地了解糖基化修饰对CTLA4-Ig稳定性的影响,为其质量控制提供可靠的参考。
| [1] |
Hernández-Jiménez J, Martínez-Ortega A, Salmerón-García A, et al. Study of aggregation in therapeutic monoclonal antibodies subjected to stress and long-term stability tests by analyzing size exclusion liquid chromatographic profiles[J]. Int J Biol Macromol, 2018, 118(3): 511. |
| [2] |
Tang X, Chen L, Li A, et al. Anti-GPC3 antibody-modified sorafenib-loaded nanoparticles significantly inhibited HepG2 hepatocellular carcinoma[J]. Drug Deliv, 2018, 25(1): 1484. DOI:10.1080/10717544.2018.1477859 |
| [3] |
Stamm TA, Machold KP, Aletaha D, et al. Induction of sustained remission in early inflammatory arthritis with the combination of infliximab plus methotrexate:the DINORA trial[J]. Arthritis Res Ther, 2018, 20(1): 174. DOI:10.1186/s13075-018-1667-z |
| [4] |
Ding JD, Lincoln VJ, Rolf H, et al. Anti-amyloid therapy protects against retinal pigmented epithelium damage and vision loss in a model of age-related macular degeneration[J]. Proc Natl Acad Sci USA, 2011, 108(28): 279. DOI:10.1073/pnas.1100901108 |
| [5] |
Cao YX, Liu HH, Dong QT, et al. Effect of proprotein convertase subtilisin/kexin type 9(PCSK9) monoclonal antibodies on new-onset diabetes mellitus and glucose metabolism:A systematic review and meta-analysis[J]. Diabetes Obes Metab, 2018, 20(6): 1391. DOI:10.1111/dom.2018.20.issue-6 |
| [6] |
ÇELIK E, OLLIS AA, LASANAJAK Y, et al. Glycoarrays with engineered phages displaying structurally diverse oligosaccharides enable high-throughput detection of glycan-protein interactions[J]. Biotechnol J, 2015, 10(1): 199. DOI:10.1002/biot.v10.1 |
| [7] |
Bumbaca D, Boswell CA, Fielder PJ, et al. Physiochemical and biochemical factors influencing the pharmacokinetics of antibody therapeutics[J]. AAPS J, 2012, 14(3): 554. DOI:10.1208/s12248-012-9369-y |
| [8] |
Andersen DC, Bridges T, Gawlitzek M, et al. Multiple cell culture factors can affect the glycosylation of Asn-184 in CHO-produced tissue-type plasminogen activator[J]. Biotechnol Bioeng, 2000, 70(9): 25. |
| [9] |
Butler M. Optimisation of the cellular metabolism of glycosylation for recombinant proteins produced by Mammalian cell systems[J]. Cytotechnology, 2006, 50(1-3): 57. DOI:10.1007/s10616-005-4537-x |
| [10] |
Nanke Y, Kotake S, Akama H, et al. Alkaline phosphatase in rheumatoid arthritis patients:possible contribution of bone-type ALP to the raised activities of ALP in rheumatoid arthritis patients[J]. Clin Rheumatol, 2002, 21(3): 198. DOI:10.1007/s10067-002-8285-4 |
| [11] |
Lee DM, Weinblatt ME. Rheumatoid arthritis[J]. Lancet, 2001, 358(9285): 903. DOI:10.1016/S0140-6736(01)06075-5 |
| [12] |
Hot A, Miossec P. Effects of interleukin (IL)-17A and IL-17F in human rheumatoid arthritis synoviocytes[J]. Ann Rheum Dis, 2011, 70(5): 727. DOI:10.1136/ard.2010.143768 |
| [13] |
Woodworth TG, den Broeder AA. Treating to target in established rheumatoid arthritis:challenges and opportunities in an era of novel targeted therapies and biosimilars[J]. Best Pract Res Clin Rheumatol, 2015, 29(4-5): 543. DOI:10.1016/j.berh.2015.10.001 |
| [14] |
Bernett MJ, Chu SY, Leung I, et al. Immune suppression in cynomolgus monkeys by XPro9523:an improved CTLA4-Ig fusion with enhanced binding to CD80, CD86 and neonatal Fc receptor FcRn[J]. MAbs, 2013, 5(3): 384. DOI:10.4161/mabs.23976 |
| [15] |
ZHU L, GUO Q, GUO H, et al. Versatile characterization of glycosylation modification in CTLA4-Ig fusion proteins by liquid chromatography-mass spectrometry[J]. MAbs, 2014, 6(6): 1474. DOI:10.4161/mabs.36313 |
 2019, Vol. 39
2019, Vol. 39 
