单克隆抗体(以下简称单抗)在抗肿瘤、抗自身免疫病上发挥着重要的功效,既可治疗几千个或更少病人群体的孤儿症状,如阵发性夜行性血红蛋白尿或与冷冻蛋白相关的周期性综合症,又可治疗有数百万患者的哮喘或类风湿性关节炎,故而成为发展最迅猛的治疗性蛋白药物,在新批准的药品中所占比例也越来越大[1-7]。但治疗性单抗类制品在生产、纯化、储存、运输过程中可能发生脱酰胺化、N端焦谷氨酸基团修饰、异构化、唾液酸化和C端赖氨酸裁剪等蛋白质修饰作用,导致电荷变异体的形成,而某些电荷变异体因对单抗分子的稳定性及其生物学功能的发挥具有重要影响,故成为关键质量属性(CQA)[8]。电荷变异体也可作为生产工艺稳定性的监控指标,因此对治疗性单抗进行电荷变异体分析和控制十分必要。境外药企均对抗体产品开发相应的方法进行电荷变异体质量控制和批间一致性检测。
单抗电荷异质性的检测技术包括离子色谱、区带电泳以及等电聚焦等。等电聚焦技术按发明时间顺序包括平板等电聚焦电泳(isoelectric focusing,IEF)、毛细管等电聚焦电泳(capillary isoelectric focusing,CIEF)和成像毛细管等电聚焦电泳(imaging capillary isoelectric focusing electrophoresis,iCIEF),它们都可以作为表征蛋白质电荷异质性的工具。最早出现的IEF由于操作复杂、时间长以及分辨率相对较低等缺点,已逐渐被新技术所替代;CIEF在聚焦完成后需要1个额外的移动过程,把毛细管内聚焦完成的蛋白推到检测器窗口,对于复杂的样品类型,这个移动过程可能出现裂峰,从而影响样品的重现性;iCIEF可对整个毛细管柱进行实时扫描,克服了CIEF通过外力推动样品至检测器窗口的影响,该技术使等电聚焦时间显著缩短,分析结果重复性改善,已成为蛋白质药物开发领域中产品鉴别、稳定性监测和表征的工具方法[9-15],该技术也是治疗性单抗电荷异质性方面主要的分析方法之一[16-19]。
iCIEF测定单抗电荷异质性的方法在国内外单抗生产企业均已得到比较广泛的应用,但企业在进行质控方法开发时,仍需要花费大量的时间、人工、费用在方法学的验证及系统适用性的评价上。为助力国内企业降低方法学开发成本,推进研发速度,同时为《中国药典》标准的提高提供技术支撑,组织国内多家质控实验室进行方法学的联合验证,并开发出该方法的系统适用性对照品。
1 单抗试剂与仪器设备 1.1 单抗及主要试剂系统适用性对照品、系统适用性对照品制剂缓冲液、抗体1(抗RANKL单抗,IgG2)、抗体2(抗PD-1单抗,IgG4),均为中国食品药品检定研究院单克隆抗体产品室留样;两性电解质Pharmalyte 3-10(货号17-0456-01)购自GE Healthcare公司;pI标记物6.14(货号102220)、pI标记物9.22(货号102231)、1%甲基纤维素(MC)溶液(货号101876)、0.5%甲基纤维素(MC)溶液(货号102505)和电解液套件(货号102506)均购自ProteinSimple公司;羧肽酶B(CPB):Roche,5 mg·mL-1,P/N 10103233001;其他试剂均为分析纯。
1.2 仪器耗材配备有自动进样器的毛细管等电点聚焦分析仪(方法学验证参与单位使用):iCE280,ProteinSimple公司;iCE 3,ProteinSimple公司;iCE280 Advance,荣捷生物工程(苏州)有限公司;CEInfinite,Advanced Electrophoresis Solutions Ltd.。恒温恒湿箱[(5±3)℃]:KBF-240,BINDER公司;医用低温保存箱(-70±10)℃:MDF-382E,Panasonic公司;高效液相色谱仪:1100/1200/1260,Agilent公司;毛细管电泳仪:PA 800 plus,Beckman Coulter公司。
FC涂层cIEF柱(5 cm×100 μm,货号101701)购自ProteinSimple公司;FC涂层cIEF柱(5 cm×100 μm,货号CP00201)购自Advanced Electrophoresis Solutions Ltd.。CE-SDS毛细管,57 cm×50 μm无涂层熔融石英,货号338451购自Beckman Coulter公司;Thermo Propac WCX-10 IEC色谱柱,4 mm×250 mm,购自赛默飞世尔科技(中国)有限公司。TSK-GEL G3000 SWxl凝胶色谱柱,7.8 mm×300 mm,购自TOSOH公司。
2 方法与结果 2.1 iCIEF系统适用性对照品的建立 2.1.1 建立iCIEF系统适用性对照品比较一系列单抗,选取具有典型电荷异质性特点的单抗作为系统适用性对照品(特征图谱见图 1)。该系统适用性对照品等电点(pI)范围介于7.5~9.5之间,大多数单抗pI位于该范围内,具有代表性;酸性变异体区含量约20%(中等丰度),酸性变异体区含量约10%(低丰度),主峰含量超过60%(高丰度),该对照品同时具有多种丰度区间的异构体类型。所建立对照品的浓度为10 mg·mL-1,包装容器为螺口塑料小瓶,装量100 μL,储存温度≤-70 ℃。
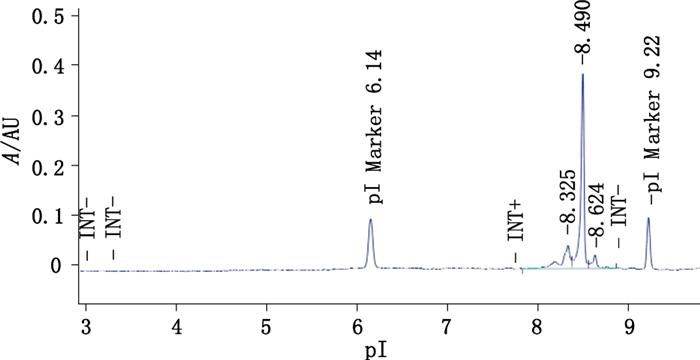
|
图 1 验证中使用的系统适用性对照品的典型图谱 Figure 1 Representative electropherogram of the system suitability control used in the validation |
系统适用性对照品在加速(4 ℃)条件保存(0、1、2、3、6个月)及长期储存温度(-70 ℃)条件保存(0、3、6、9、12个月),利用SEC-HPLC评价其单体含量的稳定性。
2.1.2.1 测定参数设置流动相:0.2 mol·L-1磷酸钾缓冲液-0.25 mol·L-1的氯化钾溶液(pH 6.2);流速:0.5 mL·min-1;进样器:30 ℃;柱温:30 ℃;检测波长:280 nm;进样量:100 μL;运行时间:30 min。
2.1.2.2 供试品处理用流动相稀释供试品至0.5 mg·mL-1,于30 ℃孵育24 h后分别进样分析。
2.1.2.3 SEC-HPLC评价iCIEF系统适用性对照品的稳定性结果加速(4 ℃)条件及长期储存温度(-70 ℃)条件下,系统适用性对照品的单体含量无显著变化,状态稳定。
2.1.3 利用IEC-HPLC评价评价iCIEF系统适用性对照品的稳定性系统适用性对照品在加速(4 ℃)条件保存及长期储存温度(-70 ℃)条件保存后,利用IEC-HPLC评价其电荷变异体的稳定性。
2.1.3.1 测定参数设置流动相A:20 mmol·L-1 N-乙酰氨基-2-氨基乙烷磺酸(ACES),pH 6.50±0.05;流动相B:200 mmol·L-1氯化钠溶液,20 mmol·L-1 ACES,pH 6.50±0.05;梯度洗脱,洗脱程序见表 1;流速:见表 1;柱温:40 ℃;检测波长:280 nm;进样量:100 μL;运行时间:100 min。
|
|
表 1 HPLC梯度洗脱程序及流速 Table 1 The gradient elution procedure flow rate for HPLC |
分别取供试品适量,用流动相A稀释至1 mg·mL-1,按照1:100的比例加入1 mg·mL-1羧肽酶B(CPB),于37 ℃孵育30 min,待测。
2.1.3.3 IEC-HPLC评价iCIEF系统适用性对照品的稳定性结果加速(4 ℃)条件及长期储存温度(-70 ℃)条件下,系统适用性对照品的电荷变异体含量无显著变化,状态稳定。
2.1.4 利用非还原CE-SDS评价iCIEF系统适用性对照品的稳定性系统适用性对照品在加速(4 ℃)条件保存及长期储存温度(-70 ℃)条件保存后,利用非还原CE-SDS评价其大小变异体的稳定性。
2.1.4.1 毛细管及仪器参数设置裸管毛细管长度:至检测器长20 cm,总长30 cm;进样电压:5 kV;进样时间:20 s;分离电压:15 kV,分离时间:40 min;极性:负极到正极(反相);检测波长:220 nm。
2.1.4.2 供试品处理取供试品10 μL(100 μg),加入缓冲液(1% SDS,50 mmol·l-1 Na2HPO4·12H2O,pH 6.5)50 μL,加入去离子水补足体积至100 μL。溶液混匀后置于65 ℃水浴,5 min,12 000 r·min-1离心3 min后,取上层清液80 μL进样分析。
2.1.4.3 非还原CE-SDS评价iCIEF系统适用性对照品的稳定性结果加速(4 ℃)条件及长期储存温度(-70 ℃)条件下,系统适用性对照品的大小变异体含量无显著变化,状态稳定。
2.2 iCIEF分析单抗电荷异质性的方法学预验证(19个质控实验室,22台iCIEF设备) 2.2.1 方法学预验证样品检测 2.2.1.1 供试品预稀释将供试品(系统适用性对照品)用去离子水稀释至1 mg·mL-1,即得供试品预稀释溶液;用去离子水按相同比例稀释系统适用性对照品制剂缓冲液。
2.2.1.2 供试品检测将40 μL供试品预稀释溶液与70 μL的1%甲基纤维素、1 μL的pI Marker 6.14、1 μL的pI Marker 9.22、8 μL的Pharmalytes 3-10和80 μL去离子水混匀,12 000 r·min-1离心5 min,取上层清液即得供试品溶液;取上述供试品溶液150 μL,移入进样瓶。电泳参数:预聚焦,1.5 kV,1 min;聚焦,3 kV,7.5 min。系统适用性对照品制剂缓冲液进样1针,系统适用性对照品溶液进样6针。
2.2.1.3 方法学预验证结果按照系统适用性对照品典型图谱(图 1),计算酸性变异体区、主峰、碱性变异体区的pI及相对百分含量,见表 2。统计分析全部样品结果数据(n=132),系统适用性对照品酸性变异体区、主峰、碱性变异体区的pI分别为8.28±0.04、8.46±0.04、8.60±0.04;系统适用性对照品酸性变异体区、主峰、碱性变异体区的相对百分含量分别为(22.27±2.09)%、(70.55±2.58)%、(7.18±0.97)%。22台iCIEF设备涵盖了目前市场上全部品牌的主流型号设备,预验证结果显示,该方法具有良好的仪器设备兼容性。
|
|
表 2 预验证结果—iCIEF分析pI及电荷变异体区的相对百分含量(均值±s,n=6) Table 2 Pre-validation results—iCIEF analysis of pI and relative percentage contents in charge variant regions(mean±s, n=6) |
将系统适用性对照品、抗体1、抗体2用去离子水稀释至1 mg·mL-1,用去离子水按相同比例稀释系统适用性对照品制剂缓冲液(空白)。供试品溶液配制及检测同“2.2.1.2”项下方法。该方法能够区分不同的单抗(抗体1,抗体2,系统适用性对照品),特异性良好,见图 2。
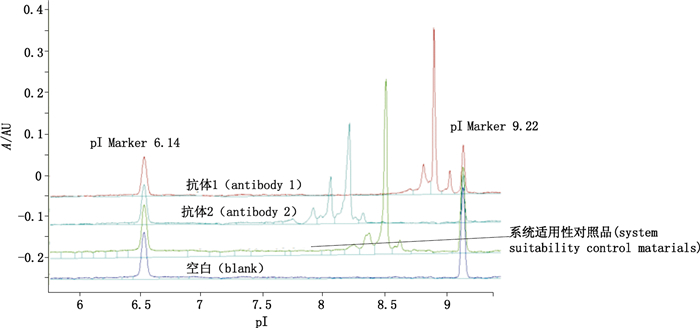
|
图 2 iCIEF方法学验证的特异性分析(280 nm) Figure 2 Specificity analysis of methodological validation by iCIEF(280 nm) |
将系统适用性对照品用去离子水稀释至0.50、0.75、1.00、1.25、1.50 mg·mL-1。供试品溶液配制及检测同“2.2.1.2”项下方法。采用回收率计算方法来评估准确性。以各浓度点的总峰面积平均值(n=3)与蛋白浓度做直线回归方程;将各浓度点的浓度值带入回归方程,计算得到各个浓度点的理论总峰面积。按(试验测定总峰面积平均值)÷(理论总峰面积)×100%计算各浓度点的回收率。14套仪器设备的各个浓度点回收率均在93.2%~109.2%,准确度符合要求。
2.3.3 精密度 2.3.3.1 重复性检测将系统适用性对照品用去离子水稀释至1 mg·mL-1,做6个平行重复供试品预稀释溶液。供试品溶液配制及检测同“2.2.1.2”项下方法。计算系统适用性对照品6次重复进样的酸性变异体区、主峰、碱性变异体区的pI及主峰相对百分含量,结果RSD均小于5%,重复精密度良好。
2.3.3.2 中间精密度检测按照“2.3.3.1”项下方法独立进行3次(每天1次)重复实验。计算系统适用性对照品6次重复进样的酸性变异体区、主峰、碱性变异体区的pI及主峰相对百分含量,结果RSD均小于5%,中间精密度良好。
2.3.4 定量下限(LOQ)将系统适用性对照品用去离子水稀释至1 mg·mL-1,再倍比稀释至0.5、0.25、0.125、0.062 5、0.031 2、0.015 6 mg·mL-1。供试品溶液配制及检测同“2.2.1.2”。据ICH_Q2_R1中计算公式,LOQ=10σ/S。本次方法学验证的LOQ(mean±s,n=14)为(0.005 0±0.003 7)mg·mL-1,该方法的定量限为微克级,灵敏度较高。
2.3.5 耐用性 2.3.5.1 供试品溶液完成制备后在4 ℃条件下保存时间的耐用性供试品溶液完成制备后避光保存于4 ℃,在4个时间点(0、12、24、48 h)分别进行检测,通过计算各个时间点系统适用性对照品酸性变异体区、主峰、碱性变异体区pI及主峰的百分含量,评价耐用性,结果RSD均小于5%,耐用性良好。
2.3.5.2 Pharmalyte 3-10终浓度分别在3%、4%(目标终浓度)、5%的耐用性Pharmalyte 3-10是iCIEF检测溶液中的1个主要组分,调整其终浓度[3%、4%(目标终浓度)、5%],通过比较系统适用性对照品酸性变异体区、主峰、碱性变异体区pI及主峰的相对百分含量,评价Pharmalyte 3-10的耐用性,结果RSD均小于5%,耐用性良好。
2.3.5.3 Methyl Cellulose终浓度分别在0.25%、0.35%(目标终浓度)、0.45%的耐用性Methyl Cellulose是iCIEF检测溶液中的1个主要组分,调整其终浓度[0.25%、0.35%(目标终浓度)、0.45%],通过比较系统适用性对照品酸性变异体区、主峰、碱性变异体区的pI及主峰的相对百分含量,评价Methyl Cellulose的耐用性,结果RSD均小于5%,耐用性良好。
2.3.6 线性和范围以“2.3.2”项下测得的各浓度点的总峰面积均值(n=3)与蛋白浓度做直线回归方程,利用R2评价线性,R2均大于0.98,在质量浓度为0.15~0.3 mg·mL-1范围内,线性符合要求。
2.4 iCIEF系统适用性对照品的可接受标准建立方法学验证涵盖了目前市场上全部品牌(进口 & 国产)的主要型号设备,根据“2.2”项下(19个质控实验室,22台iCIEF设备)数据和“2.3”项下方法学联合验证(11个质控实验室,14台iCIEF设备)数据(n=662),获得iCIEF系统适用性对照品的pI及电荷异质性数据(表 3)。参考USP/EP进行统计分析,按照95%置信区间,系统适用性对照品主峰pI及相对百分含量可接受标准设定为1.96倍的SD & RSD(表 4)。
|
|
表 3 系统适用性对照品的pI及电荷变异体区的相对百分质量(n=662) Table 3 pI and relative percentage contonts in charge variant regions of the system suitability control materials |
|
|
表 4 系统适用性对照品可接受标准 Table 4 Acceptable standard of the system suitability control materials |
药物质量控制中作为放行和稳定性研究的检测方法均需进行详细的方法学验证才能进行实际应用,而相对较新的先进方法,如经过了实验室间的联合验证,则可以增加工业界对方法的信心并促进其应用,并得到监管机构的认可。iCIEF作为单抗制品的电荷异质性检测方法,近年来在工业界的应用逐渐增加,但是此方法在世界范围内一直未按照国际准则如ICH-Q2进行验证,而我们的研究填补了此项空白。检测系统的稳定性会影响供试品的检测值,ICH-Q2[20]建议在分析方法中加入系统适用性对照品,由于系统适用性对照品经过充分的验证后已经赋予其一定的检测值,所以可以用来判断整个检测系统是否处于适用于分析的良好状态。所以本文在进行方法学验证的同时建立了应用该方法的系统适用性对照品,并建立了相应的可接受标准,所建立的对照品对于iCIEF方法的实际应用将发挥重要的作用。
本次方法学联合验证,利用所建立的系统适用性对照品为供试品,将目前已经上市的全部iCIEF品牌设备纳入,参与验证的质控实验室也具有代表性,包括国家药检质控实验室、国内单抗生产企业质控实验室、外企驻中国质控实验室。方法学联合验证结果显示,该方法具有良好的特异性、准确度、精密度、耐用性、线性及其范围。
因iCIEF设备的品牌、型号较多,难以统一仪器参数,同时,两性电解质、甲基纤维素、pI Marker(影响最大)、涂层毛细管等试剂耗材也存在批间差异,这些因素都会影响供试品pI的计算值(绝对值),因此不同仪器设备测定同一供试品的计算值差异较大的情况是可能存在的,但同一台仪器设备的重复性、精密度、准确度等都是稳定可靠的,所以建立系统适用性对照品可接受标准时使用的是SD、RSD可接受范围而不是测定得到的绝对值。系统适用性对照品主峰相对百分含量除规定SD、RSD范围外,还要求主峰相对百分含量的量值范围符合规定,这样可达到考察系统分离能力的目的。相对于含量较低的酸碱变异体区,主峰可以更好地完成系统适用性评价的功能,因此酸碱变异体区在可接受标准中不做要求。
系统适用性对照品检测体系是经过了方法学验证的,但该体系未必适用于所有制品类型,企业应用该方法时可根据制品的特点对供试品检测体系进行优化,如调整预混溶液体系组分或比例、供试品终浓度、聚焦电压、聚焦时间等。对于盐浓度较高的制品,可能还需要做脱盐前处理。iCIEF分析仪器品牌差异与试剂耗材的品牌及批间差异可能造成系统适用性对照品的检测图谱与参考典型图谱的峰形略有差异是可以接受的。
由于单抗制品具有较为复杂的电荷异质性,因此需要组合多种理化分析技术对其进行检测。iCIEF方法为电荷异质性分析提供了一个快速、灵敏、高分离度的选择,对保证单抗类生物技术药物生产工艺的稳定性及质量控制具有重要意义。
| [1] |
KOHLER G, MILSTEIN C. Continuous cultures of fused cells secreting antibody of predefined specificity[J]. Nature, 1975, 256(5517): 495. DOI:10.1038/256495a0 |
| [2] |
CHRISTIANSEN J, RAJASEKARAN AK. Biological impediments to monoclonal antibody-based cancer immunotherapy[J]. Mol Cancer Ther, 2004, 3(11): 1493. |
| [3] |
BREEN ED, CURLEY JG, OVERCASHIER DE, et al. Effect of moisture on the stability of a lyophilized humanized monoclonal antibody formulation[J]. Pharm Res, 2001, 18(9): 1345. DOI:10.1023/A:1013054431517 |
| [4] |
GESKIN LJ. Monoclonal antibodies[J]. Dermatol Clin, 2015, 33(4): 777. DOI:10.1016/j.det.2015.05.015 |
| [5] |
KIRLEY TL, NORMAN AB. Characterization of a recombinant humanized anti-cocaine monoclonal antibody and its fab fragment[J]. Hum Vaccin Immunother, 2015, 11(2): 458. DOI:10.4161/21645515.2014.990856 |
| [6] |
DESOUBEAUX G, REICHERT JM, SLEEMAN M, et al. Therapeutic monoclonal antibodies for respiratory diseases:current challenges and perspectives[J]. MAbs, 2016, 8(6): 999. DOI:10.1080/19420862.2016.1196521 |
| [7] |
ECKER DM, JONES SD, LEVINE HL. The therapeutic monoclonal antibody market[J]. MAbs, 2015, 7(1): 9. DOI:10.4161/19420862.2015.989042 |
| [8] |
于传飞, 郭玮, 王兰, 等. 成像毛细管等电聚焦电泳法对单克隆抗体制品的电荷异质性分析[J]. 药物分析杂志, 2014, 34(7): 1212. YU CF, GUO W, WANG L, et al. Charge heterogeneity analysis of monoclonal antibody products with imaging capillary isoelectric focusing electrophoresis[J]. Chin J Pharm Anal, 2014, 34(7): 1212. |
| [9] |
王丽, 周勇, 王军志. 成像毛细管等电聚焦电泳分析糖蛋白类生物技术药物[J]. 中国生物制品学杂志, 2012, 25(8): 1035. WANG L, ZHOU Y, WANG JZ. Analysis of glycoproteins by imaging capillary isoelectric focusing electrophoresis[J]. Chin J Biol, 2012, 25(8): 1035. |
| [10] |
SOSIC Z, HOUDE D, BLUM A, et al. Application of imaging capillary IEF for characterization and quantitative analysis of recombinant protein charge heterogeneity[J]. Electrophoresis, 2008, 29(21): 4368. DOI:10.1002/elps.v29:21 |
| [11] |
ANDERSON CL, WANG Y, RUSTANDI RR. Applications of imaged capillary isoelectric focussing technique in development of biopharmaceutical glycoprotein-based products[J]. Electrophoresis, 2012, 33(11): 1538. DOI:10.1002/elps.201100611 |
| [12] |
SALAS SO, KENNEL B, PARK SS, et al. Robustness of iCIEF methodology for the analysis of monoclonal antibodies:an inter laboratory study[J]. J Sep Sci, 2012, 35(22): 3124. DOI:10.1002/jssc.201200633 |
| [13] |
WU J, PAWLISZYN J. Application of capillary isoelectric focusing with absorption imaging detection to the quantitative determination of human hemoglobin variants[J]. Electrophoresis, 1995, 16(4): 670. |
| [14] |
DADA OO, JAYA N, VALLIERE DJ, et al. Characterization of acidic and basic variants of IgG1 therapeutic monoclonal antibodies based on non-denaturing IEF fractionation[J]. Electrophoresis, 2015, 36(21-22): 2695. DOI:10.1002/elps.201500219 |
| [15] |
WU XZ, PAWLISZYN J. Whole-column imaging capillary electrophoresis of proteins with a short capillary[J]. Electrophoresis, 2002, 23(4): 542. DOI:10.1002/(ISSN)1522-2683 |
| [16] |
SOSIC Z, HOUDE D, BLUM A, et al. Application of imaging capillary IEF for characterization and quantitative analysis of recombinant protein charge heterogeneity[J]. Electrophoresis, 2008, 29(21): 4368. DOI:10.1002/elps.v29:21 |
| [17] |
RUSTANDI RR, ANDERSON C, HAMM M. Application of capillary electrophoresis in glycoprotein analysis[J]. Methods Mol Biol, 2013, 988: 181. DOI:10.1007/978-1-62703-327-5 |
| [18] |
JANINI G, SAPTHARISHI N, WASELUS M, et al. Element of a validation method for MU-B3 monoclonal antibody using an imaging capillary isoelectric focusing system[J]. Electrophoresis, 2002, 23(11): 1605. DOI:10.1002/1522-2683(200206)23:11<1605::AID-ELPS1605>3.0.CO;2-O |
| [19] |
WU J, WU XZ, HUANG T, et al. Analysis of proteins by CE, CIEF, and microfluidic devices with whole-column-imaging detection[J]. Methods Mol Biol, 2004, 276: 229. |
| [20] |
Harmonised Tripartite Guideline.Validation of Analytical Procedures: Text and Methodology Q2(R1)(Current Step 4 Version Dated 12 September 2005)[S/OL].[2016-07-01].https://www.ich.org/products/guidelines/quality/article/quality-guidelines.html
|
 2019, Vol. 39
2019, Vol. 39 
