2. 福建省医疗器械与药品包装材料检验所, 福州 350001
2. Fujian Institute for Medical Device and Pharmaceutical Packaging Material Control, Fuzhou 350001, China
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)基因,即c-erbB-2基因,定位于人染色体17q21,编码1个相对分子质量为185 k的受体样跨膜蛋白。HER2蛋白属于跨膜酪氨酸激酶受体家族的一员,包含3个区域:N端胞外区结构域(extracellular domain,ECD),含1个α螺旋的跨膜区(transmembrane domain,TMD)和细胞内的酪氨酸激酶结构域(tyrosine kinase domain,TKD)[1]。HER2在正常情况下处于非激活状态,主要在胚胎发育期表达,成年后,仅在极少数正常组织内微量表达,参与细胞的正常分化调控[2-3]。研究表明,HER2的过表达与肿瘤的发生、发展密切相关,在乳腺癌[4]、卵巢癌[5]、胃癌[6]等癌症中均存在不同程度的HER2过表达。HER2的过表达可使其不需生长因子的刺激而形成二聚体,进而激活其下游细胞信号转导途径,引起细胞的无限生长、分裂[7]。因此,HER2是肿瘤免疫治疗研究中的一个重要靶分子。
美国FDA在1998年批准了针对HER2靶点的第1个人源化单克隆抗体药物曲妥珠(trastuzumab)的上市,该药用于HER2蛋白表达阳性的转移性乳腺癌患者的治疗及早期患者的术后辅助治疗。目前研究认为,抗HER2单抗对HER2基因扩增或蛋白过表达的肿瘤发挥治疗作用的机制如下:(1)通过与HER2受体胞外段的第4个结构域特异性结合,抑制受体的酪氨酸激酶活性,阻滞整个HER2网络的信号传递,从而抑制癌细胞生长或诱导细胞凋亡;(2)作为抗体依赖的细胞介导细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)的潜在介质,单抗的Fc段可与CD16+淋巴细胞表面的FcRγⅢa受体相结合,从而激活这些效应细胞的杀伤活性,释放穿孔素和颗粒酶,对肿瘤靶细胞进行杀伤,利用机体免疫系统杀伤HER2阳性的肿瘤细胞;(3)可通过抑制金属蛋白酶活性,抑制HER2细胞外段(extracellular domain,ECD)的裂解,阻止其释放到血液中,避免其持续激活HER2下游信号通路。在这些机制中,ADCC效应对于HER2单抗杀伤肿瘤靶细胞具有重要意义。抗HER2单抗介导的ADCC被证明在HER2过表达的癌细胞中比HER2非过度表达的癌细胞中更优先产生。另外在体外研究中也证实,乳腺癌患者对短期抗HER2单抗单一治疗的反应依赖于ADCC机制[8]。
在以HER2抗原为靶点的抗体类药物及其偶联药物的质量研究中,生物学活性测定是确保产品有效性的重要质控指标。目前抗HER2单抗的体外生物学活性主要通过细胞增殖抑制法来测定,对于抗HER2单抗的另一重要作用机制ADCC的研究相对较少。经典的ADCC测定方法主要是将靶细胞暴露于结合有抗体的效应细胞,如外周血单核细胞(peripheral blood mononuclear cell,PBMC)或自然杀伤细胞(natural killer cell,NK cell)中,通过对靶细胞的细胞毒检测试验来测定ADCC活性。最早的ADCC细胞毒检测方法是通过放射性铬51Cr元素或镧系元素铕(63Eu)标记的靶细胞释放法,但因同位素存在半衰期短,不易保存,实验废弃物易污染等缺点,限制了该方法的应用研究。此外,又相继建立了乳酸脱氢酶释放法、甘油醛-3-磷酸脱氢酶定量法等试验方法,虽然这些新方法避免了同位素的操作污染,但仍然需要利用供试者的新鲜PBMC或NK细胞作为效应细胞[9-10]。从实验操作来说,这些细胞的提取过程烦琐,又由于供试者的不同,个体及免疫水平的差异都会导致应答变异性很大,且容易造成较高的背景值。因此迫切需要建立一种不依赖于原始PBMC或NK细胞的评价抗HER2单抗ADCC生物学活性的新方法,转基因细胞技术恰好为我们提供了新思路。本文使用工程改造的Jurkat细胞作为效应细胞,以NFAT应答元件驱动的荧光素酶报告基因检测系统为平台,在国内首次建立了准确、快速的抗HER2抗体ADCC生物学活性检测方法[11]。
1 材料与方法 1.1 主要仪器NEONTM电穿孔转染系统(Invitrogen公司);流式细胞仪FACS Calibur(BD公司);多功能酶标仪及SoftMax分析软件(Molecular Devices公司);Waters 2695高效液相色谱仪、2487紫外检测器、Waters Millennium 32分析软件(Waters公司);G3000SWXL(7.8 mm×300 mm,5 μm)色谱柱(TSK公司)。
1.2 材料SKBR3、BT474、MCF7细胞系(人乳腺癌细胞,购自ATCC公司);Jurkat细胞系(人淋巴细胞,购自ATCC公司);抗HER2单抗及抗HER2单抗的偶联药物样品均为中检院单抗室留样;Lipofectamine 2000为Life公司产品;胎牛血清(FBS)、含EDTA的胰酶、无酚红RPMI 1640培养基、MEM非必需氨基酸溶液(NEAA)及潮霉素B溶液为GIBCO公司产品;嘌呤霉素(puromycin)为Sigma公司产品;牛血清白蛋白(BSA)、磷酸盐缓冲液(PBS)、G418及Bio-GloTM Luciferase Assay System为Promega公司产品;Hoechst 33258、Phorbol-12-myristate-13-acetate(PMA)、离子霉素为碧云天公司产品;PE Anti-Human HER2 Antibody为北京义翘神州生物技术有限公司产品;重组化脓性链球IgG降解酶(IdeS)为上海张江生物技术有限公司产品。
1.3 方法 1.3.1 Jurkat-hFcγRⅢa-NFAT细胞株的构建 1.3.1.1 质粒转染效应细胞株构建FcγRⅢ表达质粒pcDNA 3.1-hFcγRⅢa和报告基因质粒pcDNA3.1-NFAT-RE-luc,并转染Jurkat细胞,接种密度为2.5×105~4×105个·mL-1,2~3 d传代,最高细胞密度不应超过2×106个·mL-1;传代培养基为RPMI 1640+10%FBS。电转参数如下:电转体积为100 μL;细胞数目为2×106个·mL-1;质粒用量为10 μg;电转条件为1 350 V,10 ms,3次。电转后的Jurkat细胞于6孔板培养,每孔培养基为2 mL。
1.3.1.2 效应细胞株的筛选转染24 h或48 h后加入筛选压力,以G418作为单转pcDNA3.1-hFcγRⅢa的选择压力剂,筛选质量浓度为500 μg·mL-1;以嘌呤霉素作为单转pcDNA3.1-NFAT-RE-luc的选择压力剂,筛选质量浓度为1.0 μg·mL-1;对于细胞表面的hFcγRⅢa分子,采用流式分析的方法进行克隆鉴定和筛选。200 g离心5 min收集1×105个细胞,以PBS洗1次,200 g离心5 min后,加入1 μg·mL-1 FITC标记remicade 4 ℃孵育1 h,再以PBS洗细胞3次,每次200 g离心5 min,最后以200 μL PBS重悬细胞进行流式检测。通过NFAT通路激活因子PMA和离子霉素共刺激的方法检测NFAT-RE-luc报告基因信号高的克隆,不同克隆每孔加入200 μL含有0.1 μmol·L-1 PMA和1 μmol·L-1离子霉素的细胞培养基(含10%FBS的RPMI 1640培养基)刺激过夜,以仅加200 μL细胞培养基的细胞孔作为阴性对照进行荧光信号比较筛选。
1.3.2 ADCC生物学活性测定向处于对数生长期的SKBR3细胞中加入含0.25%EDTA的胰蛋白酶0.5 mL,放入37 ℃、5% CO2培养箱中消化2~3 min,加入5 mL含10%FBS的无酚红RPMI 1640培养基(细胞培养基)终止消化,200 g离心5 min后以含0.5%BSA的无酚红RPMI 1640培养基(稀释液)重悬细胞,并调整细胞浓度至1×105个·mL-1,接种于白色不透明板中,每孔100 μL,置于37 ℃、5% CO2培养箱中培养12~16 h,使细胞贴壁,作为SKBR3细胞培养板待用。以(稀释液)稀释抗HER2单抗至起始工作质量浓度为4 000 ng·mL-1,再用稀释液进行1:4倍稀释,制得9个稀释度的稀释样品,每一稀释度设2个复孔。收集对数生长期的Jurkat-hFcγRⅢa-NFAT细胞,200 g离心5 min后弃去上清,加入PBS 5 mL,200 g离心5 min洗涤1次,用1 mL稀释液重悬细胞,并调整细胞浓度至3×106个·mL-1。取出SKBR3细胞培养板,轻轻将上清吸尽;将Jurkat-hFcγRⅢa-NFAT细胞接种于SKBR3细胞培养板,每孔50 μL;然后将已稀释的稀释样品转移至细胞培养板内,每孔25 μL。以25 μL稀释液代替抗HER2单抗作为阴性对照孔,75 μL稀释液作为背景孔;置37 ℃、5% CO2条件下诱导20 h后,室温条件下平衡至少15 min;加入荧光素酶底物溶液,每孔75 μL,混合后在室温条件下避光反应5 min,用酶标仪在细胞培养板上读取相对光单位(relative light unit,RLU)数值并按照以下公式计算(FI值。FI=RLU(反应均值-背景均值)/RLU(阴性对照均值-背景均值);利用Graphpad Prism 6软件分析试验数据,以抗HER2单抗浓度对数为x轴,对应的FI值为y轴,选用四参数方程回归模型,拟合抗HER2单抗的剂量效应曲线。
1.3.3 试验条件的优化 1.3.3.1 靶细胞的选择 1.3.3.1.1 流式细胞术检测不同靶细胞表面HER2表达量取对数生长期的细胞,消化计数收集1×106个细胞,200 g离心5 min弃上清。以4 ℃预冷的含有1%BSA的PBS(PBA)重悬细胞,200 g离心5 min,弃上清。试验管加入190 μL PBA+10 μL PE Anti-Human HER2 Antibody,以10 μL PBA代替PE Anti-Human HER2 Antibody作为阴性对照管,4 ℃或者冰上孵育0.5~1 h。200 g离心5 min,弃上清,加入1 mL PBS离心洗涤2次以除去未结合的抗体。以500 μL PBS重悬细胞,吹打混匀置于流式管,应用流式细胞仪FACS Calibur进行检测,FlowJo 7.2.5软件分析试验结果。
1.3.3.1.2 不同HER2+靶细胞的免疫荧光检测按“1.3.3.1.1”项的方法对贴壁的HER2+细胞进行流式标记后,以甲醇750 μL和乙酸250 μL作为固定液,固定细胞10 min。取1 mL Hoechst 33258染料对细胞核进行染色10 min后,用荧光显微镜观察细胞染色情况。
1.3.3.1.3 不同HER2+靶细胞的ADCC活性测定分别以表达HER2+的人乳腺癌细胞SKBR3、BT474及MCF7细胞作为靶细胞,按“1.3.2”项方法进行ADCC活性测定。
1.3.3.2 抗体浓度范围的选择设定抗HER2单抗的起始工作质量浓度分别为5 000、4 000、3 000 ng·mL-1,用稀释液分别按照1:5、1:4、1:3的梯度稀释,按“1.3.2”项方法进行ADCC活性测定。
1.3.3.3 效靶比的选择固定效应细胞数量(3×106个·mL-1),以改变靶细胞数量的方式分别设定效靶比为3:1、6:1、10:1、15:1、30:1及45:1,按“1.3.2”项方法进行ADCC活性测定。
1.3.3.4 诱导时间的选择分别设定诱导时间为3、5、7、9、20、24、48和72 h,按“1.3.2”项方法进行ADCC活性测定。
1.3.4 方法学验证 1.3.4.1 专属性试验 1.3.4.1.1 靶细胞专属性以HER2-的L929细胞及稀释液代替SKBR3细胞,按“1.3.2”项方法进行ADCC活性测定。
1.3.4.1.2 效应细胞专属性以未转染hFcγRⅢa-NFAT的Jurkat细胞及稀释液代替Jurkat-hFcγRⅢa-NFAT细胞,按“1.3.2”项方法进行ADCC活性测定。
1.3.4.1.3 抗体专属性以抗CD25单抗及稀释液代替抗HER2单抗,按“1.3.2”项方法进行ADCC活性测定。
1.3.4.2 精密性试验以稀释液稀释抗HER2单抗至起始工作质量浓度为4 000 ng·mL-1的稀释样品,每次平行试验3块板,在不同时间点(3 d)按“1.3.2”项方法各检测1次。通过对最大FI值及半数有效浓度(EC50)的统计,计算其板间及日间RSD,验证该方法的精密性。
1.3.4.3 准确性试验以稀释液稀释抗HER2单抗制备起始工作质量浓度分别为4 000 ng·mL-1的50%、75%、100%、125%及150%样品,每个浓度样品按“1.3.2”项方法重复检测3次。以100%样品作为参比品,根据各浓度样品的EC50值计算相对效价,相对效价=参比品EC50 /样品EC50×100%;并计算回收率,回收率=相对效价测定值/相对效价理论值×100%。通过对相对效价和回收率的计算,验证该方法的准确性。
1.3.5 方法应用 1.3.5.1 检测不同类型的抗HER2单抗的ADCC活性以原研抗HER2单抗为参比品,选取不同类型的抗HER2单抗1、单抗2,运用优化后的报告基因法,按“1.3.2”项方法分别进行3次独立检测,测定针对该靶点不同类型的单抗类药物的ADCC活性。
1.3.5.2 检测不同变性程度的抗HER2单抗的ADCC活性 1.3.5.2.1 酶切变性试验将蛋白酶IdeS与抗HER2单抗以质量比例1:50混合,于37 ℃孵育1 h。采用SEC-HPLC分析蛋白结构是否改变,并按“1.3.2”项方法进行ADCC活性测定。采用Waters 2695 HPLC系统、2487紫外检测器、TSK-gel G3000SWXL(7.8 cm×300 mm,5 μm)色谱柱进行检测。检测条件:流动相为0.2 mol·L-1磷酸氢二钾-0.25 mol·L-1氯化钾,流速0.5 mL·min-1,进样量20 μL,进样器温度5 ℃,柱温25 ℃,在280 nm处检测,利用Waters Millennium 32分析软件按面积归一化法计算主峰面积百分比。
1.3.5.2.2 热稳定性试验将抗HER2单抗置于水浴锅中恒温65 ℃加热1、2、3 d,分别收集3 d的样品,采用SEC-HPLC法测定蛋白变性程度,并按“1.3.2”项方法进行ADCC活性测定。
2 结果 2.1 Jurkat-hFcγRⅢa-NFAT细胞株的构建转染24 h或48 h后加入筛选压力,单转pcDNA3.1-hFcγRⅢa的选择压力剂为G418,筛选质量浓度为500 μg·mL-1,细胞活力恢复后进行有限稀释铺96孔板,即每孔1~2个细胞,15 d左右进行鉴定。对于细胞表面的hFcγRⅢa分子,采用流式分析(FACS)的方法进行克隆鉴定和筛选,如图 1。筛选出表达高的单克隆进行扩大培养,然后转染另一质粒。单转pcDNA3.1-NFAT-RE-luc的选择压力剂为嘌呤霉素,筛选质量浓度为1.0 μg·mL-1,通过NFAT通路激活因子PMA和离子霉素共刺激的方法检测NFAT-RE-luc报告基因信号高的克隆,活率开始恢复后有限稀释铺96孔板,最后按“1.3.2”项ADCC活性测定方法进行鉴定。

|
图 1 Jurkat-hFcγRⅢa-NFAT细胞克隆的hFcγRⅢa流式表达检测结果 Figure 1 Clone expression level of Jurkat-hFcγRⅢa-NFAT cells analyzed by FACS |
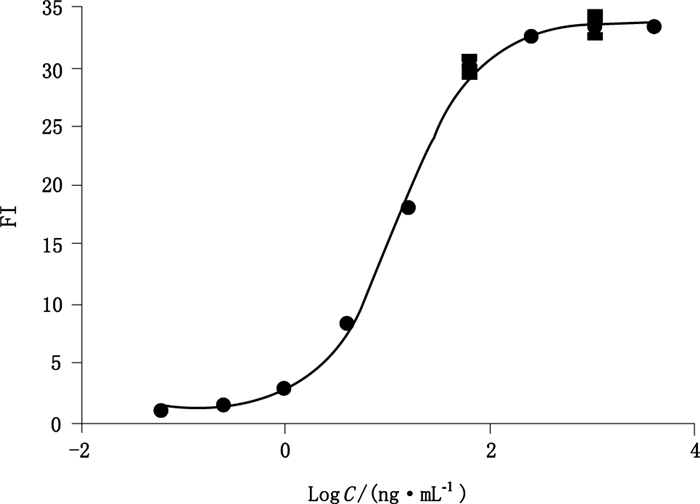
利用GraphPad Prism 6软件分析试验数据,以抗HER单抗浓度对数为x轴,对应的FI值为y轴,选用四参数方程回归模型,拟合抗HER2单抗的剂量效应曲线。所得数据经GraphPad Prism 6软件分析,符合四参数方程式:y=(A-D)/[1+(x/C)B]+D,在半对数坐标轴上呈典型的S型曲线,R2 > 0.99,如图 2,EC50为13.27 ng·mL-1。
|
图 2 建立抗HER2单抗的ADCC剂量效应曲线 Figure 2 ADCC dose-response curve of anti-HER2 mAb |
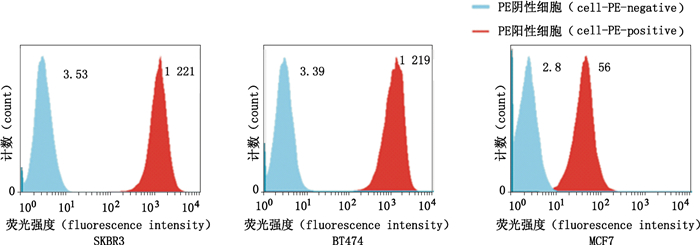
流式细胞术检测人乳腺癌细胞系SKBR3、BT474及MCF7表面HER2表达量差异结果如图 3,经FlowJo 7.2.5软件分析可知,这3株细胞表面HER2蛋白的表达量高低为SKBR3 > BT474 > MCF7。ADCC试验成功的重要条件之一就是特异的HER2+靶细胞,在这几个HER2+细胞株中,SKBR3和BT474表面均高表达HER2抗原,明显优于MCF7。
|
图 3 流式检测3株不同HER2+靶细胞表面的HER2表达量 Figure 3 FACS analysis for HER2 expression of three groups of different HER2+ cells |
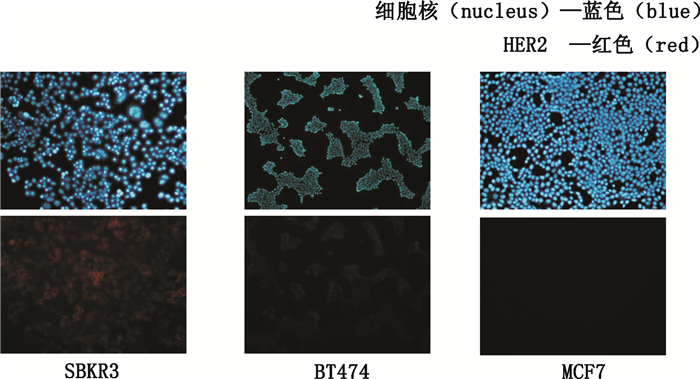
免疫荧光试验检测人乳腺癌细胞系SKBR3、BT474及MCF7表面HER2表达量差异结果如图 4。与流式细胞术检测结果一致,SKBR3、BT474表面红色荧光强于MCF7细胞,证明HER2高表达。
|
图 4 免疫荧光试验检测3株不同HER2+靶细胞表面的HER2表达量 Figure 4 Immunofluorescent assay showed HER2 expression of three groups of different HER2+ cells |
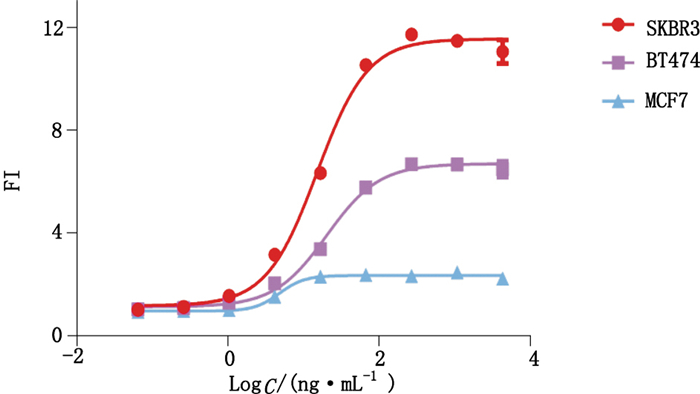
分别以HER2+的人乳腺癌细胞系SKBR3、BT474及MCF7作为靶细胞,按“1.3.2”项方法进行ADCC活性测定,结果见图 5。由试验结果可知,上述3种表达HER2分子的人乳腺癌细胞,均可作为抗HER2单抗介导ADCC生物学活性的靶细胞,其中SKBR3细胞呈现更好的剂量效应曲线,最大FI值达11.56,分别为BT474细胞和MCF7细胞的1.726倍和4.951倍。
|
图 5 利用报告基因法比较3株不同HER2+靶细胞的ADCC效应 Figure 5 The dose-response curves of three groups of different HER2+ target cells |
综上试验结果,SKBR3细胞表面高表达HER2抗原,同时与BT474细胞相比,其能呈现更好的ADCC剂量效应曲线,最终选择SKBR3细胞作为靶细胞。
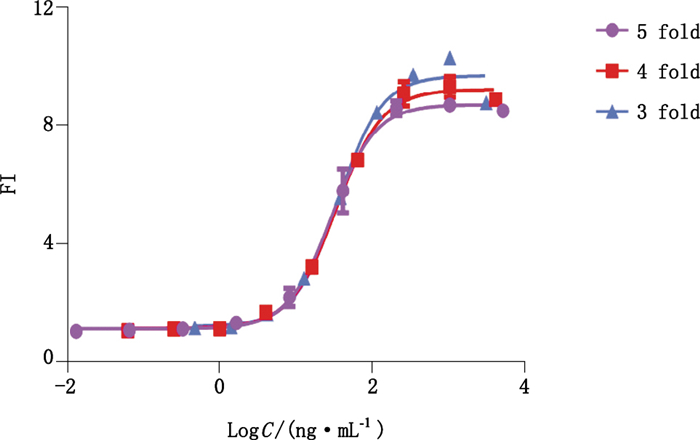
2.3.2 抗体浓度范围的选择设定抗HER2单抗的起始工作质量浓度分别为5 000、4 000、3 000 ng·mL-1,再分别按照1:5、1:4、1:3的梯度进行稀释,共设9个稀释度,按“1.3.2”项方法进行ADCC活性测定,结果见图 6。基于保证剂量效应四参数曲线平台及保证诱导效果的考虑,最终选择起始稀释工作浓度为4 000 ng·mL-1,1:4梯度稀释作为检测抗HER2单抗ADCC生物学活性时的试验方案。
|
图 6 3组不同稀释度的效应曲线 Figure 6 The dose-response curves of three different diluting multiple |
固定效应细胞数量(3×106个·mL-1),调整靶细胞数量使效靶比分别为3:1、6:1、10:1、15:1、30:1及45:1进行检测,共6组,按“1.3.2”项方法进行ADCC活性测定,结果见图 7。从不同效靶比得到的不同ADCC试验FI值并结合考虑EC50值,效靶比为15:1时能有效诱导ADCC活性并得到最大的FI值。

|
图 7 6组不同效靶比的效应曲线 Figure 7 The dose-response curves of FI with six different ratio of effectorcells over target cells |
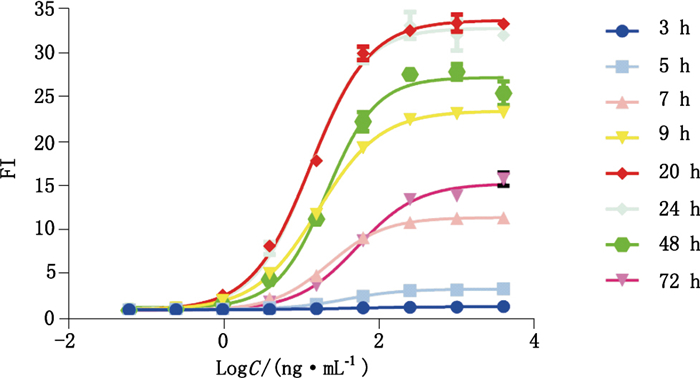
改变加入靶细胞、抗HER2单抗及效应细胞后的诱导时间,设立3、5、7、9、20、24、48及72 h共8个时间点,按“1.3.2”项方法进行ADCC活性测定,结果见图 8。ADCC诱导倍数随着不同诱导时间变化明显,当诱导时间为20和24 h时可得到较大诱导倍数,考虑到工作效率等因素,选择诱导时间为20 h。
|
图 8 8组不同诱导时间的效应曲线 Figure 8 The dose-response curves under eight different induction durations |
共设立6组对照,分别为:
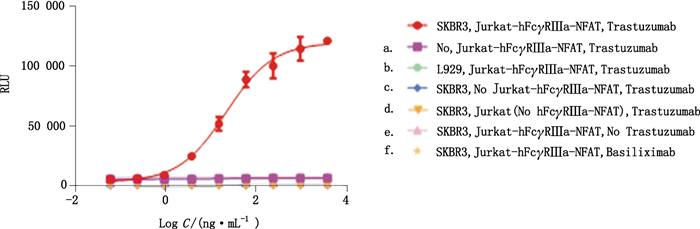
靶细胞专属性:a.稀释液+效应细胞+抗HER2单抗;b. L929细胞(HER2-)+效应细胞+抗HER2单抗;效应细胞专属性:c.靶细胞+稀释液+抗HER2单抗;d.靶细胞+Jurkat细胞(FcγRⅢa-;NFAT-luc-)+抗HER2单抗;抗体专属性:e.靶细胞+效应细胞+稀释液;f.靶细胞+效应细胞+抗CD25单抗。按“1.3.2”项方法进行ADCC活性测定,结果见图 9。只有当实验体系中同时存在专属的靶细胞、效应细胞及抗体时,才能获得良好的ADCC剂量效应曲线。
|
图 9 抗HER2单抗ADCC报告基因法的专属性验证 Figure 9 The specificity results of anti-HER2 mAb ADCC |
利用优化后的条件进行3次独立检测,每次平行试验3块板,得到最大FI值及EC50值如表 1。最大FI值的板间RSD在1.10%~8.76%之间,日间RSD为5.69%,RSD均小于10%;EC50值的板间RSD在1.50%~8.30%之间,日间RSD为5.34%,说明本方法具有良好的精密性。
|
|
表 1 抗HER2单抗ADCC报告基因法的精密性验证(n=3) Table 1 The precision results of anti-HER2 mAb ADCC |
制备50%、75%、100%、125%及150%回收率样品,重复检测3次,结果见表 2。4组回收率样品的相对效价平均值分别为(46.27±2.01)%、(71.18±1.55)%、(133.17±9.91)%以及(166.55±15.73)%;对应回收率分别为(92.53±4.01)%、(94.91±2.07)%、(106.54±7.93)%、(111.04±10.48),RSD均小于10%。分别以4组回收率样品的相对效价理论值与实测值进行直线回归分析,相关系数为0.997 9,线性拟合较好,表明该方法的准确性较好。
|
|
表 2 抗HER2单抗ADCC报告基因法的准确性验证(n=4) Table 2 The accuracy results of anti-HER2 mAb ADCC detection |
以原研HER2单抗为参比品,选取不同类型的抗HER2单抗1、单抗2,运用优化后的报告基因法,分别进行3次ADCC活性测定,其中1次结果如图 10。单抗1作用于HER2胞外的第2个结构域,主要通过阻断HER2的二聚化发挥其抗肿瘤效应。单抗2是针对HER2靶点的新型抗体-药物偶联物(antibody drug conjugates,ADC),其不仅具有原研抗HER2单抗类似的生物学活性,还能通过其偶联的化学药物的释放特异性地杀伤肿瘤细胞。从实验结果看出,不同类型的HER2单抗在本实验中均呈现较好的剂量效应曲线,说明本方法可应用于不同类型HER2靶点单抗ADCC效应的比较。

|
图 10 不同类型HER2靶点的单克隆抗体类药物的ADCC效应曲线 Figure 10 The dose-response curves of different classes of anti-HER2 mAbs |
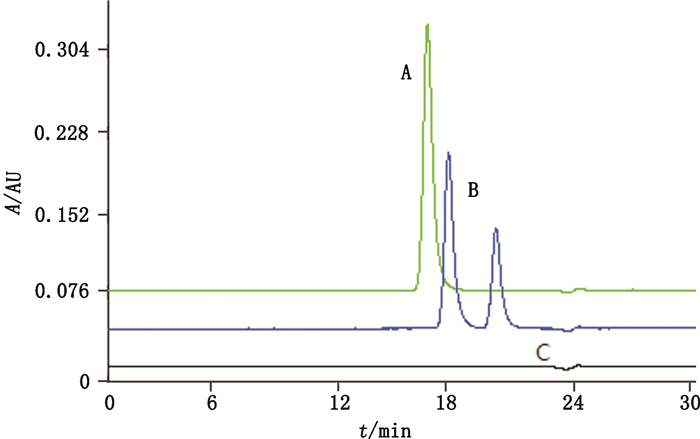
将酶切完全的抗HER2单抗进行SEC-HPLC分析结果如图 11,对照单抗样本的出峰时间在16 min附近,变性后的样本其单体峰消失,变为2个碎片峰,出峰时间分别为17.277 min和19.744 min,说明单抗结构被完全破坏。将抗HER2单抗、变性样本、Ides酶预稀释后进行ADCC试验得到的活性测定结果如图 12,作为阳性对照的抗HER2单抗能呈现良好的剂量效应曲线,作为阴性对照的Ides酶没有ADCC活性,变性后的样本丧失ADCC活性,证明了该方法的可靠性。
|
A. anti-HER2 mAb B. denatured anti-HER2 mAb C. Ides 图 11 SEC-HPLC检测抗HER2单抗及变性抗HER2单抗 Figure 11 Size exclusion HPLC results of anti-HER2 mAb vs. denatured anti-HER2 mAb |
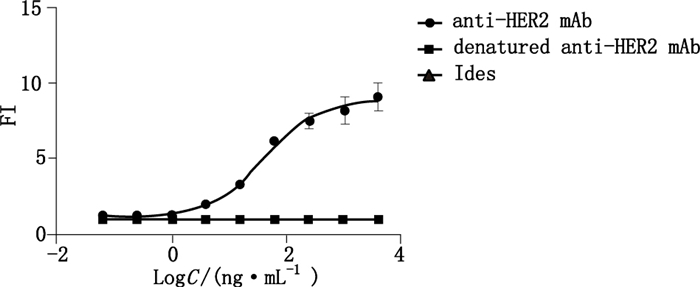
|
图 12 抗HER2单抗、变性抗HER2单抗及Ides的ADCC效应曲线 Figure 12 The dose-response curves between anti-HER2 mAb, denatured anti-HER2 mAb and Ides |
对抗HER2单抗进行65 ℃恒温水浴加热1、2、3 d后得到不同变性程度的样本,对样本进行SEC-HPLC分析,进行峰面积积分可发现,随着加热时间的增加,单抗中单体的比例相应减少,分别为67.98%、58.26%、41.67%。同时以未加热变性的样品作为参比品,对样本进行ADCC活性测定,其相对生物活性学分别为66.38%、60.05%、48.51%,结果如图 13。从这2组数据可看出,随着单体含量的减少,其ADCC生物学活性也相应降低,将这2组数据进行线性拟合,R2=0.985 9,拟合较好,证明了该ADCC试验方法能有效检测出由于热变性引起的抗体活性丧失,进一步证明了该试验方法的可靠性。

|
图 13 抗体热变性程度与ADCC效应关系 Figure 13 The relation between heat degradation level of mAb and ADCC potency |
曲妥珠单抗已被我国批准用于乳腺癌和胃癌的治疗,它在临床应用中表现出了良好的疗效,显著增加和提高了HER2+患者的生存期和生活质量,对相关恶性肿瘤的治疗具有里程碑意义。同时作为重磅炸弹药物之一,曲妥珠单抗2014年的全球销售额超过50亿美元,居于全球处方药销售前10位,具有广阔的市场前景。目前,曲妥珠单抗的专利失效期临近,由于其具有巨大的经济和社会效益,它已成为我国制药企业研发的热点,多家药企开展了针对该单抗的仿制和申报工作。同时针对HER2靶点的曲妥珠治疗失败后的进口二线抗体类治疗药物帕妥珠,虽然未在我国上市,但已在我国进行临床注册检验,未来也将应用于乳腺癌的临床治疗。只有不断完善药物质量控制标准,才能确保众多的抗HER2单抗药物的安全有效。
生物学活性测定是确保重组抗体有效性的重要质控指标。目前,测定抗HER2单抗的体外生物学活性的方法为细胞增殖抑制法,并未将ADCC活性测定方法纳入质控标准。而抗HER2单抗的ADCC活性也是其发挥生物学效应的重要因素,它对癌细胞的杀伤具有重要意义。由于传统的ADCC活性测定方法均需利用PBMC或NK细胞作为效应细胞,该方法操作烦琐,变异大,且存在较高背景值,因此目前尚无稳定而可靠的ADCC活性检测方法。因此迫切需要建立稳定而可靠的方法对抗HER2单抗ADCC活性这一关键属性进行质量控制。
本文建立的抗HER2单抗ADCC生物学活性测定方法是利用经过基因工程改造的Jurkat细胞系,基于荧光素酶报告基因活性检测系统,通过生物发光读数定量测定细胞中的荧光素酶活性。抗HER2单抗经倍比稀释后,可以得到较好的S型剂量效应曲线。通过试验条件的优化,选择SKBR3作为靶细胞,单抗起始工作质量浓度为4 000 ng·mL-1,按照1:4倍进行梯度稀释;效靶比选择在15:1;诱导时间选择20 h。
方法学验证数据显示,只有同时具备带有表面HER2抗原的靶细胞、正确的特异性抗体及表达FcγRⅢa的效应细胞时才会获得ADCC良好应答,其中任一缺失都不能产生应答。日间和板间的精密度及准确性试验证明该方法的重现性好,变异度小。通过多次试验发现,最大FI值及EC50值受效应细胞试验前的培养密度及细胞活率、试验用缓冲液、孵育条件等因素影响,因此为保证试验结果的一致性,因尽量保证每次试验条件的一致性。为了保证能提供良好的信噪比,建议将靶细胞Jurkat-hFcγRⅢa-NFAT在试验前调整至最佳密度1.2×106~1.8×106个·mL-1、保证靶细胞维持良好的生长速率;同时采用1%BSA的无酚红的RPMI 1640作为稀释液,降低试验背景值;靶细胞Jurkat-hFcγRⅢa-NFAT接种前用PBS清洗,去除细胞表面的结合的血清IgG,利于测试抗体的结合。采用酶切及热变性的方法对抗HER2单抗样本进行不同程度的变性,实验证明本文所述的基于报告基因的检测方法能有效检测其ADCC活性的改变,且与蛋白变性程度有良好的一致性。综上,本文建议的ADCC活性检测方法,操作简便,专属性强,准确性高,精密度高,可作为抗HER2单抗ADCC生物学活性的常规检查方法。
单抗类药物所介导的ADCC活性与许多因素相关,如IgG Fc受体的类型、肿瘤细胞抗原及血清抗体水平、抗体的N-糖基化修饰异质性等。已有文献报道,ADCC活性与单抗制品的岩藻糖及唾液酸含量相关,与岩藻糖含量成正相关,与唾液酸含量成负相关。因此本方法可用于评价不同糖型HER2单抗。又由于不同制品的生产工艺不同,如生产用CHO细胞株的遗传背景不同、发酵条件的差异等,都会导致单抗制品的差异,从而影响其ADCC活性,导致药物疗效的不同。因此可通过本方法对单抗制品的ADCC活性进行检测,控制其工艺稳定性。本文利用优化后的方法对HER2靶点的几种不同类型的单抗类药物进行了ADCC活性检测,试验结果显示这几类单抗均能呈现良好的剂量效应曲线。单抗1结合于HER2胞外段的第2个结构域,其主要通过阻断HER2抗原的二聚化从而抑制其下游通路的激活来发挥抗肿瘤效应[12],它的ADCC功能尚未被报道。由于本文是运用曲妥珠的检测条件来对单抗1进行检测,所以通过进一步的试验条件优化能获得更准确的单抗1的测量窗口及EC50值。单抗2是一种新型ADC药物,ADC药物由单克隆抗体和强效毒性药物通过生物活性连接器偶联而成,是一种定点靶向癌细胞的强效抗癌药物,它不仅具有单抗药物的生物学活性,还能通过内化其偶联的小分子化学药物特异性的杀伤肿瘤细胞,发挥更强大的抗肿瘤效应[13-14]。目前ADC药物的ADCC效应也并不明确,由于ADC药物能促进HER2抗原的内化,在不同检测时间点由于靶细胞的状态不同将导致其表面HER2内化率的不同,可能会导致实验结果有波动,因此应通过进一步的实验探究ADC药物的ADCC活性的试验条件。综上,本文所述的基于报告基因的ADCC检测方法能用于检测针对HER2靶点的不同类型的抗体类药物,为该靶点的抗体药物的研发和质量控制提供了新思路。
| [1] |
CASTAGNOLI L, IORIO E, DUGO M, et al. Intratumor lactate levels reflect HER2 addiction status in HER2-positive breast cancer[J]. J Cell Physiol, 2019, 234(2): 1768. DOI:10.1002/jcp.27049 |
| [2] |
GERECKE KM, WYSS JM, KALAVANOVA I, et al. ErbB transmembrane tyrosine kinase receptors are differentially expressed throughout the adult rat central nervous system[J]. J Comp Neurol, 2001, 433(l): 86. |
| [3] |
XU ZH, FORD BD. Up regulation of erbB receptors in rat brain after middle cerebral arterial occlusion[J]. Neurosci Lett, 2005, 375(3): 181. DOI:10.1016/j.neulet.2004.11.039 |
| [4] |
汤沁, 丁倩, 林莉, 等. 针对HER2靶点的抗体药物研究与肿瘤靶向治疗[J]. 药学学报, 2012, 47(10): 1297. TANG Q, DING Q, LIN L, et al. Development of antibody drugs targeting against HER2 for cancer therapy[J]. Acta Pharm Sin, 2012, 47(10): 1297. |
| [5] |
JONATHAN DB, SALVATORE L, EMILIANO C, et al. PIK3CA oncogenic mutations represent a major mechanism of resistance to trastuzumab in HER2/neu overexpressing uterine serous carcinoma[J]. Brit J Cancer, 2015, 113(7): 1026. |
| [6] |
QI WW, LI XX, ZHAN YC, et al. Overexpression of Her-2 upregulates FoxM1 in gastric cancer[J]. Int J Mol Med, 2014, 33(6): 1531. DOI:10.3892/ijmm.2014.1732 |
| [7] |
乔杉杉, 王大业. 乳腺癌HER2基因的研究进展及其靶点治疗[J]. 首都医科大学学报, 2008, 29(1): 96. QIAO SS, WANG DY. The progressive study of HER2 gene and target therapy in breast cancer[J]. J Cap Med Univ, 2008, 29(1): 96. DOI:10.3969/j.issn.1006-7795.2008.01.025 |
| [8] |
CHENG ZJ, GARVIN D, PAGUIO A, et al. Development of a robust reporter-based ADCC assay with frozen, thaw-and-use cells to measure Fc effector function of therapeutic antibodies[J]. J Immunol Methods, 2014, 18(9): 69. |
| [9] |
MILLER AS, TEJADA ML, GAZZANO SH. Methods for measuring antibody-dependent cell-mediated cytotoxicity in vitro[J]. Methods Mol Biol, 2014, 11(34): 59. |
| [10] |
MATA MM, MAHMOOD F, SOWELL RT, et al. Effects of cryopreservation on effector cells for antibody dependent cell-mediated cytotoxicity (ADCC) and natural killer (NK) cell activity in (51)Cr-release and CD107a assays[J]. J Immunol Methods, 2014, 40(6): 1. |
| [11] |
PAREKH BS, BERGER E, SIBLEY S, et al. Development and validation of an antibody-dependent cell-mediated cytotoxicity-reporter gene assay[J]. MAbs, 2012, 4(3): 310. DOI:10.4161/mabs.19873 |
| [12] |
ALVARE RH. Present and future evolution of advanced breast cancer therapy[J]. Breast Cancer Res, 2010, 12(1): 68. |
| [13] |
LEWIS PHILLIPS GD, LI GM, DUGGER DL, et al. Targeting HER-2-positive breast cancer with trastuzumab-DM1, an antibody-cytotoxic drug conjugate[J]. Cancer Res, 2008, 68(22): 9280. DOI:10.1158/0008-5472.CAN-08-1776 |
| [14] |
JUNTTILA TT, LI G, PARSONS K, et al. Trastuzumab-DM1(T-DM1) retains all the mechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer[J]. Breast Cancer Res Treat, 2011, 128(2): 347. |
 2019, Vol. 39
2019, Vol. 39 
