近年来抗体类生物治疗药物因其与靶抗原结合的特异性、有效性和安全性等特点,在临床恶性肿瘤、心血管疾病和自身免疫病等重大疾病中取得了快速发展,已经成为近年来研究的热门药物之一[1-2]。抗体药物的活性测定反映了其临床应用的体内效力,是抗体药物质量控制的重要指标。目前抗体药物的活性测定主要是在体外建立相应的细胞评价模型,模拟其作用机制,产生客观的全程量效反应,并通过与活性标准品的比较对其生物学活性进行评价[3]。近年来,转基因细胞技术和一些新技术也被应用于抗体类药物的活性测定。本文建立的均相时间分辨荧光(HTRF)技术即为其中之一。
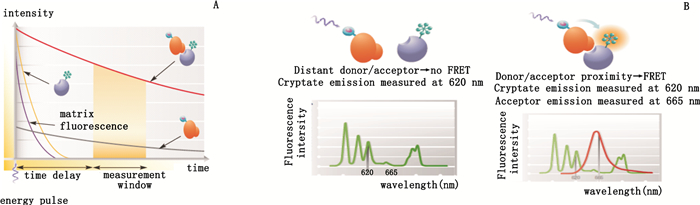
HTRF技术是在时间分辨荧光共振能量转移理论基础上建立的,结合了时间分辨荧光(time-resolved fluorescence,TRF)和荧光共振能量转移(fluorescence resonance energy transfer,FRET)2种技术原理。TRF技术利用稀土元素中镧系元素的独特性质,其荧光比普通荧光持续时间更长,普通荧光的半衰期为纳秒级,镧系元素的半衰期是毫秒级,有6个数量级的差别[4]。所以,在检测时,每个激发光脉冲过后,通过时间延缓期,让短寿命的荧光衰变掉后,再记录稀土螯合物的荧光强度,几乎可以完全消除背景荧光的干扰,提高灵敏度,反映样品的实际情况(图 1-A,Cisbio公司提供)。FRET技术(图 1-B,Cisbio公司提供)利用了2种荧光基团的能量转移,这2种荧光基团分别称为能量供体和能量受体。能量供体被外来光源激发(例如氙灯或激光),如果它与受体比较接近,可以将能量共振转移到受体上,使受体受到激发,发出特定波长的发射光[5-6]。当供体和受体分别与相互作用的2个生物分子结合,生物分子的结合可以将能量供体和受体拉到足够近的距离,产生能量转移。由于受体的发射光来自于能量转移,所以实验中不需要将未结合与已结合的分子分开,即不需要洗涤步骤,大大减少了实验操作步骤。
|
图 1 TRF技术(A)及FRET技术(B)的原理 Figure 1 Principles of TRF technique(A) and FRET technique(B) |
HTRF的能量供体是铕(Eu)和铽(Tb)的穴状化合物,在这个穴状化合物里,Eu和Tb被永久地嵌合在1个笼子里,结构非常稳定,对温度、pH、金属离子、螯合物等耐受性极强。HTRF的能量受体也有2种,交联别藻蓝蛋白(cross-linked APC,商品名XL665)和小分子荧光探针d2,它们的光学性质相同,相对分子质量不同。前者相对分子质量为1.05×105,实际上就是改良过的别藻蓝蛋白(APC);后者相对分子质量较小,约为1×103,可减少空间位阻对实验的可能影响。本实验中选定铽(Tb)为能量供体,d2为能量受体。
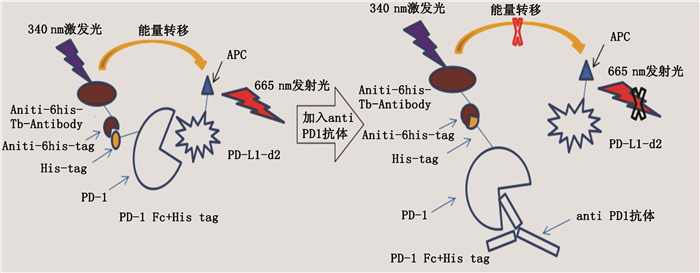
基于以上原理,使得HTRF技术具有可有效去除背景荧光,操作简单,体系稳定等优点[7-9]。故本研究利用此技术建立一种快速、简便测定以程序性死亡因子(PD-1)/程序性死亡因子受体(PD-L1)为靶点的单抗药物活性的分析方法,具体原理见示意图 2(Cisbio公司提供)。
|
图 2 HTRF法检测PD-1/PD-L1的原理 Figure 2 The principle of detecting PD-1/PD-L1 by HTRF method |
Envision多功能酶标仪,PerkinElmer公司产品。
1.1.2 供试品及主要试剂抗PD-1单抗参比品和供试品、抗PD-L1单抗供试品、抗RANKL单抗供试品、抗CTLA-4单抗供试品均为中国食品药品检定研究院单克隆抗体产品室留存。
Human PD1/PDCD1 Protein(His Tag),货号10377-H08H;Human PD-L1/B7-H1/CD274 Protein(Fc Tag),货号10084-H02H,均为Sino Biologcal公司产品。Anti-6his-Tb和d2 labeling kit及96半孔板均为Cisbio公司产品;其他试剂为进口或国产分析纯。
1.2 方法 1.2.1 Human PD-L1 Protein的标记按照d2 labeling kit说明书进行操作。用50 mmol·L-1的碳酸盐缓冲液(用800 mL超纯水溶解1.5 g碳酸钠和2.9 g碳酸氢钠,调pH 9.0后定容至1 000 mL)置换PD-L1蛋白的反应体系,得到16.67 μmol·L-1的蛋白溶液。将此溶液100 μL加入d2荧光受体的染料瓶中,室温孵育45 min。用NAP-5的分子筛柱子进行纯化,上样后先用600 μL洗脱剂(100 mmol·L-1磷酸盐缓冲液,pH 7.2)进行洗脱不收集,再加入400 μL洗脱剂进行洗脱,收集洗脱液即为标记后PD-L1-d2蛋白,用于测定蛋白浓度。
1.2.2 HTRF法测定抗PD-1/PD-L1单抗活性用稀释液(0.1% BSA PBST)将抗PD-1/PD-L1单抗供试品稀释至20 μg·mL-1,再进行1.8倍比稀释,共制备11个梯度,质量浓度分别为20.00、11.11、6.17、3.43、1.91、1.06、0.59、0.33、0.18、0.10、0.06 μg·mL-1,即得供试品溶液;用反应缓冲液(0.1% BSA PBST)稀释Human PD1/PDCD1 Protein(His Tag)至2.64 μg·mL-1,稀释Anti-6his-Tb至300 ng·mL-1,稀释PD-L1-d2至6.4 μg·mL-1,即得各检测试剂;在96半孔板中,每孔5 μL加入供试品溶液,再将各个检测试剂每孔5 μL加入其中,空白对照孔不加入Human PD1/PDCD1 Protein和供试品,用反应缓冲液替代。室温震荡孵育3 h后读数,设置激发波长340 nm,在发射波长620 nm和665 nm处读取荧光值。读取荧光信号值后,用软件进行分析,以ΔF={[(A样品665 nm÷A样品620 nm)-(A空白665 nm÷A空白620 nm)]÷(A空白665 nm÷A空白620 nm)}×100值作为纵坐标,以单抗浓度对数为横坐标绘制四参数拟合曲线。
1.2.3 实验条件的优化在反应缓冲液(0.1% BSA PBST)中添加0.4 mol·L-1氟化钾进行检测,考察氟化钾对HTRF荧光值的影响。
1.2.4 方法学验证按照《生物制品质量控制分析方法验证技术审评一般原则》(GPH1-1),验证方法的专属性、精密性、准确性和线性。
1.2.4.1 专属性分别按“1.2.2”项下方法制备抗PD-1、PD-L1、细胞核因子κB受体活化因子配体(RANKL)、细胞毒性T细胞抗原-4(CTLA-4)的单抗供试品溶液进行实验,考察检测试剂是否与各单抗供试品反应,且呈浓度变化。
1.2.4.2 精密度(1)重复性:按优化后的实验条件,同一名分析人员对抗PD-1单抗参考品和供试品在相同条件下重复检测6次,测定供试品的相对效价并计算6次测定结果的RSD。(2)不同分析人员精密性:按优化后的实验条件,由2名不同分析人员对抗PD-1单抗参考品和供试品在相同条件下重复检测6次,测定供试品的相对效价并计算2名分析人员12次测定结果的RSD。
1.2.4.3 准确性制备抗PD-1单抗预稀释质量浓度分别为10、15、20、25、30 μg·mL-1的样品溶液,其相对结合活性的理论值分别为50%、75%、100%、125%、150%,按优化后的检测方法进行3次重复实验,分析不同浓度样品活性回收率。
1.2.4.4 线性以各浓度样品的理论相对活性为横坐标,以实际测得的相对活性的为纵坐标,进行线性拟合。
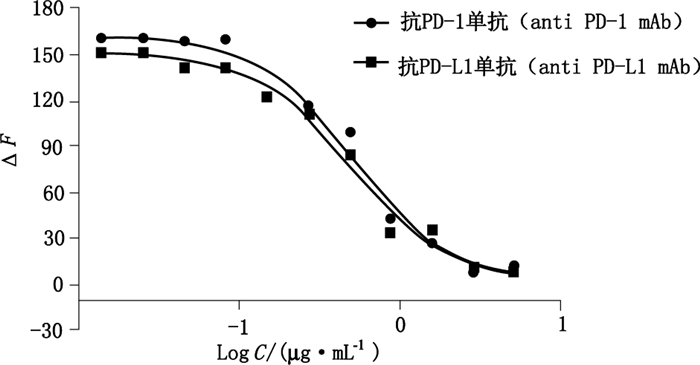
2 结果 2.1 HTRF测定抗PD-1/PD-L1单抗活性的剂量效应曲线利用GraphPad Prism 7软件分析实验数据,以抗PD-1/PD-L1单抗浓度对数为横坐标,对应的Delta F值为纵坐标,绘制四参数拟合曲线。抗PD-1/PD-L1单抗供试品均存在剂量依赖性,呈反S型剂量效应曲线见图 3。
|
图 3 抗PD-1/PD-L1单抗供试品剂量效应曲线 Figure 3 Dose-response curves of anti PD-1/PD-L1 mAb |
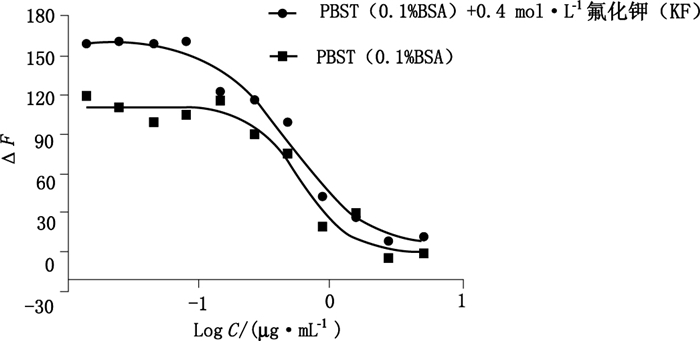
氟化钾是HTRF实验中荧光基团穴状化合物的保护剂,其对荧光值有显著的影响[10]。如图 4所示,反应缓冲液中添加0.4 mol·L-1的氟化钾可以提高荧光响应值。
|
图 4 氟化钾对反应值的影响 Figure 4 Effect of potassium fluoride on the assay window |
如图 5的结果表明:检测试剂只与抗PD-1/PD-L1单抗发生反应,并呈剂量依赖性,不与抗RANKL和抗CTLA-4单抗发生反应,说明本方法对抗PD-1/PD-L1单克隆抗体具有特异性,专属性符合要求。
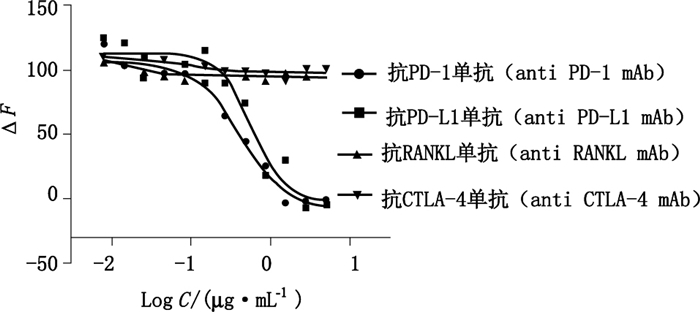
|
图 5 方法的专属性分析 Figure 5 Specificity analysis of the method |
由2名不同分析人员按优化后方法对抗PD-1单抗参比品和供试品进行检测,在相同条件下分别重复检测6次。如表 1结果所示,2名分析人员检测的相对效价范围为85%~117%,且总RSD小于15%。
|
|
表 1 方法的重复性及精密度分析 Table 1 Repeatability and accuracy analysis of the method |
方法准确性的结果如图 6所示,不同浓度样品单次回收率及平均回收率均在80%~120%之间,且3次重复结果的RSD≤15%,本方法准确性符合要求。
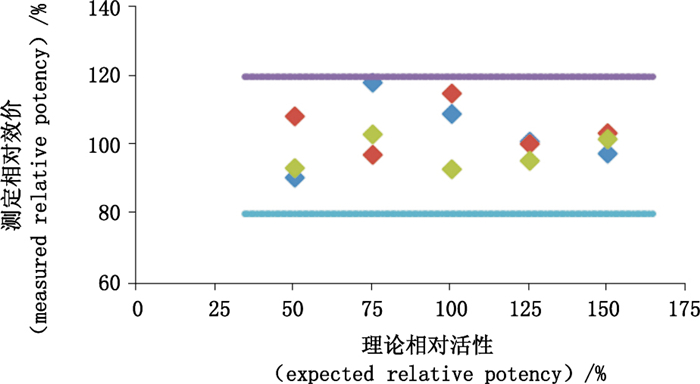
|
图 6 方法的准确性分析 Figure 6 Accuracy analysis of the method |
理论相对活性与实际测得的相对活性线性拟合图见图 7,线性方程y=0.996 6x-1.450 8,线性方程的斜率0.996 6,相关系数R2=0.993 2。线性方程的相关系数R2≥0.95,斜率接近1.0,本方法的线性符合要求。
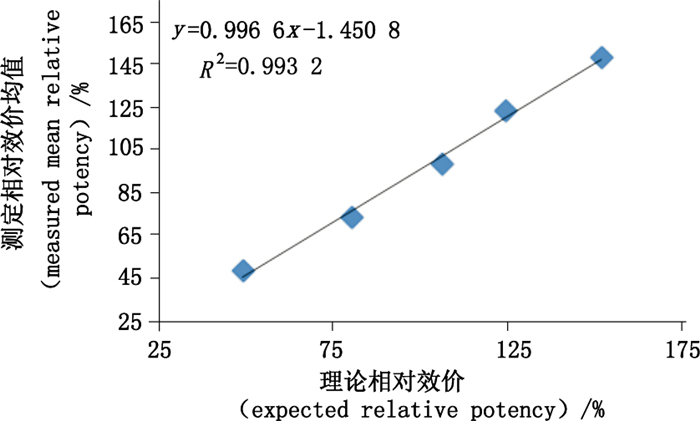
|
图 7 方法的线性分析 Figure 7 Linearity analysis of the method |
HTRF技术继放射免疫、酶标免疫、化学发光、电化学发光之后成为一种更新、更灵敏的检测方法。由于它集合了酶标记技术、放射标记技术和同位素标记技术的优点[11-12],是用来检测纯液相体系中待测物的一种常用方法,也是用来研究药物靶标的理想平台[13-14]。HTRF技术凭借诸多优势越来越受到各领域科研工作者的关注。首先,操作步骤简单,不需要提前包被、封闭和洗板等诸多环节,可以极大地减少实验所需时间[15];其次,体系非常稳定,可以反复读板,抗干扰能力强;再次,假阳性率低,可去除产物自发荧光引起的背景,反映样品的实际情况;最后,应用灵活,荧光标记手段可以检测蛋白相互作用、配体受体结合、信号通路、酶学修饰等不同的生物模型。
本文构建的HTRF检测方法选择穴状化合物Tb为能量供体,d2为能量受体,当使用340 nm波长的光激发穴状化合物供体时,会发出620 nm波长的荧光,如果此时其与受体d2足够近,那么供体能量将会转移给受体,使得受体d2发出665 nm波长的荧光,将供体和受体分子分别标记到相互作用的2个分子上,分子结合后供体d2发出的荧光强度与形成的复合物的量成正比。成功地构建了抗PD-1/PD-L1单抗药物活性检测方法,其操作简便易行,专属性强,准确性和精密度良好,多次重复结果总RSD均小于15%,线性相关系数在0.99以上,满足测定的要求,可用于单抗药物的活性检测,也可以为其他单克隆抗体活性测定方法的建立提供参考。
| [1] |
王志明, 高健, 李耿. 治疗性单克隆抗体药物的现状及发展趋势[J]. 中国生物工程杂志, 2013, 33(6): 117. WANG ZM, GAO J, LI G. Current status and development trend of the therapeutic monoclonal antibody drugs[J]. China Biochnol, 2013, 33(6): 117. |
| [2] |
王兰, 朱磊, 高凯, 等. 单克隆抗体生物治疗药物研究进展[J]. 中国药学杂志, 2014, 49(23): 2058. WANG L, ZHU L, GAO K, et al. Progress of research and development of antibody -based therapeutics[J]. Chin Pharm J, 2014, 49(23): 2058. |
| [3] |
高凯, 陶磊, 王军志, 等. 重组抗体药物的质量控制[J]. 中国新药杂志, 2011, 20(19): 1849. GAO K, TAO L, WANG JZ, et al. Quality control for recombinant therapeutic antibodies[J]. Chin J New Drugs, 2011, 20(19): 1849. |
| [4] |
解肖鹏, 张雷. 时间分辨荧光免疫分析技术的研究进展[J]. 食品与药品, 2012, 14(5): 204. XIE XP, ZHANG L. Research development of time-resolved fluoroimmunoassay[J]. Food Drug, 2012, 14(5): 204. |
| [5] |
ENOMOTO K, NAGASAKI T, YAMAUCHI A, et al. Development of high throughput spemidine synthase activity assay homogeneous time resolved fluorescence[J]. Anal Biochem, 2006, 351(2): 229. DOI:10.1016/j.ab.2006.01.012 |
| [6] |
ENOMOTO K, OKAMOTO H, NUMATA D, et al. A simple and rapid assay for eparanase activity using homogeneous time-resolved fluorescence[J]. J Pharm Biomed Anal, 2006, 41(3): 912. DOI:10.1016/j.jpba.2006.01.032 |
| [7] |
DEGORCE F, CARD A, SOH S, et al. HTRF:a technology tailored for drug discovery-a review of theorrtical aspects and recent applications[J]. Curr Chem Genomics, 2009, 28(3): 22. |
| [8] |
GERARD M. HTRF technology[J]. J Biomol Screen, 1999, 4(6): 309. DOI:10.1177/108705719900400605 |
| [9] |
CLARKE E E, SHEARMAN MS. Quantitation of amyloid-beta peptides in biological milieu using a novel homogeneous time-resolved flurescence(HTRF) assay[J]. J Neurosci Methods, 2000, 102(1): 61. DOI:10.1016/S0165-0270(00)00280-6 |
| [10] |
王慧洁, 周子涵, 徐嘉辰, 等. 基于均相时间分辨荧光技术(HTRF)的HSP90-HOP相互作用抑制剂活性测定方法的构建及应用[J]. 药学学报, 2017, 52(4): 592. WANG HJ, ZHOU ZH, XU JC, et al. HTRF-based method for determination of HSP90-HOP inhibition activity and its application[J]. Acta Pharm Sin, 2017, 52(4): 592. |
| [11] |
王泽洲, 吴俊清, 张永宁, 等. 时间分辨荧光免疫分析技术的研究进展[J]. 四川畜牧兽医, 2015, 42(7): 34. WANG ZZ, WU JQ, ZHANG YN, et al. Research progress of iime-resolved fluoroimmunoassay technology[J]. Sichuan Anim Vet Sci, 2015, 42(7): 34. DOI:10.3969/j.issn.1001-8964.2015.07.015 |
| [12] |
梁菊, 陈攀, 吴文澜, 等. 荧光共振能量转移新技术及其在药物筛选中的应用[J]. 中国药学杂志, 2009, 44(13): 964. LIANG J, CHEN P, WU WL, et al. The new technology fluorescence resonance energy transfer and its application in drug screening[J]. Chin Pharm J, 2009, 44(13): 964. |
| [13] |
ROSSANT CJ, MATTHEWS C, NEAL F, et al. Versatility of homogeneous time-resolved fluorescence resonance energy transfer assays for biologics drug discovery[J]. J Biomol Screen, 2014, 11(7): 1. |
| [14] |
王兰, 徐刚领, 高凯, 等. 抗体类生物治疗药物活性测定方法[J]. 中国生物工程杂志, 2015, 35(6): 101. WANG L, XU GL, GAO K, et al. Determination of biological activity of antibody-based biotherapeutics[J]. China Biotechnol, 2015, 35(6): 101. |
| [15] |
邓春平, 秦玉敏, 邓巧春, 等. 均相时间分辨荧光(HTRF)法测定重组单抗含量[J]. 中国生物工程杂志, 2013, 33(12): 67. DENG CP, QIN YM, DENG QC, et al. Determination of the contents of recombinant monoclonal antibodies by homogeneous time-resolved fluorescence (HTRF) method[J]. China Biotechnol, 2013, 33(12): 67. |
 2019, Vol. 39
2019, Vol. 39 
