抗体类药物不但可通过其抗原结合片段(antigen binding fragment,Fab)结合抗原发挥生物学效应,而且可通过可结晶片段(crystallizable fragment,Fc段)发挥作用[1-3]。如单抗与靶细胞表面分子结合后,可介导补体1q(complement 1q,C1q)结合到抗体的Fc段发挥补体依赖的细胞毒效应(complement dependent cytotoxicity,CDC),重组抗CD20、CD52单抗即是通过测定免疫复合物活化补体产生细胞毒作用后B淋巴瘤细胞的死亡评价其生物学活性[4-6];Fc段也可以通过和不同的IgG Fc受体(crystallizable fragment gamma receptors,FcγRs)结合介导抗体依赖性细胞介导的细胞毒作用(antibody-dependent cell-mediated cytotoxicity,ADCC)和抗体依赖性细胞介导的吞噬作用(antibody-dependent cell-mediated phagocytosis,ADCP)。人类的FcγRs分为FcγRⅠ、FcγRⅡ、FcγRⅢ3类,其中FcγRⅠ是一种高亲和力Fc受体糖蛋白,多表达在骨髓细胞如单核细胞、巨噬细胞,与抗体Fc段结合后可激活信号传导,引起ADCP,是治疗性抗体通过天然免疫杀伤肿瘤细胞的重要作用机制[1, 3, 7-9]。
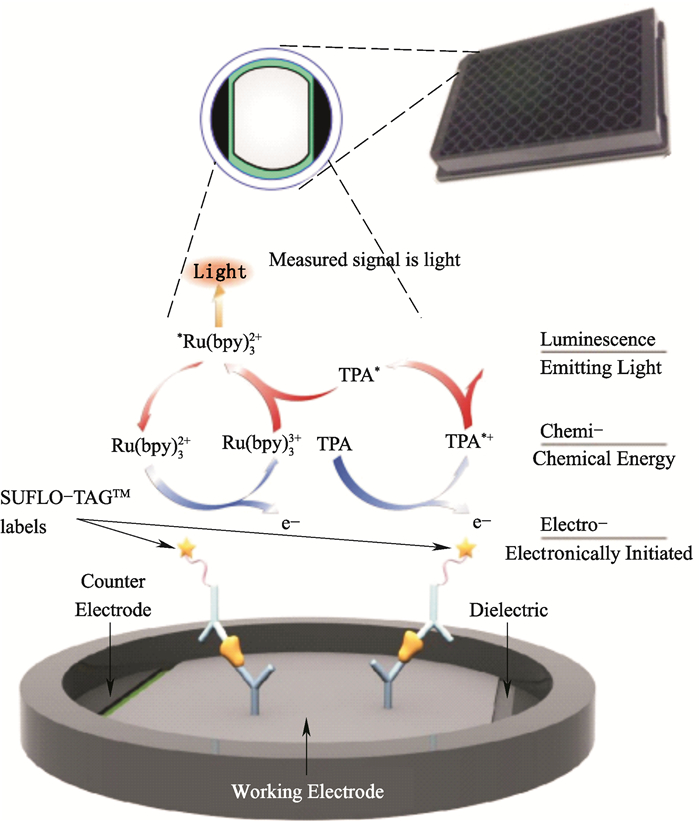
ECLI是将电化学发光和免疫测定相结合的一种标记免疫测定技术,基本原理为电化学发光剂标记的分子与靶分子在石墨电极板发生结合后,能够在电极表面由电化学引发特异性化学发光反应,光信号可用光学仪器测量,并通过电化学发光信号强度的改变,定量分析电化学发光剂标记的分子与靶分子的结合情况[10-14](图 1)。该方法具有线性范围宽,灵敏度高,背景低,样品用量少等优点,被广泛应用于细胞因子、免疫原性及药代动力学检测[15-16]。
|
图 1 ECLI的原理示意图(https://www.mesoscale.com/en/ technical_resources/our_technology/ecl) Figure 1 The principle sketch of ECLI(https://www.mesoscale.com/en/ technical_resources/our_technology/ecl) |
本研究利用ECLI平台建立了贝伐珠单抗与FcγRⅠ结合活性的测定方法,并评价了SBP候选物与FcγRⅠ的相对结合活性,为分析单抗与FcγRⅠ的结合活性提供了新的技术平台。
1 材料和方法 1.1 主要仪器和试药SECTOR S600 ECLI检测仪购自Meso Scale Discovery公司;FcγRⅠ-Biotin(CD64,货号10256-H27H-B)购自Sino Biological公司。MSD GOLD 96-Well Small Spot Streptavidin Plates(货号L45SA-5)、Read Buffer T(货号R92TC-2)、MSD GOLD SULFO-TAG NHS-Ester(货号R91AO-2)购自Meso Scale Discovery公司;磷酸盐缓冲液(PBS)购自Gibco公司,货号10010023;牛血清白蛋白(BSA)购自Amresco公司,货号0332;Tween 20(货号P1379)购自Sigma公司;封闭液为5%BSA/PBS;稀释液为1%BSA/PBS;洗涤液为0.05% Tween 20/PBS;羊F(ab’)2抗人IgG(Fab’)2(货号ab98531)购自Abcam公司。贝伐珠单抗RBP和贝伐珠单抗SBP候选药均为中国食品药品检定研究院单克隆抗体产品室留样。
1.2 方法 1.2.1 SULFO-TAG检测抗体的标记按照说明书在羊F(ab’)2抗人IgG(Fab’)2上标记SULFO-TAG作为检测抗体。
1.2.2 MSD法检测贝伐珠单抗与FcγRⅠ的结合MSD GOLD 96-Well Small Spot Streptavidin Plates每孔中加入封闭液150 μL,2~8 ℃孵育过夜,弃去封闭液;加入用1%BSA稀释的不同浓度的FcγRⅠ-Biotin,每孔25 μL,室温孵育2 h后用洗涤液清洗3次;再加入用1%BSA稀释的不同浓度的样品,每孔50 μL,室温震荡孵育1 h后用洗涤液清洗3次;最后每孔加入25 μL检测抗体,室温孵育1 h后用洗涤液清洗3次;每孔加入Read Buffer T 150 μL,上机检测读数。
1.2.3 方法优化初步优化包括(1)包被抗原浓度选择,将FcγRⅠ分别按0.1、0.3、1.0 μg·mL-1的浓度包被;(2)样品浓度选择2个点(20、2000 ng·mL-1);(3)检测抗体质量浓度为0.1、0.3、1.0、3.0 μg·mL-1。进一步优化的条件为0.1、0.3 μg·mL-1包被抗原分别与0.1、0.3 μg·mL-1检测抗体浓度的组合检测;贝伐珠单抗浓度以250 μg·mL-1为起始点,按5倍倍比梯度稀释11个浓度点(共12个浓度点)。
1.2.4 方法验证专属性验证以1%BSA代替样品进行检测。准确性验证以10 μg·mL-1的贝伐珠样品作为参比,分别制备起始质量浓度为5.0、7.5、10、12.5及15 μg·mL-1的贝伐珠样品,则其相对生物学活性理论值分别为50%、75%、100%、125%和150%。按照优化后的方法在3 d内进行试验,每个点做2个平行复孔,拟合四参数曲线方程,根据各样品的EC50值计算相对生物学活性和回收率;相对生物学活性测定值=(参比品EC50/样品EC50)×100%,回收率=(相对生物学活性测定值/相对生物学活性理论值)×100%。根据不同天的检测结果计算回收率的精密度。
1.2.5 贝伐珠单抗SBP候选药物和贝伐珠单抗RBP与FcγRⅠ结合能力的相似性分析采用优化好的方法测定12批贝伐珠单抗RBP和2家企业各3批贝伐珠单抗SBP候选药物与FcγRⅠ的结合能力,每板均带有同一参比品,所测得的贝伐珠单抗EC50值均与参比品EC50值进行比较,得出相对结合活性,用来比较与FcγRⅠ的结合能力。
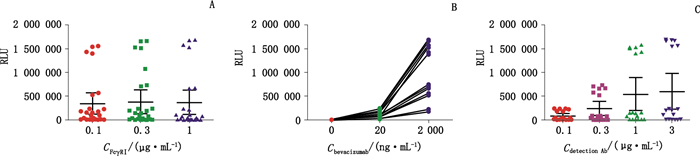
2 结果 2.1 方法优化将3个浓度(0.1、0.3、1.0 μg·mL-1)FcγRⅠ,3个浓度(0、20、2 000 ng·mL-1)贝伐珠单抗,4个浓度(0.1、0.3、1.0、3.0 μg·mL-1)检测抗体进行棋盘法组合检测。从图 2可见,3个FcγRⅠ包被质量浓度1.0、0.3、0.1 μg·mL-1的检测结果没有明显差异(图 2-A);0、20、2 000 ng·mL-1贝伐珠单抗的检测结果逐步增高,说明贝伐珠单抗在2 000 ng·mL-1仍未达到饱和(图 2-B),为进一步选择浓度点提供了参考依据。检测抗体为1.0和3.0 μg·mL-1时信号值没有明显差异,质量浓度在0.1、0.3、1.0 μg·mL-1时信号值逐步增高(图 2-C)。综合考虑信号值和使用的试剂量,初步选取FcγRⅠ包被质量浓度为0.1、0.3 μg·mL-1,检测抗体质量浓度为0.1、0.3 μg·mL-1用于试验条件的进一步优化。
|
A. FcγRⅠ包被浓度优化(optimization of FcγRⅠ coating concentration) B.贝伐珠单抗浓度摸索(exploration of bevacizumab concentration) C.检测抗体浓度优化(optimization of detection Ab concentration) 图 2 ECLI法测定FcγRⅠ与贝伐珠单抗结合活性的初步方法优化 Figure 2 Preliminary optimization of FcγRⅠ and bevacizumab binding activity by ECLI method |
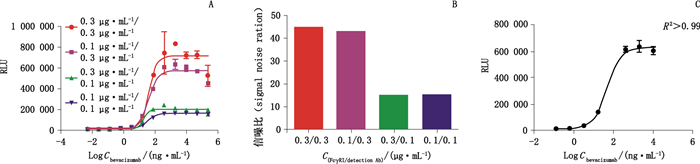
进一步优化时将贝伐珠单抗进行了梯度稀释,起始质量浓度为250 μg·mL-1,按5倍倍比梯度稀释11个浓度点(250~0.005 12 ng·mL-1),结果见图 3-A。可见4条拟合曲线R2均 > 0.95,当检测抗体浓度固定时,包被FcγRⅠ质量浓度分别为0.1、0.3 μg·mL-1,最大信号值和信噪比无明显差异;当FcγRⅠ包被浓度固定时,检测抗体质量浓度为0.3 μg·mL-1时的最大信号值和信噪比约为检测抗体质量浓度为0.1 μg·mL-1时的3倍,信噪比对比见图 3-B。从剂量反应曲线可见,所选择的浓度点涵盖了曲线的上平台,线性段和下平台,但高浓度和低浓度在上下平台均有2个多余的点。根据以上结果,确定如下参数,包被FcγR1质量浓度为0.1 μg·mL-1,每孔25 μL;样品初始质量浓度为10 μg·mL-1,5倍倍比稀释7个浓度点(共8个浓度点),每孔50 μL;检测抗体质量浓度为0.3 μg·mL-1,每孔25 μL。优化后结果如图 3-C,R2 > 0.99,线性段有4个浓度点,上下平台各2个浓度点,拟合优度和浓度点分布均符合预期。
|
A. FcγRⅠ/检测抗体浓度组合的优化(optimization of FcγRⅠ concentration and detection Ab combination) B. FcγRⅠ/检测抗体浓度4种组合的信噪比(signal noise ratio of four concentration combination of FcγRⅠ concentration and detection Ab) C.优化后的剂量反应曲线(dose-response curve after optimization) 图 3 ECLI法测定FcγRⅠ与贝伐珠单抗结合活性的进一步方法优化 Figure 3 Further optimization of FcγRⅠ and bevacizumab binding activity by ECLI method |
对所建立方法的准确度和精密性进行了初步方法学验证。以10 μg·mL-1的贝伐珠样品作为参比,分别制备了靶值为50%、75%、100%、125%和150%回收率样品,每天检测1次,连续检测3 d,结果见表 1。5组样品的相对效价平均值分别为(51.86±2.04)%、(77.79±6.13)%、(103.34±8.65)%、(126.39±4.33)%以及(142.84±6.34)%;对应回收率分别为(103.72±2.04)%、(103.72±6.13)%、(103.34±8.65)%、(101.11±4.33)%以及(95.23±6.34)%,回收率均在80%~120%之间。5组样品于3 d内检测的RSD均小于10%。以上结果表明该方法的准确性和日间精密度较好。
|
|
表 1 方法的准确度和精密性验证结果 Table 1 Validation results of accuracy and precision of the method |
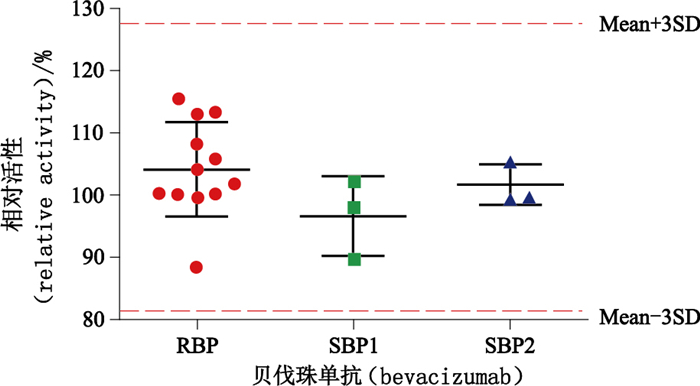
采用建立的方法测定了12批贝伐珠单抗RBP和2家企业各3批SBP候选药与FcγRⅠ的相对结合活性。由于贝伐珠单抗主要依靠其Fab段阻断可溶性血管内皮生长因子(vascular endothelial growth factor,VEGF)对血管内皮细胞增殖和迁移的促进作用,其Fc段与FcγRⅠ的结合不属于与临床机理对应的生物学活性,不需与RBP进行等效性检验,而采用了RBP检测结果的均值±3SD作为SBP相似性的判定范围。从图 4可见,与参比品比较,12批RBP的相对结合活性在88.30%~115.38%之间,平均值为104.63%,RSD为6.95%。企业1的3批SBP候选药相对结合活性分别为97.74%、102.17%、89.46%;企业2的3批SBP候选药相对结合活性分别为99.86%、99.45%、105.00%。可见企业1的相对结合活性均值与RBP差距较大,而企业2的相对结合活性均值与RBP差距较小,但2家企业的检测结果均在RBP检测结果的均值±3SD之间。
|
图 4 贝伐珠单抗RBP和SBP候选药与FcγRⅠ结合活性的相似性比较 Figure 4 Comparison of the binding activity of bevacizumab RBP and SBP candidates with FcγRⅠ |
本研究优化并建立了基于ECLI技术检测IgG与FcγRⅠ结合活性的方法,即使用SA预包被的MSD板,FcγRⅠ- Biotin的包被质量浓度为0.1 μg·mL-1,每孔25 μL;样品初始质量浓度为10 μg·mL-1,5倍比梯度稀释7个浓度点(共8个浓度点),每孔50 μL;检测抗体质量浓度为0.3 μg·mL-1,每孔25 μL。所测得的剂量反应曲线拟合度较好,浓度点分布较合理;经初步验证,方法的准确性和精密度也较好。目前检测单抗与FcγR结合主要采用SPR方法,亲和力以结合常数表示[17-18],其试验过程较复杂,检测通量低,检测灵敏度为nmol·L-1级,且需要纯化的蛋白进行试验,另外,在检测高亲和力分子之间的亲和力时,由于解离较慢,可能会导致结果不准确。ECLI技术可采用96孔板进行试验和检测,操作简单,通量高;结果以剂量反应曲线表示,展示了单抗与FcγRⅠ的生物学结合特性;其灵敏度可达nmol·L-1甚至fmol·L-1级,准确性较高,线性范围可达106,且具有良好的抗基质作用,可使用前期未经纯化的抗体直接检测,将Fc功能评价阶段提前,是结合活性检测的一种有力方法[19-20]。
治疗性单抗的糖基化程度、聚集状态等均能影响其与FcγR的结合活性,并可能进一步影响单抗的治疗作用。文献也显示单抗与FcγR的结合特性能反映糖基化程度与聚集状态的改变,如IgG单抗的297位天冬酰胺是糖基化的位点,该位点去糖基化后可使单抗与FcγR的结合减弱;单抗Fc段核心岩藻糖的缺失能使其与FcγRⅢ的结合增强而并不会使其与FcγRⅠ的结合增强[2, 21]。另外,FcγRⅠ主要与IgG单抗单体结合,如果单抗聚集,则结合活性下降。单抗稳定的糖基化图谱和聚体含量有赖于细胞株状态、培养基成分、培养条件、后续纯化、储存运输等一系列参数的严格控制,是工艺过程与储存运输过程稳定与否的反映。因此,单抗与FcγR的结合活性能间接反映单抗工艺和储存条件的稳定性。
FcγRs还包括FcγRⅡ、FcγRⅢ,根据胞浆区的结构不同,FcγRⅡ分为FcγRⅡA、FcγRⅡB和FcγRⅡC,与Fc段亲和力相对较低,有文献报道FcγRⅡA主要发挥ADCP效应;FcγRⅢ可分为FcγRⅢA和FcγRⅢB,有研究表明FcγRⅢA是介导单抗发挥ADCC效应的主要受体[8, 22]。活性测定是对抗体类药物有效成分和含量以及药物效价的测定,是确保药物有效性的重要质控指标,所以对于可能存在Fc效应子功能的单抗,评价其与FcγRⅡ和FcγRⅢ的结合活性也尤为重要。本文建立了单抗与FcγRⅠ结合活性的ECLI分析方法,后续将研究建立单抗与FcγRⅡ、FcγRⅢ结合能力的分析方法。另外,MSD还有U-plex技术平台,可以利用一系列特异性的连接子将多种FcγRs包被在检测孔中的不同位置,进而检测各分子与单抗Fc段的结合,该方法可以将Fc段与各FcγRs的结合在1次试验中完成,大大简化了试验过程,为测定单抗与FcγRs结合活性提供了一种新思路。
| [1] |
BRANDSMA AM, JACOBINO SR, MEYER S, et al. Fc receptor inside-out signaling and possible impact on antibody therapy[J]. Immunol Rev, 2015, 268(1): 74. DOI:10.1111/imr.12332 |
| [2] |
SWISHER JFA, FELDMAN GM. The many faces of FcγRⅠ:implications for therapeutic antibody function[J]. Immunol Rev, 2015, 268(1): 160. DOI:10.1111/imr.12334 |
| [3] |
BARNHART BC, QUIGLEY M. Role of Fc-FcγR interactions in the antitumor activity of therapeutic antibodies[J]. Immunol Cell Biol, 2017, 95(4): 340. DOI:10.1038/icb.2016.121 |
| [4] |
ZHUANG Y, XU W, SHEN Y, et al. Fcγ receptor polymorphisms and clinical efficacy of rituximab in non-hodgkin lymphoma and chronic lymphocytic leukemia[J]. Clin Lymphoma Myeloma Leuk, 2010, 10(5): 347. DOI:10.3816/CLML.2010.n.067 |
| [5] |
GABELLIER L, CARTRON G. Obinutuzumab for relapsed or refractory indolent non-Hodgkin's lymphomas[J]. Ther Adv Hematol, 2016, 7(2): 85. DOI:10.1177/2040620715622613 |
| [6] |
ELIAS S, KAHLON S, KOTZUR R, et al. Obinutuzumab activates FcγRⅠ more potently than other anti-CD20 antibodies in chronic lymphocytic leukemia (CLL)[J]. Oncoimmunology, 2018, 7(6): e1428158. DOI:10.1080/2162402X.2018.1428158 |
| [7] |
PINCETIC A, BOURNAZOS S, DILILLO DJ, et al. TypeⅠ and typeⅡ Fc receptors regulate innate and adaptive immunity[J]. Nat Immunol, 2014, 15(8): 707. DOI:10.1038/ni.2939 |
| [8] |
HARGREAVES CE, MJ R, MACHADO LR, et al. Fcγ receptors:genetic variation, function, and disease[J]. Immunol Rev, 2015, 268(1): 6. DOI:10.1111/imr.12341 |
| [9] |
YING C, YOU F, JIANG L, et al. Gene-modified NK-92MI cells expressing a chimeric CD16-BB-ζ or CD64-BB-ζ receptor exhibit enhanced cancer-killing ability in combination with therapeutic antibody[J]. Oncotarget, 2017, 8(23): 37128. |
| [10] |
ADCOCK JL, BARROW CJ, BARNETT NW, et al. Chemiluminescence and electrochemiluminescence detection of controlled drugs[J]. Drug Test Anal, 2011, 3(3): 145. DOI:10.1002/dta.236 |
| [11] |
WEI H, WANG E. Electrochemiluminescence of tris(2, 2 ' -bipyridyl)ruthenium and its applications in bioanalysis:a review[J]. Luminescence, 2011, 26(2): 77. DOI:10.1002/bio.v26.2 |
| [12] |
BERTONCELLO P, STEWART AJ, DENNANY L. Analytical applications of nanomaterials in electrogenerated chemiluminescence[J]. Anal Bioanal Chem, 2014, 406(23): 5573. DOI:10.1007/s00216-014-7946-x |
| [13] |
MUZYKA K. Current trends in the development of the electrochemiluminescent immunosensors[J]. Biosens Bioelectron, 2014, 54: 393. DOI:10.1016/j.bios.2013.11.011 |
| [14] |
GROSS EM, MADDIPATI SS, SNYDER SM. A review of electrogenerated chemiluminescent biosensors for assays in biological matrices[J]. Bioanalysis, 2016, 8(19): 2071. DOI:10.4155/bio-2016-0178 |
| [15] |
KEUSTERMANS GCE, HOEKS SBE, MEERDING JM, et al. Cytokine assays:an assessment of the preparation and treatment of blood and tissue samples[J]. Methods, 2013, 61(1): 10. DOI:10.1016/j.ymeth.2013.04.005 |
| [16] |
PARTRIDGE MA, PURUSHOTHAMA S, ELANGO C, et al. Emerging technologies and generic assays for the detection of anti-drug antibodies[J]. J Immunol Res, 2016, 1. |
| [17] |
DORION-THIBAUDEAU J, RAYMOND C, LATTOV E, et al. Towards the development of a surface plasmon resonance assay to evaluate the glycosylation pattern of monoclonal antibodies using the extracellular domains of CD16a and CD64[J]. J Immunol Methods, 2014, 408: 24. DOI:10.1016/j.jim.2014.04.010 |
| [18] |
DORION-THIBAUDEAU J, DUROCHER Y, DE CRESCENZO G. Quantification and simultaneous evaluation of the bioactivity of antibody produced in CHO cell culture—The use of the ectodomain of FcγRⅠ and surface plasmon resonance-based biosensor[J]. Molr Immunol, 2017, 82: 46. |
| [19] |
ESTEP P, REID F, NAUMAN C, et al. High throughput solution-based measurement of antibody-antigen affinity and epitope binning[J]. MAbs, 2013, 5(2): 270. DOI:10.4161/mabs.23049 |
| [20] |
DELLA DUCATA D, JAEHRLING J, HÄNEL C, et al. Solution equilibrium titration for high-throughput affinity estimation of unpurified antibodies and antibody fragments[J]. J Biomol Screen, 2015, 20(10): 1256. DOI:10.1177/1087057115595002 |
| [21] |
LU J, CHU J, ZOU Z, et al. Structure of FcγRⅠ in complex with Fc reveals the importance of glycan recognition for high-affinity IgG binding[J]. Proc Natl Acad Sci USA, 2015, 112(3): 833. DOI:10.1073/pnas.1418812112 |
| [22] |
BOURNAZOS S, RAVETCH JV. Diversification of IgG effector functions[J]. Int Immunol, 2017, 29(7): 303. DOI:10.1093/intimm/dxx025 |
 2019, Vol. 39
2019, Vol. 39 
