单克隆抗体类生物治疗产品是指含有抗体基因片段的蛋白药物,作为靶向药物,由于其作用机制明确,治疗效果比较理想,在抗肿瘤、自身免疫病、抗感染及器官移植排斥等多种疾病中取得了较好的疗效,因此成为国内外研发的热点。目前全球销售排名前10位的药品中有7个为抗体类新型生物大分子药物。抗体药物的接连上市和重磅销售引发了抗体药物的研发热潮[1-3]。
肿瘤坏死因子-α(tumor necrosis factor α,TNFα)是一种主要由巨噬细胞和单核细胞产生的具有多种生物学活性的细胞因子,参与正常炎症反应和免疫反应,通过细胞膜上的TNF受体(TNFR)介导炎症发生,在抗感染和抗肿瘤治疗中发挥重要作用,TNF-α在机体内过量产生却可与其他炎性因子一起介导多种免疫病理损伤[4-5]。
抗TNF-α单抗作为肿瘤坏死因子的生物抑制剂,对类风湿性关节炎(rheumatoid arthritis,RA)、强直性脊柱炎(ankylosing spondylitis,AS)、银屑病性关节炎(psoriaticarthritis,PsA)、溃疡性结肠炎(ulcerative colitis,UC)、成人和儿童克罗恩病(Crohn’s disease,CD)等自身免疫病具有显著疗效[6-10]。英夫利西单抗是一类人-鼠嵌合型抗TNF-α单抗,它可以高吸附性、高亲合性地与TNF-α的可溶性和跨膜形式(tm TNF-α)特异性结合,但不能结合于淋巴毒素(TNF-β),抗体的高特异性结合可以减少其对其他生物学过程可能的非特异性影响。与tm TNF-α结合后,英夫利西单抗可以抑制TNF-α与受体结合,从而中和TNF-α的生物活性[11]。
WHO疫苗批签发指南指出,趋势分析是疫苗批签发的一个重要组成部分。近年来,许多国家对质控实验室的检测结果以及企业自检结果进行趋势分析,是判定疫苗是否放行的重要依据之一[12]。对于单克隆抗体的质量控制,各国国家质控实验室及制品生产企业在对制品进行质量控制时,除对制品进行检验外,也越来越重视对检测结果的趋势分析。面对国内外抗体类药物的快速发展,迫切需要建立相应的抗体药物趋势分析评价技术体系,对单抗类药物的关键质量属性进行较系统的趋势分析研究。趋势分析的结果能够反馈生产工艺过程控制,为药物警戒性监测提供数据支持,也为上市后市场监督抽验提供依据。为了对英夫利西单抗药物进行有效的质量控制和上市后监管,本文在疫苗制品趋势分析的基础上,对英夫利西单抗的关键质量属性进行趋势分析[13-14]。
1 材料与方法 1.1 样品英夫利西单抗供试品和英夫利西单抗参比品均为中国食品药品检定研究院单克隆抗体产品室留样。
1.2 主要仪器及试剂M5多功能酶标仪及SoftMax分析软件(Molecular Devices公司);SPSS 24分析软件(IBM公司);Waters 2695 HPLC系统(Waters公司);TSK G3000SWXL凝胶色谱柱(7.8 mm×30 cm)(Tosoh Bioscience公司);紫外分光光度计(岛津公司);pH计(Meteler Toleko公司)。胎牛血清(FBS)、胰蛋白酶和RPMI 1640培养基,Gibco公司;TNF-α,NIBSC;放线菌素D,Sigma公司;CellTiter 96AQueous试剂盒,Promega公司;WEHI164-13var细胞株为中国食品药品检定研究院单克隆抗体产品室保存。
1.3 方法 1.3.1 生物学活性检测以含10% FBS的RPMI 1640培养基(完全培养基)将英夫利西单抗供试品及参比品分别稀释至1 000 ng·mL-1,再按照1:2的稀释倍数往下稀释11个梯度;将稀释至2 ng·mL-1的TNF-α与各稀释梯度的单抗进行1:2混合后,以每孔75 μL加入96孔细胞培养板中,37 ℃,5% CO2条件下中和1 h;取培养至对数生长期的WEHI164-13var细胞,加入胰蛋白酶0.5 mL,25 ℃条件下作用1 min,加入5 mL完全培养基终止消化,200 g离心5 min,再以完全培养基重悬,调整细胞浓度至2×106个·mL-1,向细胞悬液中加入放线菌素D至终质量浓度8 μg·mL-1,以每孔25 μL加入中和后的96孔细胞培养板中,37 ℃,5% CO2条件下孵育20~24 h;每孔加入CellTiter 96AQueous检测试剂20 μL,置37 ℃,5% CO2条件下孵育2~3 h;在酶标仪上读取吸收度(A),检测波长为492 nm。检测结果利用SoftMax软件进行数据分析,以英夫利西单抗浓度对数为X轴,对应的吸收值为Y轴,选用四参数方程回归模型,拟合剂量效应曲线,按照参比品EC50/供试品EC50×100%计算供试品的相对百分效价。
1.3.2 蛋白质含量检测采用紫外分光光度法,以注射用水将样品稀释至适当倍数,检测278 nm处吸收度,按A278 nm×稀释倍数×复溶体积/消光系数计算蛋白质含量(mg·瓶-1)。
1.3.3 分子排阻色谱(SEC-HPLC)分析采用分子排阻凝胶填充色谱柱,流动相为含0.2 mol·L-1磷酸钠,0.01%吐温80,pH 6.8的缓冲液,上样量不低于10 μg,在25 ℃条件下以0.5 mL·min-1的流速进行洗脱,检测波长为214 nm,按面积归一化法计算单体峰面积百分比。
1.3.4 pH检测采用电位法检测供试品的pH,将电极插入5 mL样品中,待样品与电极充分接触后读数。
1.4 趋势分析 1.4.1 数据来源选取2008—2017年来,连续10年NIFDC以及某企业质控实验室对65批英夫利西单抗的生物学活性、蛋白质含量、分子排阻色谱及pH的检测结果。
1.4.2 图表绘制和分析以批次为横坐标,检测结果为纵坐标,将每批产品NIFDC以及某企业质控实验室的检测结果、警戒限、行动限和均值绘于图上,观察图中检测结果的趋势线是否有较大的波动,是否超出警戒限、行动限及在均值两侧平均分布的情况。连续性趋势分析:从2008—2017年底,共检测英夫利西单抗65批。周期性趋势分析:每隔1年对制品进行周期性趋势分析,分别对本年度的检测结果与上一年度的检测结果以及NIFDC检测结果与企业自检结果进行比较,对该英夫利西单抗2014—2017年度的生物学活性检测结果进行周期性趋势分析,采用图表直接比对法结合SPSS 24统计学软件进行比较。将近几年试验数据进行单因素方差分析,以P < 0.05为差异有统计学意义。
1.4.3 警戒限和行动限的建立使用统计学SPSS 24软件,对企业及NIFDC的检测结果进行正态性检验,数据需符合正态分布。根据已累积的65批英夫利西单抗的检测结果,计算均值及标准差(SD),均值±2SD作为警戒限(引起警示的界限),均值±3SD作为行动限(需采用措施控制产品质量的界限)[12]。
1.4.4 可疑结果的调查和分析通常情况下,1批制品的检测结果超出行动限,或连续3批制品的检测结果超出警戒限,或结果趋势有严重的漂移(连续6批结果上升或下降,连续8批结果在均值同侧),或连续2批结果相差4SD以上,均应视为严重问题,应对产生的原因进行调查分析,并根据制品的检验项目及质量标准进行讨论[12]。
2 结果 2.1 检测结果 2.1.1 生物学活性检测英夫利西单抗参比品及供试品均存在量效关系,在半对数坐标纸上呈S型曲线分布,且符合四参数方程y=(A-D)/[1+(x/C)B]+D曲线相关系数在0.99以上(图 1)。

|
图 1 英夫利西单抗参比品及供试品剂量反应曲线 Figure 1 The dose-response curves of reference and test articles of infliximab |
英夫利西单抗经分子排阻色谱检测(图 2),于214 nm处检测吸收值,按面积归一化法计算单体峰面积百分比。
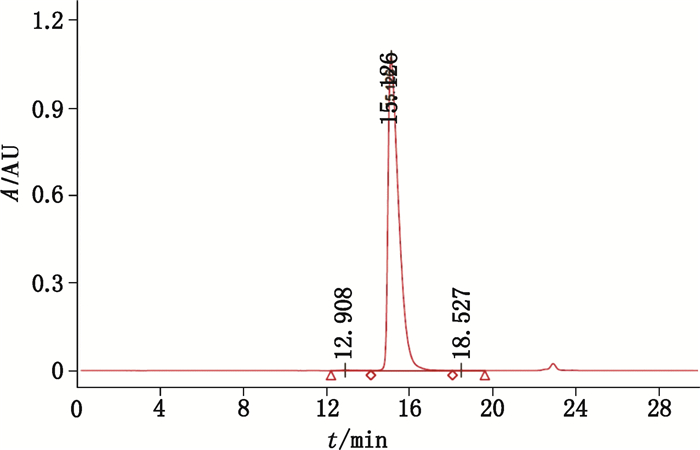
|
图 2 英夫利西单抗分子排阻色谱检测图谱 Figure 2 SEC-HPLC chromatogram of infliximab |
从2008—2017年底,共检测某企业英夫利西单抗65批,其生物学活性、蛋白质含量、分子排阻色谱及pH的检测结果的均值(X)、标准差(SD)、相对标准偏差(RSD)见表 1。
|
|
表 1 某企业英夫利西单抗检测结果(n=65) Table 1 Test results of infliximab of a manufacturer |
以批次为横坐标,检测结果为纵坐标,将NIFDC检测结果及企业自检结果、各自均值、警戒限(均值±2SD)、行动限(均值±3SD)绘于趋势分析图上。英夫利西单抗的检测结果均符合标准规定,趋势分析的结果如下:
2.2.1 生物学活性检测结果的趋势分析NIFDC检测结果未出现超出警戒限,未出现连续2批结果相差4SD以上,未出现连续6批结果上升或下降情况,出现连续13批结果在均值同侧的漂移情况。经分析,漂移数据在趋势分析曲线上集中且接近均值,未超过警戒限(均值±2SD);企业自检结果出现1批超出行动限但在质量标准范围内结果,为早期批次数据结果。见图 3。
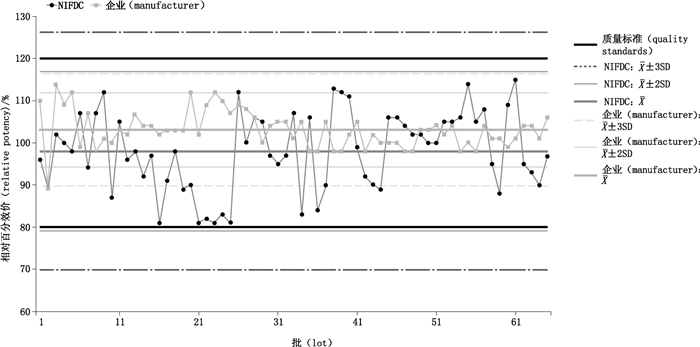
|
图 3 英夫利西单抗生物学活性检测结果的连续性趋势分析 Figure 3 Consistent trend analysis of biological activity for infliximab |
NIFDC绝大多数结果在警戒限以内,未出现连续2批结果相差4SD以上,未出现超出行动限或连续3批超出警戒限结果,未出现连续6批结果上升或下降情况,但出现连续13批结果在均值同侧的漂移情况;企业自检结果出现1批超出行动限但在质量标准范围内结果,为早期批次数据结果。见图 4。
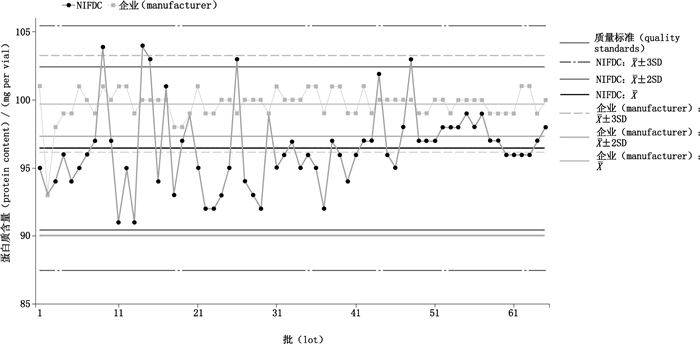
|
图 4 英夫利西单抗蛋白质含量检测结果的连续性趋势分析 Figure 4 Consistent trend analysis of protein content for infliximab |
NIFDC绝大多数检测结果在警戒限以内,未出现连续2批结果相差4SD以上,出现2批结果超出行动限,但未超出质量标准范围,未出现连续6批结果上升或下降或连续8批结果在均值同侧的漂移情况;企业自检结果出现3批结果超出行动限,但未超出质量标准范围,出现连续11批结果在均值同侧的漂移情况。几批超出行动限的结果均为早期批次,从趋势分析曲线可以看出,早期的数据变异较大,而随着时间,生产批次增加,检测结果趋于上升且趋于稳定;出现漂移的数据也均在平均值以上,对于分子排阻色谱的单体峰质量控制为不低于某一限值,因此,高于平均值的结果认为纯度更高(图 5)。
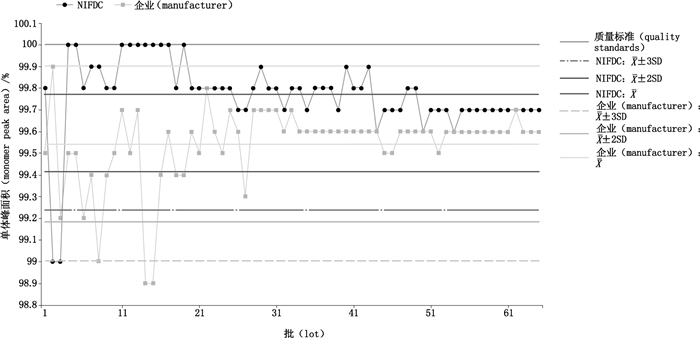
|
图 5 英夫利西单抗SEC-HPLC检测结果的连续性趋势分析 Figure 5 Consistent trend analysis of SEC-HPLC for infliximab |
NIFDC绝大多数结果在警戒限以内,未出现连续2批结果相差4SD以上,未出现超出行动限结果,出现连续3批超出警戒限结果,存在连续8批以上结果在均值同侧的漂移情况,经回顾该漂移批次为仪器更新原因;企业自检结果出现1批超出行动限但在质量标准范围内结果,为早期批次数据结果,存在连续8批以上结果在均值同侧的漂移情况,从趋势分析曲线可以看出,早期的数据变异较大,且数据偏高,导致总体均值较高,而随着生产批次增加,检测结果趋于稳定。(图 6)
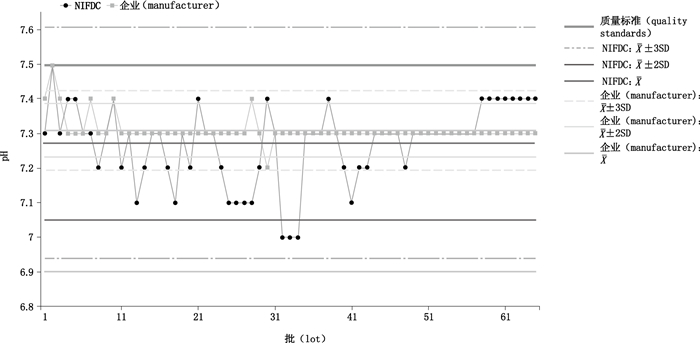
|
图 6 英夫利西单抗pH检测结果的连续性趋势分析 Figure 6 Consistent trend analysis of pH for infliximab |
对制品的检测结果进行周期性趋势分析,分别对该段时间内的检测结果与前段时间内的检测结果进行比较。以生物学活性检测为例,对NIFDC检测结果与企业自检结果进行比较。选取2014—2017年度数据,采用直接的图表比对法进行比较。以批次为横坐标,检测结果为纵坐标,以上一年度检测生物学活性结果的均值和标准差制定警戒限(均值±2SD)、行动限(均值±3SD),对下一年度数据进行周期性趋势分析。结果显示,NIFDC检测结果绝大多数在警戒限以内,未出现超出行动限结果,出现连续4批超出警戒限结果;而企业自检结果未超出行动限,未出现连续6批结果上升或下降或连续8批结果在均值同侧的漂移情况。见图 7~9。

|
图 7 英夫利西单抗生物学活性周期性趋势分析(2014/2015年度) Figure 7 Periodic trend analysis of biological activity for infliximab (in 2014/2015) |

|
图 8 英夫利西单抗生物学活性周期性趋势分析(2015/2016年度) Figure 8 Periodic trend analysis of biological activity for infliximab (in 2015/2016) |
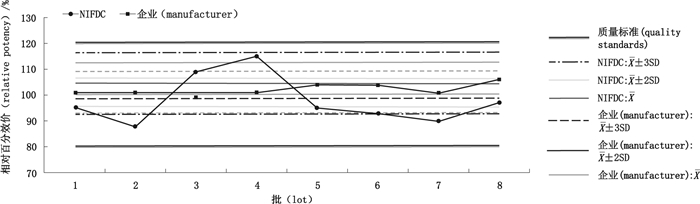
|
图 9 英夫利西单抗生物学活性周期性趋势分析(2016/2017年度) Figure 9 Periodic trend analysis of biological activity for infliximab (in 2016/2017) |
近20年来,抗体类药物的发展势头迅猛,其安全性和有效性越来越受到关注,建立和完善各类单抗的质量控制分析方法是质控关键,与此同时,对检测结果的评价和分析也是不可或缺的质控步骤。
本文对2008—2017年以来,连续10年共计65个批次的英夫利西单抗进行趋势分析,发现NIFDC的生物学活性和蛋白质含量检测结果绝大多数在警戒限以内,未出现超出行动限结果,但出现连续结果在均值同侧的漂移情况,回顾出现漂移结果的批次,发现生物学活性与蛋白质含量结果存在大部分重叠,将该部分检测数据进行相关性分析(P=0.617),结果证明两者存在相关关系,说明蛋白质含量与生物学活性具有相关性;分子排阻色谱检测结果出现个别结果超出行动限情况,但全部结果均在质量标准范围内。提示应对整个检验过程进行回顾分析,对仪器校准、人员培训、标准液批次、样品稀释操作及缓冲液配制等相关因素的影响进行评估。
企业的生物学活性、蛋白质含量、分子排阻色谱和pH检测的自检结果均出现1批超出行动限但未超出质量标准范围内的结果,回顾出现超行动限结果的批次,发现其中生物学活性与蛋白质含量和pH的超行动限结果均为2008年的同一批次,当时英夫利西检测批次和数据积累有限,未能及时监测及提示,这也进一步证明了动态监测试验数据和对每次检测结果进行趋势分析的在产品质量控制中的重要性,而趋势分析曲线上显示早期的检测数据变异较大,随着生产批次的增加,检测结果趋于稳定,也从侧面反映产品生产工艺趋于稳定。
将NIFDC各项检测结果与企业的自检结果进行配对t检验,发现两者差异有统计学意义(P < 0.05),而NIFDC检测结果相对于企业结果变异性较大,分析其原因,首先企业自检为多次试验结果取均值,因此整体变异度相对较小,而NIFDC为单次试验结果;另外,NIFDC的检测有操作人员变动,仪器换代等因素,这也是出现较大变异的原因。
英夫利西单抗的生物学活性评价是将英夫利西单抗参比品和供试品进行同步检测,拟合四参数曲线并计算供试品相对于参比品的相对百分效价,相对百分效价越高,则供试品的效力越高[15]。生物学活性,相对于其他项目,检测结果受细胞状态、孵育时间、关键试剂批次以及人员操作等影响较大,因此是一个变异度较大的检测项目;对生物学活性检测结果进行年度周期性趋势分析,也能够从侧面反映这些因素对结果的影响。各年度NIFDC检测结果与企业自检结果绝大多数位于根据上一年度检测结果均值及标准差制订的警戒限内,表明与上一年度相比,当年的检测结果未发生大的偏移,也说明该制品的生产工艺和检测方法在近几年之内相对稳定。
通过对英夫利西单抗几个关键质量项目的趋势分析,不但可以监测该制品生产的批间一致性,从而间接反映生产过程稳定性,保证每批制品应用于人体的安全有效,同时也可以提示单抗生产企业通过对连续生产批次的检测结果进行数据积累及趋势分析,从而达到质量控制和质量检测的目的,趋势分析结果还对单抗生产的工艺过程控制具有一定反馈作用。如果在趋势分析中发现某批制品的数据异常,超出警戒限或行动限,则应对整个生产过程进行回顾,检查环境、仪器、人员、原料、方法等相关因素,查明原因并及时进行纠正。在进行趋势分析时,有时需要考虑一些特殊情况,如生产工艺变更、实验方法变更以及参比品批次更换等重大改变,均需要重新累积批数来计算均值及标准差。
本文以英夫利西单抗为例对抗TNF-α单抗的检测结果进行趋势分析,对其他单抗类治疗药物的质控和监测具有一定借鉴意义,也为单抗的稳定性提供参考。
| [1] |
SLIWKOWSKI MX, MELLMAN I. Antibody therapeutics in cancer[J]. Science, 2013, 341(6151): 1192. DOI:10.1126/science.1241145 |
| [2] |
GAO K, WANG J. The biopharmaceutical industry in China:historyand future perspectives[J]. Front Med, 2012, 6(2): 101. DOI:10.1007/s11684-012-0191-9 |
| [3] |
陈玉琴, 刘春雨, 郭玮, 等. 关于进口单克隆抗体类生物治疗产品注册检验资料规范性的思考[J]. 中国新药杂志, 2015, 24(16): 1838. CHEN YQ, LIU CY, GUO W, et al. Normalization of registration testing information of imported monoclonal antibody-based biotherapeutics[J]. Chin J New Drugs, 2015, 24(16): 1838. |
| [4] |
LI J, ZHU ZP. Research and development of next generation of antibody-based therapeutics[J]. Acta Pharmacol Sin, 2010, 120(2): 1198. |
| [5] |
BRADLEY JR. TNF-mediated inflammatory disease[J]. J Pathol, 2008, 214(2): 149. |
| [6] |
GARY R, FAYE AH, JOHN DI, et al. Emerging immunotherapies for rheumatoid arthritis[J]. Hum Vaccin Immunother, 2014, 10(4): 822. DOI:10.4161/hv.27910 |
| [7] |
HINZE AM, LOUIE GH. Osteoporosis management in ankylosing spondylitis[J]. Curr Treatm Opt Rheumatol, 2016, 2(4): 271. DOI:10.1007/s40674-016-0055-6 |
| [8] |
FELETAR M, BROCKBANK J, SCHENTAG C, et al. Treatment of refractory psoriatic arthritis with infliximab:a 12 month observational study of 16 patients[J]. Ann Rheum Dis, 2004, 63(2): 156. DOI:10.1136/ard.2003.006775 |
| [9] |
SUNG CP. Current and emerging biologics for ulcerative colitis[J]. Gut Liver, 2015, 9(1): 18. DOI:10.5009/gnl14226 |
| [10] |
JONATHAN RD, SOUDABEH FD, ETHAN AS, et al. Defining the ultrasound longitudinal natural history of newly diagnosed pediatric small bowel Crohn disease treated with infliximab and infliximab-azathioprine combination therapy[J]. Pediatr Radiol, 2017, 47(8): 924. DOI:10.1007/s00247-017-3848-3 |
| [11] |
TAKAHIKO H, HIROKI M, SHINICHI H, et al. Transmembrane TNF-alpha:structure, function and interaction with anti-TNF agents[J]. Rheumatology, 2010, 49(7): 1215. DOI:10.1093/rheumatology/keq031 |
| [12] |
WHO Expert Committee on Biological Standardization.Guidelines for Independent Lot Release of Vaccines by Regulatory Authorities[S/OL].[2018-10-11].http://apps.who.int/iris/bitstream/10665/89148/1/9789241209786_eng.pdf
|
| [13] |
刘春雨, 王兰, 郭玮, 等. 抗CD20单克隆抗体质量控制中生物学活性的趋势分析[J]. 中国生物制品学杂志, 2015, 28(1): 58. LIU CY, WANG L, GUO W, et al. Trend analysis of biological activity in quality control of anti-CD20 monoclonal antibody[J]. Chin J Biol, 2015, 28(1): 58. |
| [14] |
刘欣玉, 张洁, 贾丽丽, 等. 乙型脑炎减毒活疫苗质量控制中趋势分析的应用[J]. 中国生物制品学杂志, 2012, 25(11): 1562. LIU XY, ZHANG J, JIA LL, et al. Application of trend analysis in quality control of Japanese encephalitis attenuated live vaccine[J]. Chin J Biol, 2012, 25(11): 1562. |
| [15] |
MORRIS TS, SINGER R. Biological potency assays are key to assessing product consistency.The bioassay procedure can ensure up-to-date measurement of the potency of biological and biotechnology-derived products[J]. Nat Rev Drug Discov, 2009, 22(6): 66. |
 2019, Vol. 39
2019, Vol. 39 
