与正常细胞相比,肿瘤细胞有诸多遗传学和表观遗传学的改变,这些改变产生大量宿主免疫系统能够识别的肿瘤相关抗原,具有较强的免疫原性,然而,免疫系统对肿瘤细胞的主动清除有时并不奏效,其中一个重要原因是免疫耐受。肿瘤细胞可能利用免疫系统的一系列抑制途径(即免疫检查点)介导免疫耐受[1],尤其是T细胞介导的针对肿瘤抗原的特异性免疫的免疫耐受[2-3]。这一领域的研究早在10年前便已开展,近期在治疗肿瘤方面也显示了巨大的潜力,迅速成为生物制药企业研发的热点。
PD-1/PD-L1分子是目前免疫检查点领域倍受关注的靶点[4]。与细胞毒T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated antigen 4,CTLA4)表达在初始T细胞表面不同,PD-1分子在外周T细胞上的表达需要T细胞活化的诱导。在肿瘤微环境中,除了少数肿瘤细胞组成性表达PD-L1,绝大部分肿瘤细胞上PD-L1的表达需要T细胞受体(T cell receptor,TCR)与肿瘤细胞表面抗原结合后所释放的干扰素γ(interferon,IFN-γ)的诱导。PD-L1与PD-1或白细胞分化抗原80(cluster of differentiation 80,CD80)结合后,PD-L1可以通过诱导效应T细胞免疫无能、凋亡、白介素10(interleukin-10,IL-10)分泌以及调节性T细胞(regulatory T cell,Treg)分化等多种机制介导免疫耐受[2, 5-8]。抗PD-L1抗体能够打破免疫耐受,起到有效的抗肿瘤作用[9-13]。截止2017年底,美国食品药品监督管理局(Food and Drug Administration,FDA)批准了3个PD-L1抗体,分别为罗氏的Atezolizumab、阿斯利康的Durvalumab和辉瑞/默沙东的Avelumab,适应症包括非小细胞肺癌、尿路上皮癌以及merkel细胞癌等少见癌种[14-18];国内也有10多家药企布局了该靶点抗体的研发,但抗PD-L1抗体尚未发展到上市申请阶段。
根据对抗PD-L1单抗作用机制的不同认知和差异化的研发策略,目前抗PD-L1单抗有不同类别,如去糖基化改造的IgG1、IgG4以及保留糖基化的IgG1。本研究以去糖基化改造的IgG1型抗PD-L1单抗为目标产品,根据产品特征及关键质量属性,结合iCIEF、肽图、CE-SDS、SEC-HPLC、IEC-HPLC、生物学活性等,对抗PD-L1单抗的质控分析方法进行探讨,为PD-L1的质量控制提供参考。
1 材料与方法 1.1 供试品抗PD-L1人源化单抗的参比品和样品均为中国食品药品检定研究院单克隆抗体产品室留样。
1.2 细胞CHO和Jurkat细胞系均购自ATCC公司。表达PD-L1的CHO-K1细胞系(CHO-K1/PD-L1)、转染PD-L1与膜型抗CD3单链抗体的CHO细胞系(CHO/PD-L1-CD3L)、稳定转染PD-1与NFAT反应元件控制下的荧光素酶基因的Jurkat细胞系(Jurkat/PD-1-NFAT)由中国食品药品检定研究院单克隆抗体产品室保存、传代。
1.3 试剂材料载体两性电解质Pharmalyte 3-10及8-10.5购自GE Healthcare公司;iCE280试剂盒(包括1%甲基纤维素,阳极及阴极电解液)、涂层毛细管、pI Markers均购自ProteinSimple公司。胰蛋白酶购自Promega公司;AdvanceBio Peptide Map(4.6 mm×150 mm,2.7 μm)购自Agilent公司。SDS-MW分析试剂盒(含有0.1 mol·L-1氢氧化钠,0.1 mol·L-1盐酸,SDS样品缓冲液,SDS-MWGel Buffer)、毛细管(50 μm×65 cm)均购自Beckman Coulter公司,TSK G3000SWXL色谱柱(300 mm×7.8 mm,5 μm)购自Tosoh公司,Dionex ProPacWCX-10色谱柱(250 mm×4 mm)购自Thermo公司。F-12K基础培养基购自Invitrogen公司,胎牛血清购自Gibco公司,带鼠可结晶片段的PD-1(PD-1-mFc)为中国食品药品检定研究院单克隆抗体产品室保存;MSD高结合96孔板、Ru(bpy)32+标记的羊抗鼠抗体、4×Read Buffer均购自Meso Scale Discovery公司。潮霉素B购自Roche公司,嘌呤霉素购自Sigma公司;RPMI1640、DMEM/F12、PBS、NEAA均购自Gibco公司;Bio-GloTM荧光素酶检测试剂盒购自Promega公司。
1.4 主要仪器iCE280(ProteinSimple公司);1260高效液相色谱系统(Agilent公司)。PA800 plus系统、PDA检测器(Beckman Coulter公司)。2695高效液相色谱仪(Waters公司)。SECTOR S 600超敏多因子电化学发光分析仪(Meso Scale Discovery公司);SPECTRAM5酶标仪(Molecular device公司)。GWJ-8型微粒检测仪(天津天大天发公司);FlowCAM 8100流体颗粒成像分析系统(Fluid Imaging公司)。
1.5 方法 1.5.1 鉴别 1.5.1.1 iCIEF将样品用纯水稀释至2 mg·mL-1,将50 μL样品溶液与70 μL 1%甲基纤维素混合,再加入0.5 μL pI marker 7.05、0.5 μL pI marker 9.50、8.0 μL Pharmalytes 3-10、2.0 μL Pharmalytes 8-10.5,最后添加43%尿素溶液69 μL,混匀,6 500 r·min-1离心3 min。分析条件:预聚焦电压1.5 kV,持续1 min;聚焦电压3 kV,持续10 min。
1.5.1.2 肽图取0.5 mg样品(以单抗蛋白量计),加入1 mol·L-1二硫苏糖醇5 μL,100 mmol·L-1碳酸氢铵溶液100 μL,混匀后置于95 ℃水浴15 min,取出后加入尿素300 μL,10 kD离心管超滤。加入100 mmol·L-1碘乙酰胺200 μL,室温避光孵育30 min,置换至200 μL 25 mmol·L-1碳酸氢铵缓冲液中,按体积比12:1加入0.5 mg·mL-1胰酶混匀,37 ℃水浴酶切20 h后,加入20 μL 5%TFA终止反应。采用Agilent 1260高效液相色谱系统,AdvanceBio Peptide Map色谱柱分离。检测条件:流动相A为0.1%的三氟乙酸-水溶液,流动相B为0.1%的三氟乙酸-乙腈溶液,梯度洗脱(0~65 min,流动相B从2%上升至95%;65.1~75 min,流动相B从95%降低至2%),流速0.5 mL·min-1,上样量10 μg,样品室温度8 ℃,柱温50 ℃,检测波长214 nm。
1.5.2 纯度 1.5.2.1 CE-SDS用超纯水将样品稀释至3.0 mg·mL-1,取该溶液25 μL,加入巯基乙醇(还原)/0.1 mol·L-1 N-乙基马来酰亚胺(非还原)5 μL,SDS样品缓冲液75 μL,混匀后,70 ℃水浴10 min,取80 μL置进样瓶中后上机分析。采用Beckman PA800 plus毛细管电泳系统,使用无涂层毛细管(内径50 μm,总长度31 cm,有效长度21 cm)检测。检测条件:分离电压为15 kV,毛细管温度30 ℃,样品室温度为15 ℃,检测波长为220 nm。计算样品轻链峰+重链峰(还原型)或主峰(非还原型)峰面积百分比。
1.5.2.2 SEC-HPLC将样品用流动相(50 mmol·L-1磷酸钾-300 mmol·L-1氯化钠溶液)稀释至10.0 mg·mL-1,采用Waters 2695 HPLC系统、2489紫外检测器、TSK G3000SWXL色谱柱进行检测。检测条件:流动相为50 mmol·L-1磷酸钾-300 mmol·L-1氯化钠,流速1.0 mL·min-1,上样量10 μL,进样器温度5 ℃,柱温25 ℃,在280 nm处检测。采用面积归一化法计算单体百分比。
1.5.2.3 IEC-HPLC用超纯水将样品稀释至1.0 mg·mL-1,采用Waters 2695 HPLC系统、2489紫外检测器、Dionex ProPacWCX-10色谱柱检测。检测条件:流动相A为10 mmol·L-1磷酸盐(pH 6.5),流动相B为10 mmol·L-1磷酸盐-500 mmol·L-1氯化钠(pH 6.5),梯度洗脱(0 min,流动相B为8%;0~30 min,流动相B上升至100%;30~60 min,流动相B维持在100%;40~60 min,流动相B为8%),流速1 mL·min-1,上样量100 μL,样品温度2~8 ℃,柱温35 ℃,检测波长280 nm,检测时间60 min。采用面积归一化法计算主峰、酸性区域和碱性区域峰面积百分比。
1.5.3 生物学活性测定 1.5.3.1 细胞结合抑制法将150 μL封闭液(含15%胎牛血清的F-12K培养基)加入到高结合96孔石墨电极板中,于振荡器上以200 r·min-1的转速室温振荡2 h。将样品用分析培养基(含10%胎牛血清的F-12K培养基)进行梯度稀释,然后分别与一定浓度的PD-1-mFc和Ru(bpy)32+标记的羊抗鼠抗体混合后转移至96孔板中,2~8 ℃冰箱避光保存。复苏CHO-K1/PD-L1细胞,用分析培养基重悬,以每孔5 000个细胞加入到已封闭的高结合96孔板中,并将96孔板中的混合液加入,总体积为100 μL,样品终浓度梯度在0~4 000 ng·mL-1之间,室温避光孵育1 h。将4×读数缓冲液(Read Buffer)与杜氏磷酸盐缓冲液(Dulbecco’s phosphate buffered saline,DPBS)以1:1的比例制备成2×Read Buffer,以每孔100 μL加入MSD高结合96孔板中,用MSD MESOTM SECTOR S600读板。
1.5.3.2 转基因细胞法Jurkat/PD-1-NFAT细胞复苏后于含10%胎牛血清、1%非必需氨基酸(non-essential amino acid,NEAA)、0.4 mg·mL-1潮霉素B、4 μg·mL-1嘌呤霉素的RPMI 1640的培养基中37 ℃、5% CO2培养。CHO/PD-L1-CD3L细胞复苏后于10%胎牛血清、1%NEAA、0.2 mg·mL-1潮霉素B、8 μg·mL-1嘌呤霉素的DMEM/F12培养基中37 ℃、5% CO2培养。2~3 d传代1次。以每孔50 000个细胞的密度将CHO/PD-L1-CD3L接种于白色96孔板中,并于37 ℃、5% CO2孵箱中孵育12~14 h。去除培养基,将于50 μL测试培养基(含2%胎牛血清的RPMI 1640培养基)中的100 000个Jurkat/PD-1-NFAT添加至各孔中。抗PD-L1抗体以100 μg·mL-1为起始点,用测试培养基按1:3进行倍比稀释后,以每孔50 μL加入各孔,每个浓度点设置双复孔。之后将96孔板于37 ℃、5% CO2孵箱中孵育6 h。每孔添加100 μL发光底物,并在SPECTRAM5酶标仪上采用化学发光模式进行读数。
1.5.4 不溶性微粒检测不溶性微粒检测采用光阻法和液流成像分析法2种方法。光阻法按2015年版《中华人民共和国药典》检测并报告≥10 μm、≥25 μm的微粒数。液流成像分析法采用Fluid imaging公司的FlowCAM 8100流体颗粒成像分析系统检测。系统主要参数设定如下:设定比背景亮及比背景暗15个像素的“物”均被有效拍照,上样量500 μL,测试流速为0.1 mL·min-1,拍照频率为每秒22帧;样品间采用超纯水以3 mL·min-1流速清洗5~10次,以减小样品间互相干扰;结果报告2~10 μm、≥10 μm、≥25 μm的微粒数及微粒的组成。
2 结果 2.1 鉴别 2.1.1 iCIEF参比品与样品的iCIEF代表性图谱见图 1。目视观察,样品与参比品图谱无明显差异,均有1个主峰。按照线性回归方式将pI标准品(pI 7.05、9.50)拟合标准曲线,用以计算主峰pI,参比品主峰pI为8.556,样品主峰pI为8.560,样品主峰pI与参比品主峰pI的差值≤0.2,认为样品主峰与参比品一致。积分结果显示,参比品酸性峰、主峰、碱性峰百分比分别为25.79%、70.48%、3.73%,样品酸性峰、主峰、碱性峰百分比分别为25.93%、70.27%、3.80%,可见样品与参比品酸碱变异体比例类似。
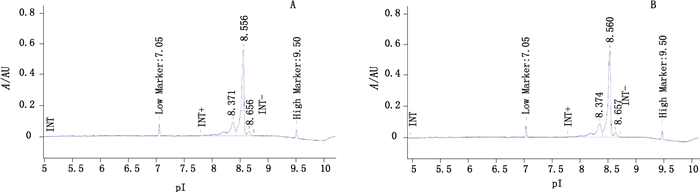
|
图 1 抗PD-L1单抗参比品(A)与样品(B)的iCIEF代表图谱 Figure 1 Representative iCIEF profiles of reference (A) and sample (B) of anti-PD-L1 mAb |
RP-HPLC肽图检测代表性图谱见图 2。目视观察,样品与参比品肽图谱无明显差异,均具有1个参比峰和4个特征色谱峰,参比峰保留时间在31.5~33.5 min之间,4个特征色谱峰轻链-互补决定区3(light chain-complementarity determining region 3,LC-CDR3)、重链-互补决定区3(heavy chain-complementarity determining region 3,HC-CDR3)、轻链-互补决定区1(light chain-complementarity determining region 1,LC-CDR1)、重链-互补决定区2(heavy chain-complementarity determining region 2,HC-CDR2)与参比峰的相对保留时间均在0.73~0.79、1.05~1.11、1.07~1.13、1.11~1.17内。以上结果表明,样品的肽图图谱与参比品一致。
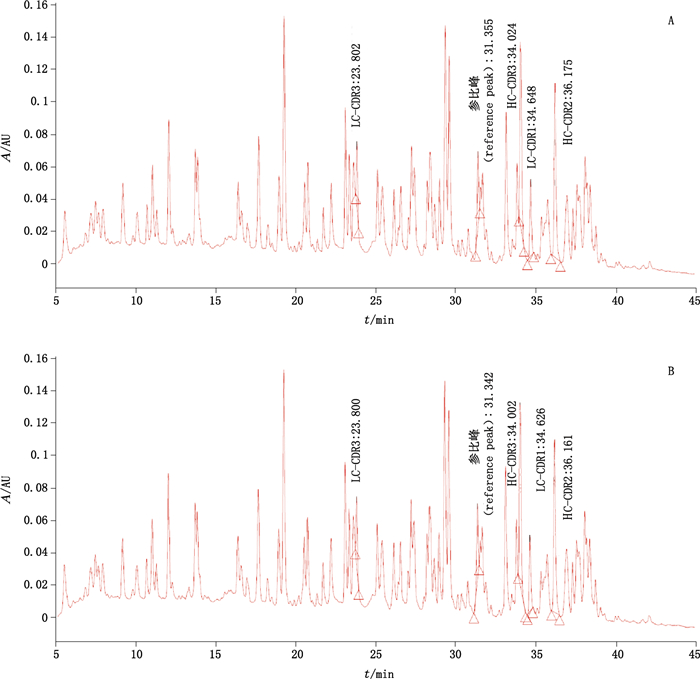
|
图 2 抗PD-L1单抗参比品(A)与样品(B)的肽图代表图谱 Figure 2 Representative peptide mapping profiles of reference(A) and sample(B) of anti-PD-L1 mAb |
还原CE-SDS检测结果表明(图 3-A),样品轻链+重链的峰面积百分比为(98.37±0.21)%,RSD为0.21%(n=3)。非还原CE-SDS检测结果表明(图 3-B),样品主峰峰面积百分比为(96.33±0.15)%,RSD为0.16%(n=3)。
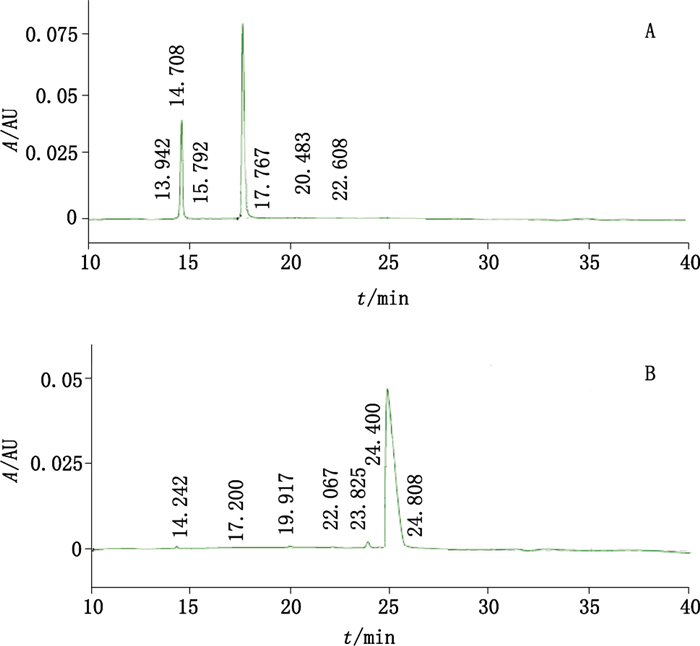
|
图 3 抗PD-L1单抗样品的还原(A)和非还原(B)CE-SDS代表图谱 Figure 3 Representative profiles of reduced(A) and non-reduced(B) CE-SDS for anti-PD-L1 mAb samples |
SEC-HPLC检测结果见图 4,10 mg·mL-1样品溶液上样100 μL时,样品中单体的峰面积百分比为(99.43±0.02)%,RSD为0.02%;聚体的峰面积百分比为(0.43±0.01)%,RSD为3.20%(n=3)。
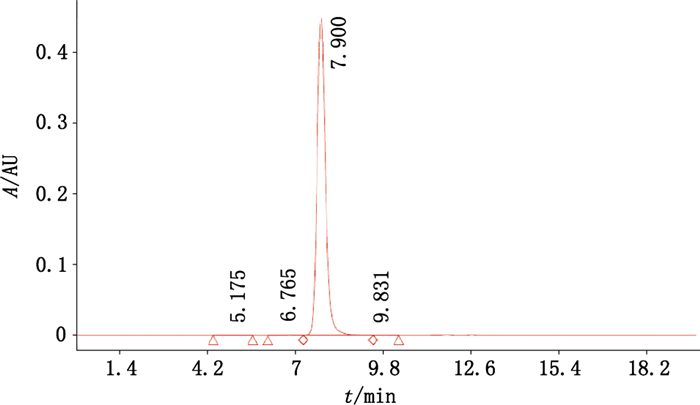
|
图 4 抗PD-L1单抗样品的SEC-HPLC代表图谱 Figure 4 Representative SEC-HPLC profile of anti-PD-L1 mAb |
IEC-HPLC色谱图见图 5,样品中酸性峰峰面积百分比为(13.63±0.40)%,RSD为2.96%;主峰峰面积百分比为(80.00±0.36)%,RSD为0.45%;碱性区峰面积百分比为(6.37±0.15)%,RSD为2.40%(n=3)。
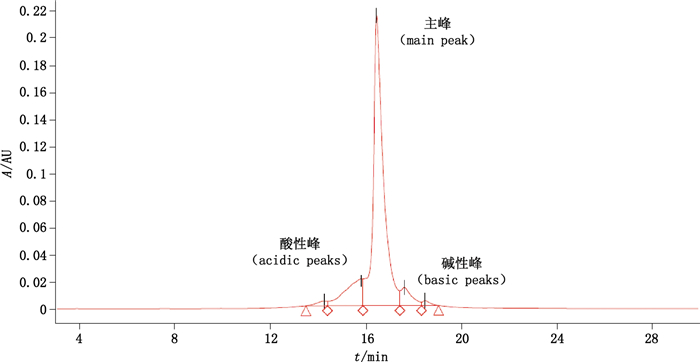
|
图 5 抗PD-L1单抗样品的IEC-HPLC代表图谱 Figure 5 IEC-HPLC representative profiles of anti-PD-L1 mAb samples |
细胞结合抑制法采用电化学发光(electro-chemiluminescence,ECL)原理[19],以抗PD-L1单抗抑制带Ru(bpy)32+标记的游离PD-1与表达PD-L1的CHO-K1细胞结合的原理来检测其阻断活性(图 6)。检测结果(图 7-A)显示,反应曲线呈典型的S型,符合四参数方程Y=(A-D)/[1+(X/C)B]+D。拟合方程中,A为上渐近线值,即当抗PD-L1单抗浓度为0时,对游离PD-1与CHO-K1/PD-L1的结合无抑制时的化学发光值;D为下渐近线值,即游离PD-1与CHO-K1/PD-L1的结合被抗PD-L1单抗完全抑制时的化学发光值;B为线性段斜率,即随着PD-L1单抗浓度升高,游离PD-1与CHO-K1/PD-L1的结合被抑制后信号的下降幅度;C为半数有效剂量,即EC50。与参比品比较,样品相对活性为(90.67±6.03)%,RSD为6.65%(n=3)。
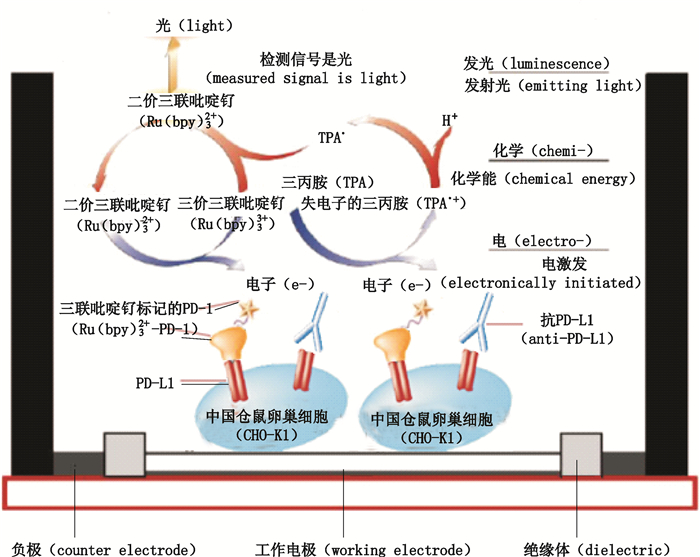
|
图 6 ECL技术检测抗PD-L1单抗活性的原理示意图(https://www.mesoscale.com/en/ technical_resources/our_technology/ecl) Figure 6 The principle of anti-PD-L1 mAb bioassay by ECL(https://www.mesoscale.com/en/ technical_resources/our_technology/ecl) |
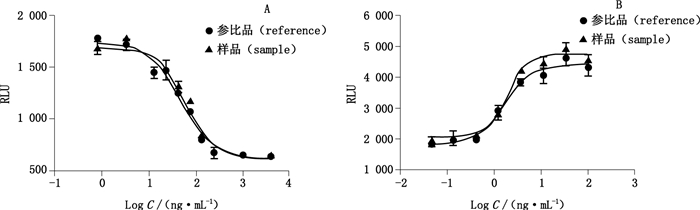
|
图 7 抗PD-L1单抗样品的细胞结合抑制法(A)和转基因细胞法(B)活性检测结果 Figure 7 Testing results of anti-PD-L1 mAb biological activity by cell binding inhibition method(A) and transgenic cell method(B) |
转基因细胞法检测抗PD-L1单抗活性的系统中包含CHO/PD-L1-CD3L和Jurkat/PD-1-NFAT 2个细胞系,用以模拟PD-1/PD-L1在体内真实的作用机制,进而评价抗PD-1/PD-L1单抗的生物学活性,原理见图 8。从检测结果(图 7-B)来看,抗PD-L1单抗能剂量反应性地抑制两细胞间PD-L1与PD-1的结合,拟合优度R2达0.99。与参比品比较,样品相对生物学活性为(100.69±10.02)%,RSD为9.95%(n=3)。
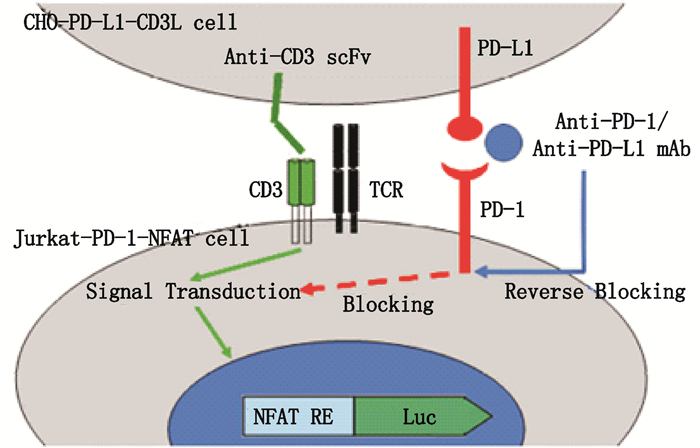
|
图 8 转基因细胞法检测抗PD-L1单抗活性的原理[20] Figure 8 The principle of anti-PD-L1 mAb bioassay by transgenic cell method[20] |
不溶性微粒指粒径为1~100 μm的流动性的、不溶解的污染颗粒,成分为蛋白聚体、硅油滴、纤维等。样品用光阻法检测,经3次测定,≥10 μm及≥25 μm的微粒数分别为(1.33±0.58)粒·mL-1和(0.00±0.00)粒·mL-1,符合2015年版《中华人民共和国药典》规定。用液流成像分析法检测,经3次测定,2~10 μm、≥10 μm及≥25 μm的微粒数分别为(1 243.67±242)粒·mL-1、(45.67±16.07)粒·mL-1和(10.00±5.00)粒·mL-1;成分分析及代表图像见图 9,可见在所有微粒中,蛋白聚体占87.45%,非蛋白聚体占12.55%。
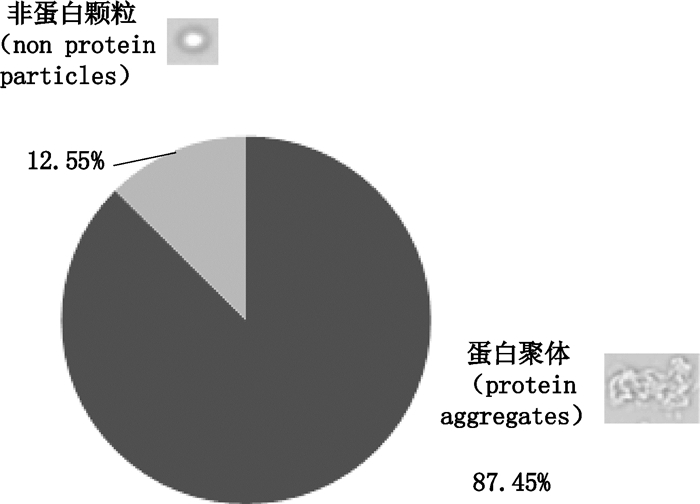
|
图 9 液流成像分析法检测抗PD-L1单抗样品不溶性微粒的成分分析及代表图像 Figure 9 Component analysis and representative image of sub-visible particles in anti-PD-L1 mAb samples by liquid flow imaging analysis |
随着免疫学的发展和对病理机制的深入研究,新的抗肿瘤靶点和作用机制不断出现,肿瘤免疫治疗领域不断拓展。抗PD-L1单抗具有持续的抗肿瘤效果和可耐受的不良反应,是肿瘤治疗里程碑式的新手段,也是联合用药的候选药物,对其质控方法进行研究十分必要。
3.1 鉴别等电点和肽图是单抗特征性的质量属性,因此,可作为鉴别项目。本文采用iCIEF对等电点进行控制,该方法分辨率高,操作简单,已被越来越多的企业所采用[21]。它不但可以从等电点的角度对抗体进行鉴别,还可以从酸性峰、主峰、碱性峰的含量上进行控制和评价。肽图检测采用了对脱氨基、甲硫氨酸氧化、C-末端封闭和错误二硫键等结构改变敏感的胰酶肽图,通过与参比品比较,可见样品中无新峰出现,并使用相对保留时间对4个互补决定区(complementarity determining region,CDR)特征峰进行控制,从而对抗PD-L1单抗进行识别。2种方法的结合使用起到了鉴别作用。
3.2 纯度单抗纯度多采用CE法和HPLC法进行控制。非还原CE-SDS侧重检测不完整抗体;还原CE-SDS侧重检测非糖基化重链、断裂片段等。由于重链的糖基化与抗体的Fc效应有关,而抗PD-L1单抗发挥抗肿瘤作用主要依靠其结合活性,而非Fc效应,因此,并未对非糖基化重链含量进行专门的控制,若抗PD-L1单抗在设计时保留了Fc效应功能,则除了控制非糖基化重链含量,还需对寡糖图谱进行分析。SEC-HPLC采用温和的条件对抗PD-L1抗体进行分离,保持了抗体天然的状态,使得共价和非共价结合的聚体均能与单体进行有效分离,且本文中使用了较高的浓度进行检测,以便更加灵敏地发现聚体的存在。IEC-HPLC主要用于检测样品中不同电荷异构体的比例,可与iCIEF结合起来应用,对酸性峰、主峰、碱性峰进行含量分析和控制,并可通过适当手段对各组分进行分离、鉴别以及对活性等功能进行评价。3种方法的结合应用,对该抗PD-L1单抗纯度进行了有效控制,检测结果均符合质量标准的要求。
3.3 生物学活性抗PD-L1单抗的活性检测包括结合活性和生物学活性2个方面,前者侧重于抗体与靶抗原的结合,后者则侧重于抗体结合靶抗原后引起的生物学效应。本文采用了细胞结合抑制法对抗PD-L1单抗与靶抗原的竞争结合进行检测,试验中使用CHO-K1/PD-L1细胞,采用电化学发光技术,相较于传统的结合ELISA、竞争ELISA等评价方法而言,试验是在细胞上和均相环境中进行,更真实地反映了抗原抗体的结合状态。虽然对于抗PD-L1单抗来说,其主要作用机制有赖于与靶抗原的结合,但就其发挥抗肿瘤效应而言,结合活性并不足以对其进行阐释,故本文还采用了基于细胞的抗PD-L1单抗生物学效应的检测手段。原理为当CHO/PD-L1-CD3L与Jurkat/PD-1-NFAT细胞处在同一环境中,CHO细胞上的膜型抗CD3单链抗体与Jurkat细胞上的CD3分子结合,提供T细胞激活的第一信号,同时会诱发CHO细胞上PD-L1与Jurkat细胞上PD-1结合,启动抑制信号,导致Jurkat细胞的免疫耐受,即无法转导第一信号和激活下游荧光素酶的表达。当抗PD-1/PD-L1单抗存在时,能抑制PD-1/PD-L1结合,使T细胞恢复激活状态,并引发下游信号转导。与其他生物学效应检测方法,如T细胞增殖后细胞因子检测、T细胞表面标记物检测及混合淋巴细胞反应等相比,该方法克服了检测时间长,操作复杂,细胞状态变异较大等难点和不便,能够稳定、快速、特异地反映抗PD-L1单抗的生物学效应[20],是单抗质量控制中非常关键的一个检测项目。
3.4 不溶性微粒2015年版《中华人民共和国药典》三部通则0903要求采用光阻法对不溶性微粒进行检测,该方法仅能对不溶性微粒进行计数,并不能分辨其性质。液流成像分析法通过拍照将不溶性微粒的图像拍摄和保存下来,该方法不但能分辨出与背景差别较小的透明或半透明微粒,大幅提高对蛋白颗粒的检测灵敏度,还能通过对图像进行参数分析进而判断颗粒是否为蛋白聚体,有助于对不溶性微粒的来源进行分析并进行有针对性的控制,这也使不溶性微粒的检测更有意义。
鉴于单抗产品的复杂性和多样性,应从生产工艺控制到质量属性分析以及稳定性评价等方面,不断积累对产品的认知,分阶段选择适宜的方法,建立有效的质量控制体系。我国研发的抗PD-L1单抗均为新药,且各具特点,有人源化抗体,也有全人源抗体;有IgG1型抗体,也有IgG4型抗体;有保留Fc功能的设计,也有将Fc改造以弱化抗体依赖细胞介导的细胞毒作用(ADCC)功能的策略,因此,质量控制手段也有差异,没有哪一种方法适用于所有产品。根据ICHQ6B建议,对药物的某一质量属性应建立2种或2种以上基于不同原理的检测方法,本文以去糖基化改造的人源化抗PD-L1 IgG1抗体为例,采用多种方法对抗PD-L1单抗进行了鉴别,纯度分析,活性检测与不溶性微粒检测等,印证了多种方法交互应用在保证产品安全、有效、质量可控方面的必要性,为抗PD-L1单抗的质量控制提供了参考。
| [1] |
PARDOLL DM. The blockade of immune checkpoints in cancer immunotherapy[J]. Nat Rev Cancer, 2012, 12(4): 252. DOI:10.1038/nrc3239 |
| [2] |
KEIR ME, LIANG SC, INDIRA G, et al. Tissue expression of PD-L1 mediates peripheral T cell tolerance[J]. J Exp Med, 2006, 203(4): 883. DOI:10.1084/jem.20051776 |
| [3] |
FRANCISCO LM, SALINAS VH, BROWN KE, et al. PD-L1 regulates the development, maintenance, and function of induced regulatory T cells[J]. Clin Immunol, 2009, 131(13): S41. |
| [4] |
OKAZAKI T, HONJO T. PD-1 and PD-1 ligands:from discovery to clinical application[J]. Int Immunol, 2007, 19(7): 813. DOI:10.1093/intimm/dxm057 |
| [5] |
IWAI Y, ISHIDA M, TANAKA Y, et al. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade[J]. Proc Natl Acad Sci USA, 2002, 99(19): 12293. DOI:10.1073/pnas.192461099 |
| [6] |
BLANK C, MACKENSEN A. Contribution of the PD-L1/PD-1 pathway to T-cell exhaustion:an update on implications for chronic infections and tumor evasion[J]. Cancer Immunol Immunother, 2007, 56(5): 739. DOI:10.1007/s00262-006-0272-1 |
| [7] |
GAO Q, WANG XY, QIU SJ, et al. Overexpression of PD-L1 significantly associates with tumor aggressiveness and postoperative recurrence in human hepatocellular carcinoma[J]. Clin Cancer Res, 2009, 15(3): 971. DOI:10.1158/1078-0432.CCR-08-1608 |
| [8] |
MU CY, HUANG JA, CHEN Y, et al. High expression of PD-L1 in lung cancer may contribute to poor prognosis and tumor cells immune escape through suppressing tumor infiltrating dendritic cells maturation[J]. Med Oncol, 2011, 28(3): 682. DOI:10.1007/s12032-010-9515-2 |
| [9] |
BLANK C, KUBALL J, VOELKL S, et al. Blockade of PD-L1 (B7-H1) augments human tumor-specific T cell responses in vitro[J]. Int J Cancer, 2010, 119(2): 317. |
| [10] |
TOPALIAN SL, DRAKE CG, PARDOLL DM. Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity[J]. Curr Opin Immunol, 2012, 24(2): 207. DOI:10.1016/j.coi.2011.12.009 |
| [11] |
CHEN L, HAN X. Anti-PD-1/PD-L1 therapy of human cancer:past, present, and future[J]. J Clin Invest, 2015, 125(9): 3384. DOI:10.1172/JCI80011 |
| [12] |
SWAIKA A, HAMMOND WA, JOSEPH RW. Current state of anti-PD-L1 and anti-PD-1 agents in cancer therapy[J]. Mol Immunol, 2015, 67(2): 4. DOI:10.1016/j.molimm.2015.02.009 |
| [13] |
TENG F, MENG X, KONG L, et al. Progress and challenges of predictive biomarkers of anti PD-1/PD-L1 immunotherapy:a systematic review[J]. Cancer Lett, 2018, 414: 166. DOI:10.1016/j.canlet.2017.11.014 |
| [14] |
HERBST RS, SORIA JC, KOWANETZ M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients[J]. Nature, 2014, 515(7528): 563. DOI:10.1038/nature14011 |
| [15] |
POWLES T, EDER JP, FINE GD, et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer[J]. Nature, 2014, 515(7528): 558. DOI:10.1038/nature13904 |
| [16] |
KOTSAKIS A, GEORGOULIAS V. Avelumab, an anti-PD-L1 monoclonal antibody, shows activity in various tumour types[J]. Lancet Oncol, 2017, 18(5): 556. DOI:10.1016/S1470-2045(17)30227-9 |
| [17] |
RAMOS-ESQUIVEL A, van der LAAT A, ROJAS-VIGOTT R, et al. Anti-PD-1/anti-PD-L1 immunotherapy versus docetaxel for previously treated advanced non-small cell lung cancer:a systematic review and meta-analysis of randomised clinical trials[J]. ESMO Open, 2017, 2(3): e000236. DOI:10.1136/esmoopen-2017-000236 |
| [18] |
VALECHA GK, VENNEPUREDDY A, IBRAHIM U, et al. Anti-PD-1/PD-L1 antibodies in non-small cell lung cancer:the era of immunotherapy[J]. Expert Rev Anticancer Ther, 2017, 17(1): 47. DOI:10.1080/14737140.2017.1259574 |
| [19] |
ADCOCK JL, BARROW CJ, BARNETT NW, et al. Chemiluminescence and electrochemiluminescence detection of controlled drugs[J]. Drug Test Anal, 2011, 3(3): 145. DOI:10.1002/dta.236 |
| [20] |
WANG L, YU C, YANG Y, et al. Development of a robust reporter gene assay to measure the bioactivity of anti-PD-1/anti-PD-L1 therapeutic antibodies[J]. J Pharm Biomed Anal, 2017, 145: 447. DOI:10.1016/j.jpba.2017.05.011 |
| [21] |
ANDERSON CL, WANG Y, RUSTANDI RR. Applications of imaged capillary isoelectric focussing technique in development of biopharmaceutical glycoprotein-based products[J]. Electrophoresis, 2012, 33(11): 1538. DOI:10.1002/elps.201100611 |
 2019, Vol. 39
2019, Vol. 39 
