2. 成都康弘药业集团股份有限公司, 成都 610000
2. Chengdu Kanghong Pharmaceutical Group, Chengdu 610000, China
年龄相关性黄斑变性(age-related maculard-egeneration,AMD)是视网膜黄斑部的退行性病变,主要发生于50岁以上人群,是全球成年人致盲的首要疾病之一[1-2]。AMD引起视力下降的主要原因为玻璃体中血管内皮生长因子(vascular endothelial growth factor,VEGF)浓度升高,导致脉络膜血管增生、渗出、出血和疤痕形成[3]。目前,玻璃体内注射抗VEGF药物是治疗湿性年龄相关性黄斑变性AMD的首选方法[4]。康柏西普(Conbercept)是一种重组人血管内皮生长因子受体-抗体融合蛋白,玻璃体内注射后,通过结合VEGF抑制新生血管生成,该产品于2013年12月被原国家食品药品监督管理总局(CFDA)批准上市,用于治疗湿性年龄相关性黄斑变性(nAMD),2017年5月批准用于治疗继发于病理性近视的脉络膜新生血管(pathologic myopia by choroidal neovascularization,pmCNV)引起的视力损伤,是CFDA批准的治疗pmCNV的首个抗VEGF药物[5-6]。2016年10月,美国食品和药品监督管理局(FDA)准许康柏西普在美国直接开展Ⅲ期临床试验。为在更高水平上控制康柏西普质量,以进一步确保产品的安全性和有效性,本文针对康柏西普的生物学活性、非还原SDS-PAGE纯度、唾液酸含量、糖基化项目的质量控制方法和不溶性微粒项目的质量标准,开展优化和提高研究,为实现我国自主知识产权的大分子眼用注射剂质量标准的国际化提供支持,也为国内同类产品的质量控制提供借鉴和参考。
1 材料和方法 1.1 材料HUVEC细胞,购自Sciencell公司,培养至第3代后冻存备用;NFAT-RE-luc2P/KDR HEK293细胞,购自Promega公司;Bio-Glo luciferase Assay System购自Promega公司;VEGF购自R & D公司,以1 mL磷酸盐缓冲液(phospahte buffered saline,PBS)溶解为50 μg·mL-1的VEGF浓缩液;康柏西普标准品,成都康弘生物技术有限公司制备;ECM培养基和ECGS,购自Sciencell公司;CCK-8购自Dojindo公司;4×上样缓冲液、10%固定浓度和4%~15%预制SDS-PAGE电泳胶购自Bio-Rad公司;唾液酸标准品为USP标准物质;Glycoworks HILIC uElution Plate购自Waters公司;PorteoExtract All-in-one Trypsin Digestion Kit(包括Trypsin、PNGase F、2-AB标记试剂及相关缓冲液等)购自Merck公司;ZORBAX Eclipse Plus C18色谱柱(2.1 mm×150 mm,1.8 μm)购自Agilent公司;Signal DMB Labeling Kit购自Prozyme公司;Bio SAX色谱柱(No-Porous,2.1 mm×250 mm,5 μm)购自Agilent公司;读板仪购自Molecular Devices公司,工作站配备SoftMax Pro控制和分析软件;XRS+型高分辨率凝胶成像系统购自Bio-Rad公司;Fluorescence Detector(FLD)-HPLC购自Agilent公司,工作站配备OpenLAB色谱控制和分析系统。
1.2 试验方法 1.2.1 生物学活性测定 1.2.1.1 HUVEC增殖抑制法HUVEC细胞以ECM完全培养基[含5%胎牛血清(fetal bovine serum,FBS)和ECGS的ECM培养基]重悬,按每孔100 μL接种于96孔细胞培养板,置37 ℃、5% CO2孵箱中培养20~28 h。用稀释液(含2% FBS的ECM培养基)梯度稀释参比品/样品和VEGF浓缩液,取参比品/样品系列稀释溶液与稀释后的VEGF溶液等体积混合,置37 ℃、5% CO2孵箱中培养3~4 h。孵育结束后,取出接种细胞的培养板,吸尽上清,每孔加入各浓度参比品/样品和VEGF的混合液100 μL,置37 ℃、5% CO2孵箱中培养90~98 h;孵育结束,每孔加入CCK-8 20 μL,置37 ℃、5% CO2孵箱中培养(4.0±0.5)h后,读板仪测定450 nm处各孔吸收度。以参比品/样品浓度为横坐标,以对应孔吸收度为纵坐标,绘制参比品/样品四参数模式剂量-反应曲线,其中拟合的四参数方程的C值即为EC50值,样品生物学活性=参比品EC50/样品EC50×100%。
1.2.1.2 RGA法NFAT-RE-luc2P/KDR HEK293细胞以测定稀释液(含1% FBS的DMEM)重悬,调整浓度至5×105个·mL-1,以每孔80 μL接种于96孔不透明细胞培养板上,置37 ℃、5% CO2孵箱中孵育1 h。用测定稀释液梯度稀释参比品/样品和VEGF浓缩液,取参比品/样品系列稀释样品溶液与稀释后VEGF溶液等体积混合,室温孵育30 min后,混合液以每孔20 μL加入上述细胞培养板中,置37 ℃、5% CO2孵箱中孵育6 h。孵育结束后,细胞培养板室温平衡10~15 min,每孔加入Bio-Glo Luciferase底物溶液100 μL,室温放置3~5 min,读板仪以化学发光模式读取各孔发光值,以参比品/样品浓度为横坐标,以对应孔发光值为纵坐标,绘制参比品/样品四参数模式剂量-反应曲线,其中拟合的四参数方程的C值即为EC50值,样品生物学活性=参比品EC50/样品EC50×100%。
1.2.2 非还原SDS-PAGE电泳20 μL稀释到特定浓度(使制备的供试品溶液上样量在0.125~20 μg范围内)的样品加入超纯水9 μL,3.6%(w/v)碘乙酰胺1 μL,4×上样缓冲液10 μL,70 ℃水浴10 min即得供试品溶液。取供试品溶液10 μL上样,80 V电泳30 min后再120 V电泳60 min,考马斯亮蓝R250染色液(考马斯亮蓝R250 1 g,甲醇200 mL,冰醋酸50 mL,超纯水250 mL)染色60 min后,以脱色液(乙醇250 mL,冰醋酸80 mL,超纯水定容至1 000 mL)脱色至背景无色,XRS+型高分辨率凝胶成像系统照相并分析。
1.2.3 唾液酸含量测定 1.2.3.1 间苯二酚法取特定量康柏西普置10 kD超滤管中,10 000 r·min-1离心20 min,弃滤过液,后加入500 μL PBS重复上述步骤2次,最后1次离心后,倒置超滤管,10 000 r·min-1离心20 min,获得脱盐的康柏西普样品。取超纯水系列稀释的唾液酸标准品和10 kD超滤管超滤脱盐的康柏西普样品各100 μL,分别置于磨口玻璃试管中,各标准品/样品中加入间苯二酚工作液(0.2%间苯二酚,0.25 mmol·L-1硫酸铜,20%盐酸)1 mL,于旋涡混合仪上震荡15 s并沸水浴30 min后,置冰浴3 min,然后每管加乙酸丁酯-正丁醇液(4:1)2 mL,振荡15 s混匀后室温静置10 min,吸取上层溶液于580 nm波长测定各管吸收度。以各标准品浓度为横坐标,吸收度为纵坐标,绘制直线回归标准曲线。根据标准曲线计算样品中唾液酸含量并转换为每1 mol康柏西普蛋白中含有的唾液酸摩尔数。
1.2.3.2 RP-HPLC法康柏西普样品按“1.2.3.1”项步骤描述,用10 kD超滤管超滤脱盐,脱盐样品以超纯水洗脱并紫外法定量。唾液酸标准品以超纯水溶解并梯度稀释。Signal DMB Labeling Kit中取出A瓶中的全部液体吸出加入到B瓶中,吹打至B瓶中的物质完全溶解后,将液体全部吸出,再加入到C瓶中,制备DMB标记溶液。取标准品/脱盐后样品100 μL,加入5 mol·L-1乙酸溶液80 ℃水浴2 h释放唾液酸。取标准品/脱盐样品各5 μL,置于1.5 mL离心管中,加入DMB标记溶液20 μL,50 ℃反应3 h,用水终止反应后通过C18反相色谱柱分离。色谱条件:流动相A为0.1%甲酸-水,流动相B为0.1%甲酸-乙腈,Agilent FLD-HPLC梯度洗脱(0~16 min,92%流动相A;16~20 min,0%流动相A;20~20.01 min,92%流动相A;20.01~35 min,92%流动相A),流速0.2 mL·min-1,柱温35 ℃,激发波长373 nm,发射波长448 nm,上样体积3 μL。检测结束后,根据标准品色谱图曲线下峰面积绘制浓度-峰面积标准曲线,根据标准曲线计算康柏西普样品中唾液酸含量,并转换为每1 mol康柏西普蛋白中含有的唾液酸摩尔数。
1.2.4 IEX-HPLC法测定糖谱样品用10 kD超滤管超滤脱盐后加入胰蛋白酶37 ℃下酶切1 h,然后加入PNGase F 37 ℃下反应2.5 h释放N-糖。酶切后样品经SPE纯化(样品中加入300 μL乙腈混匀,转移至Glycoworks HILIC μElution plate中,收集流穿液),真空离心干燥后,用2-AB试剂标记N-糖,65 ℃标记3 h,再次经SPE纯化后通过Bio-SAX色谱柱分离。Agilent FLD-HPLC色谱条件:流动相A为20%乙腈水溶液,流动相B为200 mmol·L-1甲酸铵-20%乙腈水溶液,梯度洗脱(0~5 min,100%流动相A;5~35 min,0%流动相A;35~40 min,0%流动相A;40~41 min,100%流动相A;41~60 min,100%流动相A),流速0.2 mL·min-1,柱温为室温,激发波长330 nm,发射波长420 nm,上样体积5 μL。按色谱图曲线下峰面积比例计算Z值,Z值=1×含1个唾液酸N-糖的峰面积比例+2×含2个唾液酸N-糖的峰面积比例+3×含3个唾液酸N-糖的峰面积比例+4×含4个唾液酸N-糖的峰面积比例[7]。
2 结果 2.1 RGA法测定康柏西普生物学活性康柏西普原检定规程中采用HUVEC增殖抑制法对其生物学活性进行检测,NFAT-RE-Luc2P/KDR HEK293为根据生理状态下人体内VEGF的信号传导机制建立的工程细胞株(图 1-A),通过对细胞密度、抗体浓度、VEGF浓度和孵育时间等一系列检测参数进行优化,建立康柏西普生物学活性的RGA测定方法[9],检测中所绘制的剂量反应曲线(图 1-B)明显优于HUVEC增殖抑制法。本研究对RGA法和HUVEC增殖抑制法进行比较,结果见表 1。由结果可见,RGA法检测周期更短,曲线的R2、信噪比和线性段范围均高于HUVEC增殖抑制法。检测性能方面,RGA法的准确度、精密度和中间精密度均优于HUVEC增殖抑制法。RGA法和HUVEC增殖抑制法测定康柏西普87个历史批次的生物学活性,结果见表 2、图 1-C。2种方法检测结果无显著性差异(t-test,P > 0.05),2种方法结果间具有可比性。RGA法检测结果的Mean±3SD范围窄于HUVEC增殖抑制法,说明RGA法的精密度更优,与方法验证结果相一致。使用RGA法对加速试验样品进行检测,并与HUVEC增殖抑制法结果比较,结果如图 1-D所示,RGA法在反映加速试验过程中的生物学活性下降方面,趋势更明显,且活性变化曲线的R2值显著高于HUVEC增殖抑制法(0.979 9 vs. 0.524 3)。综合各方面的比较结果,RGA法显著优于HUVEC增殖抑制法。
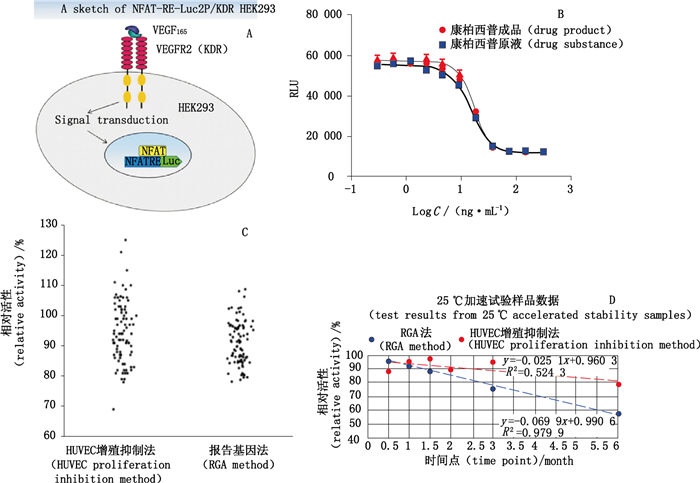
|
A. RGA法检测中VEGF激活NFAT-RE-Luc2P/KDR HEK293细胞报告基因表达机制(test mechanism of RGA method)B. RGA法检测康柏西普生物学活性的剂量-反应曲线(dose-reaction curve of Conbercept in RGA test)C. 2种方法测定康柏西普87个历史批次生物学活性的结果比较(comparison of the results of biological activity determinated by two methods in 87 historical batches)D. 2种方法测定加速稳定性样品结果比较(comparison of the results of two methods for determination of accelerated stability test samples) 图 1 RGA法与HUUVEC增殖抑制法比较 Figure 1 Comparison of RGA and HUVEC proliferation inhibition method |
|
|
表 1 RGA法和HUVEC增殖抑制法的验证和比较结果 Table 1 Comparison and validation results of RGA method and HUVEC proliferation inhibition method |
|
|
表 2 RGA法与HUUVEC增殖抑制法测定康柏西普87个历史批次生物学活性的结果比较 Table 2 Comparison of biological activity of Conbercept in 87 historical batches determined by RGA and HUUVEC |
康柏西普非还原SDS-PAGE纯度测定最初直接采用了《中华人民共和国药典》2015年版四部0541电泳法(第五法SDS-聚丙烯酰胺凝胶电泳),采用10%固定浓度胶,在10 μg上样量条件下对其电泳纯度进行控制。本研究中,在3 μg和10 μg上样量条件下,分别以4%~15%梯度胶和10%固定浓度胶进行SDS-PAGE电泳(图 2-A),梯度胶结果中可辨识3条杂带,而固定浓度胶中仅能辨识分子量差异最大的杂带3,杂带1、2不能与主带充分分离。为确定上样量,取0.125、0.25、0.5、1、1.5、2、3、4、10、20 μg共计10个上样量进行非还原SDS-PAGE测定,上样量与主带、主要杂带平均灰度值的线性关系分别如图 2-B、C所示。当上样量≤3 μg时,主带灰度值线性相关系数R2=0.993 7;当上样量在4 μg以上时,主带灰度值线性相关系数R2 < 0.99并随上样量增加快速下降。对于主要杂带的灰度值,当上样量≤20 μg时线性相关系数R2=0.990 0,因此选择3 μg作为上样量以保证主带和主要杂带的响应均位于线性范围内。根据上述结果,在非还原SDS-PAGE电泳检测中,选取4%~15%梯度胶,以3 μg上样量进行电泳,检测康柏西普非还原SDS-PAGE纯度。
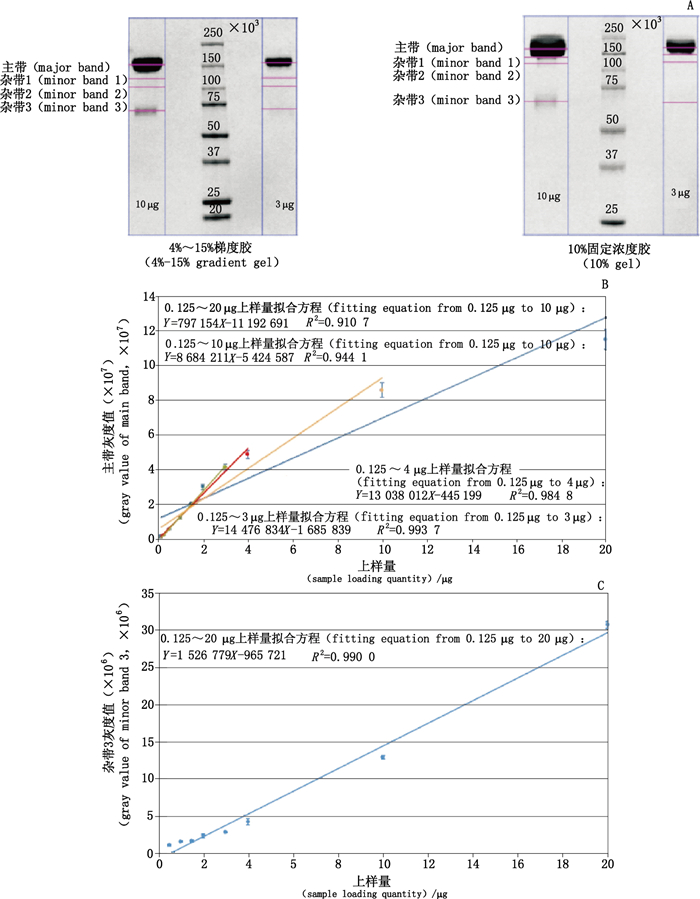
|
A. 4%~15%梯度胶和10%固定浓度电泳结果比较(electrophoresis results comparison of 4%-15% gradient gel and 10% gel)B. 0.125~20 μg上样量范围内主带灰度值与上样量线性回归图(main band grayscale value and loading quantity regression results within different loading range of 0.125-20 μg)C. 0.125~20 μg上样量范围内主要杂带灰度值与上样量线性回归图(main impurity band grayscale value and loading quantity regression results within loading range of 0.125-20 μg) 图 2 非还原SDS-PAGE电泳结果 Figure 2 Electrophoresis resutls of non-reduced SDS-PAGE |
康柏西普检定规程中采用间苯二酚法对其唾液酸含量进行控制,分别对RP-HPLC法(厂家方法)和间苯二酚法进行方法学验证,结果见表 3。验证结果显示,RP-HPLC法精密性、准确性、线性均优于间苯二酚法。分别采用RP-HPLC法和间苯酚法测定70个批次康柏西普原液的唾液酸含量,结果如图 3-A所示,RP-HPLC法检测结果的Mean±3SD范围窄于间苯二酚法,说明RP-HPLC法的精密度更优,与方法验证结果相一致。同时对结果进行比较,RP-HPLC法唾液酸含量检测结果的均值为13.1mol·mol-1,其均值比间苯二酚法检测结果均值低2.7 mol·mol-1(均值:15.8 mol·mol-1),因此对产生该差异的原因进行分析。
|
|
表 3 RP-HPLC法和间苯二酚法方法学验证结果 Table 3 Validation results of RP-HPLC method and phenylenediol coloring method |
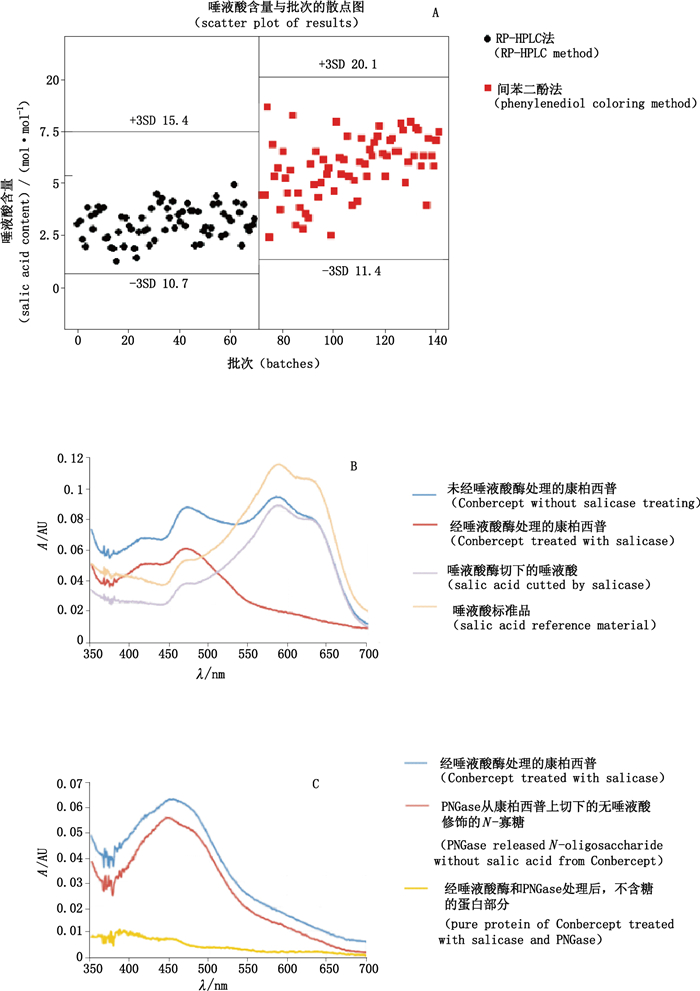
|
A. 70批次康柏西普原液的检测结果比较(comparison of 70 Conbercept batches tested with RP-HPLC method and phenylenediol coloring method)B.经唾液酸酶处理后的样品与间苯二酚反应后的吸收光谱(350~700 nm)[phenylenediol coloring result(350-700 nm)of sialidase treated Conbercept sample] C.经唾液酸酶和PNGase F处理后的样品与间苯二酚反应后的吸收光谱(350~700 nm)[phenylenediol coloring result(350-700 nm)of sialidase and PNGase F treated Conbercept samples] 图 3 RP-HPLC法与间苯二酚显色法检测结果比较和差异原因分析 Figure 3 Result difference between RP-HPLC method and phenylenediol coloring method and reason analysis |
康柏西普蛋白用10 kD超滤管超滤脱盐后加入唾液酸酶37 ℃水浴16~18 h,然后再次用10 kD超滤管超滤以去除切下的唾液酸,经质谱鉴定,唾液酸已完全切除。分别用RP-HPLC法和间苯二酚法检测不含唾液酸康柏西普蛋白中的唾液酸含量,RP-HPLC法检测结果接近于0,而间苯二酚法检测中不含唾液酸的康柏西普蛋白在580 nm处仍有一定光吸收,根据标准曲线计算切除唾液酸后的康柏西普蛋白中唾液酸含量约为3.1 mol·mol-1(图-B),与历史批次检测中2种方法唾液酸含量均值的差异(2.7 mol·mol-1)接近,结合文献分析,该显色可能来源于糖基化寡糖链中的非唾液酸糖[8]。为验证该假设,康柏西普蛋白经唾液酸酶切除唾液酸之后再加入0.2% RapiGest SF,沸水浴20 min后加入PNGase F 37 ℃ 16~18 h,切除剩余的寡糖链,并分离切下的寡糖链与蛋白。使用间苯二酚法分别检测经唾液酸酶处理的康柏西普蛋白、PNGase F切下的不含唾液酸的寡糖链及经唾液酸酶和PNGase F双重处理后的康柏西普蛋白部分,结果如图 3-C所示,证明糖基化寡糖链中的非唾液酸糖在间苯二酚法检测中于580 nm处亦有光吸收,而蛋白部分无吸收。这部分研究结果证明,康柏西普唾液酸含量检测中,RP-HPLC法较间苯二酚法更准确。
2.4 糖谱测定康柏西普蛋白2条肽链共计含有14个N-糖基化位点,对其N-糖基化的糖型无法与单个糖基化位点糖型进行关联。针对N-糖的唾液酸化是康柏西普稳定性的重要影响因素之一,本文选择IEX-HPLC方法测定康柏西普N-糖基化中唾液酸化糖链的Z值,对其糖基化进行控制。典型的IEX-HPLC图谱如图 4-A所示,可见N-糖链按所带唾液酸残基的数量被分为了5组,5组峰之间的分离度较好,说明该方法适用于康柏西普的糖谱检测。方法验证结果显示,各项验证数据均符合预定的合格标准。对21个历史批次的康柏西普原液进行检测,结果如4-B所示,所有批次的Z值均位于Mean±3SD范围内。
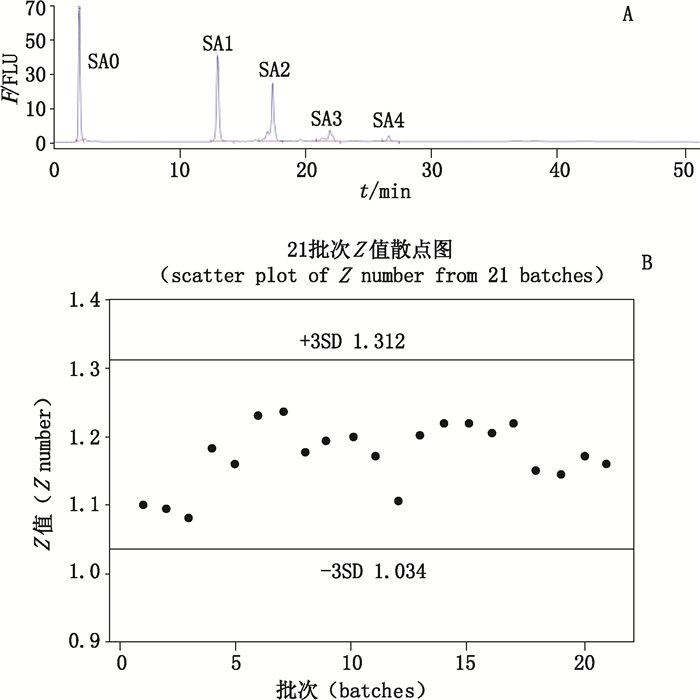
|
A.典型的糖谱检测色谱图(typical profile of glycosylation analysis with IEX-HPLC)B. 21个历史批次康柏西普糖谱Z值检测结果(Z number results of 21 Conbercept batches) 图 4 康柏西普的糖谱(IEX-HPLC)检测 Figure 4 Glycosylation assay of Conbercept with IEX-HPLC |
不溶性微粒按照2015年版《中华人民共和国药典》四部通则0903,采用光阻法测定,检测3批康柏西普成品,粒径≥10 μm的微粒数为(3.1±0.5)粒·mL-1,粒径≥25 μm和≥50 μm的微粒均未检出,符合美国药典中(USP<789>)关于眼用注射液不溶性微粒的相关规定(≥10 μm的微粒应≤50粒·mL-1;≥25 μm的微粒应≤5粒·mL-1;≥50 μm的微粒应≤2粒·mL-1)。
3 讨论RGA法检测中所使用的NFAT-RE-Luc2P/KDR HEK293细胞由Wang等构建,其报告基因激活表达机制完全模拟生理状态下人体内VEGF的信号传递机制,Wang等对比RGA法和HUVEC增殖抑制法对7个不同批次贝伐珠单抗的检测,结果显示RGA法的检测精密度和灵敏度更高[9],本文的结果也显示RGA法的精密度优于HUVEC增殖抑制法,且能够更好地反映康柏西普生物学活性的变化;非还原SDS-PAGE纯度检测中,本文研究结果显示4%~15%的梯度胶较10%固定浓度的凝胶对主带和杂带的分离度高,在上样量优化中,上样量为10 μg时,主带灰度值与上样量之间脱离线性范围,所计算的纯度低于实际值。只有当上样量位于主带、杂带灰度值的线性范围内时所得出的结果才能准确反映样品纯度。根据上述论述最终选择3 μg上样量,在该上样量条件下,主带与杂带均可检出,且对康柏西普纯度的测定结果更准确客观。文献报道中国仓鼠卵巢(Chinese hamster overy,CHO)细胞表达蛋白中常见的糖基化修饰[8],例如岩藻糖、半乳糖、甘露糖等能够与间苯二酚发生显色反应,显色产物在580 nm处仍有一定吸收度,本研究的结果也发现蛋白上非唾液酸的糖基化修饰能够与间苯二酚反应,生成在580 nm处有吸收度的产物,从而导致间苯二酚法检测结果高于RP-HPLC法。同时根据验证结果,RP-HPLC法定量唾液酸的准确度和精密度均优于间苯二酚法,因此使用RP-HPLC法替代原采用的间苯二酚法对康柏西普唾液酸含量进行检测;康柏西普有14个N-糖基化位点,糖型复杂且唾液酸修饰丰富,EP 9.2 <2.2.59> Glycan analysis of glycoproteins认可选择Z值定量反映唾液酸修饰的程度和分布,可以在产品各论中用作糖基化检测指标,因此在康柏西普N-糖基化质量标准设定中通过控制糖基化的Z值对康柏西普的糖基化类型进行控制。选择IEX-HPLC法检测N-糖基化修饰,N-糖链的唾液酸残基数量越多,其与阴离子交换柱的静电相互作用力越强,因此在盐梯度洗脱下的保留时间也越长,而带有相同唾液酸残基数量的不同糖型会在相近的保留时间被洗脱,从而避免色谱图过于复杂。除上述检测方法的优化外,针对康柏西普作为眼用注射剂,在不溶性微粒的质量标准进行提高,达到美国药典中对眼用溶液不溶性微粒的要求(USP<789>)。目前康柏西普眼用注射液的不溶性微粒标准已达到USP、EP、JP对于治疗性蛋白注射剂和眼用溶液的要求,在不溶性微粒控制上达到了国际化水平。
本部分工作对康柏西普的生物学活性、非还原SDS-PAGE纯度、唾液酸含量、N-糖谱的检测方法进行优化/提升,优化后方法的准确度、精密度,以及反映样品变化、杂质监控的能力均有明显提高。同时本文还对康柏西普的不溶性微粒项目的质量标准进行了提升,达到USP<789>中对眼用注射剂的要求。通过上述工作,可对康柏西普质量进行更加精确全面的控制,为保证产品质量提供技术保障。
| [1] |
FRIEDMAN DS, O'COLMAIN BJ, MUÑOZ B, et al. Prevalence of age-related macular degeneration in the United States[J]. Arch Ophthalmol, 2004, 122(4): 564. DOI:10.1001/archopht.122.4.564 |
| [2] |
HOGG RE, CHAKRAVARTHY U. Visual function and dysfunction in early and late age-related maculopathy[J]. Prog Retin Eye Res, 2006, 25(3): 249. DOI:10.1016/j.preteyeres.2005.11.002 |
| [3] |
NOMA H, MIMUYA T, EGUCHI S. Association of inflammatory factors with macular edema in branch retinal vein occlusion[J]. JAMA Ophthalmol, 2013, 131(2): 160. DOI:10.1001/2013.jamaophthalmol.228 |
| [4] |
李志强, 王春晓, 杨芳. 康柏西普辅助玻璃体切除术治疗糖尿病视网膜病变的效果[J]. 中华眼外伤职业眼病杂志, 2016, 38(10): 773. LI ZQ, WANG CX, YANG F. The effect of Conbercept assited vitrectomy for severe proliferation diabetic retinopathy[J]. J Injuries Occup Dis Eye Ophthalmic Surg, 2016, 38(10): 773. DOI:10.3760/cma.j.issn.2095-1477.2016.10.015 |
| [5] |
NGUYEN TT, GUYMER R. Conbercept (KH-902) for the treatment of neovascular age-related macular degeneration[J]. Expert Rev Clin Pharmacol, 2015, 8(5): 541. DOI:10.1586/17512433.2015.1075879 |
| [6] |
LU X, SUN X. Profile of Conbercept in the treatment of neovascular age-related macular degeneration[J]. Drug Des Devel Ther, 2015, 9: 2311. |
| [7] |
YUEN CT, ZHOU Y, WANG QZ, et al. Glycan analysis of glycoprotein pharmaceuticals:evaluation of analytical approaches to Z number determination in pharmaceutical erythropoietin products[J]. Biologicals, 2011, 39(6): 396. DOI:10.1016/j.biologicals.2011.08.012 |
| [8] |
SVENNERHOLM L. Quantitative estimation of sialic acids.Ⅱ.A colorimetric resorcinol-hydrochloric acid method[J]. Biochim Biophys Acta, 1957, 24(3): 604. |
| [9] |
WANG L, XU GL, GAO K, et al. Development of a robust reporter-based assay for the bioactivity determination of anti-VEGF therapeutic antibodies[J]. J Pharm Biomed Anal, 2016, 125: 212. DOI:10.1016/j.jpba.2016.03.042 |
 2019, Vol. 39
2019, Vol. 39 
