国家教育部主管、北京师范大学主办。
文章信息
- 曹衍淼, 林小楠, 纪林芹, 张粤萍, 张文新. 2017.
- CAO Yanmiao, LIN Xiaonan, JI Linqin, ZHANG Yueping, ZHANG Wenxin. 2017.
- COMT基因Val158Met多态性与同伴关系对青少年抑郁的影响
- The Interaction between Val158Met Polymorphism in the COMT Gene and Peer Relationship on Adolescents' Depression
- 心理发展与教育, 33(2): 216-227
- Psychological Development and Education, 33(2): 216-227.
- http://dx.doi.org/10.16187/j.cnki.issn1001-4918.2017.02.11
2. 美国Lewis and Clark大学, 波特兰 97219
2. Lewis & Clark College, Portland 97219
青少年抑郁是一种常见的情绪障碍和心理健康问题。在世界范围内,有接近1/3的青少年经历过明显的亚临床抑郁症状(Balazs et al., 2013)。青少年抑郁不仅会导致个体的心理社会功能失调,还会造成巨大的经济和医疗负担(Lépine & Briley, 2011)。由此,考察青少年抑郁的发病机制至关重要。
儿茶酚胺假说(catecholamine hypothesis)指出抑郁症的发病与儿茶酚胺在重要脑区的绝对或相对缺乏密切相关(Schildkraut, 1965)。因此,编码儿茶酚胺氧位甲基转移酶(catechol-O-methyltrans-ferase, COMT)的COMT基因受到研究者的广泛关注。该基因通过编码COMT酶降解中脑边缘系统和大脑奖赏通路中的多巴胺神经递质,减少这些脑区突触间隙中多巴胺的含量并且降低多巴胺释放,进而引发抑郁(Lachman et al., 1996)。COMT基因位于22号染色体q11.1~22q11.2区,在该基因上,Val158Met多态性是研究最为广泛的基因位点。该多态性在第158号密码子上蛋氨酸(Met)到缬氨酸(Val)的替换,能够导致COMT酶活性降低3~4倍(Lotta et al., 1995)。国内外研究一致显示,COMT基因Val158Met多态性与抑郁症状密切相关(Cao et al., 2014; Sheikh et al., 2013)。如Sheikh等人(2013)在两个独立的样本中进行研究均发现携带ValVal基因型的儿童比携带Met等位基因的儿童有更高水平的抑郁症状。
除了遗传基因,环境因素也是青少年抑郁的重要预测源。研究显示,在青少年期,个体对同伴的重视程度达到高峰,而来自同伴的评价及社会比较能够影响青少年自我概念的形成,进而影响焦虑、抑郁情绪(Cole et al., 2014)。同时,研究显示同伴关系是影响青少年抑郁的重要环境因素。同伴接纳(peer acceptance)和同伴拒绝(peer rejection)是测量同伴关系最常用的研究指标,前者是指同伴群体对某一个体的喜爱程度,后者是指同伴群体对某一个体的不喜欢程度(王美萍, 纪林芹, 张文新, 2015)。同伴接纳是青少年自尊和归属感的重要来源,是青少年抑郁的一种保护性因素(Baumeister & Leary, 1995)。同伴拒绝能够增加青少年的被排斥感,导致其形成较差的自我意识和自我图式,是青少年抑郁的风险因素(Platt, Kadosh, & Lau, 2013)。
更为重要的是,研究发现COMT基因Val158Met多态性与环境因素交互影响个体抑郁,但是研究结果尚存在分歧。譬如Mandelli等人(2007)对重性抑郁患者的研究发现,在经历压力性生活事件后,COMT Met等位基因携带者比ValVal基因型携带者表现出更高的罹患重性抑郁的风险。但是,Drury等人(2010)对儿童的追踪研究表明,在传统养育组中(高风险组),携带ValVal基因型的儿童比携带Met等位基因的儿童报告了更高水平的抑郁症状,而在新型看护组(低风险组)中,未发现COMT基因与儿童抑郁之间存在显著关联。此外,Zannas,McQuoid,Steffens,Chrousos和Taylor(2012)的研究发现,COMT基因Val158Met多态性不能调节压力性生活事件与老年抑郁症之间的关联。研究分歧的原因可能是不同研究考察的抑郁类型存在差异。抑郁存在不同的亚型,如抑郁情绪、抑郁综合症、重性抑郁或抑郁障碍以及伴随其他情绪障碍或躯体疾病的抑郁障碍(depressive disorders with comorbid somatic disorders)等(肖泽萍, 于欣, 徐一峰, 2009)。尽管多数研究发现重性抑郁(Fan et al., 2010)和抑郁情绪(Priess-Groben & Hyde, 2013)具有同样的风险基因,但是目前多基因研究也显示遗传因素对抑郁的影响因其严重程度而不同(Chang et al., 2014),并且重性抑郁和抑郁情绪中可能也存在着不同的发生机制(曹衍淼, 王美萍, 曹丛, 张文新, 2016)。已有研究被试主要为重性抑郁临床样本或具有受虐经历的特殊儿童,关于常态群体青少年抑郁的研究极少。已有研究结论能否解释正常青少年较为普遍的抑郁情绪和抑郁综合症尚有待验证。
通过梳理COMT基因与环境交互效应的研究,可以发现既有研究主要采用压力性生活事件、早期社会剥夺等消极环境指标(如如Åberg, Fandiño-Losada, Sjöholm, Forsell, & Lavebratt, 2011; Nyman et al., 2011)。这些研究的主要理论框架是“素质—压力模型”(diathesis-stress model),该模型假设行为或心理障碍是个人携带的易感基因和压力性事件的综合结果(Monroe & Simons, 1991),强调了风险基因和不良环境的消极累加效应,使得潜在的基因与积极环境的交互效应遭到忽视。近期,越来越多的研究显示“素质—压力模型”已经不能充分描述其他重要的基因×环境交互作用形式。新近兴起的理论模型——“不同易感性模型”(differential susceptibility model)认为,同一基因型不仅能够令个体在消极环境中变得“更坏”,也可能使个体从积极环境中获益而变得“更好”(Belsky & Pluess, 2009)。因此,为深入揭示遗传基因与环境因素对青少年抑郁的作用机制,需要同时考察青少年成长的积极和消极环境的影响,验证上述两种理论模型。
值得指出的是,研究者通常采用回归以及绘制交互作用图,以直接观察判定基因环境交互作用模式符合“素质—压力”还是“不同易感性”模型。然而,Belsky,Pluess和Widaman(2013)指出这种探索性而非假设检验的统计方法,其检验力的限制不利于检验两个竞争模型。近期研究者提出了更为严格的、基于理论假设的统计标准以检验这两个相互竞争的理论模型——再参数化回归模型(re-parameterized regression model)(Widaman et al., 2012)。该方法主要是将交互作用图的交叉点作为模型的一个参数进行点估计与区间估计,若交叉点的点估计与区间估计均落在环境变量取值范围内时模型拟合最优,则说明符合“不同易感性模型”;若点估计固定在环境变量的最大值处时模型拟合最优,则说明符合“素质—压力模型”(Widaman et al., 2012;Zhang et al., 2016; 曹丛等, 2016)。本研究采用这种新兴的方法验证COMT基因与同伴接纳、同伴拒绝的交互作用符合何种理论模型。
虽然目前研究致力于探索COMT基因与环境对抑郁的交互效应,但这些研究中仅有两项研究考察了COMT基因与环境交互作用机制的性别差异。Åberg等人(2011)的研究显示童年时期经历负性生活事件与Val158Met多态性交互预测成年男性患者罹患重性抑郁的风险,而与女性重性抑郁无关。Nyman等人(2011)对5225名正常成人被试进行的研究也表明COMT基因与压力性环境的交互效应仅能预测男性抑郁症状,相比MetMet基因型携带者,携带Val等位基因的男性在经历了环境压力后抑郁水平更高。事实上,诸多关于COMT基因与心理行为表型的关联研究显示,COMT基因的功能及其对药物的反应性均存在性别差异(Harrison & Tunbridge, 2008)。但是,以往多数研究未检验COMT基因与环境交互作用机制的性别差异,或者仅采用男性进行研究(Harrison & Tunbridge, 2008),因而无法充分回答COMT基因与环境的交互作用是否存在性别差异以及具体的差异模式等问题。基于此,本研究拟对性别差异问题进行考察。
综上,本研究拟以正常青少年为被试,同时采用同伴接纳和同伴拒绝指标,考察COMT基因Val158Met多态性与同伴关系对青少年抑郁的交互作用及其性别差异,并验证其交互作用符合何种理论假说(“素质—压力模型”或“不同易感性模型”)。
2 研究方法 2.1 研究对象本研究被试取自国内一项大型追踪项目。该追踪项目初始被试为山东省济南市14所小学(6所省级规范化小学,8所普通小学)39个班级(每所学校班级数在26到70人之间)的儿童。对这些儿童自9岁(小学三年级)开始每年进行一次追踪测评,至初中时被试分布在12所初中。初三时,同时测评了青少年的同伴关系和抑郁水平,并采取了被试的唾液样本测取基因信息。鉴于工作量和研究经费问题,以各学校班级为单位进行随机抽样进行基因测序,最终获得有效被试1082名,具有基因数据的样本和原始样本在基本人口学变量(性别、父母职业、受教育水平及家庭收入) (χ2s<6.04, ps>0.05)、抑郁及同伴接纳和拒绝得分上(ts<1.30, ps>0.05) 均不存在显著差异。为了解决潜在的人口分层问题,我们选择在汉族被试中进行分析,剔除少数民族(34人)的数据后共获有效被试1048名,其中男女各占50%,被试的平均年龄为15.34 ± 0.35岁。母亲和父亲平均年龄分别为42.13 ± 2.48岁和43.94 ± 3.07岁。母亲和父亲受教育水平在大专及大专以上者分别占61.9%和71.1%,高中学历者分别占26.6%和20.6%,初中及初中以下者分别占11.5%和8.3%。母亲和父亲职业为“农民或下岗失业人员”者分别占7.1%和3.6%,“蓝领”分别占23.3%和24.1%,“专业或半专业性人员”分别占69.6%和72.3%。青少年家庭月收入在3000元以下的占23.2%,3000~6000元之间的占48.0%,6000元以上的占28.8%。
2.2 研究工具、仪器与材料 2.2.1 同伴接纳和同伴拒绝采用同伴提名法评定青少年的同伴关系。要求被试写出班里最不喜欢的三位同学(消极提名)和最喜欢的三位同学(积极提名)。对每个被试的被提名次数进行班级内标准化,以便于不同班级青少年提名分数的比较。消极提名的标准分是同伴拒绝的指标,积极提名的标准分是同伴接纳的指标。
2.2.2 青少年抑郁量表采用儿童抑郁量表(Children’s Depression Inventory, CDI; Kovacs, 1992)测量青少年的抑郁水平。该量表共包含27个题目,要求被试评价近两周内的抑郁水平(如“我的生活很有意义”, “我的生活没有多大意义”, “我的生活一点意义都没有”),分别采用0、1、2记分,计算被试的抑郁均分,得分越高,表明青少年的抑郁水平越高。本研究中青少年抑郁的Cronbach’s α系数为0.88。
2.2.3 家庭社会经济地位家庭社会经济地位(social economic status, SES)由父母文化程度、父母职业及家庭收入合成。其中父母职业根据职业的专业技术性程度将职业归为三类:“农民或下岗失业人员”、“蓝领”和“专业或半专业性人员”,分别记为1~3分。父母受教育水平包括“小学或小学以下”、“初中(含初中未毕业)”、“高中或中专(含高中未毕业)”、“大专(含夜大、电大)”、“大学本科”和“研究生(硕士或博士)”六类,每一类分别记1~6分。家庭月收入从“1000元以下”到“8000元以上”每隔1000元划分为一类,分别记1~9分。参照有关研究(范兴华, 方晓义, 刘杨, 蔺秀云, 袁晓娇, 2012),采用因子分析法合成SES指标。SES得分越高,代表家庭社会经济地位越高。本研究采用合成后的SES变量作为控制变量。被试的SES平均数为0.01,标准差为0.97。
2.3 施测方法与程序本研究经过山东师范大学伦理委员会审核并获得批准。此外,本研究在进行数据收集前,将问卷施测、唾液提取及COMT基因分型流程等相关信息告知青少年所在学校、青少年监护人及青少年本人,得到三方的知情同意后进行了研究。
2.3.1 问卷调查程序以班级为单位采用问卷测评的方式分别测量青少年的抑郁水平及同伴关系;每次施测每个班级由2名经过严格培训并具有丰富施测经验的发展心理学教师和研究生担任主试,施测结束后问卷当场收回。所有问卷施测均取得了青少年、青少年家长及学校的同意。
2.3.2 DNA样本采集、提取、分型程序在征得青少年、监护人及学校三方同意的前提下,以班级为单位采集青少年的唾液样本以对COMT基因Val158Met多态性进行基因分型,每人采集2~5ml。本研究对唾液采集过程进行了严格的控制,具体的检测条件如下:1、要求被试在采样前30分钟不能进食、喝水、嚼口香糖、吸烟,在正式采样前会对被试进行询问,如果出现上述情况我们将会等待30分钟后进行唾液采集。2、在正式采样前会询问被试的身体状况,发高烧38℃以上的被试此次不予采集,后续联系被试在其身体状况良好时进行唾液采集。3、在采样完成后现场确认采样管中的纯净唾液是否符合标准,不符合标准的被试进行重新采集。获得唾液样本后,利用Sequenom(San Diego, CA, USA)芯片基质辅助激光解吸/电离飞行时间(MALDI-TOF)质谱平台对COMT基因Val158Met多态性进行基因分型。PCR(polymerase chain reaction,聚合酶链式反应)引物为F:ACGTTGGATGACCCAGCGGATGGTGGATTT,R:ACGTTGGATGTTTTCCAGGTCTGACAACGG。PCR反应条件为:94℃ 15min;94℃ 20s,56℃ 30s,72℃ 1min,共45个循环;最终72℃ 3min。随后经历单碱基延伸反应,并由MassARRAY Typer软件系统(版本号3.4) 完成基因分型分析。本研究所使用的检测平台和技术具有较高的可靠性(基因分型有效率>97%)。此外,我们随机抽查了检测结果与质谱图结果的一致性,保证了测序结果的可靠性。
2.4 数据处理与分析采用SPSS 22.0进行数据处理与分析。首先,采用独立样本t检验考察COMT基因Val158Met多态性与同伴接纳、同伴拒绝以及青少年抑郁间的关系;其次,采用皮尔逊积差相关考察同伴接纳、同伴拒绝、家庭社会经济地位与青少年抑郁的关系。第三,控制家庭社会经济地位,采用分层回归考察COMT基因与同伴接纳和拒绝对整体样本抑郁的影响,若交互项显著进行简单斜率检验。为了避免多元共线性问题,本研究将同伴接纳、同伴拒绝分别建模。第四,采用SAS、SPSS与R统计软件检验再参数化模型,通过F检验、AIC与BIC值等比较确定最优拟合模型(Widaman et al., 2012; 曹丛等,2016)。为了检验基因×环境交互作用是否存在性别差异,本研究将性别纳入回归模型考察其与COMT基因、同伴关系的三者交互作用。最后,分性别报告基因×环境交互效应结果。此外,根据Curran,West和Finch(1996)的标准(偏度不超过2,峰度不超过7),本研究中除了同伴拒绝外,所有变量均未明显偏离正态分布,因此仅对同伴拒绝进行平方根转换(DiLalla, Bersted, & John, 2015),转换后较好的矫正了偏态(校正后偏度为2.00,峰度为4.78)。
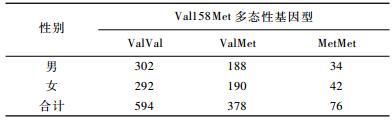
3 研究结果 3.1 COMT基因Val158Met位点的基因型分布在本研究中,COMT基因Val158Met位点的基因型分布见表 1,基因型的观测值与期望值吻合良好(χ2=2.16, df=1, p>0.05),符合Hardy-Weinberg平衡定律。COMT基因型分布不存在显著的性别差异(χ2=1.02, d=2, p>0.05)。由于MetMet和ValMet基因型与较低的COMT酶活性有关,因此参照同类研究的常规做法(如Hygen et al., 2015),在后续的分析中我们将MetMet与ValMet基因型携带者进行了合并,统称为Met等位基因携带者。
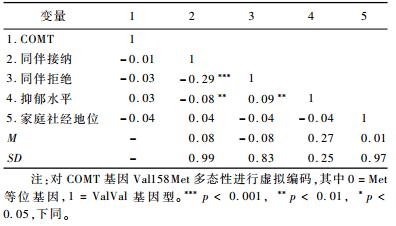
各变量的平均数、标准差及相关系数见表 2。为排除基因与环境相关,本研究对COMT基因与同伴接纳、同伴拒绝进行独立样本t检验,结果显示携带不同基因型的个体在同伴接纳(t(1042)=-0.36, p>0.05)、同伴拒绝(t(1042)=-0.91, p>0.05) 上均不存在显著差异。独立样本t检验显示,携带不同基因型的个体在抑郁水平上亦不存在显著差异(t(1010)=0.88, p>0.05)。同伴接纳与青少年抑郁呈显著负相关(r =-0.08, p<0.01),同伴拒绝与青少年抑郁呈显著正相关(r=0.09, p<0.01)。此外,独立样本t检验显示,青少年期抑郁水平(t(1010)=0.82, p>0.05) 和同伴接纳(t(1042)=-1.83, p>0.05) 均不存在显著的性别差异,但男生的同伴拒绝得分显著高于女生(t=4.25, p<0.001)。
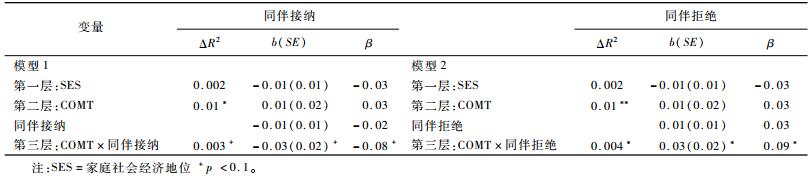
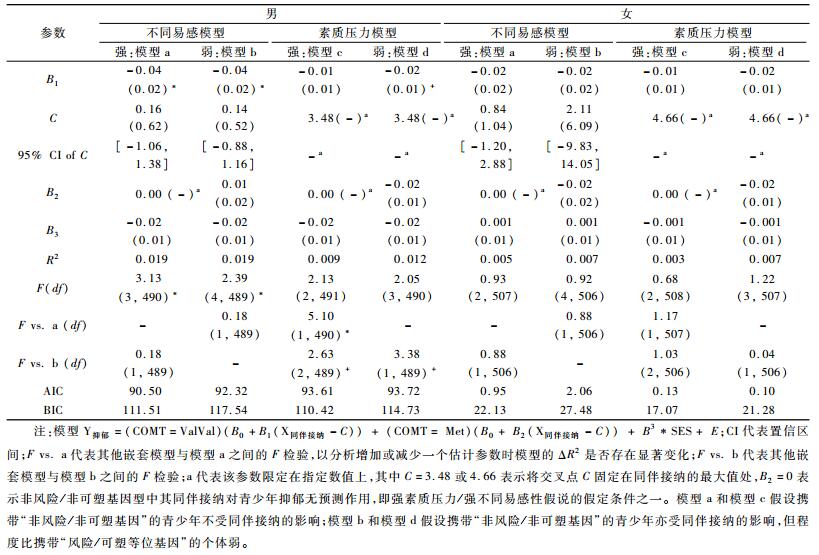
分层回归结果显示(见表 3),COMT基因与同伴接纳、同伴拒绝对青少年抑郁均无显著主效应;COMT基因与同伴接纳的交互作用可以边缘显著预测青少年抑郁,COMT基因与同伴拒绝的交互作用可以显著预测青少年抑郁。进一步的分组回归分析表明,同伴接纳显著负向预测携带ValVal基因型的青少年抑郁(β=-0.13, t=-3.02, p<0.01),同伴拒绝显著正向预测携带ValVal基因型的青少年抑郁(β=0.16, t=3.78, p<0.001),但是同伴接纳(β=-0.02, t=-0.40, p>0.05) 和同伴拒绝(β=0.03, t=0.66, p>0.05) 对携带Met等位基因的青少年抑郁预测作用均不显著。
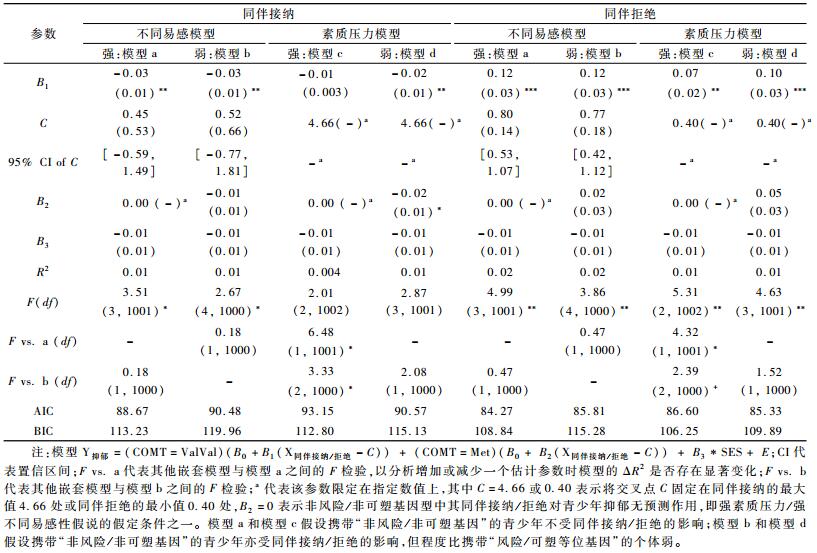
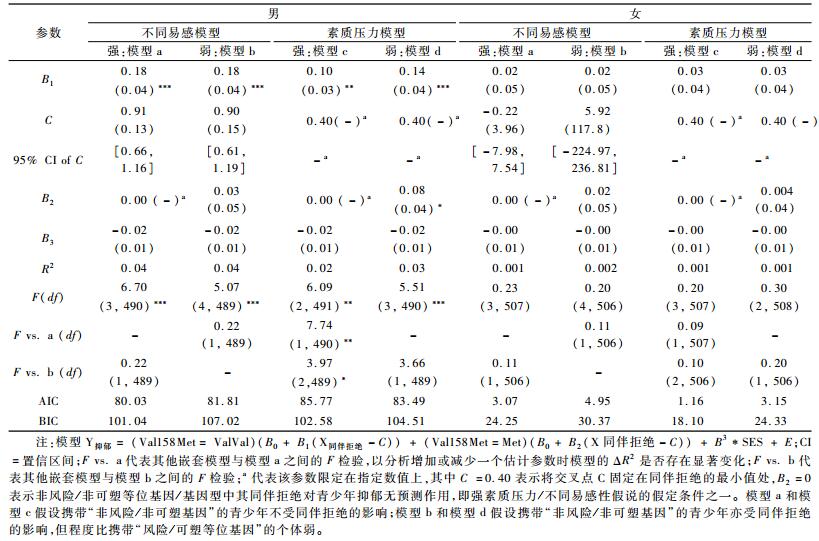
依据探索性结果,我们假设ValVal基因型为“风险/可塑”基因型,Met等位基因为“非风险/非可塑”等位基因,建构再参数化模型检验“素质—压力模型”与“不同易感性模型”。再参数化结果见表 4。在同伴接纳和拒绝模型中,强不同易感性模型(模型a)均优于其他模型(b、c、d)。具体指标如下:(1) 模型a本身拟合良好(同伴接纳:R2=0.01, p<0.05;同伴拒绝:R2=0.02, p<0.01);(2) 在限定B2=0(即限定Met等位基因携带者不受同伴关系的影响)时,同伴关系显著预测携带ValVal基因型青少年的抑郁(同伴接纳:B1=-0.03, SE=0.01, t=-2.91, p<0.01;同伴拒绝:B1=0.12, SE=0.03, t=3.59, p<0.001);(3) 交叉点C的点估计值及其95%置信区间位于同伴接纳(range=-1.84~4.66) 和拒绝(range=0.40~2.55) 变量的取值范围内,这说明结果模式更符合“不同易感性模型”。(4)F检验显示尽管模型b比模型a增加一个参数估计,但模型b解释的变异量并没有显著高于模型a(ΔR2s=0.00, ps>0.05),所以无法拒绝模型a;但模型a解释的变异量显著高于模型c(同伴接纳:ΔR2=0.01, p<0.05;同伴拒绝:ΔR2=0.01, p<0.05),所以拒绝模型c,选择模型a。(5) 模型a的AIC、BIC值均小于模型d,因此拒绝模型d,并且模型a的AIC值是四个模型中最小的。综上,各参数均表明,COMT基因Val158Met多态性与同伴关系对青少年抑郁的交互作用更加符合强不同易感性模型,相比Met等位基因携带者,携带ValVal基因型的青少年对同伴接纳和同伴拒绝均更加敏感。
为检验COMT基因与同伴接纳、同伴拒绝的交互效应是否存在性别差异,本研究将性别作为调节变量纳入上述回归模型,考察COMT基因×同伴接纳/拒绝×性别的三者交互作用。然而,分层回归结果显示,COMT基因×同伴接纳×性别的三者交互作用不显著(β=-0.09, t=-1.20, p>0.05)、COMT基因×同伴拒绝×性别的三者交互作用边缘显著(β=0.12, t=1.65, p=0.09)。进一步分性别进行回归分析(见表 5)发现,COMT基因与同伴接纳/同伴拒绝的交互作用可以显著预测男生抑郁,而对女生抑郁不存在显著的预测作用。对男生的分组回归结果与全样本结果完全一致,同伴接纳显著负向预测携带ValVal基因型的男生抑郁(β=-0.15, t=-2.62, p<0.01),同伴拒绝显著正向预测携带ValVal基因型的男生抑郁(β=0.25, t=4.32, p<0.001),但是同伴接纳(β=0.03, t=0.50, p>0.05) 和同伴拒绝(β=0.03, t=0.43, p>0.05) 对携带Met等位基因的男生抑郁预测作用均不显著。
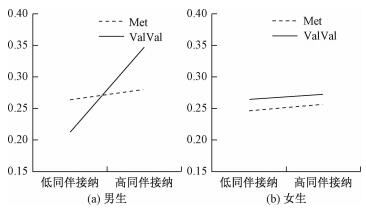
同样,本研究分性别建构再参数化模型检验“素质—压力模型”与“不同易感性模型”(见表 6和表 7)。对于男生而言,与全样本结果完全一致,在同伴接纳和拒绝模型中,强不同易感性模型(模型a)均优于其他模型(b、c、d)(图 1a和2a),在此不再赘述。对于女生而言,COMT基因与同伴接纳、同伴拒绝对女生抑郁均无显著交互作用,两等位基因亚组中同伴接纳、同伴拒绝对青少年抑郁的预测作用在四个模型中均不显著(|B1| ≤ 0.03, ps>0.05; |B2| ≤ 0.02, ps>0.05)。
|
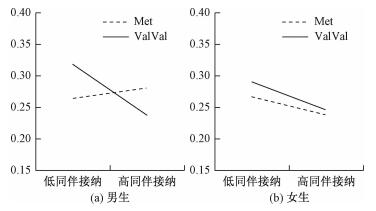
| 图 1 COMT基因Vall58Met多态性与同伴接纳对青少年抑郁的交互作用 |
|
| 图 2 COMT基因Vall58Met多态性与同伴拒绝对青少年抑郁的交互作用 |
本研究以汉族青少年为被试,考察COMT基因Val158Met多态性与同伴关系对青少年抑郁的交互作用模式及其性别差异。结果显示,COMT基因与同伴接纳、同伴拒绝对青少年抑郁具有交互作用,并且该交互作用更加符合不同易感性模型。具体表现为在高同伴接纳或低同伴拒绝环境中,携带ValVal基因型的青少年抑郁水平显著低于Met等位基因携带者,而在低同伴接纳或高同伴拒绝环境中,携带ValVal基因型的青少年抑郁水平显著高于Met等位基因携带者;值得指出的是,进一步的性别差异分析提示,相比女青少年,该交互作用与男青少年抑郁的关联更加密切。
与已有研究不同(Platt et al., 2013; 王美萍等, 2015),本研究未发现同伴关系对抑郁的主效应。正如一些研究指出,同伴接纳通常与青少年的亲社会行为等积极行为关系更加密切,而抑郁的缺失并不意味着一定表现出积极行为,这可能导致我们未检测到同伴接纳与抑郁之间的显著关联(Janssens et al., 2015)。此外,可能是由于本研究选取了正常群体的青少年,所报告的同伴拒绝的严重性程度较低,因而对抑郁没有显著的直接效应。COMT基因对青少年抑郁的主效应不显著,一方面正如Dunn等人(2015)所指出,单个候选基因位点对个体发展结果的效应量很小。另一方面可能是因为我们选取了正常青少年被试测量抑郁情绪,并不像重性抑郁患者那样具有严重的抑郁症状,因此其受到遗传影响的比重相对较小。此外,人类的抑郁情绪可能更多地受到基因与环境间更加复杂的交互作用机制的影响,而非仅仅是单基因的直接效应。
更为重要的是,我们发现COMT基因与同伴接纳/拒绝交互影响青少年抑郁,仅在ValVal纯合子中,同伴接纳/拒绝显著预测青少年抑郁。再参数化回归模型进一步发现相比“素质—压力模型”,上述交互作用更加符合“强不同易感性模型”,即ValVal基因型可能是一种可塑基因,携带ValVal基因型的青少年在消极环境中抑郁水平更高,但在积极环境中罹患抑郁的风险更小。虽然目前有关ValVal基因型对环境更为敏感的内在机制尚不清楚,但相关文献显示:在应对情绪面孔时,Val等位基因携带者的杏仁核与眶额叶皮层功能性联接能力减弱(Drabant et al., 2006),而前额叶晚熟理论指出前额叶与边缘系统之间联通能力的降低可能导致个体的情绪调节能力减弱,从而对环境更加敏感(Andersen & Teicher, 2008)。此外,Val等位基因可能引起阶段型多巴胺(phasic dopamine)释放升高,而调节细胞外多巴胺含量稳态的稳定型多巴胺(tonic dopamine)降低,阶段型多巴胺高于稳定型多巴胺的表现为神经网络的稳定性降低、认知灵敏性增加(Bilder, Volavka, Lachman, & Grace, 2004)。鉴于此,我们推测ValVal基因型更容易受到外界环境的影响。
较多的理论和实证证据表明,COMT基因的功能及其与心理或行为表型的关联存在性别差异(参见综述Harrison & Tunbridge, 2008),本研究分性别的回归分析也发现了类似的性别差异,但遗憾的是,这种差异的效果量很小。由此,我们对待这一性别差异结果应该更加谨慎。出现这种结果的原因在于本研究被试处于青少年期这一特殊的年龄阶段。事实上,在不同的发展阶段COMT的表达模式的性别差异可能存在差异(Harrison & Tunbridge, 2008)。研究发现COMT基因功能的性别差异主要受到雌性激素的影响(Jiang, Xie, Ramsden, & Ho, 2003)。而在女性一生中雌性激素水平并非保持稳定,尤其是在青少年期,女生的雌激素开始迅速升高但尚未达到成年女性的水平(Steinberg, 2014),我们推测青少年期是COMT基因功能出现性别差异的初始阶段,由此可能导致我们未检测到显著的性别差异。值得指出的是,本研究中分性别的回归分析与成人被试的研究结果(Åberg et al., 2011; Nyman et al., 2011)具有相同的趋势,均是发现COMT基因与环境因素的交互作用仅能预测男生抑郁,这也提示青少年期可能是性别差异的初始期。但是,未来需要更多的研究采用更广泛的年龄跨度来验证这一结果。此外,COMT基因与同伴关系的交互作用与男生抑郁更为密切可能源于雌激素对COMT基因表达的重要影响。既有研究显示,处于生理浓度的E2(17-β-雌二醇)能够抑制细胞中的COMT mRNA的表达,进而导致COMT酶活性降低(Jiang et al., 2003),由此女性脑内的多巴胺含量较高。研究一致表明过低的多巴胺含量与重性抑郁密切相关(Dunlop & Nemeroff, 2007)。由此,雌二醇可以通过影响COMT mRNA的表达,从而对女性起到保护性作用,男性则因缺少这种保护性机制而表现出较高的抑郁易感性。但是,雌激素对转录的调节仅能部分解释COMT基因功能的性别差异(Tunbridge & Harrison, 2010),未来研究应该进一步深入揭示COMT基因与环境交互作用性别二态性的机制。
尽管,本研究结果显示COMT基因×同伴接纳/拒绝的交互作用能够显著预测男青少年的抑郁。但是,COMT基因与同伴关系交互作用的效应量仅为1%,不仅对抑郁的解释率极为微弱,也远低于定量行为遗传学发现的抑郁遗传率(24~55%),由此应该更加谨慎的看待本研究结果:一方面,遗传基因及其与环境的交互效应仅仅揭示了抑郁致病因素的冰山一角。众所周知,抑郁的致病因素非常复杂,涉及生物、认知与社会环境因素等多方面的共同影响。如著名心理学家Hyde,Mezulis和Abramson(2008)提出的ABC模型将抑郁的影响因素概括为三类:情绪因素(affective),包含气质和情绪调节等;生物因素(biological),包含基因和荷尔蒙等;认知因素(cognitive),包含认知风格和反思特质等。即便是与抑郁密切相关的父母教养(环境因素)对儿童青少年抑郁的解释率也仅为8%(McLeod, Weisz, & Wood, 2007)。由此,仅仅考察单个影响因素(如环境)或者两个影响因素间的共同作用(如基因×环境交互效应)不足以充分解释抑郁的发病机制。未来研究应该进一步开展认知、生物、情绪和社会环境等多因素研究,以深入解释青少年抑郁的病因。另一方面,抑郁具有复杂的遗传机制,受到多种遗传基因的共同影响。单基因×环境交互研究为理解抑郁的发生机制与个体差异提供了重要启示,但可能简化了遗传基因对抑郁的作用过程,因而解释率受到限制。由此,未来研究应该考察多遗传基因对抑郁的联合效应。
最后需要指出的是,本研究仍存在一些局限性。首先,本研究依然是采用单基因—单环境交互设计考察问题,在遗传和环境指标上均与早期研究存在部分相似(曹丛等, 2016; 王美萍, 张文新, 陈欣银, 2015)。但是,不可否认单基因—环境交互效应仍然是当前研究的主流范式之一。近年来越来越多的研究采用更加丰富的设计考察多个基因和不同类型环境因素及不同年龄的共同作用(Zhang et al., 2015; Zhang, Cao, Wang, Ji, & Cao, 2016)。由此,未来研究应该进一步丰富研究设计,考察多基因—多环境对青少年抑郁及其发展变化的影响。尽管如此,本研究也具有创新之处:与以往研究选择青少年早期(11~13岁)不同(曹丛等, 2016; Zhang et al., 2015),本研究考察青少年中期(平均年龄15岁)也具有特殊的理论和实践意义:既有抑郁的发展轨迹研究显示虽然抑郁的发病率和严重性程度在青少年早期开始迅速增加(Avenevoli, Swendsen, He, Burstein, & Merikangas, 2015),但是在14~15岁左右时才达到顶峰(Natsuaki, Biehl, & Ge, 2009)。与此同时,15岁青少年处于初三年级,是从初中到高中生态过渡的关键期。正如有研究指出,生态过渡期是对同伴侵害等进行干预的最佳时期(陈亮, 2012)。由此,考察这一时期的基因×同伴关系交互作用,依据不同易感性模型,确定易感性个体,有针对性地进行同伴关系的预防与矫正,或许能够更有效的利用资源。第二,我们仅选取了一个时间点考察COMT基因与同伴关系对青少年中期抑郁的即时影响,而有研究显示青少年期可能是基因功能发展变化的关键期(Zhang et al., 2015),因此该研究结果能否扩展到青少年发展的其他阶段需要采用追踪研究进行验证。
5 结论据我们所知,本研究是首篇考察COMT基因Val158Met多态性与同伴关系对青少年抑郁的交互作用的研究。主要得出以下主要结论:(1) COMT基因与同伴关系交互影响青少年期抑郁,且这一交互作用与男生抑郁的关联更加紧密;(2) COMT基因与同伴关系的交互效应模式符合不同易感性模型,ValVal基因型对消极和积极同伴经历均更加敏感。
| Åberg E., Fandiño-Losada A., Sjöholm L. K., Forsell Y., & Lavebratt C.(2011). The functional Val 158 Met polymorphism in catechol-O-methyltransferase (COMT) is associated with depression and motivation in men from a Swedish population-based study. Journal of Affective Disorders, 129(1), 158-166. |
| Andersen S. L., & Teicher H. M.(2008). Stress, sensitive periods and maturational events in adolescent depression. Trends in Neurosciences, 31(4), 183-191. DOI: 10.1016/j.tins.2008.01.004. |
| Avenevoli S., Swendsen J., He J. P., Burstein M., & Merikangas K. R.(2015). Major depression in the national comorbidity survey-adolescent supplement:Prevalence, correlates, and treatment. Journal of the American Academy of Child & Adolescent Psychiatry, 54(1), 37-44. |
| Balazs J., Miklósi M., Keresztény á., Hoven C. W., Carli V., Wasserman C., & Cotter P.(2013). Adolescent subthreshold-depression and anxiety:Psychopathology, functional impairment and increased suicide risk. Journal of Child Psychology and Psychiatry, 54(6), 670-677. DOI: 10.1111/jcpp.12016. |
| Baumeister R. F., & Leary M. R.(1995). The need to belong:Desire for interpersonal attachments as a fundamental human motivation. Psychological Bulletin, 117(3), 497-529. DOI: 10.1037/0033-2909.117.3.497. |
| Belsky J., & Pluess M.(2009). Beyond diathesis stress:Differential susceptibility to environmental influences. Psychological Bulletin, 135(6), 885-908. DOI: 10.1037/a0017376. |
| Belsky J., Pluess M., & Widaman K. F.(2013). Confirmatory and competitive evaluation of alternative gene-environment interaction hypotheses. Journal of Child Psychology and Psychiatry, 54(10), 1135-1143. DOI: 10.1111/jcpp.12075. |
| Bilder R. M., Volavka J., Lachman H. M., & Grace A. A.(2004). The catechol-O-methyltransferase polymorphism:Relations to the tonic-phasic dopamine hypothesis and neuropsychiatric phenotypes. Neuropsychopharmacology, 29(11), 1943-1961. DOI: 10.1038/sj.npp.1300542. |
| Cao C. Q., Wang L., Wang R. C., Qing Y. L., Zhang J. X., & Wu G. W. Y.(2014). The COMT gene variant is associated with depression's decreased positive affect symptoms in Chinese adults. PsyCh Journal, 3(4), 264-272. DOI: 10.1002/pchj.63. |
| Chang S. C., Glymour M. M., Walter S., Liang L. M., Koenen K. C., & Tchetgen E. J.(2014). Genome-wide polygenic scoring for a 14-year long-term average depression phenotype. Brain and Behavior, 4(2), 298-311. DOI: 10.1002/brb3.2014.4.issue-2. |
| Cole D. A., Dukewich T. L., Roeder K., Sinclair K. R., McMillan J., & Will E.(2014). Linking peer victimization to the development of depressive self-schemas in children and adolescents. Journal of Abnormal Child Psychology, 42(1), 149-160. DOI: 10.1007/s10802-013-9769-1. |
| Curran P. J., West S. G., & Finch J. F.(1996). The robustness of test statistics to nonnormality and specification error in confirmatory factor analysis. Psychological Methods, 1(1), 16-29. DOI: 10.1037/1082-989X.1.1.16. |
| DiLalla L. F., Bersted K., & John S. G.(2015). Peer victimization and DRD4 genotype influence problem behaviors in young children. Journal of Youth and Adolescence, 44(8), 1478-1493. DOI: 10.1007/s10964-015-0282-4. |
| Drabant E. M., Hariri A. R., Meyer-Lindenberg A., Munoz K. E., Mattay V. S., & Kolachana B. S.(2006). Catechol O-methyltransferase Val158Met genotype and neural mechanisms related to affective arousal and regulation. Archives of General Psychiatry, 63(12), 1396-1406. |
| Drury S. S., Theall K. P., Smyke A. T., Keats B. J. B., Egger H. L., & Nelson C. A.(2010). Modification of depression by COMT val158met polymorphism in children exposed to early severe psychosocial deprivation. Child Abuse & Neglect, 34(6), 387-395. |
| Dunlop B. W., & Nemeroff C. B.(2007). The role of dopamine in the pathophysiology of depression. Archives of General Psychiatry, 64(3), 327-337. DOI: 10.1001/archpsyc.64.3.327. |
| Dunn E. C., Brown R. C., Dai Y., Rosand J., Nugent N. R., & Amstadter A. B.(2015). Genetic determinants of depression:Recent findings and future directions. Harvard Review of Psychiatry, 23(1), 1-18. DOI: 10.1097/HRP.0000000000000054. |
| Fan M., Liu B., Jiang T., Jiang X., Zhao H., & Zhang J.(2010). Meta-analysis of the association between the monoamine oxidase-A gene and mood disorders. Psychiatric Genetics, 20(1), 1-7. DOI: 10.1097/YPG.0b013e3283351112. |
| Harrison P. J., & Tunbridge E. M.(2008). Catechol-O-methyltransferase (COMT):A gene contributing to sex differences in brain function, and to sexual dimorphism in the predisposition to psychiatric disorders. Neuropsychopharmacology, 33(13), 3037-3045. DOI: 10.1038/sj.npp.1301543. |
| Hyde J. S., Mezulis A. H., & Abramson L. Y.(2008). The ABCs of depression:Integrating affective, biological, and cognitive models to explain the emergence of the gender difference in depression. Psychological Review, 115(2), 291-313. DOI: 10.1037/0033-295X.115.2.291. |
| Hygen B. W., Belsky J., Stenseng F., Lydersen S., Guzey I. C., & Wichstrøm L.(2015). Child exposure to serious life events, COMT, and aggression:Testing differential susceptibility theory. Developmental Psychology, 51(8), 1098-1104. DOI: 10.1037/dev0000020. |
| Janssens A., Van Den Noortgate W., Goossens L., Verschueren K., Colpin H., De Laet S., & Van Leeuwen K.(2015). Externalizing problem behavior in adolescence:Dopaminergic genes in interaction with peer acceptance and rejection. Journal of Youth and Adolescence, 44(7), 1441-1456. DOI: 10.1007/s10964-015-0304-2. |
| Jiang H., Xie T., Ramsden D. B., & Ho S. L.(2003). Human catechol-O-methyltransferase down-regulation by estradiol. Neuropharmacology, 45(7), 1011-1018. DOI: 10.1016/S0028-3908(03)00286-7. |
| Kovacs, M. (1992). Children's depression inventory(CDI) manual. Toronto:Multi-Health Systems Inc. |
| Lachman H. M., Papolos D. F., Saito T., Yu Y. M., Szumlanski C. L., & Weinshilboum R. M.(1996). Human catechol-O-methyltransferase pharmacogenetics:Description of a functional polymorphism and its potential application to neuropsychiatric disorders. Pharmacogenetics and Genomics, 6(3), 243-250. DOI: 10.1097/00008571-199606000-00007. |
| Lépine J. P., & Briley M.(2011). The increasing burden of depression. Neuropsychiatric Disease and Treatment, 7(1), 3-7. |
| Lotta T., Vidgren J., Tilgmann C., Ulmanen I., Melen K., Julkunen I., & Taskinen J.(1995). Kinetics of human soluble and membrane-bound catechol O-methyltransferase:A revised mechanism and description of the thermolabile variant of the enzyme. Biochemistry, 34(13), 4202-4210. DOI: 10.1021/bi00013a008. |
| Mandelli L., Serretti A., Marino E., Pirovano A., Calati R., & Colombo C.(2007). Interaction between serotonin transporter gene, catechol-O-methyltransferase gene and stressful life events in mood disorders. The International Journal of Neuropsychopharmacology, 10(4), 437-447. DOI: 10.1017/S1461145706006882. |
| McLeod B. D., Weisz J. R., & Wood J. J.(2007). Examining the association between parenting and childhood depression:A meta-analysis. Clinical Psychology Review, 27(8), 986-1003. DOI: 10.1016/j.cpr.2007.03.001. |
| Monroe S. M., & Simons A. D.(1991). Diathesis-stress theories in the context of life stress research:Implications for the depressive disorders. Psychological Bulletin, 110(3), 406-425. DOI: 10.1037/0033-2909.110.3.406. |
| Natsuaki M. N., Biehl M. C., & Ge X.(2009). Trajectories of depressed mood from early adolescence to young adulthood:The effects of pubertal timing and adolescent dating. Journal of Research on Adolescence, 19(1), 47-74. DOI: 10.1111/jora.2009.19.issue-1. |
| Nyman E. S., Sulkava S., Soronen P., Miettunen J., Loukola A., Leppä V., & Paunio T.(2011). Interaction of early environment, gender and genes of monoamine neurotransmission in the aetiology of depression in a large population-based Finnish birth cohort. BMJ Open, 1(1), 1-13. |
| Platt B., Kadosh K. C., & Lau J. Y.(2013). The role of peer rejection in adolescent depression. Depression and Anxiety, 30(9), 809-821. DOI: 10.1002/da.2013.30.issue-9. |
| Priess-Groben H. A., & Hyde J. S.(2013). 5-HTTLPR X stress in adolescent depression:Moderation by MAOA and gender. Journal of Abnormal Child Psychology, 41(2), 281-294. DOI: 10.1007/s10802-012-9672-1. |
| Schildkraut J. J.(1965). The catecholamine hypothesis of affective disorders:A review of supporting evidence. American Journal of Psychiatry, 122(5), 509-522. DOI: 10.1176/ajp.122.5.509. |
| Sheikh H. I., Kryski K. R., Smith H. J., Dougherty L. R., Klein D. N., & Bufferd S. J.(2013). Catechol-O-Methyltransferase gene val 158 met polymorphism and depressive symptoms during early childhood. American Journal of Medical Genetics Part B:Neuropsychiatric Genetics, 162(3), 245-252. DOI: 10.1002/ajmg.b.v162.3. |
| Steinberg, L. (2014). Adolescence (10th ed.). New York:McGraw-Hill. |
| Tunbridge, E. M., & Harrison, P. J. (2010). Importance of the COMT gene for sex differences in brain function and predisposition to psychiatric disorders. In J. C. Neill & J. Kulkarni (Eds.), Biological Basis of Sex Differences in Psychopharmacology (pp. 119-140). Berlin Heidelberg:Springer. |
| Widaman K. F., Helm J. L., Castro-Schilo L., Pluess M., Stallings M. C., & Belsky J.(2012). Distinguishing ordinal and disordinal interactions. Psychological Methods, 17(4), 615-622. DOI: 10.1037/a0030003. |
| Zannas A. S., McQuoid D. R., Steffens D. C., Chrousos G. P., & Taylor W. D.(2012). Stressful life events, perceived stress, and 12-month course of geriatric depression:Direct effects and moderation by the 5-HTTLPR and COMT Val158Met polymorphisms. Stress, 15(4), 425-434. DOI: 10.3109/10253890.2011.634263. |
| Zhang L., Li Z., Chen J., Li X., Zhang J., & Belsky J.(2016). The BDNF Val66Met polymorphism interacts with maternal parenting influencing adolescent depressive symptoms:Evidence of differential susceptibility model. Journal of Youth and Adolescence, 45(3), 471-483. DOI: 10.1007/s10964-015-0378-x. |
| Zhang W. X., Cao Y. M., Wang M. P., Ji L. Q., Chen L., & Deater-Deckard K.(2015). The dopamine D2 receptor polymorphism (DRD2 TaqIA) Interacts with maternal parenting in predicting early adolescent depressive symptoms:Evidence of differential susceptibility and age differences. Journal of Youth and Adolescence, 44(7), 1428-1440. DOI: 10.1007/s10964-015-0297-x. |
| Zhang W., Cao C., Wang M., Ji L., & Cao Y.(2016). Monoamine oxidase a (MAOA) and catechol-o-methyltransferase (COMT) gene polymorphisms interact with maternal parenting in association with adolescent reactive aggression but not proactive aggression:evidence of differential susceptibility. Journal of Youth and Adolescence, 45(4), 812-829. DOI: 10.1007/s10964-016-0442-1. |
| 曹丛, 王美萍, 纪林芹, 魏星, 曹衍淼, 张文新. (2016). MAOA基因rs6323多态性与母亲支持性教养对青少年抑郁的交互作用:素质-压力假说与不同易感性假说的检验. 心理学报, 48(1), 22-35. |
| 曹衍淼, 王美萍, 曹丛, 张文新. (2016). 抑郁的多基因遗传基础. 心理科学进展, 24(4), 525-535. |
| 陈亮. (2012). 青少年早期的同伴侵害: 发展轨迹, 相关因素及性别差异(博士学位论文). 山东师范大学. |
| 范兴华, 方晓义, 刘杨, 蔺秀云, 袁晓娇. (2012). 流动儿童歧视知觉与社会文化适应, 社会支持和社会认同的作用. 心理学报, 44(5), 647-663. |
| 王美萍, 纪林芹, 张文新. (2015). MAOA基因rs6323多态性与同伴关系对男青少年早期抑郁的影响. 心理学报, 47(10), 1260-1268. |
| 王美萍, 张文新, 陈欣银. (2015). 5-HTR1A基因rs6295多态性与父母教养行为对青少年早期抑郁的交互作用:不同易感性模型的验证. 心理学报, 47(5), 600-610. |
| 肖泽萍, 于欣, 徐一峰. (2009). 抑郁障碍的抗抑郁药物治疗和其他治疗. 北京: 人民卫生出版社. |
 2017, Vol. 33
2017, Vol. 33