病毒必需依赖于宿主细胞进行自我复制和增殖。病毒增殖过程分为吸附、穿入、脱壳、生物合成、装配与释放5个阶段。如果在病毒吸附宿主细胞这一阶段发生障碍,则可显著影响病毒的增殖,且细胞内部的线粒体等细胞器不会受到损害。补体调节蛋白46(complement regulator protein,CD46),在人类上也常被称为膜辅因子蛋白(membrane cofactor protein,MCP)[1],是补体活化的调节因子。由于CD46是多种细菌和病毒的受体,所以也被称为病原体磁铁[2-3]。这些病原体包括11种人类病原体(6种细菌和5种病毒),以及黄病毒科,瘟病毒属的一些成员,如牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)、经典猪瘟病毒(classical swine fever virus,CSFV)和非典型猪瘟病毒(atypical porcine pestivirus,APPV)等[1]。
牛病毒性腹泻是威胁牛群健康的重要传染病之一。近期有研究发现,通过CRISPRs/Cas9基因编辑技术改变牛CD46的BVDV结合域在个体水平具有抗BVDV的作用[4]。因此,研究CD46对加快抗病育种,提高畜牧业生产效益具有重要意义。本文主要综述了CD46的基因结构及其与家畜病毒性疾病感染的关系,为家畜抗病育种相关工作研究提供新思路。
1 CD46基因1986年,Seya等[5]在人单核细胞样细胞系中发现一种可以切割补体因子C3b和C4b的膜蛋白,其在防止自体补体活化方面起着重要作用,将其命名为MCP。MCP是补体激活调节因子(regulators of complement activation,RCA)家族中的跨膜蛋白[6-7]。补体系统是一组由20多种血清蛋白组成的系统,它们在暴露于外来抗原时被激活,在早期针对病原体启动快速、局部和严格调节的酶级联反应,即先天免疫反应[8]。在病毒感染的初始阶段,补体可能通过多种机制干扰病毒的增殖,包括改变病毒受体的空间位阻以阻止病毒附着、融合和进入宿主细胞。无论是否存在抗体,C3b和/或C4b蛋白水解片段的调理作用可以产生炎症和适应性免疫应答,以及诱导吞噬细胞聚集、裂解和清除病毒[9]。补体的不适当激活可能对正常宿主细胞或组织造成潜在损害,因此受到膜结合蛋白CD35、CD46、CD55和CD59等RCA的严格调节,它们参与补体级联反应各个阶段的生理控制[8]。
CD46存在于哺乳动物所有的有核细胞上,除了在补体调节中的作用外,CD46还与T细胞活化、细胞代谢、增殖和自噬有关。已被证明CD46功能缺陷会导致非典型溶血性尿毒症综合征等其他疾病,而CD46表达的上调在所有癌症中都有发现,但上调程度不同[3]。CD46由4个补体调控蛋白(complement control protein,CCP)结构域(也称短共识重复序列(short consensus repeats,SCRs))组成,记为CCP1~CCP4(或SCR1~SCR4),它们具有不同的功能。补体因子C3b和C4b在CCP2、CCP3和CCP4位点结合[10]。CD46的生理配体主要与细胞膜近端CCP3和CCP4相互作用,而病原体主要与细胞膜远端CCP1和CCP2相互作用[11]。
根据美国国家生物技术信息中心(national center for biotechnology information,NCBI)的数据显示,CD46基因在染色体的位置及mRNA长度在不同物种中存在差异(表 1)。以牛为例,CD46基因位于16号染色体上,mRNA长度为3 402 bp,蛋白质编码区序列(coding sequence,CDS)位于1~1 098 bp。据研究报道,在不同物种中,以CD46为受体的病毒及其与CD46的结合位点也有差异(表 1)。
|
|
表 1 不同物种CD46基因的信息 Table 1 Information of CD46 gene in different species |
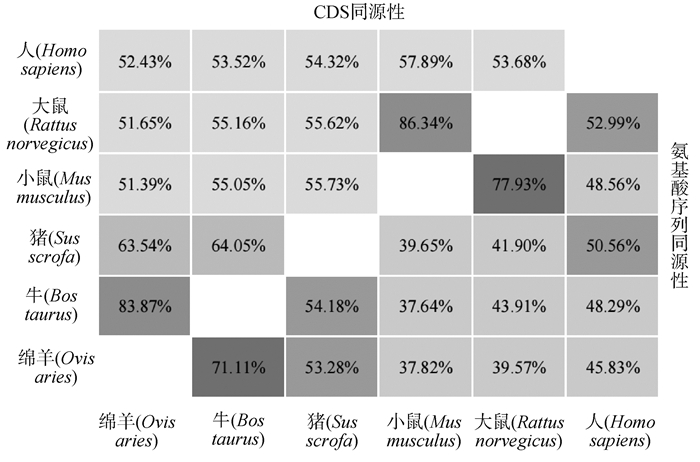
使用Mega7构建进化树,以牛CD46的蛋白质序列为根,以人、小鼠、大鼠、牛、猪和绵羊的CD46蛋白序列为外群,进行同源性比较。结果显示,牛、绵羊和猪的同源性较近,其中牛与绵羊的同源性最高,与小鼠和大鼠的同源性最低(图 1)。使用DNAMAN的Alignment功能将人、小鼠、大鼠、牛、猪和绵羊CD46的CDS及其编码的氨基酸序列以两两比对的方式进行同源性分析。在CDS上,大鼠和小鼠的同源性最高(86.34%),牛和绵羊的同源性次之(83.87%),小鼠和绵羊的同源性最低(51.39%)。在蛋白质水平上,大鼠和小鼠的同源性最高(77.93%),牛和绵羊的同源性次之(71.11%),小鼠和牛的同源性最低(37.64%)(图 2)。由此看出,不同物种间CD46基因的同源性存在一定差异。说明哺乳动物进化过程中不同物种的CD46基因和蛋白出现了较大的差异。

|
图 1 CD46基因在不同物种上的进化树 Fig. 1 Evolution tree of CD46 gene in different species |
|
图 2 各物种间CD46基因在CDS序列及氨基酸序列的同源性比较 Fig. 2 Comparison of homology in CDS and amino acid sequences of CD46 gene among different species |
病毒通过与细胞受体的相互作用来识别易感细胞是成功感染的先决条件[26]。作为病毒的细胞受体,必须满足可以与病毒结合和介导病毒入侵这两个要求[27]。多种物质可以作为病毒受体,例如碳水化合物、脂质和蛋白质,通常有多种受体参与病毒进入。迄今为止,已有大量研究证明,黄病毒科(Pestivirus)瘟病毒属(Flaviviridae)病毒的E2囊膜蛋白与宿主细胞CD46膜蛋白有相互作用。如BVDV进入宿主细胞的主要方式是通过E2结合CD46并介导网格蛋白依赖的内吞作用[23, 26, 28-29]。其他瘟病毒属的成员如CSFV、APPV和类似HoBi的瘟病毒(HoBi-like pestiviruses,HoBiPeV)也被证明进入宿主细胞的过程与CD46有关[22, 30]。
2.1 BVDV与CD46蛋白的相互作用BVDV的宿主动物种类繁多,包括牛、山羊、绵羊、猪、马、鹿和骆驼等[31],其可以造成牛群繁殖力下降,犊牛、羔羊或仔猪的死亡,猪瘟疫苗免疫失败[32],给全球养殖业造成巨大的经济损失。BVDV可以感染多种组织,有研究发现牛黏膜上皮组织、中枢神经系统[33-34]、骨髓、外周血、淋巴组织[35]和生殖道[36]的细胞都能感染BVDV。在感染的晚期,BVDV几乎存在于所有器官和组织中[37],这表明该病毒进入宿主细胞使用了CD46等普遍存在的受体。
2004年,Maurer等[23]用单克隆抗体技术首次检测出牛CD46参与BVDV的吸附和进入。他还发现,人HeLaCD46和鼠LCD46细胞系可以被BVDV吸附,但病毒无法进入细胞。这一结果可能与CD46的蛋白结构有关,牛和人/鼠的氨基酸序列同源性较低,人/鼠的CD46蛋白无法介导BVDV病毒入侵。还有研究发现,多种BVDV分离株接种CD46敲除MDBK细胞系后的感染率明显降低[38]。随后Krey等[24]发现,牛的CD46蛋白CCP1结构域中反向平行的β链上的两个短肽(E66QIV69和G82QVLAL87)对BVDV结合和感染至关重要。将GQVLAL替换为ALPTFS或者将EQIV和GQVLAL这两个短肽序列交换,都会导致牛CD46无法吸附BVDV,并且如果在猪的CD46 CCP1中添加这两种牛的短肽,会使得猪对BVDV的易感性增加30倍。猪和绵羊对BVDV的易感性远低于牛,但仍然易感。根据NCBI上的蛋白质序列,猪和绵羊的CD46蛋白都不含EQIV短肽,但绵羊含有GQVLAL这一短肽,说明BVDV相较于牛,不容易吸附于猪和绵羊的细胞,但也许可以通过吸附其他细胞受体或者CD46的其他结构域进入宿主细胞。
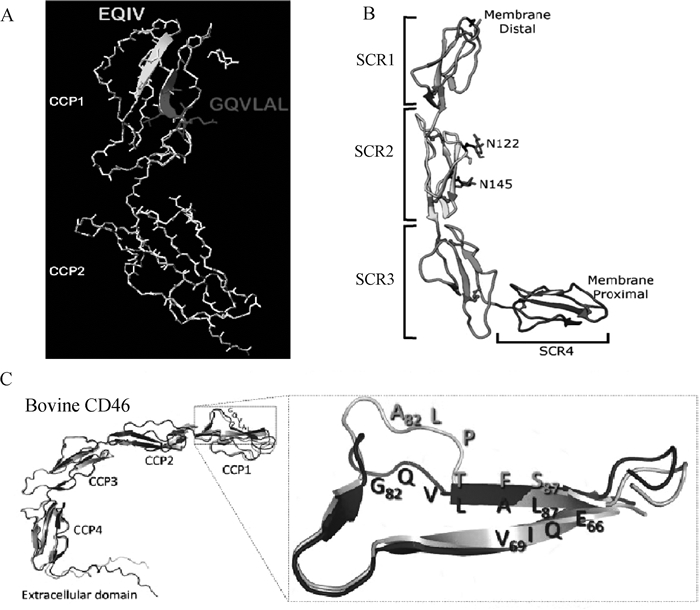
随着科学技术的发展,科学家们对牛CD46蛋白质的结构有了更直观的了解,包括各种不同形式的卷曲、转向以及与BVDV结合位点等情况。2006年,Krey等[24]在人CD46 CCP1和CCP2晶体结构基础上,用瑞士模型对牛CD46进行建模(图 3A)。Aitkenhead等[7]揭示了牛CD46细胞外区域的X射线晶体结构(图 3B)。还有研究者用AlphaFold2对野生型牛CD46细胞外结构域(G82QVLAL87)进行了预测(图 3C)[4]。
|
A.瑞士模型对牛CD46的建模[24];B.牛CD46细胞外区域的X射线晶体结构[7];C.AlphaFold2对野生型牛CD46细胞外结构域(G82QVLAL87链)的预测[4] A. The Swiss model for modeling bovine CD46[24]; B. The X-ray crystal structure of the extracellular region of bovine CD46[7]; C. Prediction of the extracellular domain (G82QVLAL87 chain) of wild-type bovine CD46 by using AlphaFold2[4] 图 3 牛CD46蛋白质的结构 Fig. 3 Structure of bovine CD46 protein |
已知BVDV进入宿主细胞主要有3个阶段。首先是Erns与硫酸乙酰肝素(heparan sulphates,HS)发生互作[39],然后E2与CD46结合,通过网格蛋白介导的内吞作用,最后在酸性环境下,内吞囊泡和宿主细胞膜结构融合,病毒释放到宿主细胞质中[40]。虽然诸多研究证明CD46是BVDV的细胞受体,但并未解析它在病毒附着和进入过程中的确切功能。Riedel等[41]使用荧光基团-E2标记的BVDV颗粒和荧光基团-CD46诱导表达的SK6细胞系,进行了活细胞成像试验。发现在添加病毒后20 min,表达荧光基团标记的牛CD46在SK6细胞表面存在定向和扩散运动。与未接种BVDV相比,接种BVDV后细胞膜上的CD46蛋白定向运动的速度显著增加。表明牛CD46的存在影响病毒定向转运的速度。如果E2未与CD46结合,则BVDV难以进入细胞。
2.2 其他瘟病毒与CD46蛋白的相互作用CSFV是唯一一种选择性感染猪的瘟病毒,会导致猪流行性出血热,具有高度传染性,对全球养猪业构成威胁,被世界动物卫生组织确定为法定报告疾病[42]。猪CD46是否是CSFV的重要细胞受体存在争议。有研究表明,用猪CD46单克隆抗体将PK15和从家猪外周血收集的单核细胞的CD46受体阻断后,CSFV的感染阳性率只有30%(未处理组感染率接近100%),表明猪CD46是CSFV的重要细胞受体[20]。另一项研究也发现,用干扰性小RNA分子将PK15的CD46干扰后,可以显著抑制CSFV的复制;并且免疫共沉淀试验证实CD46与CSFV的E2存在相互作用,激光共聚焦试验发现CD46和E2蛋白在细胞膜上存在共定位现象;微量热泳动检测结果证明CD46与E2蛋白具有较强的亲和力,证明CD46蛋白通过与E2蛋白相互作用介导CSFV在细胞表面的吸附[43]。与此相反的是,另一项研究使用CRISPR/CAS9技术,在猪CD46 CCP1结构域设计了引导RNA,获得猪CD46敲除的SPEV和PK15细胞系,但敲除细胞系的CSFV感染率与对照组没有显著差异[22]。该作者认为猪CD46不是进入宿主细胞的重要决定因素。以上两个研究结果提示,猪CD46在CSFV入侵宿主细胞的过程中起了一定作用,但CSFV与猪CD46的结合位点可能不在CCP1。APPV与仔猪的健康有关,在全世界的猪群中高度流行[44]。猪CD46敲除的PK15和SPEV细胞系感染试验证明猪CD46是APPV的主要受体[22]。
HoBiPeV是2004年首次从一批来自巴西的胎牛血清中分离出来[45],之后在几个国家的健康牛和患病牛中也检测到了该病毒。临床症状与BVDV引起的牛病毒性腹泻病相似,该病毒后来被归为Pestivirus H[46]。有研究发现,牛CD46是HoBiPeV的主要细胞进入因子,CD46敲除的MDBK细胞系中HoBiPeV感染阳性率低于1%[30]。
边境病病毒(border disease virus,BDV)主要感染绵羊和山羊,牛[47]和猪[48]也易感,不同物种间可以相互传播。2013至2015年,中国相继从山羊群[49]、绵羊群[50]和仔猪[51]中分离出BDV,但没有从牛上分离出BDV的报道。可能由于BDV感染牛后的临床病程与BVDV感染的临床病程相似[47],有些BDV感染被当作BVDV感染处理。国外出现多个经ELISA检测呈BVDV阳性,但RT-PCR鉴定为BDV的病例[52]。由于几乎所有的BDV分离株在细胞培养中都是非细胞致病性的[53],鲜见急性病程,多为流产、不孕、生产弱羔等生产性疾病,也有公牛持续感染BDV后发生睾丸变性和萎缩[52]。还有研究表明,猪感染BDV后4~14 d内出现病毒血症,但没有出现临床症状和病理变化。值得注意的是,BDV的感染会使猪对CSFV疫苗接种的抗体反应下调。初次接种疫苗后CSFV抗体特异性和中和抗体滴度均为阴性,即使在加强疫苗接种后,这两个指标仍然显著低于未感染BDV组[51]。如今对该病毒进入宿主细胞的机制研究较少,用NCBI比对BVDV和BDV E2蛋白的氨基酸序列,同源性为54%,有极大可能BDV的宿主受体也是CD46,值得进一步研究。
3 CD46基因在抗病育种中的研究BVDV对牛群危害巨大,且目前针对BVDV的疫苗免疫达不到理想效果。由于该病毒各型之间存在抗原性差异,即使机体针对某个基因型的疫苗产生了抗体,也不能抵御其他基因型病毒的侵染。目前,我国流行的BVDV和CSFV野毒株在E2抗原基因上均存在较大的变异现象,E2蛋白结构的改变尤其是在抗原表位上的改变,都可使病毒逃脱抗体对其的清除,是防治持续性感染的主要困难之一[54]。前人的研究表明,牛CD46是多种BVDV毒株的细胞受体,包括一些临床分离的未经细胞水平检验的毒株[24, 55]。由此可见,通过基因编辑CD46产生具有抗BVDV性状的牛具有良好的前景。
2023年,Workman等[4]使用CRISPR介导的同源性定向修复和体细胞核移植技术产生1头抗BVDV的活犊牛。该牛CD46基因的BVDV结合结构域中有6个氨基酸被替换(G82QVLAL87替换为A82LPTFS87)。研究称该牛能正常存活至少20个月,首次证明了牛CD46基因中A82LPTFS87的替代可能不会对出生前或出生后的发育产生负面影响。他们对该犊牛进行了全基因组测序,没有发现脱靶。而后从该犊牛分离皮肤成纤维细胞、外周血淋巴细胞和单核细胞,进行了11个BVDV毒株的体外攻毒试验。各个毒株对皮肤成纤维细胞的感染效率平均降低了96%(范围88%~99%),对淋巴细胞的易感性平均降低了96%(范围84%~100%),单核细胞对BVDV的易感性显著降低,RNA水平平均减少163倍(范围7~446倍)[4]。之后该团队在该牛10月龄的时候进行了BVDV自然感染试验。使其以及1头野生型CD46荷斯坦牛与1头自然持续感染BVDV(基因型1b)的犊牛共处7 d。两只试验牛都出现了发烧和外周血白细胞减少的症状,但只有野生型牛表现出咳嗽、鼻炎和鼻孔周围发红等其他感染迹象。通过全血RT-qPCR测量,在野生型牛中检测到BVDV病毒血症,并持续28 d,但BVDV的RNA仅有3 d能在CD46编辑牛的全血中检测到,并且病毒RNA载量峰值显著降低。此外,从CD46编辑牛中分离的外周血单核细胞在整个过程中未感染BVDV,而来自野生型牛的外周血单核细胞在12 d内为BVDV RNA检测阳性[4]。该团队从体外和体内都证明了CD46基因G82QVLAL87的替换可以有效抵御BVDV的侵染。
值得注意的是,和其他病毒一样,BVDV具有多个宿主细胞受体。除CD46以外,还有HS[39],低密度脂蛋白(low density lipoprotein,LDL)[56]和ADAM17[26]。有研究发现,虽然用CRISPR/Cas9核糖核蛋白复合物介导的编辑方法获得的CD46(E66QIV69和G82QVLAL87)敲除MDBK细胞系能抵抗BVDV的初次感染,但进一步传代后,感染率显著上升,将BVDV测序发现,病毒基因组发生改变,通过增加与HS的结合来补偿不能与CD46受体结合[38]。除此之外,虽然BVDV主要通过E1-E2二聚体结合细胞受体CD46并介导网格蛋白依赖性内吞作用的方式入侵宿主细胞,但有研究证明在CD46受体被中和的情况下,BVDV可以通过直接细胞间传播的方式从感染细胞进入未感染细胞[57]。虽然现在通过编辑CD46生产的第一头抗BVDV牛已经出生,且初步检测证明在细胞水平具有抗多种BVDV的效果,个体水平具有抵抗来自持续感染BVDV牛传播的非细胞病变毒株的能力。但仍需要更长时间的观察以及更多方式的检验。检验后代是否仍具有抗BVDV的能力?个体对细胞病变型BVDV的易感性如何?已知CD46在精子的顶体外膜表达[58],A82LPTFS87的替代是否会对授精有负面影响?
已经清楚BVDV能侵染牛单核细胞和巨噬细胞并进行复制,影响天然免疫和特异性免疫,严重阻碍机体对病毒的清除[59-60]。如果E66QIV69和G82QVLAL87的敲除或替换可以有效阻碍BVDV吸附并进入普通细胞、单核细胞和巨噬细胞,将在机体病毒载量不会有大量增加的同时,极大的有利于免疫细胞对病毒的清除。
4 总结与展望首先,CD46是一个可以选择的抗瘟病毒育种的重要靶标,多种瘟病毒间可以多物种交叉感染,且CD46是一个共有的受体蛋白,修饰一个基因可以达到抵抗多种疫病的作用。但是CD46具有多种重要的生理功能,进行随机敲除可能产生生理缺陷,不能获得健康的动物个体。其次,病原体主要与CD46的CCP1和CCP2相互作用,基于现在可以从分子水平上对某单个或多个氨基酸进行定点修饰的基因编辑技术,如果发现病毒的特定结合域,就可以在不影响CD46基因其他功能的情况下生产具有特定抗病性能的家畜。但目前仅牛CD46蛋白BVDV的精准结合位点已被解析,由于种间CD46蛋白结构具有一定差异,BVDV的猪和绵羊CD46精准靶点,以及其他瘟病毒在各物种CD46的特定结合区域尚有待进一步发现。最后,病毒进入宿主细胞的途径多,机制复杂,且变异能力强,瘟病毒的受体蛋白有待进一步研究与验证。通过多基因编辑改变宿主细胞上多个瘟病毒受体蛋白的结构也许是一种可以选择的方式,进一步结合高通量筛选评估,筛选能有效编辑的干细胞株,结合细胞核移植技术,定向培育能高繁殖率抗病的优质种家畜,加快精准育种进程。
| [1] |
LISZEWSKI M K, ATKINSON J P. Complement regulator CD46:genetic variants and disease associations[J]. Hum Genomics, 2015, 9(1): 7. DOI:10.1186/s40246-015-0029-z |
| [2] |
CATTANEO R. Four viruses, two bacteria, and one receptor: membrane cofactor protein (CD46) as pathogens' magnet[J]. J Virol, 2004, 78(9): 4385-4388. DOI:10.1128/JVI.78.9.4385-4388.2004 |
| [3] |
LISZEWSKI M K, ATKINSON J P. Membrane cofactor protein (MCP; CD46): deficiency states and pathogen connections[J]. Curr Opin Immunol, 2021, 72: 126-134. DOI:10.1016/j.coi.2021.04.005 |
| [4] |
WORKMAN A M, HEATON M P, VANDER LEY B L, et al. First gene-edited calf with reduced susceptibility to a major viral pathogen[J]. PNAS Nexus, 2023, 2(5): pgad125. DOI:10.1093/pnasnexus/pgad125 |
| [5] |
SEYA T, TURNER J R, ATKINSON J P. Purification and characterization of a membrane protein (gp45-70) that is a cofactor for cleavage of C3b and C4b[J]. J Exp Med, 1986, 163(4): 837-855. DOI:10.1084/jem.163.4.837 |
| [6] |
LISZEWSKI M K, POST T W, ATKINSON J P. Membrane cofactor protein (MCP or CD46): newest member of the regulators of complement activation gene cluster[J]. Annu Rev Immunol, 1991, 9: 431-455. DOI:10.1146/annurev.iy.09.040191.002243 |
| [7] |
AITKENHEAD H, STUART D I, EL OMARI K. Structure of bovine CD46 ectodomain[J]. Viruses, 2023, 15(7): 1424. DOI:10.3390/v15071424 |
| [8] |
BISWAS M, JOHNSON J B, KUMAR S R P, et al. Incorporation of host complement regulatory proteins into newcastle disease virus enhances complement evasion[J]. J Virol, 2012, 86(23): 12708-12716. DOI:10.1128/JVI.00886-12 |
| [9] |
BLUE C E, SPILLER O B, BLACKBOURN D J. The relevance of complement to virus biology[J]. Virology, 2004, 319(2): 176-184. DOI:10.1016/j.virol.2003.11.029 |
| [10] |
IWATA K, SEYA T, YANAGI Y, et al. Diversity of sites for measles virus binding and for inactivation of complement C3b and C4b on membrane cofactor protein CD46[J]. J Biol Chem, 1995, 270(25): 15148-15152. DOI:10.1074/jbc.270.25.15148 |
| [11] |
PERSSON B D, SCHMITZ N B, SANTIAGO C, et al. Structure of the extracellular portion of CD46 provides insights into its interactions with complement proteins and pathogens[J]. PLoS Pathog, 2010, 6(9): e1001122. DOI:10.1371/journal.ppat.1001122 |
| [12] |
NANICHE D, VARIOR-KRISHNAN G, CERVONI F, et al. Human membrane cofactor protein (CD46) acts as a cellular receptor for measles virus[J]. J Virol, 1993, 67(10): 6025-6032. DOI:10.1128/jvi.67.10.6025-6032.1993 |
| [13] |
MANCHESTER M, VALSAMAKIS A, KAUFMAN R, et al. Measles virus and C3 binding sites are distinct on membrane cofactor protein (CD46)[J]. Proc Natl Acad Sci U S A, 1995, 92(13): 2303-2307. |
| [14] |
SANTORO F, KENNEDY P E, LOCATELLI G, et al. CD46 is a cellular receptor for human herpesvirus 6[J]. Cell, 1999, 99(7): 817-827. DOI:10.1016/S0092-8674(00)81678-5 |
| [15] |
MORI Y, SEYA T, HUANG H L, et al. Human Herpesvirus 6 variant A but not variant B induces fusion from without in a variety of human cells through a Human Herpesvirus 6 entry receptor, CD46[J]. J Virol, 2002, 76(13): 6750-6761. DOI:10.1128/JVI.76.13.6750-6761.2002 |
| [16] |
PARSONS A J, STEIN K R, ATANASOFF K E, et al. The CD46 ectodomain participates in human cytomegalovirus infection of epithelial cells[J]. J Gen Virol, 2023, 104(9): 001892. |
| [17] |
HEMSATH J R, LIACI A M, RUBIN J D, et al. Ex vivo and in vivo CD46 receptor utilization by species D human adenovirus serotype 26 (HAdV26)[J]. J Virol, 2022, 96(3): e0082621. DOI:10.1128/JVI.00826-21 |
| [18] |
EFFANTIN G, HOGRAINDLEUR M A, FENEL D, et al. Toward the understanding of DSG2 and CD46 interaction with HAdV-11 fiber, a super-complex analysis[J]. J Virol, 2023, 97(11): e0091023. DOI:10.1128/jvi.00910-23 |
| [19] |
SEGERMAN A, ATKINSON J P, MARTTILA M, et al. Adenovirus type 11 uses CD46 as a cellular receptor[J]. J Virol, 2003, 77(17): 9183-9191. DOI:10.1128/JVI.77.17.9183-9191.2003 |
| [20] |
DRÄGER C, BEER M, BLOME S. Porcine complement regulatory protein CD46 and heparan sulfates are the major factors for classical swine fever virus attachment in vitro[J]. Arch Virol, 2015, 160(3): 739-746. DOI:10.1007/s00705-014-2313-y |
| [21] |
LAMOTHE-REYES Y, FIGUEROA M, SÁNCHEZ O. Host cell factors involved in classical swine fever virus entry[J]. Vet Res, 2023, 54(21): 115. |
| [22] |
CAGATAY G N, ANTOS A, SUCKSTORFF O, et al. Porcine complement regulatory protein CD46 is a major receptor for atypical porcine pestivirus but not for classical swine fever virus[J]. J Virol, 2021, 95(9): e02186-20. |
| [23] |
MAURER K, KREY T, MOENNIG V, et al. CD46 is a cellular receptor for bovine viral diarrhea virus[J]. J Virol, 2004, 78(4): 1792-1799. DOI:10.1128/JVI.78.4.1792-1799.2004 |
| [24] |
KREY T, HIMMELREICH A, HEIMANN M, et al. Function of bovine CD46 as a cellular receptor for bovine viral diarrhea virus is determined by complement control protein 1[J]. J Virol, 2006, 80(8): 3912-3922. DOI:10.1128/JVI.80.8.3912-3922.2006 |
| [25] |
ZEZAFOUN H, DECREUX A, DESMECHT D. Genetic and splice variations of Bos taurus CD46 shift cell permissivity to BVDV, the bovine pestivirus[J]. Vet Microbiol, 2011, 152(3-4): 315-327. DOI:10.1016/j.vetmic.2011.05.028 |
| [26] |
QI S H, WO L, SUN C, et al. Host cell receptors implicated in the cellular tropism of BVDV[J]. Viruses, 2022, 14(10): 2302. DOI:10.3390/v14102302 |
| [27] |
TARDIEU M, EPSTEIN R L, WEINER H L. Interaction of viruses with cell surface receptors[J]. Int Rev Cytol, 1982, 80: 27-61. |
| [28] |
LIANG D L, SAINZ I F, ANSARI I H, et al. The envelope glycoprotein E2 is a determinant of cell culture tropism in ruminant pestiviruses[J]. J Gen Virol, 2003, 84(5): 1269-1274. DOI:10.1099/vir.0.18557-0 |
| [29] |
BORCA M V, HOLINKA L G, RAMIREZ-MEDINA E, et al. Identification of structural glycoprotein E2 domain critical to mediate replication of Classical Swine Fever Virus in SK6 cells[J]. Virology, 2019, 526: 38-44. DOI:10.1016/j.virol.2018.10.004 |
| [30] |
LEVERINGHAUS E, CAGATAY G, HARDT J, et al. Different impact of bovine complement regulatory protein 46 (CD46bov) as a cellular receptor for members of the species Pestivirus H and Pestivirus G[J]. Emerg Microbes Infect, 2022, 11(1): 60-72. DOI:10.1080/22221751.2021.2011620 |
| [31] |
赵玉宾. 新疆南疆地区马鹿感染BVDV流行病学调查[D]. 阿拉尔: 塔里木大学, 2021. ZHAO Y B. Epidemiological investigation of BVDV infection in red deer in southern Xinjiang[D]. Alaer: Tarim University, 2021. (in Chinese) |
| [32] |
邹宏, 夏应菊, 李玲, 等. 猪瘟病毒和牛病毒性腹泻病毒双重荧光定量PCR检测方法的建立和初步应用[J]. 畜牧兽医学报, 2023, 54(10): 4422-4427. ZOU H, XIA Y J, LI L, et al. Establishment and preliminary application of a dual real-time RT-PCR assay for CSFV and BVDV[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(10): 4422-4427. (in Chinese) |
| [33] |
HEWICKER-TRAUTWEIN M, TRAUTWEIN G, MOENNIG V, et al. Infection of ovine fetal brain cell cultures with cytopathogenic and non-cytopathogenic bovine viral diarrhoea virus[J]. Vet Microbiol, 1992, 33(1-4): 239-248. DOI:10.1016/0378-1135(92)90052-U |
| [34] |
GALLINA L, KOCH M C, GENTILE A, et al. Bovine viral diarrhoea virus 1b infection associated with congenital tremor and hypomyelination in Holstein calves[J]. Vet Microbiol, 2021, 256: 109047. DOI:10.1016/j.vetmic.2021.109047 |
| [35] |
MARSHALL D J, MOXLEY R A, KELLING C L. Distribution of virus and viral antigen in specific pathogen-free calves following inoculation with noncytopathic bovine viral diarrhea virus[J]. Vet Pathol, 1996, 33(36): 311-318. |
| [36] |
FRAY M D, MANN G E, CLARKE M C, et al. Bovine viral diarrhoea virus: its effects on ovarian function in the cow[J]. Vet Microbiol, 2000, 77(1-2): 185-194. DOI:10.1016/S0378-1135(00)00275-3 |
| [37] |
LIEBLER-TENORIO E M, GREISER-WILKE I, POHLENZ J F. Organ and tissue distribution of the antigen of the cytopathogenic bovine virus diarrhea virus in the early and advanced phase of experimental mucosal disease[J]. Arch Virol, 1997, 142(8): 1613-1634. DOI:10.1007/s007050050184 |
| [38] |
SZILLAT K P, KOETHE S, WERNIKE K, et al. A CRISPR/Cas9 generated bovine CD46-knockout cell line-A tool to elucidate the adaptability of bovine viral diarrhea viruses (BVDV)[J]. Viruses, 2020, 12(8): 859. DOI:10.3390/v12080859 |
| [39] |
IQBAL M, FLICK-SMITH H, MCCAULEY J W. Interactions of bovine viral diarrhoea virus glycoprotein E(rns) with cell surface glycosaminoglycans[J]. J Gen Virol, 2000, 81(2): 451-459. |
| [40] |
LECOT S, BELOUZARD S, DUBUISSON J, et al. Bovine viral diarrhea virus entry is dependent on clathrin-mediated endocytosis[J]. J Virol, 2005, 79(16): 10826-10829. DOI:10.1128/JVI.79.16.10826-10829.2005 |
| [41] |
RIEDEL C, CHEN H W, REICHART U, et al. Real time analysis of bovine viral diarrhea virus (BVDV) infection and its dependence on bovine CD46[J]. Viruses, 2020, 12(1): 116. DOI:10.3390/v12010116 |
| [42] |
MOENNIG V. Introduction to classical swine fever: virus, disease and control policy[J]. Vet Microbiol, 2000, 73(2-3): 93-102. DOI:10.1016/S0378-1135(00)00137-1 |
| [43] |
王文静. CD46蛋白介导猪瘟病毒感染的机制研究[D]. 杨凌: 西北农林科技大学, 2019. WANG W J. The mechanism of porcine CD46 protein in classical swine fever virus infection[D]. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [44] |
POSTEL A, BECHER P, HAAS L, et al. The newly discovered "atypical porcine pestivirus" (APPV): An old player in the "shaking piglets" disease complex?[J]. Tierarztl Prax Ausg G Grosstiere Nutztiere, 2018, 46(4): 261-270. DOI:10.15653/TPG-180053 |
| [45] |
SCHIRRMEIER H, STREBELOW G, DEPNER K, et al. Genetic and antigenic characterization of an atypical pestivirus isolate, a putative member of a novel pestivirus species[J]. J Gen Virol, 2004, 85(12): 3647-3652. DOI:10.1099/vir.0.80238-0 |
| [46] |
SMITH D B, MEYERS G, BUKH J, et al. Proposed revision to the taxonomy of the genus Pestivirus, family Flaviviridae[J]. J Gen Virol, 2017, 98(8): 2106-2112. DOI:10.1099/jgv.0.000873 |
| [47] |
BRAUN U, HILBE M, PETERHANS E, et al. Border disease in cattle[J]. Vet J, 2019, 246: 12-20. DOI:10.1016/j.tvjl.2019.01.006 |
| [48] |
CABEZÓN O, VELARDE R, ROSELL R, et al. Experimental infection of lambs with Border disease virus isolated from a Pyrenean chamois[J]. Vet Rec, 2010, 167(16): 619-621. DOI:10.1136/vr.c4966 |
| [49] |
LI W, MAO L, ZHAO Y, et al. Detection of border disease virus (BDV) in goat herds suffering diarrhea in eastern China[J]. Virol J, 2013, 10(50): 80. |
| [50] |
MAO L, LIU X, LI W L, et al. Characterization of one sheep border disease virus in China[J]. Virol J, 2015, 12: 15. DOI:10.1186/s12985-014-0217-9 |
| [51] |
MAO L, LI W L, LIU X, et al. Chinese border disease virus strain JSLS12-01 infects piglets and down-regulates the antibody responses of classical swine fever virus C strain vaccination[J]. Vaccine, 2015, 33(32): 3918-3922. DOI:10.1016/j.vaccine.2015.06.059 |
| [52] |
MCFADDEN A M J, TISDALL D J, HILL F I, et al. The first case of a bull persistently infected with Border disease virus in New Zealand[J]. N Z Vet J, 2012, 60(5): 290-296. DOI:10.1080/00480169.2012.675568 |
| [53] |
NETTLETON P F, GILRAY J A, RUSSO P, et al. Border disease of sheep and goats[J]. Vet Res, 1998, 29(3-4): 327-340. |
| [54] |
任艳. 牛病毒性腹泻病毒囊膜蛋白E2与牛胚胎滋养层细胞相互作用的分子机制研究[D]. 石河子: 石河子大学, 2010. REN Y. Molecular mechanism of Bovine viral diarrhea virus envelope protein E2 interact with bovine trophoblast cells[D]. Shihezi: Shihezi University, 2010. (in Chinese) |
| [55] |
SCHELP C, GREISER-WILKE I, WOLF G, et al. Identification of cell membrane proteins linked to susceptibility to bovine viral diarrhoea virus infection[J]. Arch Virol, 1995, 140(11): 1997-2009. DOI:10.1007/BF01322688 |
| [56] |
AGNELLO V, ABEL G, ELFAHAL M, et al. Hepatitis C virus and other flaviviridae viruses enter cells via low density lipoprotein receptor[J]. Proc Natl Acad Sci U S A, 1999, 96(22): 12766-12771. DOI:10.1073/pnas.96.22.12766 |
| [57] |
MERWAISS F, CZIBENER C, ALVAREZ D E. Cell-to-cell transmission is the main mechanism supporting bovine viral diarrhea virus spread in cell culture[J]. J Virol, 2019, 93(3): e01776-18. |
| [58] |
JANKOVICOVA J, ANTALIKOVA J, SIMON M, et al. Comparative fluorescence analysis of the bovine sperm using IVA-520 (anti-CD46 antibody) and lectins: probable localisation of CD46 on bovine sperm membrane[J]. Gen Physiol Biophys, 2011, 30: S70-S76. DOI:10.4149/gpb_2011_SI1_70 |
| [59] |
RAJPUT M K, DARWEESH M F, PARK K, et al. The effect of bovine viral diarrhea virus (BVDV) strains on bovine monocyte-derived dendritic cells (Mo-DC) phenotype and capacity to produce BVDV[J]. Virol J, 2014, 11: 44. DOI:10.1186/1743-422X-11-44 |
| [60] |
LEE S R, NANDURI B, PHARR G T, et al. Bovine viral diarrhea virus infection affects the expression of proteins related to professional antigen presentation in bovine monocytes[J]. Biochim Biophys Acta, 2009, 1794(1): 14-22. DOI:10.1016/j.bbapap.2008.09.005 |
(编辑 郭云雁)



