2. 南京农业大学动物医学院/农业部动物生理生化重点开放实验室,南京 210095
2. Key Laboratory of Animal Physiology and Biochemistry of Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, China
奶业是健康中国、强壮民族的重要产业。乳腺炎是制约其健康发展的主要疾病,80%由细菌感染所致,在我国每年造成200多亿元的经济损失[1-3]。乳房链球菌(Streptococcus uberis,S. uberis)是诱发乳腺炎的主要环境性病原之一,长期的流行病学监测显示,近年来, S. uberis性乳腺炎的发病率有升高趋势,许多地区超过了总发病率的1/3[4-5]。S.uberis感染会导致乳腺损伤、微循环障碍和免疫代谢紊乱,使产奶量减少、乳品质下降,给我国造成巨大的经济损失[6-7]。一些S. uberis含有荚膜,能够形成生物被膜,抵抗巨噬细胞的吞噬[8],降低此类病原感染造成的危害是行业当前亟需解决的“瓶颈问题”。目前抗生素联合用药是治疗乳腺炎的主要手段,但大量使用会导致细菌耐药性和抗生素残留等问题[9]。此外,S. uberis感染后可黏附、内化进入乳腺上皮细胞,躲避抗生素的杀灭/抑制作用,并产生相关酶和代谢小分子干扰宿主免疫反应,导致机体代谢紊乱,逃避免疫系统清除,导致持续的细胞内感染,诱发过度炎症反应[10],给S. uberis性乳腺炎防控带来困难,是奶牛养殖业长期面临的难题。因此,寻找有效抵抗S. uberis感染且不易产生耐药性的内源性物质,或许能够成为降低乳腺炎发病率的突破口。
氨基酸代谢作为三大物质代谢之一,在调节免疫系统和维持机体代谢稳态方面发挥着至关重要的作用[11]。同时,氨基酸是维持生命的基本物质,参与细胞内多种代谢途径,包括ATP生成,核苷酸合成和氧化还原平衡[12-13]。病原微生物入侵后会激活免疫细胞的识别受体,通过信号转导使细胞内的转录和翻译发生显著变化,促进免疫效应分子合成,诱导免疫细胞发生代谢重编程,在此过程中糖酵解、三羧酸循环和线粒体氧化磷酸化协同产生ATP,氨基酸代谢为这些产能途径提供底物,以满足增殖、分化和功能物质合成的需要[14-15]。这表明病原感染和氨基酸代谢之间关系密切。目前,关于S.uberis感染对乳腺内氨基酸代谢的影响还未见报道,亟需深入研究。
为此,本研究以S. uberis和小鼠乳腺上皮细胞为研究对象,通过靶向氨基酸代谢组学分析技术、RT-qPCR和Western blot等方法,探究S.uberis感染对乳腺上皮细胞中氨基酸代谢的影响,为挖掘关键氨基酸进行代谢调控缓解乳腺感染提供科学依据,同时也为S.uberis性乳腺炎早期预警奠定了基础。
1 材料与方法 1.1 细胞株S.uberis标准株(S.uberis 0140J)与小鼠乳腺上皮细胞系(EpH4-Ev)购自美国ATCC公司。
1.2 主要试剂Trizol试剂、Evo M-MLV和miRNA反转录试剂盒和SYBR® Green Pro Taq HS预混型qPCR试剂盒为湖南艾科瑞生物工程有限公司产品,RIPA蛋白裂解液购自南京碧云天生物技术有限公司;PVDF膜购自美国Millipore公司;ECL化学发光检测试剂盒购自翌圣生物科技(上海)股份有限公司等。
兔源β-Tubulin抗体(货号AP0064)购自南京巴傲得生物科技有限公司;辣根过氧化物酶标记的山羊抗兔IgG二抗(货号56970 S)购自美国CST生物公司;兔源精氨酸酶1抗体(ARG1,货号ab96183)、兔源诱导型一氧化氮合酶抗体(NOS2,货号ab178945)购自英国Abcam生物科技有限公司;TureColor宽范围(10~250 ku)双色预染蛋白Marker(货号C520010)购自生工生物工程(上海)股份有限公司。
1.3 细胞培养与处理1.3.1 细菌培养 将-80 ℃保存的S.uberis标准菌株划线接种于新鲜的THB固体培养基,并过夜培养,挑取单菌落的接种于新鲜的THB液体培养基中,然后在设置参数为37 ℃,200 g ·min-1的摇床中培养,直至对数生长期(OD600 nm=0.45~0.55)。
1.3.2 细胞培养与样品制备 将EpH4-Ev细胞在含有10%胎牛血清的DMEM中培养至正常状态,并接种于T75细胞瓶中培养至聚合度为80%左右,用无血清DMEM饥饿处理4 h,然后以MOI=10的感染剂量将S. uberis与细胞在37 ℃、5% CO2细胞温箱共孵育4 h。弃掉培养基,用预冷PBS洗涤3次,胰酶消化后,1 200 g离心5 min,用PBS重悬,取107个细胞再次离心,去除上清,将细胞沉淀快速置于液氮中速冻30 s,-80 ℃保存备用。
1.4 方法 1.4.1 靶向氨基酸代谢分析1.4.1.1 代谢物提取 精确吸取样本于2 mL离心管中,加入300 μL 10%甲酸甲醇溶液(1 ∶1),加入100 mg玻璃珠,液氮快速冷冻5 min,取出离心管,室温冻融后在研磨器中以50 Hz频率振荡1 min;12 000 r ·min-1 4 ℃离心5 min,取上清50 μL,加入450 μL 10%甲酸甲醇溶液(1 ∶1),涡旋振荡30 s,取100 μL,再加入100 μL浓度为10 μg ·L-1的Trp-d3内标样品,涡旋振荡30 s,用0.22 μm滤膜过滤上清液于检测瓶中。
1.4.1.2 LC-MS/MS分析 采用Shimadzu Nexera X2 LC-30AD高效液相色谱。色谱柱:Waters UPLC BEH Amide column (1.7 μm 2.1 mm×100 mm Column)。流动相:A液为5%乙腈水溶液(含20 mmol ·L-1乙酸铵pH 9.45),B液为100%乙腈。样品复溶于90 μL 50%乙腈水溶液,置于4 ℃自动进样器中,柱温40 ℃,流速300 μL ·min-1,进样量5 μL。样本队列开始前设置1个QC样本,之后每12个样本间隔加入一个QC样本,样本队列结束后设置一个QC样本,用于检测和评价系统的稳定性及重复性。采用5500QTRAP质谱仪(AB SCIEX)在正离子模式下进行质谱分析。
1.4.1.3 数据处理 用MultiQuant软件提取色谱峰面积和保留时间。再用20种氨基酸标准品进行保留时间校正,鉴定代谢物。代谢物的离子峰面积使用内标L-Glutamate_D5进行归一化处理。
1.4.2 关键代谢酶表达验证分析1.4.2.1 RNA提取 处理后的细胞快速用PBS洗涤3次,加入1 000 μL预冷Trizol裂解3 min,转移至RNase Free EP管中;加入200 μL氯仿,轻轻混匀,静置3 min,12 000 g ·min-1、4 ℃离心15 min;取上层水相并加入等体积预冷异丙醇混匀,-20 ℃放置1 h;12 000 g ·min-1、4 ℃离心10 min,弃上清,加入75%的乙醇溶液洗涤2次;管底沉淀干燥至透明色后,加入20 μL DEPC水,混匀后用紫外分光光度计测定浓度。
1.4.2.2 RT-qPCR 为了在转录水平上验证关键代谢酶的基因表达情况,在GenBank数据库中检索所需目的基因序列,将序列导入Primer Premier 5.0软件中,设计并筛选特异性引物序列,并在NCBI Primer-BLAST网站对引物特异性进行验证,将引物序列(表 1)送擎科生物科技有限公司(南京合成部)合成。根据反转录试剂盒说明书将总RNA反转录为cDNA。利用SYBR Green Ⅰ嵌合荧光法进行Real-Time PCR扩增反应,从仪器中读取样品的Ct值,以β-actin为内参基因,并采用2-ΔΔCt计算公式进行统计分析。
|
|
表 1 荧光定量PCR引物序列 Table 1 Primer sequences designed for RT-qPCR |
1.4.2.3 Western blot ① 蛋白提取:用RIPA裂解液(含1% PMSF)提取细胞蛋白,经BCA法测定蛋白浓度后统一蛋白浓度,加入上样缓冲液混匀,100 ℃ 10 min,-20 ℃保存;②SDS-PAGE电泳:配制5%浓缩胶和10%分离胶,每孔上样20 μg,蛋白Marker 3 μL,电泳条件:浓缩胶80 V,分离胶120 V;③转印:将分离胶与PVDF膜按顺序叠放于转膜仪内,加入预冷转膜液,100 V转膜90 min;④杂交和显色:转膜结束后,用5%脱脂奶粉封闭PVDF膜2 h,TBST洗膜。分别加入一抗(β-Tubulin兔源抗体1 ∶10 000稀释;NOS2、ARG1兔源抗体1 ∶1 000稀释),4 ℃孵育过夜。TBST洗膜,加入山羊抗兔IgG二抗(1 ∶10 000稀释),室温孵育2 h,最后洗膜。ECL发光(A液∶B液=1 ∶1),凝胶成像系统曝光并拍照。⑤数据处理:Image J软件检测各蛋白条带灰度值,以β-Tubulin为内参,将目的条带与其相比得到目的蛋白的相对表达量,然后对数值进行归一化处理。
1.5 数据统计与分析1.5.1 GC-TOF-MS数据分析 将数据中心化和标准化处理后进行PCA和OPLS-DA分析,总体观察代谢物差异。再根据P<0.05来筛选差异代谢物,随后对差异代谢物表达进行分析。
1.5.2 其它数据统计分析 用SPSS 20.0软件对数据进行统计分析,组间两两比较采用t检验。用Graph Pad Prism 9.0软件作图。数据结果表示为“平均值±标准误(x±s)”,P值均在图中标注,P<0.05表示处理间差异显著。
2 结果 2.1 多变量数据分析本试验采用此方法分析S. uberis感染对细胞中20种氨基酸的代谢变化,其R2X值为0.902,说明当前PCA模型可靠,能够准确地显示对照组和感染组之间的氨基酸代谢物差异。如图 1 A所示,对照组处于PC1的左侧,S. uberis组处于PC1的右侧,表明这两组之间的氨基酸代谢物有显著差异。

|
A. 代谢物PCA分析;B. 代谢物OPLS-DA分析 A. Metabolite PCA analysis; B. Metabolite OPLS-DA analysis 图 1 多变量数据分析 Fig. 1 Multivariable analysis |
为了滤除与分类信息无关的噪音,提高模型的解析能力和有效性,本研究进一步使用OPLS-DA分析方法进行了分析。在OPLS-DA模型中,感染组vs对照组的模型解释率R2Y值为0.999,预测性Q2值分别为0.979,这说明模型有效性高,可预测性好,同时,在图 1B中,组间OPLS-DA得分图未重叠,组内的代谢物离散度小,表明组内的代谢物差异较小,组间的氨基酸代谢物差异显著。
2.2 层次聚类分析层次聚类分析可全面直观地显示样本间关系以及代谢物在不同样本中的表达差异,为了表示感染组与对照组差异氨基酸间的关系,本研究测定了显著差异氨基酸的表达量,并对各组样本进行层次聚类分析,以热图展示(图 2),从而辅助本研究准确地筛选标志代谢物,并对相关代谢过程进行研究。结果显示,S. uberis感染细胞后,甘氨酸、苏氨酸、鸟氨酸、天冬酰胺和谷氨酰胺这5种氨基酸含量上升,谷氨酸、脯氨酸、精氨酸、丝氨酸、组氨酸、缬氨酸、异亮氨酸、丙氨酸、酪氨酸、色氨酸、赖氨酸、天冬氨酸、苯丙氨酸、γ-氨基丁酸、亮氨酸和甲硫氨酸等16种氨基酸含量下降,精氨酸含量下调最为显著(P<0.000 1);其中, 天冬酰胺和谷氨酰胺两种生糖氨基酸含量显著上升(P<0.05),赖氨酸和亮氨酸两种生酮氨基酸含量显著下降(P<0.05)。

|
热图中红色代表上调的氨基酸,蓝色代表下调的氨基酸 The red color represents upregulated amino acids, while the blue color represents downregulated amino acids 图 2 差异氨基酸分析 Fig. 2 The analysis of the differential amino acids |
VIP(variable important in projection)是OPLS-DA模型变量的权重值,用来衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力,VIP值越大代表该变量的重要性越高,常与t检验P值(P<0.05)作为结合分析,筛选具有生物学意义的差异代谢物。由图 3可知,S. uberis感染细胞中VIP>1且P<0.05的氨基酸有精氨酸、缬氨酸、组氨酸、异亮氨酸、丙氨酸、天冬酰胺、鸟氨酸、谷氨酰胺、酪氨酸和丝氨酸,其中, 精氨酸的重要性最高,这提示精氨酸可能在S. uberis感染中发挥着重要的作用。

|
红色圆圈代表的氨基酸从上至下依次为:精氨酸、缬氨酸、组氨酸、异亮氨酸、丙氨酸、天冬酰胺、鸟氨酸、谷氨酰胺、酪氨酸和丝氨酸 The red circles represent the amino acids in order from top to bottom: Arg, Val, His, Ile, Ala, Asn, Orn, Gln, Tyr, Ser 图 3 差异氨基酸重要性分析 Fig. 3 The importance analysis of differential amino acids |
在前期结果的基础上,本研究以精氨酸为关键氨基酸进行代谢物相关性分析,结果如图 4所示,精氨酸与丙氨酸、酪氨酸、异亮氨酸、组氨酸和丝氨酸之间有较强的正相关,与鸟氨酸、谷氨酰胺、苏氨酸和天冬酰胺有较强的负相关。
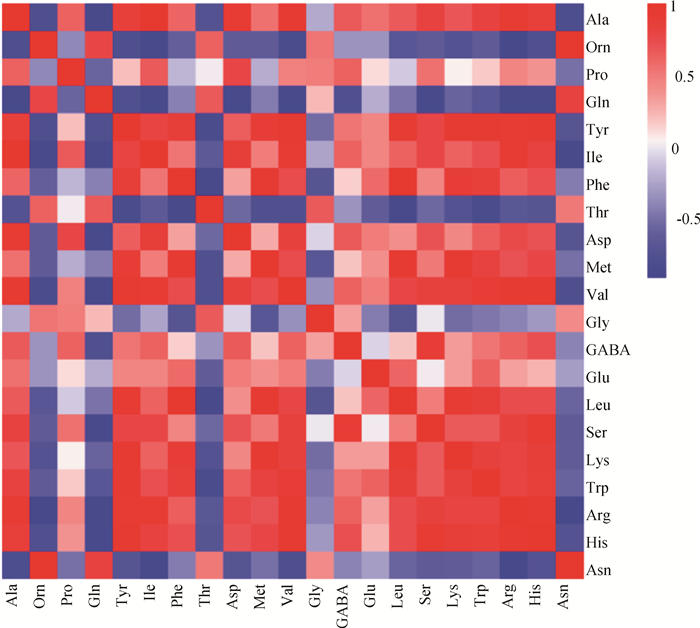
|
图 4 差异氨基酸相关性分析 Fig. 4 The correlation analysis of differential amino acids |
2.5.1 关键代谢物含量的测定 差异代谢物分析结果提示精氨酸是S.uberis感染细胞中最重要的氨基酸,因此对精氨酸代谢通路进行了进一步研究。由图 5可知,ARG1和NOS2是精氨酸分解代谢途径的关键酶,将精氨酸分别代谢为鸟氨酸、尿素、瓜氨酸和NO,与对照组相比,S.uberis感染使细胞中NO含量和鸟氨酸含量显著上升(P<0.05),表明精氨酸分解代谢增强。
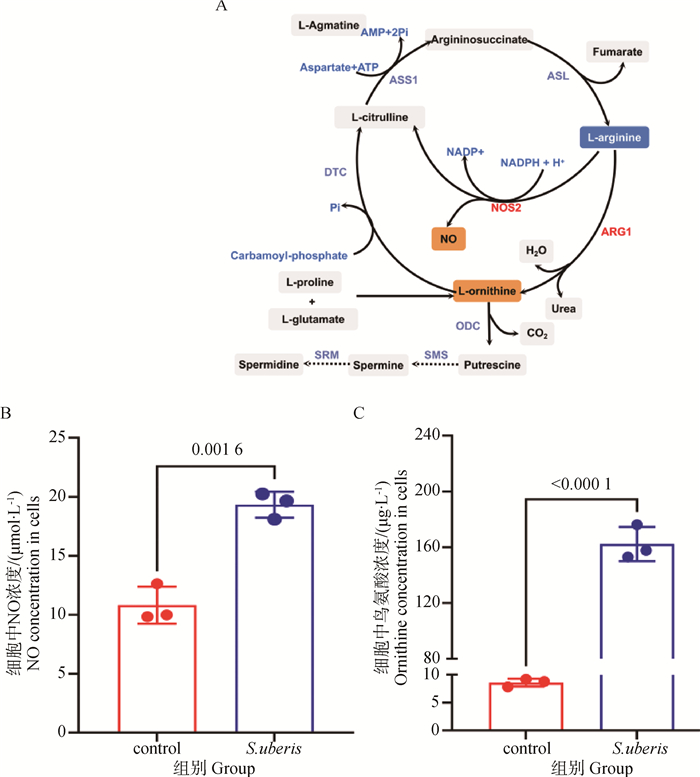
|
A. 精氨酸代谢通路;B. NO含量的测定;C.鸟氨酸含量的测定 A. Arginine metabolic pathway; B. Determination of NO content; C. Determination of ornithine content 图 5 精氨酸代谢通路关键代谢物含量 Fig. 5 Content of key metabolites of the arginine metabolic pathway |
2.5.2 关键代谢酶的基因表达验证 由图 6可知,S.uberis感染显著下调了精氨酸代谢关键酶ARG1的表达(P<0.05),显著上调了NOS2的表达(P<0.05),这提示宿主可能通过诱导NOS2的表达代谢细胞内的精氨酸,以抵抗S.uberis感染。
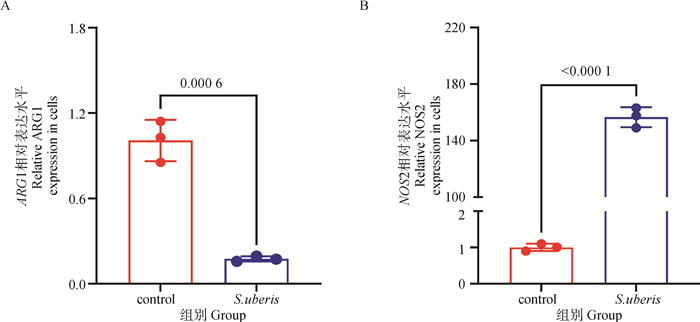
|
A. ARG1的mRNA表达水平;B. NOS2的mRNA表达水平 A. mRNA expression level of ARG1; B. mRNA expression level of NOS2 图 6 关键代谢酶的基因表达 Fig. 6 Gene expression of key metabolic enzymes |
2.5.3 关键代谢酶的蛋白表达验证 由图 7可知,S. uberis感染显著下调了精氨酸代谢关键酶ARG1的表达(P<0.05),显著上调了NOS2的表达(P<0.05),在蛋白水平上进一步验证了“2.5.2”中的结果,表明S. uberis感染会耗竭细胞内精氨酸。
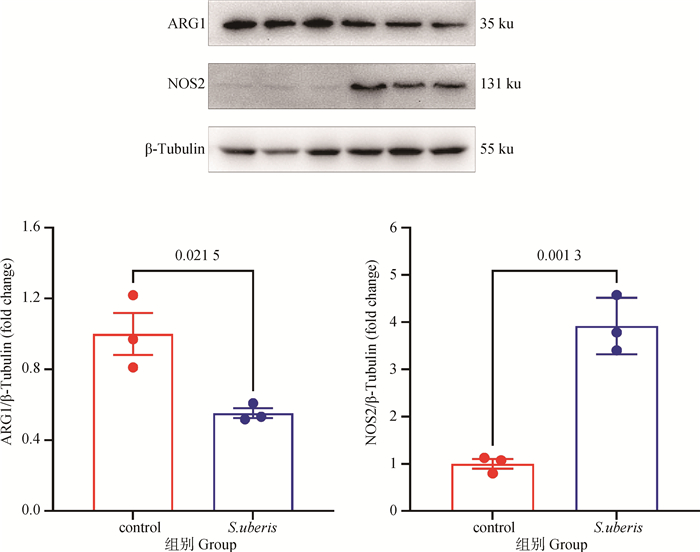
|
图 7 关键代谢酶的蛋白表达 Fig. 7 Protein expression of key metabolic enzymes |
进一步分析炎性因子的表达情况,结果如图 8所示,与control组相比,S.uberis感染小鼠乳腺上皮细胞后显著上调Il-1β和TNF-α的表达水平(P<0.05),而对IL-8和IL-10无显著影响,提示精氨酸可能在S.uberis感染中发挥重要作用。

|
图 8 S. uberis感染对炎性因子表达水平的影响 Fig. 8 The effect of S. uberis infection on the expression level of inflammatory factors |
近年来,由于免疫代谢这一概念的提出,越来越多的研究人员开始关注病原感染时代谢物的变化,以从中发现与免疫功能关系最为密切的代谢物,从而开辟新的治疗方法,这促使代谢组学技术快速发展,诞生了氨基酸分析仪、高效液相色谱法(HPLC)和液相色谱串联质谱技术(LC-MS/MS)等氨基酸检测技术。由于氨基酸分析仪对样品背景干扰太大,HPLC无法提供适用于同时检测多种氨基酸的衍生试剂,限制其广泛应用。LC-MS/MS具有灵敏度高、选择性好和高效快捷等优点,已被广泛地应用于体内化合物的测定[16]。与传统方法相比,用氨基衍生标记的LC-MS/MS氨基酸定量技术在精密度、准确度、使用范围和结果分析方面有显著提高和改善[17]。因此,本研究采用LC-MS/MS靶向氨基酸代谢组学技术对S. uberis感染小鼠乳腺上皮细胞内的氨基酸进行了全面分析,筛选差异代谢物,为进一步了解S. uberis的致病机制和疾病防控提供数据支持。
氨基酸是构成蛋白质和多肽的基本单位,对机体的生长发育至关重要,同时作为中间代谢物参与机体各种病理、生理过程,如免疫调控和炎症反应。健康状态下机体内的氨基酸含量处于动态平衡,但在感染、疾病等条件下,氨基酸将发生重新分配,主要用于免疫功能物质(如炎症因子)的合成,进而影响宿主对病原的炎症性免疫应答。Gardinassi等[18]研究表明, 新型冠状病毒感染会显著上调精氨酸代谢、脯氨酸代谢、天冬氨酸代谢以及赖氨酸代谢等多种氨基酸代谢。本研究采用LC-MS/MS技术对S.uberis感染乳腺上皮细胞中的氨基酸进行定量分析发现,S. uberis感染后显著上调了乳腺上皮细胞中甘氨酸、苏氨酸、鸟氨酸、天冬酰胺和谷氨酰胺的含量,显著下调了谷氨酸、脯氨酸、精氨酸、丝氨酸、组氨酸、缬氨酸、异亮氨酸、丙氨酸、酪氨酸、色氨酸、赖氨酸和天冬氨酸的含量,造成了氨基酸代谢紊乱[19]。实验室前期研究表明,S. uberis感染会使宿主体内ROS含量升高,诱发氧化应激,同时宿主也会通过合成抗氧化剂如谷胱甘肽等来抵抗氧化应激[20],而半胱氨酸、谷氨酸和甘氨酸是合成抗氧化剂谷胱甘肽的底物,因此在病原微生物感染时,宿主会优先合成上述物质[21]。本研究中发现甘氨酸和谷氨酰胺含量升高,这可能是由于机体为了应对氧化应激,合成更多的抗氧化剂所导致的。丝氨酸是一种非必需氨基酸,能够利用糖酵解的中间产物从头合成,本研究发现S. uberis感染乳腺上皮细胞4 h显著降低了丝氨酸的含量,这可能是被丝氨酸羟甲基转移酶代谢成为甘氨酸或用于合成嘌呤和炎性因子。
病原微生物感染宿主后会和宿主竞争营养物质,用于自身生长增殖,Urso和Prince[22]研究表明,脑膜炎奈瑟菌入侵宿主后会诱导宿主将精氨酸代谢为亚精胺来促进自身毒力因子的表达,增强在脑部的定殖,加速体内精氨酸的耗竭。但宿主在感染过程中启动各种免疫反应抵御和清除病原微生物,如Mtb感染早期会使宿主招募巨噬细胞进行代谢重编程,促进M0巨噬细胞极化为M1巨噬细胞,将精氨酸代谢为NO,抵抗病原感染,导致细胞内精氨酸含量显著降低[23]。这表明,精氨酸含量的变化能够作为病原感染宿主的生物标志物,对疾病预警有重要意义。本研究发现,S. uberis感染会显著降低细胞内精氨酸的含量,上调鸟氨酸的含量,同时在转录水平上,显著升高关键代谢酶NOS2的表达,降低ARG1的表达,推测这可能与宿主细胞产生NO清除病原有关[23]。
炎症是机体对各种致炎因素(病源微生物、物理因素、化学因素等)及其所引起的损伤而发生的一种防御性免疫反应,而氨基酸的可用性对于产生适当的免疫反应至关重要[24]。炎症发生时机体会加快机体内新陈代谢,消耗大量能量及氨基酸用于免疫功能物质的合成,促进免疫细胞的激活并释放大量的细胞因子和相关激素,氨基酸缺乏可能导致免疫细胞迁移、分裂、成熟和效应功能完成缺陷[25-26]。如巨噬细胞会利用氨基酸分解代谢来维持其免疫活性的激活和维持[27]。氨基酸可用性控制巨噬细胞反应的几种途径,包括mTOR信号传导和NO产生,改变氨基酸代谢会影响巨噬细胞反应[27-28]。最后,宿主细胞和病原体之间的代谢竞争可能会影响病原感染的进程。
综上所述,S. uberis感染会显著升高NOS2的表达,耗竭精氨酸,造成细胞氨基酸代谢紊乱,促进生成甘氨酸和谷氨酰胺等氨基酸,用于抗氧化剂的合成,抵抗病原微生物侵袭,提示精氨酸或许可作为防控奶牛乳腺炎的潜在靶点。
4 结论S.uberis感染造成小鼠乳腺上皮细胞内氨基酸代谢紊乱,加速精氨酸耗竭,诱发炎症反应,提示精氨酸在S.uberis感染中具有重要作用,也为从代谢的角度寻找奶牛乳腺炎新型调控靶点提供了新思路。
| [1] |
SULEIMAN T S, KARIMURIBO E D, MDEGELA R H. Prevalence of bovine subclinical mastitis and antibiotic susceptibility patterns of major mastitis pathogens isolated in Unguja island of Zanzibar, Tanzania[J]. Trop Anim Health Prod, 2018, 50(2): 259-266. DOI:10.1007/s11250-017-1424-3 |
| [2] |
TIMOFTE D, MACIUCA I E, EVANS N J, et al. Detection and molecular characterization of Escherichia coli CTX-M-15 and Klebsiella pneumoniae SHV-12 β-lactamases from bovine mastitis isolates in the United Kingdom[J]. Antimicrob Agents Chemother, 2014, 58(2): 789-794. DOI:10.1128/AAC.00752-13 |
| [3] |
ZHENG L H, XU Y Y, LU J Y, et al. Variant innate immune responses of mammary epithelial cells to challenge by Staphylococcus aureus, Escherichia coli and the regulating effect of taurine on these bioprocesses[J]. Free Radic Biol Med, 2016, 96: 166-180. DOI:10.1016/j.freeradbiomed.2016.04.022 |
| [4] |
LUNDBERG Å, NYMAN A, UNNERSTAD H E, et al. Prevalence of bacterial genotypes and outcome of bovine clinical mastitis due to Streptococcus dysgalactiae and Streptococcus uberis[J]. Acta Vet Scand, 2014, 56(1): 80. DOI:10.1186/s13028-014-0080-0 |
| [5] |
PETROVSKI K R, GRINBERG A, WILLIAMSON N B, et al. Susceptibility to antimicrobials of mastitis-causing Staphylococcus aureus, Streptococcus uberis and Str. dysgalactiae from New Zealand and the USA as assessed by the disk diffusion test[J]. Aust Vet J, 2015, 93(7): 227-233. DOI:10.1111/avj.12340 |
| [6] |
SATHIYABARATHI M, JEYAKUMAR S, MANIMARAN A, et al. Infrared thermography: a potential noninvasive tool to monitor udder health status in dairy cows[J]. Vet World, 2016, 9(10): 1075-1081. DOI:10.14202/vetworld.2016.1075-1081 |
| [7] |
ZHANG Z, LI X P, YANG F, et al. Influences of season, parity, lactation, udder area, milk yield, and clinical symptoms on intramammary infection in dairy cows[J]. J Dairy Sci, 2016, 99(8): 6484-6493. DOI:10.3168/jds.2016-10932 |
| [8] |
GVNTHER J, CZABANSKA A, BAUER I, et al. Streptococcus uberis strains isolated from the bovine mammary gland evade immune recognition by mammary epithelial cells, but not of macrophages[J]. Vet Res, 2016, 47: 13. DOI:10.1186/s13567-015-0287-8 |
| [9] |
DYSON R, CHARMAN N, HODGE A, et al. A survey of mastitis pathogens including antimicrobial susceptibility in southeastern Australian dairy herds[J]. J Dairy Sci, 2022, 105(2): 1504-1518. DOI:10.3168/jds.2021-20955 |
| [10] |
GUSSMANN M, STEENEVELD W, KIRKEBY C, et al. Economic and epidemiological impact of different intervention strategies for subclinical and clinical mastitis[J]. Prev Vet Med, 2019, 166: 78-85. DOI:10.1016/j.prevetmed.2019.03.001 |
| [11] |
HAN C F, GE M M, HO P C, et al. Fueling T-cell antitumor immunity: amino acid metabolism revisited[J]. Cancer Immunol Res, 2021, 9(12): 1373-1382. DOI:10.1158/2326-6066.CIR-21-0459 |
| [12] |
KAZAK L, COHEN P. Creatine metabolism: energy homeostasis, immunity and cancer biology[J]. Nat Rev Endocrinol, 2020, 16(8): 421-436. DOI:10.1038/s41574-020-0365-5 |
| [13] |
CHEN Q, LIANG X, WU T Z, et al. Integrative analysis of metabolomics and proteomics reveals amino acid metabolism disorder in sepsis[J]. J Transl Med, 2022, 20(1): 123. DOI:10.1186/s12967-022-03320-y |
| [14] |
MØLLER S H, HSUEH P C, YU Y R, et al. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging[J]. Cell Metab, 2022, 34(3): 378-395. DOI:10.1016/j.cmet.2022.02.003 |
| [15] |
GONG Y B, TANG N, LIU P R, et al. Newcastle disease virus degrades SIRT3 via PINK1-PRKN-dependent mitophagy to reprogram energy metabolism in infected cells[J]. Autophagy, 2022, 18(7): 1503-1521. DOI:10.1080/15548627.2021.1990515 |
| [16] |
SEGER C, SALZMANN L. After another decade: LC-MS/MS became routine in clinical diagnostics[J]. Clin Biochem, 2020, 82: 2-11. DOI:10.1016/j.clinbiochem.2020.03.004 |
| [17] |
MAEKAWA M, MANO N. Cutting-edge LC-MS/MS applications in clinical mass spectrometry: focusing on analysis of drugs and metabolites[J]. Biomed Chromatogr, 2022, 36(5): e5347. DOI:10.1002/bmc.5347 |
| [18] |
GARDINASSI L G, SERVIAN C D P, LIMA G D S, et al. Integrated metabolic and inflammatory signatures associated with severity of, fatality of, and recovery from COVID-19[J]. Microbiol Spectr, 2023, 11(2): e0219422. DOI:10.1128/spectrum.02194-22 |
| [19] |
WU H C, LIU J Q, CHEN S Y, et al. Jejunal metabolic responses to Escherichia coli infection in piglets[J]. Front Microbiol, 2018, 9: 2465. DOI:10.3389/fmicb.2018.02465 |
| [20] |
ZHOU Y L, LAN R G, XU Y Y, et al. Resveratrol alleviates oxidative stress caused by Streptococcus uberis infection via activating the Nrf2 signaling pathway[J]. Int Immunopharmacol, 2020, 89: 107076. DOI:10.1016/j.intimp.2020.107076 |
| [21] |
ROCHETTE L, DOGON G, RIGAL E, et al. Lipid peroxidation and iron metabolism: two corner stones in the homeostasis control of ferroptosis[J]. Int J Mol Sci, 2022, 24(1): 449. DOI:10.3390/ijms24010449 |
| [22] |
URSO A, PRINCE A. Anti-inflammatory metabolites in the pathogenesis of bacterial infection[J]. Front Cell Infect Microbiol, 2022, 12: 925746. DOI:10.3389/fcimb.2022.925746 |
| [23] |
GLEESON L E, SHEEDY F J, PALSSON-MCDERMOTT E M, et al. Cutting edge: Mycobacterium tuberculosis induces aerobic glycolysis in human alveolar macrophages that is required for control of intracellular bacillary replication[J]. J Immunol, 2016, 196(6): 2444-2449. DOI:10.4049/jimmunol.1501612 |
| [24] |
高楠, 窦秀静, 杨洋, 等. 氨基酸在炎症性肠病中的作用及其信号通路[J]. 畜牧兽医学报, 2020, 51(10): 2349-2358. GAO N, DOU X J, YANG Y, et al. Effects of amino acids on inflammatory bowel disease and its signaling pathways[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(10): 2349-2358. DOI:10.11843/j.issn.0366-6964.2020.10.003 (in Chinese) |
| [25] |
胡秀红, 任文波, 黄晶. 细胞因子与氨基酸代谢关系的研究进展[J]. 中国免疫学杂志, 2022, 38(13): 1661-1666. HU X H, REN W B, HUANG J. Research progress on relationship between cytokines and amino acid metabolism[J]. Chinese Journal of Immunology, 2022, 38(13): 1661-1666. (in Chinese) |
| [26] |
KIELER M, HOFMANN M, SCHABBAUER G. More than just protein building blocks: how amino acids and related metabolic pathways fuel macrophage polarization[J]. FEBS J, 2021, 288(12): 3694-3714. DOI:10.1111/febs.15715 |
| [27] |
安琪, 于嘉霖, 吴晓玲, 等. 谷氨酰胺对BCG诱导小鼠传代巨噬细胞凋亡的调控作用[J]. 畜牧兽医学报, 2023, 54(7): 3054-3063. AN Q, YU J L, WU X L, et al. Regulation of BCG-induced apoptosis in murine macrophages by glutamine[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(7): 3054-3063. DOI:10.11843/j.issn.0366-6964.2023.07.036 (in Chinese) |
| [28] |
FU J, HAN Z Y, WU Z B, et al. GABA regulates IL-1β production in macrophages[J]. Cell Rep, 2022, 41(10): 111770. DOI:10.1016/j.celrep.2022.111770 |
(编辑 白永平)



