传染性法氏囊病(infectious bursal disease,IBD)是由鸡传染性法氏囊病病毒(infectious bursal disease virus,IBDV)引起的主要危害3~6周龄鸡的免疫抑制性疾病。该病最早暴发于美国特拉华州的甘布罗地区,因此又被称为“Gumboro病”[1]。自1962年由Cosgrove首次报道以来,该病己成为危害养禽业的重大疾病,并形成世界范围内的大流行[2]。1979年,在我国广州首次发现该病,并在20世纪90年代发现IBDV超强毒株(very virulent IBDV, vvIBDV)的流行,这给家禽养殖业带来了巨大的经济损失。虽然目前疫苗的使用使IBD得到一定的控制,但随着IBDV新型变异毒株和新型强毒株的不断出现和免疫失败等问题[3],给防控带来了新的挑战。因此,全面了解IBDV与宿主之间潜在的相互作用将有助于新型疫苗的开发。
病毒感染宿主,一方面病毒可依赖宿主环境完成复制周期,影响宿主细胞的合成、代谢以及其他正常的生理功能,最终导致宿主发病;另一方面,为了抵抗病原体,宿主也会产生复杂的抗病毒免疫反应[4]。天然免疫应答是宿主抵御病毒入侵的第一道防线,宿主的模式识别受体(pattern recognition receptor,PRRs)通过识别病原生物的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)激活免疫信号通路,实现信号转导,从而诱导抗病毒蛋白干扰素的分泌。同时,病原体也发展了多种机制来逃避宿主的免疫应答。因此,病毒和宿主之间的“战争”持续不断。在大多数情况下,使用疫苗可以有效地预防和控制疫区鸡群中IBD的暴发。然而,由于IBDV变异毒株不断进化,很难及时开发出预防和控制IBD的高效疫苗。因此,深入研究IBDV的致病机理,研制新型有效的IBDV疫苗是当务之急。目前,科研人员已从RNA水平探究了IBDV的致病机理,这将为开发IBDV新型疫苗提供重要的线索。本文综述了宿主miRNAs、lncRNAs和circRNAs在IBDV感染中的作用,以期为研制新型IBDV疫苗或优化现有的疫苗提高免疫效果以避法氏囊损伤和免疫抑制提供理论指导。
1 IBDV概述IBDV属于双RNA病毒科(Birnaviridae),禽双RNA病毒属(Avibirnavirus),病毒粒子为二十面体,无囊膜(图 1A)。IBDV基因组是由编码五种病毒蛋白的双链RNA组成,包括A、B两个节段[5](图 1B)。A节段长度为3.2 kb,由两个重叠的开放阅读框(open reading frame,ORF)组成。ORF1主要编码病毒蛋白VP5(17 ku);ORF2编码一个多聚蛋白前体(pVP2-VP4-VP3),经VP4剪切后产生衣壳蛋白VP2(48.5 ku)、支架蛋白VP3(28 ku)和丝氨酸蛋白酶VP4(25 ku)。B节段全长2.8kb,仅含1个ORF,编码VP1蛋白(90 ku),也是该病毒特有的RNA依赖的RNA聚合酶。IBDV共编码5个蛋白,其中VP1、VP2和VP3为病毒的结构蛋白,VP4和VP5为病毒的非结构蛋白。

|
A. IBDV病毒粒子结构图;B. IBDV基因组结构图。图片引自ViralZone(http://viralzone.expasy.org/all_by_protein/572.html) A. The viral structure of IBDV; B. The viral structure of IBDV. Image is cited from ViralZone (http://viralzone.expasy.org/all_by_protein/572.html) 图 1 IBDV病毒粒子结构图及其基因组结构 Fig. 1 The viral structure and genome of IBDV |
近年来,科研人员发现IBDV引起的免疫抑制一方面与细胞凋亡有关,另一方面IBDV感染抑制了宿主细胞的天然免疫应答[6]。据报道,在病毒感染早期,IBDV通过表达病毒蛋白VP5与宿主细胞P85α蛋白相互作用抑制细胞凋亡,从而促进病毒复制[7]。在IBDV感染晚期,VP5通过与宿主细胞电压依赖性阴离子通道(voltage-dependent anion channel 2,VDAC2)以及活化的蛋白激酶C1受体(receptor of activated protein kinase C1,RACK1)相互作用诱导细胞凋亡,促进病毒复制[8]。此外,IBDV也可以通过VP2降解细胞抗凋亡蛋白ORAOV1诱导细胞凋亡,进而促进病毒复制[9]。在IBDV介导的天然免疫应答方面,有研究显示VP3可以通过与病毒基因组dsRNA结合抑制宿主细胞受体黑色素瘤分化相关基因5(melanoma differentiation-associated gene 5,MDA5)对病毒dsRNA的识别,从而抑制IFN-β的产生[10]。另外,VP3也可通过与宿主细胞蛋白双链RNA依赖性蛋白激酶(double-stranded RNA-dependent protein kinase,PKR)及核糖体蛋白L18(ribosomal protein L18,RPL18)互作形成复合物抑制天然免疫反应,促进病毒复制[11]。IBDV VP4能够作为干扰素(interferon,IFN)抑制剂,通过与糖皮质激素诱导的亮氨酸拉链(glucocorticoid induced leucine zipper,GILZ)相互作用抑制Ⅰ型IFN的表达[12]。以上研究结果表明,IBDV VP2和VP5可以通过与宿主蛋白相互作用影响细胞凋亡,IBDV VP3和VP4可以通过与宿主蛋白相互作用抑制宿主细胞的天然免疫应答,因此IBDV VP2-VP5是IBDV重要的蛋白,并通过其蛋白与宿主蛋白结合引起机体的免疫抑制。
随着研究的深入,科研人员还发现IBDV不仅通过表达病毒蛋白发挥致病作用,还通过广泛调控宿主ncRNA表达影响免疫信号转导、病毒复制和细胞凋亡。NcRNA是一种不编码蛋白质的RNA,据报道75%的人类基因组被转录成RNA,只有3%被转录成mRNA,因此体内丰富的ncRNA在多种生物过程中发挥着至关重要的作用,包括癌症、肿瘤和心血管疾病等[13-14]。根据长度、结构和位置,ncRNA可以分为miRNA、lncRNA和circRNA[15]。已有研究证实,在IBDV感染过程中,miRNAs、lncRNAs和circRNAs均发挥至关重要的调控作用,尤其是miRNAs。如果宿主与IBDV在蛋白质水平上的相互作用视为入侵者(病原体)和防御者(宿主细胞)之间“战斗的前线”[16],那么它们在RNA水平上的“战斗”可以被视为隐藏的前线。
2 miRNA在IBDV感染中的作用miRNA是细胞内源表达的一类长度为18~25 nt的非编码单链RNA分子,广泛存在于微生物、植物和动物中,主要通过靶向作用于特定的mRNA调控相关基因的表达。miRNA是研究最广泛的调节靶基因表达的小分子ncRNA,据预测miRNA负责调控约60%编码基因的表达,影响细胞周期与凋亡[17-18]、免疫应答以及肿瘤细胞的形成与分化[19]等多种生物过程。近年来,研究人员发现IBDV感染引起宿主细胞内多种miRNAs差异表达,例如Lin等[20]在IBDV感染的鸡骨髓源树突状细胞(chicken bone marrow-derived dendritic cells,chBM-DCs)中检测到18个miRNA转录本差异表达,利用KEGG和BIOCARTA数据库分析发现,这些差异表达的miRNAs的靶基因主要富集于MAPK、mTOR、神经营养因子等信号通路中。此外,从vvIBDV感染的法氏囊组织中鉴定出77个miRNAs差异表达,其中miR-1684b-3p、gga-miR-1788-3p和gga-miR-3530-5p的表达水平变化尤其显著,其潜在靶基因包括THBS1、STAT1、STAT3和MYD88[21]。由此表明,上述miRNAs可能在细胞凋亡、炎症和IFN反应中发挥重要作用,但其所发挥的具体作用及其机制仍需要进一步确定。
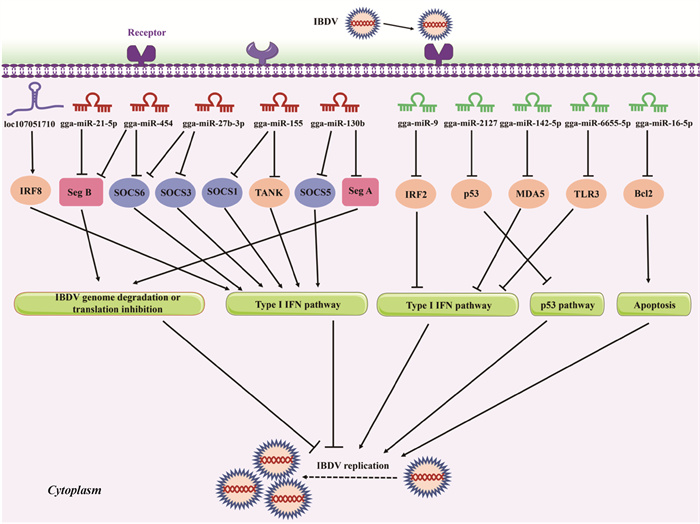
目前,许多研究表明在IBDV感染中miRNAs参与细胞免疫应答、细胞凋亡和病毒复制等生物进程[22-23]。然而,如表 1、图 2所示,miRNAs对病毒复制的影响十分复杂[24-50]。一方面,宿主miRNAs可以充当抑制病毒复制的活性因子限制病毒复制,包括gga-miR-130b、gga-miR-454、gga-miR-155、gga-miR-27b-3p和gga-miR-21-5p等;另一方面,miRNAs也可以抑制宿主防御增强病毒复制,包括gga-miR-9、gga-miR-2127、gga-miR-142-5p、gga-miR-6655-5p和gga-miR-16-5p等[16]。
|
|
表 1 非编码RNA在宿主对IBDV感染反应中的调控作用 Table 1 The roles of non-coding RNA in the host response to IBDV infection |
|
Seg A. IBDV基因组A节段;Seg B. IBDV基因组B节段;SOCS1/3/5/6. 细胞因子信号传导抑制因子1/3/5/6;TANK. TRAF家族成员相关的NF-κB激活剂;IRF2/8. 干扰素调节因子2/8;MDA5. 黑色素瘤分化相关基因5;Bcl2. B淋巴细胞瘤-2;TLR3. Toll样受体3 Seg A. IBDV genome segment A; Seg B. IBDV genome segment B; SOCS1/3/5/6. Suppressor of cytokine signaling 1/3/5/6; TANK. TRAF family member-associated NF-κB activator; IRF7. Interferon regulatory factor 7; IRF8. Interferon regulatory factor 8; MDA5. Melanoma differentiation-associated gene 5; Bcl2. B-cell lymphoma-2; TLR3. Toll-like receptors 3 图 2 非编码RNA在宿主对IBDV感染反应中的作用示意图 Fig. 2 Schematic diagram of the roles of non-coding RNA in host response to IBDV infection |
2.1.1 gga-miR-130b 据报道,IBDV感染DF-1细胞后296个miRNAs差异表达,其中gga-miR-130b在IBDV感染后显著上调,进一步研究表明gga-miR-130b可以通过直接靶向细胞因子信号传导抑制蛋白5(suppressors of cytokine signaling 5,SOCS5)间接抑制IBDV复制,也可以通过直接靶向IBDV基因组A节段直接抑制或降解病毒蛋白[24]。SOCS5是SOCS家族的一员,作为细胞因子受体信号传导的负调控因子,能够直接与JAK激酶结构域结合,抑制JAK1和JAK2的磷酸化,进而负调控JAK-STAT信号通路以防止过度免疫反应[25-27]。在这项研究中,gga-miR-130b通过抑制SOCS5的表达间接上调STAT1、STAT3和STAT6 mRNA表达以及STAT1的磷酸化水平,激活Ⅰ型IFN信号通路,从而发挥抗病毒作用[24]。此外,大多数IBDV经典毒株和弱毒株中A节段相对保守[28],gga-miR-130b可以与其靶向结合抑制IBDV复制。但是,vvIBDV基因组与gga-miR-130b的结合位点存在突变,因此vvIBDV或许可以通过自身的突变和进化来逃避宿主的免疫反应。除IBDV外,gga-miR-130b还可作为对抗猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的抗病毒因子[29],这表明gga-miR-130b有可能成为治疗病毒性疾病的新靶点。
2.1.2 gga-miR-454 gga-miR-454在IBDV感染细胞中显著降低,过表达gga-miR-454显著上调IFN-β和IRF3的表达,从而抑制IBDV的复制[30]。与gga-miR-130b类似,gga-miR-454通过两种机制抑制IBDV的复制。一方面,gga-miR-454通过靶向IBDV基因组B节段直接抑制或降解病毒蛋白[30]。值得注意的是,IBDV B节段上gga-miR-454的靶序列(TGCACT)在IBDV经典毒株和弱毒株如IBDV Lx、Cu-1和B87中相对保守,但在IBDV超强毒株如Gx、HK46和UK661毒株中已进化为TGCACC/G,所以gga-miR-454与IBDV超强毒株靶向结合的稳定性降低。由此,IBDV毒株基因组与gga-miR-454和gga-miR-130b结合能力的不同可能导致了IBDV弱毒株和超强毒株之间致病性的差异。另一方面,gga-miR-454也可通过靶向SOCS6上调IFN-β的表达,从而抑制IBDV复制[30]。据报道,hsa-miR-454能够直接靶向人类肝细胞系中的SOCS6,促进肝肿瘤细胞的扩增[31],这表明gga-miR-454和SOCS6之间可能存在广泛的相互作用。然而,与gga-miR-130b不同的是,IBDV感染后,DF-1细胞中gga-miR-454-3p的表达水平显著降低[30],由此说明gga-miR-454在IBDV感染中不能发挥抗病毒活性。但是,IBDV感染抑制gga-miR-454表达的潜在机制值得进一步研究。
2.1.3 gga-miR-155 gga-miR-155是一种典型的多功能miRNA,位于人类21号染色体和鸡1号染色体。gga-miR-155涉及多种作用,包括肿瘤和癌症的发生与发展、免疫调节以及抗病毒反应[32]。据报道,gga-miR-155可以通过靶向SOCS1和TANK增强Ⅰ型IFN信号传导,从而抑制IBDV复制[23]。另外,Yao等[33]发现网状内皮增生病病毒(reticuloendotheliosis virus,REV)也可以上调鸡胚成纤维细胞(chick embryo fibroblast,CEF)中gga-miR-155的表达,gga-miR-155通过靶向caspase 6和FOXO3a抑制细胞凋亡和加速细胞周期,从而提高REV感染CEFs的活力;Yang等[34]发现gga-miR-155可以通过靶向FOXO3/IRF7途径激活Ⅰ型IFN信号通路,从而抑制肠道病毒71(enterovirus 71,EV71)的复制。以上研究表明,在宿主抵御病毒感染过程中,gga-miR-155是一种重要的抗病毒因子。同时,gga-miR-155也是一种肿瘤相关miRNA。有研究表明,gga-miR-155在乳腺癌、宫颈癌、胰腺癌、肺癌和其他实体恶性肿瘤中异常表达,而在大多数癌症中,gga-miR-155的高表达水平与肿瘤亚型、临床病理标志物和低生存率相关[35]。因此,gga-miR-155表达的分子机制值得进一步深入探讨。近期研究人员揭示了IBDV诱导gga-miR-155表达上调的分子机制。研究发现,IBDV通过TBK1-IRF7信号通路上调转录因子GATA结合蛋白3(GATA binding protein 3,GATA3)的表达,磷酸化后的GATA3转运至细胞核中通过与gga-miR-155启动子结合上调gga-miR-155的表达[36]。由此,关于IBDV感染如何引起宿主gga-miR-155表达变化得到了充分认识。
2.1.4 gga-miR-21-5p gga-miR-21-5p是一种原癌基因,靶向人和鸡的多种抑癌基因,包括程序性细胞凋亡因子4(programmed cell death 4,PDCD4)、磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)[37-39]。研究发现,gga-miR-21-5p在IBDV感染的鸡法氏囊细胞中表达量显著上调,并通过直接靶向VP1 mRNA的22 nt区域阻断其翻译,从而抑制IBDV复制[40]。值得注意的是,VP1的22 nt序列在IBDV菌株中具有广谱性和保守性,该短序列对VP1在IBDV复制中的RNA依赖性RNA聚合酶功能也至关重要,因此gga-miR-21-5p可能被用作新的抗病毒药物开发的潜在靶点[40]。
2.1.5 gga-miR-27b-3p 与gga-miR-21-5p类似的是,gga-miR-27b-3p在IBDV感染的细胞中表达量也显著增加,并可通过靶向SOCS3和SOCS6(JAK-STAT信号的负调控因子)上调STAT1、STAT6的表达和STAT3、STAT1磷酸化,促进Ⅰ-IFN表达,从而抑制IBDV复制[41]。除了鸡,miR-27b在哺乳动物的宿主抗病毒免疫反应中也起着至关重要的作用。例如,Zhao等[42]发现miR-27b通过靶向runt相关转录因子1(runt related transcription factor 1,RUNX1)抑制传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)诱导的细胞凋亡;Wang等[43]研究表明miR-27b可以抑制猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)和猪轮状病毒(porcine epidemic diarrhea virus and,PoRV)的复制。因此,miR-27b在宿主抵抗病毒感染过程中起到广谱抗病毒的作用。
2.2 宿主miRNAs作为促进病毒复制活性因子的研究进展有些miRNAs也可通过与抗病毒相关的基因结合降低其表达,从而促进IBDV复制。鸡缺乏维甲酸诱导基因-I(retinoic-acid-inducible gene I,RIG-I),因此chMDA5是鸡的关键模式识别受体,可通过识别病毒启动机体的天然免疫应答过程[51]。已有研究表明,gga-miR-142-5p可降低chMDA5蛋白的表达,并通过IRF7依赖的途径降低IFN-β和Mx启动子的活性,从而促进IBDV复制[44]。gga-miR-9和gga-miR-2127可分别通过靶向抗病毒基因IRF2和p53抑制宿主抗病毒反应,从而也促进IBDV复制[45-46]。在H9N2亚型禽流感病毒(avian influenza virus,AIV)感染过程中,gga-miR-2127也可通过靶向p53促进病毒复制[47]。gga-miR-6655-5p可作用于TLR3的3′UTR负调控chTLR3的表达,抑制IFN-β启动子和Mx启动子活性,从而促进IBDV复制水平[48]。除此之外,据报道gga-miR-16-5p也在IBDV感染中发挥重要作用[22]。gga-miR-16被认为是一种能够通过抑制人类癌症细胞增殖和促进细胞凋亡的肿瘤抑制剂,包括两个同源成员:gga-miR-16-1和gga-miR-16-2,gga-miR-16-5p是gga-miR-16-1/gga-miR-16-2的成熟形式[49]。Duan等[22]研究发现,gga-miR-16-5p通过直接靶向宿主细胞中B细胞淋巴瘤2(B-cell lymphoma 2,Bcl2),诱导DF-1细胞凋亡,促进IBDV复制。宿主细胞的凋亡对病毒的影响具有双面性,这取决于病毒感染的时间。例如,IBDV感染早期细胞凋亡会限制病毒的复制[7],而IBDV感染后期细胞凋亡的发生有利于病毒的复制和传播[52]。gga-miR-16-5p在IBDV感染过程中似乎被病毒巧妙地操纵,在感染后期诱导细胞凋亡以促进其复制。
3 LncRNAs在IBDV感染中的作用LncRNAs是一种长度大于200个核苷酸,无明显ORF的非编码RNA。最初lncRNAs分子被认为是基因组转录的“噪音”,不具有生物学功能[53]。尽管Borsani等[54]于1991年在《Nature》发表文章指出,lncRNA-Xist参与调控X染色体失活过程。但是,由于lncRNAs表达水平很低,在当时并未引起广大学者的重视。随着人类基因组计划的完成和测序技术的发展,研究人员发现,仅有1.5%~2%的基因序列转录成具有蛋白质编码功能的mRNA,80%以上的基因组转录为ncRNAs,其中大部分为lncRNAs[55]。2007年,斯坦福大学张元豪(Howard Chang)教授团队在《Cell》发表文章指出,lncRNA-HOTAIR可以通过与多梳抑制性复合物2(polycomb repressive complexes,PRC2)相互作用,调控组蛋白H3第27位赖氨酸三甲基化(H3K27 me3),使该染色体区段处于封闭状态,沉默靶基因的表达[56]。研究结果表明,lncRNAs具有生物学功能,并在表观遗传修饰方面发挥重要的调控作用。
近年来,随着新一代高通量测序技术的发展,大量的lncRNAs被鉴定,越来越多的研究表明,lncRNAs可通过与DNA、RNA、转录因子、功能蛋白结合,在生物体内广泛参与染色质修饰、基因转录以及转录后翻译等生物学过程[57];同时,在细胞周期与凋亡、细胞分化和免疫反应中也发挥着重要的调控作用[58-59]。目前,许多研究发现,病毒感染宿主细胞会引起细胞内许多lncRNAs表达水平发生改变,而其中一些异常表达的lncRNAs能够通过调控模式识别受体、转录因子(transcription factors,TFs)、干扰素刺激基因(interferon-stimulated genes,ISGs)的表达,发挥抗病毒作用[60-62]。
近年来,许多研究表明lncRNAs在IBDV感染中发挥重要的调控作用。Lin等[20]通过微阵列技术对IBDV感染的chBM-DCs进行了转录组学分析。结果显示,IBDV感染chBM-DCs后,许多lncRNAs表达水平发生变化,并且这些差异表达的lncRNAs的靶基因主要富集于JAK-STAT和MAPK信号通路中[20]。作者对IBDV弱毒株感染的细胞进行RNA测序,发现IBDV感染后,细胞中许多lncRNAs差异表达,如LOC101748245、LOC107053553、LOC107055337等,且差异表达的lncRNAs的靶基因主要富集于Toll-like受体、RIG-I受体、NF-κB和Ⅰ型干扰素等相关免疫信号通路中[50]。这些结果表明lncRNAs在宿主抵抗IBDV感染的过程中可能发挥重要作用。进而,作者首先选择lncRNA-locl07051710和IRF8作为研究对象,探究了其在IBDV感染中的作用。研究发现,locl07051710可以通过上调干扰素调节因子8(interferon regulatory factor 8,IRF8)的表达,促进Ⅰ型IFN(IFN-α、IFN-β)和干扰素刺激基因(PKP、Mx1)的表达,抑制IBDV复制[50](表 1/图 2)。由此确定,lncRNAs可以通过调控抗病毒基因的表达抑制IBDV复制,在宿主抗IBDV感染过程中发挥着重要的作用。
此外,作者对IBDV超强毒株感染的法氏囊组织进行RNA测序,研究发现272个lncRNAs差异表达,差异表达的靶基因主要富集在JAK-STAT信号通路、核糖体和Toll-like受体信号通路中,提示JAK-STAT信号通路、核糖体和Toll-like受体信号通路参与vvIBDV感染法氏囊进程中[63]。JAK-STAT和Toll样受体被研究者广而熟知,Toll样受体信号通路可促进许多炎症细胞因子的表达[64],JAK-STAT信号通路是一条由细胞因子刺激的信号转导通路,参与细胞凋亡和免疫调节等过程[65],说明差异表达的lncRNAs在先天性免疫应答和细胞凋亡中均可能发挥重要调控作用。LncRNA通过调控靶基因的方式发挥其作用,因此作者预测了差异表达lncRNAs的靶基因。结果显示vvIBDV感染后,loc107053928、loc107054815、loc107053352和loc107053557显著上调,经生物信息学分析发现这些lncRNAs的靶基因为STAT1、STAT3、STAT4、TRIM25和IFIH1,同样,这些靶基因经vvIBDV感染后在法氏囊中表达量也显著上调[63]。这些数据支持了loc107053928、loc107054815、loc107053352和loc107053557通过调控各自相应的靶基因STAT1、STAT3、STAT4、TRIM25和IFIH1的表达水平而参与了vvIBDV感染后法氏囊组织内宿主细胞的免疫调控,也说明这些lncRNAs可能通过JAK-STAT信号通路调控其靶基因STAT1、STAT3、STAT4、TRIM25和IFIH1表达在宿主抗病毒反应中发挥重要作用[63]。
4 CircRNAs在IBDV感染中的作用CircRNAs是一种共价闭合的环状ncRNA,广泛分布在真核生物中。Hsu等[66]于1979年首次发现circRNAs,在之后的一段时间内一直被认为是病毒基因组或信使RNA前体选择性剪接的副产物,并未受到太多关注。近年发现,circRNAs可作为诱饵、转运蛋白或支架与RNA结合蛋白(RNA binding protein,RBP)相互作用来调节基因表达和翻译,进而参与肿瘤的发生与发展过程[67]。重要的是,研究人员发现circRNAs也可以作为miRNA海绵,通过与各种miRNAs结合来抑制其靶基因活性[68]。目前,越来越多的研究报道circRNAs参与了病毒-宿主的相互作用[69]。
近期,作者通过RNA测序探究了circRNAs在vvIBDV感染的法氏囊组织中的表达谱变化。结果发现,63个circRNA上调,80个circRNA下调[63],且表达水平普遍低于mRNAs和lncRNAs。人类正常组织和癌症组织中的大多数circRNAs的丰度也较低,因此这可能是pre-mRNA剪接的副产物[70-71]。同时,通过构建的circRNA-miRNA-mRNA网络发现,circRNA novel_circ_00574和novel_circ_00469在vvIBDV感染的鸡法氏囊中显著增加,并且它们分别通过与miR-1587-x和miR-4507-y结合,潜在地靶向参与免疫相关基因,例如STAT1和IRF7,这表明circRNA在宿主抵抗IBDV感染中也发挥作用[63],但仍需要进一步的研究来确定circRNA在IBDV感染中的潜在调控机制。
总的来说,宿主ncRNA参与了宿主与IBDV之间的“战斗”,其中在这一过程中,miRNAs得到了最广泛的研究。miRNAs可以通过两种方式发挥抗病毒作用:第一种是直接靶向病毒基因组以抑制病毒复制(gga-miR-130b→片段A,gga-miR-454→片段B和gga-miR-21-5p→VP1 mRNA);第二种是通过靶向宿主细胞中抗病毒免疫应答的负调节因子来抑制IBDV的复制(gga-miR-130b→SOCS5、gga-miR-454→SOCS6、gga-miR-27-3p→SOCS3和SOCS6、gga-miR-6655-5p→TLR3、gga-miR-155→SOCS1和TANK)。因此,gga-miR-130b、gga-miR-454、gga-miR-155、gga-miR-27b-3p和gga-miR-21-5p等miRNAs可以作为新的抗病毒药物开发的潜在靶点。除此之外,许多研究也已证实在IBDV感染的细胞和组织中,许多lncRNAs和circRNAs差异表达,表明这些差异表达的lncRNAs和circRNAs在IBDV感染中也可能发挥重要的调控作用。
5 展望目前,IBD呈世界分布,时常零星暴发,尚未得到有效防控,尤其是新的变异株的不断出现,仍然威胁着全球家禽养殖业。因此,深入研究IBDV致病机理,开发有效、安全的新型理想的IBDV疫苗是当务之急。NcRNA具有高丰度和多功能等生物学特征,全面研究其在宿主抵抗IBDV感染反应中的作用将有助于发现能有效控制IBDV感染的新策略。现已证实,ncRNAs是介导宿主和IBDV之间博弈的重要工具,深入研究ncRNAs和IBDV之间作用关系与调控机制,将对研制有效的新型抗IBDV药物提供一定基础和帮助。譬如,在新型IBDV疫苗研制中,可以通过关键氨基酸位点基因突变结合反向遗传操作技术获得改造病毒,在RNA层面上阻断病毒的致病作用,获得理想的弱毒(或无毒)活疫苗,同时保留疫苗毒株的免疫原性。这种既保留免疫原性又以克服免疫抑制和组织损伤的新型IBDV疫苗的研制和应用将极大提高鸡群成活率,降低死淘率,提高养禽业的经济效益。
此外,从目前来看,miRNAs在IBDV感染中的作用已被深入研究,lncRNAs和circRNAs在IBDV感染中的作用也已引起国内学者的关注,但研究主要集中于对IBDV感染的细胞或组织进行RNA测序获得大量差异表达的lncRNAs/circRNAs,缺乏对lncRNAs/circRNAs的功能分析以及lncRNAs/circRNAs如何调控。关于lncRNA和circRNA与IBDV复制之间的研究报道较少的原因可能有以下几点:(1)相较于miRNAs,lncRNAs和circRNAs的发现及其研究相对较晚;(2)有些lncRNAs和circRNAs的基因序列较长,调控机制比较复杂,加大了研究人员的科研难度。那么,在RNA水平上,宿主-IBDV相互作用待解决的问题主要是:通过测序结果和lncRNAs/circRNAs功能分析,明确更多参与宿主-IBDV相互作用的lncRNAs/circRNAs,以期为IBDV的感染与致病机制研究提供理论参考和新思路。
| [1] |
COSGROVE A S. An apparently new disease of chickens: avian nephrosis[J]. Avian Dis, 1962, 6(3): 385-389. DOI:10.2307/1587909 |
| [2] |
VAN DEN BERG T P. Acute infectious bursal disease in poultry: a review[J]. Avian Pathol, 2000, 29(3): 175-194. DOI:10.1080/03079450050045431 |
| [3] |
FAN L J, WU T T, HUSSAIN A, et al. Novel variant strains of infectious bursal disease virus isolated in China[J]. Vet Microbiol, 2019, 230: 212-220. DOI:10.1016/j.vetmic.2019.01.023 |
| [4] |
IWASAKI A, PILLAI P S. Innate immunity to influenza virus infection[J]. Nat Rev Immunol, 2014, 14(5): 315-328. DOI:10.1038/nri3665 |
| [5] |
ALKIE T N, RAUTENSCHLEIN S. Infectious bursal disease virus in poultry: current status and future prospects[J]. Vet Med (Auckl), 2016, 7: 9-18. |
| [6] |
QIN Y, ZHENG S J. Infectious bursal disease virus-host interactions: multifunctional viral proteins that perform multiple and differing jobs[J]. Int J Mol Sci, 2017, 18(1): 161. DOI:10.3390/ijms18010161 |
| [7] |
WEI L, HOU L, ZHU S S, et al. Infectious bursal disease virus activates the phosphatidylinositol 3-kinase (PI3K)/Akt signaling pathway by interaction of VP5 protein with the p85α subunit of PI3K[J]. Virology, 2011, 417(1): 211-220. DOI:10.1016/j.virol.2011.03.003 |
| [8] |
LIN W C, ZHANG Z Q, XU Z C, et al. The association of receptor of activated protein kinase C 1(RACK1) with infectious bursal disease virus viral protein VP5 and voltage-dependent anion channel 2 (VDAC2) inhibits apoptosis and enhances viral replication[J]. J Biol Chem, 2015, 290(13): 8500-8510. DOI:10.1074/jbc.M114.585687 |
| [9] |
QIN Y, XU Z C, WANG Y Q, et al. VP2 of infectious bursal disease virus induces apoptosis via triggering oral cancer overexpressed 1 (ORAOV1) protein degradation[J]. Front Microbiol, 2017, 8: 1351. DOI:10.3389/fmicb.2017.01351 |
| [10] |
YE C J, YU Z L, XIONG Y W, et al. STAU1 binds to IBDV genomic double-stranded RNA and promotes viral replication via attenuation of MDA5-dependent β interferon induction[J]. FASEB J, 2019, 33(1): 286-300. DOI:10.1096/fj.201800062RR |
| [11] |
WANG B, DUAN X Y, FU M J, et al. The association of ribosomal protein L18 (RPL18) with infectious bursal disease virus viral protein VP3 enhances viral replication[J]. Virus Res, 2018, 245: 69-79. DOI:10.1016/j.virusres.2017.12.009 |
| [12] |
LI Z H, WANG Y Q, LI X, et al. Critical roles of glucocorticoid-induced leucine zipper in infectious bursal disease virus (IBDV)-induced suppression of type I Interferon expression and enhancement of IBDV growth in host cells via interaction with VP4[J]. J Virol, 2013, 87(2): 1221-1231. DOI:10.1128/JVI.02421-12 |
| [13] |
ESTELLER M. Non-coding RNAs in human disease[J]. Nat Rev Genet, 2011, 12(12): 861-874. DOI:10.1038/nrg3074 |
| [14] |
YAN H W, BU P C. Non-coding RNA in cancer[J]. Essays Biochem, 2021, 65(4): 625-639. DOI:10.1042/EBC20200032 |
| [15] |
REN H W, WANG Q Y. Non-coding RNA and diabetic kidney disease[J]. DNA Cell Biol, 2021, 40(4): 553-567. DOI:10.1089/dna.2020.5973 |
| [16] |
LI J X, ZHENG S J. Role of microRNAs in host defense against infectious bursal disease virus (IBDV) infection: a hidden front line[J]. Viruses, 2020, 12(5): 543. DOI:10.3390/v12050543 |
| [17] |
TROBAUGH D W, KLIMSTRA W B. MicroRNA regulation of RNA virus replication and pathogenesis[J]. Trends Mol Med, 2017, 23(1): 80-93. DOI:10.1016/j.molmed.2016.11.003 |
| [18] |
SCHOBER A, BLAY R M, SABOOR MALEKI S, et al. MicroRNA-21 controls circadian regulation of apoptosis in atherosclerotic lesions[J]. Circulation, 2021, 144(13): 1059-1073. DOI:10.1161/CIRCULATIONAHA.120.051614 |
| [19] |
ALI SYEDA Z, LANGDEN S S S, MUNKHZUL C, et al. Regulatory mechanism of microRNA expression in cancer[J]. Int J Mol Sci, 2020, 21(5): 1723. DOI:10.3390/ijms21051723 |
| [20] |
LIN J, XIA J, ZHANG K Y, et al. Genome-wide profiling of chicken dendritic cell response to infectious bursal disease[J]. BMC Genomics, 2016, 17(1): 878. DOI:10.1186/s12864-016-3157-5 |
| [21] |
HUANG X W, LI Y, WANG X N, et al. Genome-wide identification of chicken bursae of Fabricius miRNAs in response to very virulent infectious bursal disease virus[J]. Arch Virol, 2022, 167(9): 1855-1864. DOI:10.1007/s00705-022-05496-6 |
| [22] |
DUAN X Y, ZHAO M L, WANG Y Q, et al. Epigenetic upregulation of chicken microRNA-16-5p expression in DF-1 cells following infection with infectious bursal disease virus (IBDV) enhances IBDV-induced apoptosis and viral replication[J]. J Virol, 2020, 94(2): e01724-19. |
| [23] |
WANG B, FU M J, LIU Y N, et al. gga-miR-155 enhances type I interferon expression and suppresses infectious burse disease virus replication via targeting SOCS1 and TANK[J]. Front Cell Infect Microbiol, 2018, 8: 55. DOI:10.3389/fcimb.2018.00055 |
| [24] |
FU M J, WANG B, CHEN X, et al. MicroRNA gga-miR-130b suppresses infectious bursal disease virus replication via targeting of the viral genome and cellular suppressors of cytokine signaling 5[J]. J Virol, 2018, 92(1): e01646-17. |
| [25] |
LARSEN L, RÖPKE C. Suppressors of cytokine signalling: SOCS[J]. Apmis, 2002, 110(12): 833-844. DOI:10.1034/j.1600-0463.2002.1101201.x |
| [26] |
LIN R J, CHANG B L, YU H P, et al. Blocking of interferon-induced Jak-Stat signaling by Japanese encephalitis virus NS5 through a protein tyrosine phosphatase-mediated mechanism[J]. J Virol, 2006, 80(12): 5908-5918. DOI:10.1128/JVI.02714-05 |
| [27] |
MORRIS R, KERSHAW N J, BABON J J. The molecular details of cytokine signaling via the JAK/STAT pathway[J]. Protein Sci, 2018, 27(12): 1984-2009. DOI:10.1002/pro.3519 |
| [28] |
ZACHAR T, POPOWICH S, GOODHOPE B, et al. A 5-year study of the incidence and economic impact of variant infectious bursal disease viruses on broiler production in Saskatchewan, Canada[J]. Can J Vet Res, 2016, 80(4): 255-261. |
| [29] |
LI L W, GAO F, JIANG Y F, et al. Cellular miR-130b inhibits replication of porcine reproductive and respiratory syndrome virus in vitro and in vivo[J]. Sci Rep, 2015, 5: 17010. DOI:10.1038/srep17010 |
| [30] |
FU M J, WANG B, CHEN X, et al. gga-miR-454 suppresses infectious bursal disease virus (IBDV) replication via directly targeting IBDV genomic segment B and cellular suppressors of cytokine signaling 6 (SOCS6)[J]. Virus Res, 2018, 252: 29-40. DOI:10.1016/j.virusres.2018.05.015 |
| [31] |
LEI Z Q, TANG X W, SI A F, et al. microRNA-454 promotes liver tumor-initiating cell expansion by regulating SOCS6[J]. Exp Cell Res, 2020, 390(1): 111955. DOI:10.1016/j.yexcr.2020.111955 |
| [32] |
GULEI D, RADULY L, BROSEGHINI E, et al. The extensive role of miR-155 in malignant and non-malignant diseases[J]. Mol Aspects Med, 2019, 70: 33-56. DOI:10.1016/j.mam.2019.09.004 |
| [33] |
YAO Y X, VASOYA D, KGOSANA L, et al. Activation of gga-miR-155 by reticuloendotheliosis virus T strain and its contribution to transformation[J]. J Gen Virol, 2017, 98(4): 810-820. DOI:10.1099/jgv.0.000718 |
| [34] |
YANG D K, WANG X W, GAO H L, et al. Downregulation of miR-155-5p facilitates enterovirus 71 replication through suppression of type I IFN response by targeting FOXO3/IRF7 pathway[J]. Cell Cycle, 2020, 19(2): 179-192. DOI:10.1080/15384101.2019.1704512 |
| [35] |
BAYRAKTAR R, VAN ROOSBROECK K. miR-155 in cancer drug resistance and as target for miRNA-based therapeutics[J]. Cancer Metastasis Rev, 2018, 37(1): 33-44. DOI:10.1007/s10555-017-9724-7 |
| [36] |
LI J X, HAIYILATI A, ZHOU L Y, et al. GATA3 Inhibits viral infection by promoting microRNA-155 expression[J]. J Virol, 2022, 96(7): e0188821. DOI:10.1128/jvi.01888-21 |
| [37] |
STIK G, DAMBRINE G, PFEFFER S, et al. The oncogenic microRNA OncomiR-21 overexpressed during Marek's disease lymphomagenesis is transactivated by the viral oncoprotein Meq[J]. J Virol, 2013, 87(1): 80-93. DOI:10.1128/JVI.02449-12 |
| [38] |
ASANGANI I A, RASHEED S A K, NIKOLOVA D A, et al. MicroRNA-21 (miR-21) post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion, intravasation and metastasis in colorectal cancer[J]. Oncogene, 2008, 27(15): 2128-2136. DOI:10.1038/sj.onc.1210856 |
| [39] |
MENG F Y, HENSON R, WEHBE-JANEK H, et al. MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J]. Gastroenterology, 2007, 133(2): 647-658. DOI:10.1053/j.gastro.2007.05.022 |
| [40] |
WANG Y S, OUYANG W, PAN Q X, et al. Overexpression of microRNA gga-miR-21 in chicken fibroblasts suppresses replication of infectious bursal disease virus through inhibiting VP1 translation[J]. Antiviral Res, 2013, 100(1): 196-201. DOI:10.1016/j.antiviral.2013.08.001 |
| [41] |
DUAN X Y, ZHAO M L, LI X Q, et al. gga-miR-27b-3p enhances type I interferon expression and suppresses infectious bursal disease virus replication via targeting cellular suppressors of cytokine signaling 3 and 6 (SOCS3 and 6)[J]. Virus Res, 2020, 281: 197910. DOI:10.1016/j.virusres.2020.197910 |
| [42] |
ZHAO X M, SONG X J, BAI X Y, et al. miR-27b attenuates apoptosis induced by transmissible gastroenteritis virus (TGEV) infection via targeting runt-related transcription factor 1 (RUNX1)[J]. PeerJ, 2016, 4: e1635. DOI:10.7717/peerj.1635 |
| [43] |
WANG C L, XUE M, WU P, et al. Coronavirus transmissible gastroenteritis virus antagonizes the antiviral effect of the microRNA miR-27b via the IRE1 pathway[J]. Sci China Life Sci, 2022, 65(7): 1413-1429. DOI:10.1007/s11427-021-1967-x |
| [44] |
OUYANG W, QIAN J, PAN Q X, et al. gga-miR-142-5p attenuates IRF7 signaling and promotes replication of IBDV by directly targeting the chMDA5's 3' untranslated region[J]. Vet Microbiol, 2018, 221: 74-80. DOI:10.1016/j.vetmic.2018.05.018 |
| [45] |
OUYANG W, WANG Y S, DU X N, et al. gga-miR-9* inhibits IFN production in antiviral innate immunity by targeting interferon regulatory factor 2 to promote IBDV replication[J]. Vet Microbiol, 2015, 178(1/2): 41-49. |
| [46] |
OUYANG W, WANG Y S, MENG K, et al. gga-miR-2127 downregulates the translation of chicken p53 and attenuates chp53-mediated innate immune response against IBDV infection[J]. Vet Microbiol, 2017, 198: 34-42. DOI:10.1016/j.vetmic.2016.12.007 |
| [47] |
张玉霞, 袁小远, 杨金兴, 等. 宿主miRNA-2127靶向p53促进禽流感病毒H9N2亚型体外复制的分子机制[J]. 山东农业科学, 2019, 51(12): 91-95. ZHANG Y X, YUAN X Y, YANG J X, et al. Molecular mechanism of host miRNA-2127 targeting p53 promoting H9N2 subtype of avian influenza virus replication in vitro[J]. Shandong Agricultural Sciences, 2019, 51(12): 91-95. (in Chinese) |
| [48] |
欧阳伟, 钱晶, 王晶宇, 等. chTLR3在传染性法氏囊病病毒感染中的作用及gga-miR-6655-5p对其调控的分子机制[J]. 中国兽医学报, 2019, 39(2): 215-222, 233. OUYANG W, QIAN J, WANG J Y, et al. gga-miR-6655-5p is a negative regulator of chTLR3 and attenuates chTLR3-mediated innate immune response against IBDV infection[J]. Chinese Journal of Veterinary Science, 2019, 39(2): 215-222, 233. (in Chinese) |
| [49] |
HOSEINBEYKI M, TAHA M F, JAVERI A. miR-16 enhances miR-302/367-induced reprogramming and tumor suppression in breast cancer cells[J]. IUBMB Life, 2020, 72(5): 1075-1086. DOI:10.1002/iub.2249 |
| [50] |
HUANG X W, XU Y G, LIN Q Y, et al. Determination of antiviral action of long non-coding RNA loc107051710 during infectious bursal disease virus infection due to enhancement of interferon production[J]. Virulence, 2020, 11(1): 68-79. DOI:10.1080/21505594.2019.1707957 |
| [51] |
SANTHAKUMAR D, RUBBENSTROTH D, MARTINEZ-SOBRIDO L, et al. Avian interferons and their antiviral effectors[J]. Front Immunol, 2017, 8: 49. |
| [52] |
LI Z H, WANG Y Q, XUE Y F, et al. Critical role for voltage-dependent anion channel 2 in infectious bursal disease virus-induced apoptosis in host cells via interaction with VP5[J]. J Virol, 2012, 86(3): 1328-1338. DOI:10.1128/JVI.06104-11 |
| [53] |
BERRETTA J, MORILLON A. Pervasive transcription constitutes a new level of eukaryotic genome regulation[J]. EMBO Rep, 2009, 10(9): 973-982. DOI:10.1038/embor.2009.181 |
| [54] |
BORSANI G, TONLORENZI R, SIMMLER M C, et al. Characterization of a murine gene expressed from the inactive X chromosome[J]. Nature, 1991, 351(6324): 325-329. DOI:10.1038/351325a0 |
| [55] |
GEISLER S, COLLER J. RNA in unexpected places: long non-coding RNA functions in diverse cellular contexts[J]. Nat Rev Mol Cell Biol, 2013, 14(11): 699-712. DOI:10.1038/nrm3679 |
| [56] |
RINN J L, KERTESZ M, WANG J K, et al. Functional demarcation of active and silent chromatin domains in human HOX loci by noncoding RNAs[J]. Cell, 2007, 129(7): 1311-1323. DOI:10.1016/j.cell.2007.05.022 |
| [57] |
KOPP F, MENDELL J T. Functional classification and experimental dissection of long noncoding RNAs[J]. Cell, 2018, 172(3): 393-407. DOI:10.1016/j.cell.2018.01.011 |
| [58] |
FATICA A, BOZZONI I. Long non-coding RNAs: new players in cell differentiation and development[J]. Nat Rev Genet, 2014, 15(1): 7-21. |
| [59] |
XU H N, JIANG Y, XU X Q, et al. Inducible degradation of lncRNA Sros1 promotes IFN-γ-mediated activation of innate immune responses by stabilizing Stat1 mRNA[J]. Nat Immunol, 2019, 20(12): 1621-1630. DOI:10.1038/s41590-019-0542-7 |
| [60] |
LIU J, JI Q L, CHENG F, et al. The lncRNAs involved in regulating the RIG-I signaling pathway[J]. Front Cell Infect Microbiol, 2022, 12: 1041682. DOI:10.3389/fcimb.2022.1041682 |
| [61] |
SUAREZ B, PRATS-MARI L, UNFRIED J P, et al. LncRNAs in the type I interferon antiviral response[J]. Int J Mol Sci, 2020, 21(17): 6447. DOI:10.3390/ijms21176447 |
| [62] |
OUYANG J, HU J Y, CHEN J L. LncRNAs regulate the innate immune response to viral infection[J]. WIREs RNA, 2016, 7(1): 129-143. DOI:10.1002/wrna.1321 |
| [63] |
HUANG X W, ZHANG J Y, LIU Z S, et al. Genome-wide analysis of differentially expressed mRNAs, lncRNAs, and circRNAs in chicken bursae of Fabricius during infection with very virulent infectious bursal disease virus[J]. BMC Genomics, 2020, 21(1): 724. DOI:10.1186/s12864-020-07129-1 |
| [64] |
DUAN T H, DU Y, XING C S, et al. Toll-like receptor signaling and its role in cell-mediated immunity[J]. Front Immunol, 2022, 13: 812774. DOI:10.3389/fimmu.2022.812774 |
| [65] |
HU X Y, LI J, FU M R, et al. The JAK/STAT signaling pathway: from bench to clinic[J]. Signal Transduct Target Ther, 2021, 6(1): 402. DOI:10.1038/s41392-021-00791-1 |
| [66] |
HSU M T, COCA-PRADOS M. Electron microscopic evidence for the circular form of RNA in the cytoplasm of eukaryotic cells[J]. Nature, 1979, 280(5720): 339-340. DOI:10.1038/280339a0 |
| [67] |
LYU D, HUANG S L. The emerging role and clinical implication of human exonic circular RNA[J]. RNA Biol, 2017, 14(8): 1000-1006. DOI:10.1080/15476286.2016.1227904 |
| [68] |
KRISTENSEN L S, ANDERSEN M S, STAGSTED L V W, et al. The biogenesis, biology and characterization of circular RNAs[J]. Nat Rev Genet, 2019, 20(11): 675-691. DOI:10.1038/s41576-019-0158-7 |
| [69] |
LOU Z H, ZHOU R, SU Y H, et al. Minor and major circRNAs in virus and host genomes[J]. J Microbiol, 2021, 59(3): 324-331. DOI:10.1007/s12275-021-1021-z |
| [70] |
GUO J U, AGARWAL V, GUO H L, et al. Expanded identification and characterization of mammalian circular RNAs[J]. Genome Biol, 2014, 15(7): 409. DOI:10.1186/s13059-014-0409-z |
| [71] |
SALZMAN J, CHEN R E, OLSEN M N, et al. Cell-type specific features of circular RNA expression[J]. PLoS Genet, 2013, 9(9): e1003777. DOI:10.1371/journal.pgen.1003777 |
(编辑 白永平)



