牛呼吸道合胞体病毒(bovine respiratory syncytial virus,BRSV)是引起犊牛呼吸道疾病的病毒性病因之一,可导致牛呼吸道合胞体病(bovine respiratory syncytial disease,BRSD),主要临床症状为支气管炎、细支气管炎、肺炎、发烧,呼吸困难、呼吸频率加快、流鼻液等[1-2]。BRSV具有发病率高、发病年龄小的特点,主要通过污染物、呼吸道飞沫或鼻腔分泌物进行传播,临床和亚临床动物均能传播[3]。由于全世界活体动物或动物产品的贸易往来,使得BRSV呈现世界性的分布,给养牛业造成极大的经济损失。据统计,由于死亡损失、生产性能下降以及疫苗和治疗费用,每年因BRSD和其它呼吸系统疾病给养牛业造成的经济损失高达30亿美元[4]。我国自从2007年首例BRSD病例确诊后,BRSV在我国东北和西北等地区迅速广泛传播,得不到有效控制,严重制约了我国畜牧业的发展[5-7]。
BRSV属于副黏病毒科(Pneumoviridae),正肺病毒属(Orthopneumovirus),是一种具有囊膜的单股负链RNA病毒,病毒粒子主要呈球型和长丝状。BRSV与人呼吸道合胞体病毒(human respiratory syncytial virus,HRSV)在所致疾病流行病学、临床症状和病原分子结构特征有很多相似之处。因此,感染BRSV的犊牛是研究HRSV致病机制和疫苗开发的重要动物模型[8-10]。BRSV主要编码11种蛋白,其中附着蛋白(G蛋白)和融合蛋白(F蛋白)是唯一能够在动物模型中诱导产生中和抗体和保护性免疫应答的蛋白,尤其是高度保守的F蛋白上的某些抗原表位和糖基化位点可以刺激机体产生高水平的中和抗体[11]。目前,和国内外对于HRSV囊膜表面糖蛋白G和F的结构功能及疫苗研究相比,有关BRSV-G和F蛋白的研究相对薄弱。因此,明确BRSV的基因组结构,特别是掌握具有免疫防制研究价值的G和F蛋白结构,将为研究新型有效的疫苗提供理论依据。本文旨在对BRSV的G和F蛋白最新研究成果进行论述, 以期对我国在BRSD疫苗研发及疫病防控方面的研究有所帮助。
1 呼吸道合胞体病毒分子生物学特征BRSV是一种有囊膜、纤突、不分节段的多形态病毒,在电镜下多呈现球型和长丝状,基因组由15 222个核苷酸组成,包含10个基因,编码9种结构蛋白和2种非结构蛋白,顺序依次为3′-NS1-NS2-N-P-M-SH-G-F-M2-L-5′[12-13]。BRSV包膜包含三个完整的跨膜包膜糖蛋白:附着蛋白(G)、融合蛋白(F)和疏水小蛋白(SH)。其中G蛋白负责病毒附着,与其他副黏病毒的附着蛋白没有任何序列或结构同源性,缺乏血凝和神经氨酸酶活性,在病毒中和中起次要作用[14]。F蛋白是主要的病毒中和抗原,其功能是介导病毒和细胞或细胞和细胞膜融合[15-16]。SH蛋白是一个高度保守的小型表面蛋白,可以改变宿主细胞膜的通透性[17]。在动物模型中SH蛋白缺失会使病毒复制减弱,且它与肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)途径对细胞凋亡的抑制作用有关[18]。RSV的核衣壳组分分别是L蛋白、P蛋白和N蛋白,它们是指导RNA复制的必要和充分条件[19-20]。非糖基化基质(M)蛋白介导核衣壳和包膜之间相互作用[19]。转录延伸因子M2-1是由M2基因的两个开放阅读框(open reading frame,ORF)中的第一个翻译而来[20]。M2-2蛋白是平衡RSV转录和复制的病毒调节因子,由M2基因中的第二个开放阅读框翻译而来[15]。NS1和NS2两个非结构蛋白,在受感染的细胞中合成,它们合作介导逃避宿主细胞的干扰素反应和抑制细胞凋亡[13, 20]。
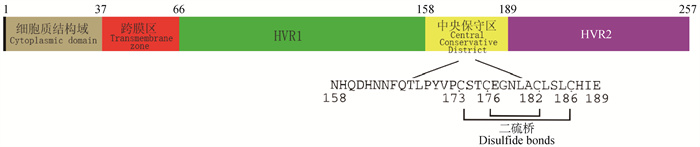
2 G蛋白结构与功能 2.1 G蛋白的结构BRSV-G蛋白是相对分子质量为90 ku,含257个氨基酸(aa)的Ⅱ型糖蛋白,可促进病毒附着在易感宿主细胞上[21-22]。它与其它副黏病毒科病毒之间没有抗原交叉反应,是BRSV的主要保护性抗原之一,主要包含N端细胞质结构域、跨膜区和细胞外结构域。G蛋白主要有可溶性(Gs)和膜结合(Gm)两种形式。Gs以单体形式存在,N末端被水解,缺乏信号/膜锚区,可从感染细胞中分泌出来,而Gm可能是同源四聚体[23]。G蛋白的外域是一个模块化的结构,由中央保守区和两端的两个高度糖基化的黏蛋白样区域(即HVR1和HVR2)构成[24]。中央保守区合成肽C端的第171~186 aa部分是一个刚性结构。这个刚性结构由两个反向平行的α-螺旋组成,通过Ⅰ′型转折和两个二硫桥连接Cys173~Cys186(外桥)和Cys176~Cys182(内桥)形成胱氨酸套索,进而形成一个圆盘状结构,里面是一个具有受体结合位点的疏水性口袋[25-26]。
2.2 G蛋白在病毒感染中的作用G蛋白具有高度变异性,主要参与受体结合、吸附和抗体产生过程[5],是BRSV和HRSV分型的主要依据。当G蛋白发生突变时,特别是174~188 aa之间的免疫显性区域的突变,可能影响G蛋白的抗原性变化[27]。Leme等[27]通过对巴西的10个BRSV菌株进行研究比对,发现G蛋白中央保守区中第180、183和184位的半胱氨酸发生替换,第181位丙氨酸突变为苏氨酸,这些变化可能影响蛋白的抗原表位、抗体反应性和结合力。Furze等[28]通过对比BRSV A和B亚群G蛋白抗原性差异,发现第184位的aa在抗体识别中可能很重要,第205位的碱基决定mAb70的识别能力。2018年,我国学者在黑龙江首次发现BRSV Ⅲ亚群毒株,经RT-PCR和测序发现,G蛋白中央保守区的第165、169、181和187位发生氨基酸取代,这些取代可能对抗体的反应性和结合力产生影响[5]。G蛋白的中央保守区与55 ku肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)的第四亚域具有序列和结构同源性,会干扰肿瘤坏死因子(tumor necrosis factor,TNF)抗病毒和引起细胞凋亡的作用,促进病毒感染宿主[29]。此外,Gorman等[30]通过截断和替换丙氨酸,发现第154~170残基可能是RSV与宿主细胞结合的重要因素。
|
图 1 G蛋白结构示意图 Fig. 1 Schematic diagram of G protein structure |
ON1基因型和BA基因型毒株是目前HRSV流行的主要毒株,经序列对比发现,在G蛋白C末端三分之一处分别出现了72和60 nt的串联重复,这些重复具有增强G蛋白功能的作用,能增强病毒的附着和适应度[17, 31]。
2.3 G蛋白抗原表位的作用G蛋白的保守区和高变区都有针对中和抗体的抗原表位,主要分为三类:(1)所有病毒分离株共享的保守表位;(2)来自同一抗原组的所有病毒中存在的群特异性表位;(3)仅存在于同一抗原组的某些株中的特异性或可变表位。前两种类型的表位位于G蛋白的中央保守段,而毒株特异性表位几乎只局限于可变的C端1/3处。研究发现在RSV A型和B型病毒G蛋白158~189aa间存在一个保守的CD4+T细胞表位,该表位会在RSV反复感染中增强[32]。Varga等[33]发现了一个I-Ed限制性CD4+T细胞表位,核心序列主要位于RSV-G蛋白185~193 aa,主要引起Th l和Th 2 CD 4 +T细胞记忆性应答,这种应答可能导致疾病增强从而对宿主产生不利的影响。Langedijk等[34]在氨基酸水平上解析了BRSV-G蛋白中央保守区的九种抗体的表位,发现第177、180位的突变可能会对抗原表面产生局部影响,不会影响骨架的结构,而第183、184位的突变则可能会对结构产生重大影响,这表明在RSV-G的进化过程中,病毒通过这些突变逃避抗体的识别。
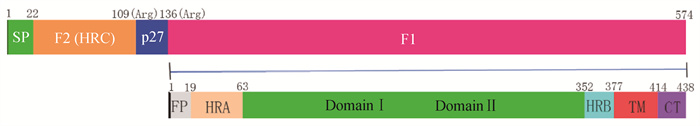
3 F蛋白结构与功能 3.1 F蛋白的结构F蛋白为Ⅰ型糖蛋白,高度保守,能够促进细胞膜融合,形成特征性合胞体。在电子显微镜下,全长的F蛋白呈现莲花状,该莲花状由锥形和棒棒糖状两种蛋白棒构成。F蛋白前体称为F0,由574个aa组成,可以在内质网天冬酰胺上糖基化,形成同源三聚体。F0在Arg109和Arg136处裂解,释放p27,产生F1、F2两个片段。P27具有高度可变性,近几年研究发现该区域可能是抗原的靶点[35]。F1和F2链通过二硫键保持共价连接。RSV F2亚基由七肽重复序列C(HRC)组成,是物种特异性病毒进入细胞的决定因素[36-37]。Lawlor等[38]发现HRSV-F蛋白的F2片段中第66位aa的改变会影响其融合活性。F1亚基包括融合肽(FP)、七肽重复序列A(HRA)、结构域Ⅰ、结构域Ⅱ、七肽重复序列B(HRB)、跨膜结构域(TM)和细胞质尾部(CT)。研究发现,F1链N端三分之一对蛋白酶有抵抗力[39]。HRA位于F1的20~63 aa残基,HRB位于F1的353~377 aa残基,它们在所有副黏病毒F糖蛋白中都是保守的[40-41]。F蛋白有三个疏水序列(SP、FP和TM),在病毒粒子中以预融合的亚稳态构象存在,在膜融合过程中重新折叠形成高度稳定的融合后构象[40]。预融合状态下,FP包埋在F蛋白中,当F蛋白与相应靶细胞受体结合后构象改变,HRA形成长长的螺旋状,使FP暴露并插入到靶细胞膜中,随后,HRA和HRB重排,形成稳定的6螺旋束(6HB)[42-44]。
|
图 2 F蛋白结构示意图 Fig. 2 Schematic diagram of F protein structure |
F蛋白是RSV表面高度保守的包膜糖蛋白,具有不稳定的融合前构象和高度稳定的融合后构象两种形态,可介导病毒与宿主细胞膜融合,而融合前F蛋白的单克隆抗体可以阻止融合后F蛋白形成,抑制病毒-细胞膜融合[43]。在感染的Vero细胞中F蛋白主要分布在病毒丝上,这可能与病毒的组装有关,而参与组装的是F蛋白的TM和CT两个结构域[40, 44-45]。Oomens等[46]和Meshram等[47]通过缺失HRSV-F蛋白的CT或用水泡性口炎病毒(vesicular stomatitis virus,VSV)G蛋白的CT替换F蛋白CT发现,F蛋白的CT结构域具有细胞定位和产生感染性病毒样粒子(virus-like particles,VLPs)的作用,而且CT的缺失或替换会废除F蛋白与Triton不溶性膜(脂质筏)的相互作用,这表明CT提供的功能独立于F蛋白外域和TM。
近年来研究发现,在缺乏G和SH蛋白的情况下,病毒仍能感染目标细胞并使其融合成合胞体[42, 48]。Oomens等[36]通过在Vbac细胞系中缺失SH、G或者SH、G和F包膜糖蛋白的ORF发现,含有F蛋白的病毒不仅可以从cDNA中恢复,并扩增到接近野生型病毒的效价水平,还可以感染Vero和Hep-2细胞,这表明F蛋白是HRSV在细胞中是否具有感染性的关键因素。
在HRSV感染宿主呼吸道期间,会诱导中性粒细胞胞外杀菌网络(neutrophil extracellular traps,NETs)中弹性蛋白酶、蛋白酶、溶菌酶等的释放,这些酶具有杀灭微生物的作用[49]。Lopes等[49]将纯化的HRSV-F蛋白与不同的酶孵育后,发现弹性蛋白酶和蛋白酶3能够切割F蛋白使其裂解,从而使病毒失活。
3.3 F蛋白的糖基化位点和抗原表位的作用BRSV-F蛋白包含有5个保守的N-糖基化位点,分别是位于F2亚基的N27和N70、位于F1亚基N500、位于p27的N116和N126[48, 50]。N-糖基化对病毒的细胞表面表达、融合性、抗原性和干扰抗病毒免疫反应等方面有重要影响。Zimmer等[48]通过突变HRSV Long株F蛋白N-糖基化位点中的天冬酰胺,发现N70聚糖的缺失导致融合活性增加40%,N27和N70缺失使融合活性降低50%,而N500、N27/N500和N70/N500的缺失会使融合活性明显下降90%,这表明N500位的N-糖基化是有效合成合胞体的关键所在。Leemans等[50]通过融合海肾荧光素酶(Renilla luciferase,Rluc)证实了N500位的N-糖基化在RSV-F融合中是必需的。他们还发现,去除N116位N-糖基化序列可以获得更高的抗体滴度, 更有效地清除病毒,这可能是因为去糖基化影响了F蛋白三聚体化,使得F蛋白构象发生改变,暴露表位中和[50]。
到目前为止,在融合前F蛋白中已经确定了六个抗原位点(Ø和Ⅰ~Ⅴ),其中Ⅱ、Ⅲ和Ⅳ抗原位点同时存在于融合后F蛋白中[51]。Ⅲ和Ⅳ抗原位点是构成原聚体间空腔的主要区域,大约位于融合前三聚体的顶端和尾部的中间位置,Ⅳ抗原位点是形成6HB的关键位点,这两个位点序列发生变化时,会影响它们在F蛋白中的作用以及F蛋白融合状态的过渡[51]。Ø表位存在于融合前F蛋白中,在小鼠体内可以引起更高的中和活性[52]。
T细胞反应主要倾向于G和F蛋白的抗原表位,这对宿主肺部病毒的清除至关重要。Levely等[53]通过比较健康成人的淋巴细胞对RSV或包含有RSV-G和F蛋白的重组杆状病毒的增殖反应,发现这两种病毒引起的反应高度相似,这表明RSV的一种或两种糖蛋白是刺激人类淋巴细胞增殖的主要原因;进一步研究发现,F1亚基第328~355个aa区域和F2亚基第51~66个aa区域可能是T细胞反应的免疫优势位点。López等[39]在HRSV-F蛋白氨基末端三分之一处发现了两个在HRSV和BRSV中保守的中和表位47F和7C2,并表示47F表位的完整性受F1亚基第262和268位aa影响。RSV-F糖蛋白是人类记忆CD4+ T细胞的主要靶结构。Van Bleek等[54]发现人CD4+T细胞靶向的免疫显性抗原多肽分布在F蛋白的整个序列上,而在牛中,CD4+T细胞主要靶向F1部分,另外,他们发现牛F1部分第301~316残基肽段中只有一个位置(305Ile→Leu)与人类不同,可以同时被人类CD4+ T细胞和牛T细胞识别。Kaplan等[55]在BRSV-F蛋白上发现了一个在北美型和欧洲型菌株间保守的新的CD+T细胞表位,核心序列为INDMPINTND,氨基酸范围为261~269,该表位仅由DRB3 *01:01等位基因表达,该发现有助于进一步了解牛和人感染RSV后的免疫反应以及促进疫苗的开发。
4 G和F蛋白在疫苗研究与开发中的应用目前,为防控BRSV,欧洲国家批准使用灭活疫苗和减毒活疫苗。虽然这些疫苗接种后可以一定程度地降低动物发病率,减少经济损失,但仍然存在免疫期短、免疫效果差的特点,有时还会介导疾病加重。这样,新型疫苗就成为近几年研究的热点。BRSV-G和F蛋白都具有引起免疫反应的能力。G蛋白产生的中和抗体具有很好的拮抗BRSV的能力,F蛋白为BRSV中最为保守的糖蛋白也有其独特优势。因此,很多研究者们都以G和F蛋白为首选来制备新型疫苗。
4.1 重组载体疫苗利用减毒活病毒为载体,将选定的基因序列插入载体传递给人类或者非人类宿主进行新的表达是疫苗研究与开发的方法之一。对于BRSV和HRSV来说,G和F蛋白是其仅有的两种保护性抗原。早期有研究将合成的BRSV-G基因插入到牛疱疹病毒1(bovine herpesvirus-1,BHV-1)的gE启动子后构建成重组体疫苗接种犊牛,发现与对照组相比,接种BHV-1/G疫苗的犊牛鼻咽分泌物和BRSV显著减少,在BRSV攻毒7 d后,犊牛肺炎病变程度显著降低[56]。有研究者通过在小鼠体内诱导HRSV-G蛋白重组痘苗病毒或纯化的HRSV-G蛋白的多克隆抗体,发现该抗体能有效地中和HRSV[57]。仙台病毒(Sendai virus,SeV)是一种载体病毒,可以在血液和呼吸道黏膜组织中诱导快速并持久的B细胞和T细胞反应。SeVRSV是一种以仙台病毒为载体包含RSV-F全基因序列的鼻内重组疫苗,可以保护非人灵长类动物免受RSV感染,给具有母体抗体的棉鼠接种时,其滴度与2个月大的人类婴儿相当,这说明SeVRSV疫苗的效力不受2个月婴儿母体抗体的影响[58]。Zhan等[59]开发了一种缺乏TM和胞内区域的RSV-F蛋白的重组SeVRSV-Fs疫苗,该疫苗在棉花鼠体内可以引发RSV特异性结合、诱导中和抗体产生以及T细胞反应,使机体完全免受RSV的攻击。新城疫病毒(Newcastle disease virus,NDV)也是载体病毒的一种。Grieves等[60]构建了一种以NDV为载体包含RSV-F蛋白的重组疫苗,该疫苗可以保护小鼠及棉鼠免受RSV感染,长期诱导中和抗体产生。Sacco等[11]以NDV为载体建立了一种密码子优化疫苗rNDV-BRSV Fopt,鼻内接种于初乳缺失的犊牛后,肺部和上呼吸道病毒载量降低,肺部病变减少,这说明该疫苗对于初乳缺失犊牛是安全的。
4.2 亚单位疫苗疫苗研究和开发的另一种方法是通过一些方式提取并筛选出具有免疫活性的病毒特殊蛋白质结构制成亚单位疫苗。安全的疫苗不仅要基于病毒蛋白结构设计增强中和活性,还要诱导Th1免疫应答,这样不会使得感染组织病变加重(如气道的嗜酸粒细胞增多)。据报道,预融合F蛋白能在小鼠、棉花大鼠和非人灵长类动物中诱导高水平中和抗体,而添加合适佐剂会使得免疫效果进一步增强[61]。CTA1-DD黏膜佐剂是一种由霍乱毒素的A1亚单位(CTA1)与葡萄球菌A蛋白D片段的二聚体(DD)连接而成的基因融合蛋白。Li等[62]用大肠杆菌BL21构建了由CTA1-DD黏膜佐剂和预融合F蛋白(RBF)组成的重组蛋白黏膜疫苗CTA1-DD-RBF,该疫苗可以诱导高水平的中和抗体,抑制小鼠肺部病毒的复制,鼻内注射接种后可诱导Th1免疫应答。Ren等[63]将预融合F蛋白(PrF)分别与黏膜佐剂CpG ODN和脂质体(Lipo)鼻内免疫小鼠,在两次免疫后发现,PrF+CpG组的小鼠产生了高滴度的中和抗体和Th1免疫反应,其中第二次免疫后的中和抗体滴度约是PrF+Lipo组的6倍,PrF组的26倍,给小鼠注射致死性病毒剂量后,PrF+Lipo组的小鼠存活率约为67%,PrF+CpG组为100%,这说明PrF与CpG ODN佐剂的结合完全保护小鼠免受致命剂量HRSV的攻击。疫苗接种途径不同也会影响免疫效果。Li等[64]通过鼻内和肌内不同途径两次接种添加了CpG佐剂的F蛋白,发现只有两次都是鼻内接种的小鼠中和抗体滴度最高,支气管肺泡灌洗液中的IgA抗体含量最多,还诱导了Th1免疫应答,并显著减轻了肺部病理损伤,这表明鼻内免疫要优于肌内注射免疫。有些疫苗不仅不会保护宿主免受病毒感染,反而会引起疾病加强。Li等[65]用BL21表达的预融合F蛋白与商业明矾佐剂(GMP级Adju-Phos)一起免疫小鼠后不仅没产生保护作用,反而造成了严重的Th2体液免疫反应以及肺部病变。因此,平衡的免疫反应是保证RSV疫苗安全性和有效性的关键。
4.3 纳米疫苗纳米疫苗也是研究和开发疫苗的一个新方向。共价结合、吸附(在纳米颗粒表面)以及包封(包裹在纳米颗粒内部)是纳米颗粒呈递抗原的三种方式。纳米颗粒可以暂时储存抗原,具有保护蛋白防止被蛋白酶降解和使包被蛋白持续释放的作用。纳米颗粒大小一般为1~1 000 nm,大小接近天然病毒,具有免疫原性高(无需佐剂)、能轻易穿透毛细血管和黏膜细胞表面的特点,因此是作为黏膜免疫的首选疫苗。有研究将BRSV的融合后F蛋白和G蛋白包封在聚酸酐纳米颗粒中,在单次鼻内注射后,引起犊牛呼吸道局部细胞和体液免疫反应,降低肺部病变和病毒脱落[66]。Madhi等[67]对RSV-F蛋白纳米颗粒疫苗进行3期临床试验评价,结果表明该疫苗是安全的,具有免疫原性,可以预防婴儿RSV下呼吸道感染。
5 展望BRSV是牛群呼吸道疾病暴发中最常见的病原体之一,目前主要分为Ⅰ~Ⅹ亚群[7, 27, 68-69],而我国主要流行的毒株是Ⅲ亚群毒株[68]。国内外的流行病学表明,BRSV分布广泛,已经严重危害养牛业的发展,造成严重经济损失[7, 70-71]。而目前尚无有效的防控措施,这可能与BRSV复杂的致病机制有关。安全有效的疫苗是防控BRSV的关键手段,但灭活疫苗和减毒活疫苗在BRSV上存在尚未解决的问题,这种情况下重组载体疫苗、亚单位疫苗、纳米疫苗等新型疫苗成为目前BRSV疫苗研究的热点,目标抗原是RSV表面的G和F蛋白。G和F蛋白作为BRSV重要的结构蛋白之一,其结构和功能在BRSV病毒的感染性、复制和免疫应答中具有重要作用。但是对于G和F蛋白结构和功能的解析仍然有许多未解之处:比如目前研究发现HIV中SP信号肽会影响相邻gp120蛋白的聚糖谱,从而影响gp120的免疫原性,而RSV的SP信号肽是否有相似作用尚未有报道[35]。P27是抗原靶点的预测尚未得到证实。BRSV G蛋白和F蛋白糖基化及其免疫原性的关系有待深入研究。对于这些问题的进一步解决可以帮助人们更加深入地了解BRSV,为BRSV的防控提供帮助。
BRSV具有活跃的变异性,而目前,在国内针对BRSV的分子流行病学的研究相对薄弱。因此,需要进一步追踪BRSV的流行特点和分子特征,了解有关氨基酸变化、抗原表位和糖基化位点的数据,这将有助于确定BRSV-G和F蛋白的抗原性以及疫苗的开发。
| [1] |
İNCE Ö B, ȘEVIK M, ÖZGÜR E G, et al. Risk factors and genetic characterization of bovine respiratory syncytial virus in the inner Aegean Region, Turkey[J]. Trop Anim Health Prod, 2021, 54(1): 4. |
| [2] |
SUDARYATMA P E, MEKATA H, KUBO M, et al. Co-infection of epithelial cells established from the upper and lower bovine respiratory tract with bovine respiratory syncytial virus and bacteria[J]. Vet Microbiol, 2019, 235: 80-85. DOI:10.1016/j.vetmic.2019.06.010 |
| [3] |
SANTOS-RIVERA M, WOOLUMS A R, THORESEN M, et al. Bovine respiratory syncytial virus (BRSV) infection detected in exhaled breath condensate of dairy calves by near-infrared aquaphotomics[J]. Molecules, 2022, 27(2): 549. DOI:10.3390/molecules27020549 |
| [4] |
MAHMOUD A H A, SLATE J R, HONG S, et al. Supplementing a Saccharomyces cerevisiae fermentation product modulates innate immune function and ameliorates bovine respiratory syncytial virus infection in neonatal calves[J]. J Anim Sci, 2020, 98(8): skaa252. DOI:10.1093/jas/skaa252 |
| [5] |
JIA S, YAO X, YANG Y Q, et al. Isolation, identification, and phylogenetic analysis of subgroup Ⅲ strain of bovine respiratory syncytial virus contributed to outbreak of acute respiratory disease among cattle in Northeast China[J]. Virulence, 2021, 12(1): 404-414. DOI:10.1080/21505594.2021.1872178 |
| [6] |
ZHANG J, WANG W, YANG M J, et al. Development of a one-step multiplex real-time PCR assay for the detection of viral pathogens associated with the bovine respiratory disease complex[J]. Front Vet Sci, 2022, 9: 825257. DOI:10.3389/fvets.2022.825257 |
| [7] |
CHANG Y M, YUE H, TANG C. Prevalence and molecular characteristics of bovine respiratory syncytial virus in beef cattle in China[J]. Animals, 2022, 12(24): 3511. DOI:10.3390/ani12243511 |
| [8] |
DÍAZ F E, GUERRA-MAUPOME M, MCDONALD P O, et al. A recombinant BCG vaccine is safe and immunogenic in neonatal calves and reduces the clinical disease caused by the respiratory syncytial virus[J]. Front Immunol, 2021, 12: 664212. DOI:10.3389/fimmu.2021.664212 |
| [9] |
MAINA T W, GREGO E A, BRODERICK S, et al. Immunization with a mucosal, post-fusion F/G protein-based polyanhydride nanovaccine protects neonatal calves against BRSV infection[J]. Front Immunol, 2023, 14: 1186184. DOI:10.3389/fimmu.2023.1186184 |
| [10] |
DE JONG R, STOCKHOFE-ZURWIEDEN N, BONSING J, et al. ChAd155-RSV vaccine is immunogenic and efficacious against bovine RSV infection-induced disease in young calves[J]. Nat Commun, 2022, 13(1): 6142. DOI:10.1038/s41467-022-33649-3 |
| [11] |
SACCO R E, MENA I, PALMER M V, et al. An intranasal recombinant NDV-BRSV Fopt vaccine is safe and reduces lesion severity in a colostrum-deprived calf model of RSV infection[J]. Sci Rep, 2022, 12(1): 22552. DOI:10.1038/s41598-022-26938-w |
| [12] |
FURZE J, WERTZ G, LERCH R, et al. Antigenic heterogeneity of the attachment protein of bovine respiratory syncytial virus[J]. J Gen Virol, 1994, 75(Pt 2): 363-370. |
| [13] |
JOBE F, SIMPSON J, HAWES P, et al. Respiratory syncytial virus sequesters NF-κB subunit p65 to cytoplasmic inclusion bodies to inhibit innate immune signaling[J]. J Virol, 2020, 94(22): e01380-20. |
| [14] |
SCHMIDT U, BEYER J, POLSTER U, et al. Mucosal immunization with live recombinant bovine respiratory syncytial virus (BRSV) and recombinant BRSV lacking the envelope glycoprotein g protects against challenge with wild-type BRSV[J]. J Virol, 2002, 76(23): 12355-12359. DOI:10.1128/JVI.76.23.12355-12359.2002 |
| [15] |
PASTEY M K, SAMAL S K. Analysis of bovine respiratory syncytial virus envelope glycoproteins in cell fusion[J]. J Gen Virol, 1997, 78(Pt 8): 1885-1889. |
| [16] |
KARGER A, SCHMIDT U, BUCHHOLZ U J. Recombinant bovine respiratory syncytial virus with deletions of the G or SH genes: G and F proteins bind heparin[J]. J Gen Virol, 2001, 82(Pt 3): 631-640. |
| [17] |
CUI G L, LIU H C, LI X G, et al. Preliminary functional and phylogeographic analyses of the 72 nucleotide duplication region in the emerging human respiratory syncytial virus ON1 strain attachment glycoprotein gene[J]. Biomed Pharmacother, 2020, 123: 109800. DOI:10.1016/j.biopha.2019.109800 |
| [18] |
TAPIA L I, SHAW C A, AIDEYAN L O, et al. Gene sequence variability of the three surface proteins of human respiratory syncytial virus (HRSV) in Texas[J]. PLoS One, 2014, 9(3): e90786. DOI:10.1371/journal.pone.0090786 |
| [19] |
BUCHHOLZ U J, GRANZOW H, SCHULDT K, et al. Chimeric bovine respiratory syncytial virus with glycoprotein gene substitutions from human respiratory syncytial virus (HRSV): effects on host range and evaluation as a live-attenuated HRSV vaccine[J]. J Virol, 2000, 74(3): 1187-1199. DOI:10.1128/JVI.74.3.1187-1199.2000 |
| [20] |
STOPE M B, KARGER A, SCHMIDT U, et al. Chimeric bovine respiratory syncytial virus with attachment and fusion glycoproteins replaced by bovine parainfluenza virus type 3 hemagglutinin-neuraminidase and fusion proteins[J]. J Virol, 2001, 75(19): 9367-9377. DOI:10.1128/JVI.75.19.9367-9377.2001 |
| [21] |
常益铭, 汤承, 岳华. 牦牛源牛呼吸道合胞体病毒的分子流行病学调查[J]. 畜牧兽医学报, 2023, 54(5): 2030-2041. CHANG Y M, TANG C, YUE H. Molecular epidemiological investigation of bovine respiratory syncytial virus in yaks[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(5): 2030-2041. DOI:10.11843/j.issn.0366-6964.2023.05.024 (in Chinese) |
| [22] |
GARCÍA-BEATO R, MELERO J A. The C-terminal third of human respiratory syncytial virus attachment (G) protein is partially resistant to protease digestion and is glycosylated in a cell-type-specific manner[J]. J Gen Virol, 2000, 81(Pt 4)): 919-927. |
| [23] |
ESCRIBANO-ROMERO E, RAWLING J, GARCÍA-BARRENO B, et al. The soluble form of human respiratory syncytial virus attachment protein differs from the membrane-bound form in its oligomeric state but is still capable of binding to cell surface proteoglycans[J]. J Virol, 2004, 78(7): 3524-3532. DOI:10.1128/JVI.78.7.3524-3532.2004 |
| [24] |
RUSSELL C J, HURWITZ J L. Sendai virus-vectored vaccines that express envelope glycoproteins of respiratory viruses[J]. Viruses, 2021, 13(6): 1023. DOI:10.3390/v13061023 |
| [25] |
STINE L C, HOPPE D K, KELLING C L. Sequence conservation in the attachement glycoprotein and antigenic diversity among bovine respiratory syncytial virus isolates[J]. Vet Microbiol, 54(3/4): 201-221. |
| [26] |
DORELEIJERS J F, LANGEDIJK J P M, HÅRD K, et al. Solution structure of the immunodominant region of protein g of bovine respiratory syncytial virus[J]. Biochemistry, 1996, 35(47): 14684-14688. DOI:10.1021/bi9621627 |
| [27] |
LEME R A, DALL AGNOL A M, BALBO L C, et al. Molecular characterization of Brazilian wild-type strains of bovine respiratory syncytial virus reveals genetic diversity and a putative new subgroup of the virus[J]. Vet Quart, 2020, 40(1): 83-96. DOI:10.1080/01652176.2020.1733704 |
| [28] |
FURZE J M, ROBERTS S R, WERTZ G W, et al. Antigenically distinct G glycoproteins of BRSV strains share a high degree of genetic homogeneity[J]. Virology, 1997, 231(1): 48-58. DOI:10.1006/viro.1997.8490 |
| [29] |
LANGEDIJK J P M, DE GROOT B L, BERENDSEN H J C, et al. Structural homology of the central conserved region of the attachment protein g of respiratory syncytial virus with the fourth subdomain of 55-kDa tumor necrosis factor receptor[J]. Virology, 1998, 243(2): 293-302. DOI:10.1006/viro.1998.9066 |
| [30] |
GORMAN J J, MCKIMM-BRESCHKIN J L, NORTON R S, et al. Antiviral activity and structural characteristics of the nonglycosylated central subdomain of human respiratory syncytial virus attachment (G) glycoprotein[J]. J Biol Chem, 2001, 276(42): 38988-38994. DOI:10.1074/jbc.M106288200 |
| [31] |
HOTARD A L, LAIKHTER E, BROOKS K, et al. Functional analysis of the 60-nucleotide duplication in the respiratory syncytial virus Buenos Aires strain attachment glycoprotein[J]. J Virol, 2015, 89(16): 8258-8266. DOI:10.1128/JVI.01045-15 |
| [32] |
DE WAAL L, YÜKSEL S, BRANDENBURG A H, et al. Identification of a common HLA-DP4-restricted T-cell epitope in the conserved region of the respiratory syncytial virus G protein[J]. J Virol, 2004, 78(4): 1775-1781. DOI:10.1128/JVI.78.4.1775-1781.2004 |
| [33] |
VARGA S M, WISSINGER E L, BRACIALE T J. The attachment (G) glycoprotein of respiratory syncytial virus contains a single immunodominant epitope that elicits both Th1 and Th2 CD4+ T cell responses[J]. J Immunol, 2000, 165(11): 6487-6495. DOI:10.4049/jimmunol.165.11.6487 |
| [34] |
LANGEDIJK J P, MELOEN R H, TAYLOR G, et al. Antigenic structure of the central conserved region of protein G of bovine respiratory syncytial virus[J]. J Virol, 1997, 71(5): 4055-4061. DOI:10.1128/jvi.71.5.4055-4061.1997 |
| [35] |
YOLITZ J, SCHWING C, CHANG J L, et al. Signal peptide of HIV envelope protein impacts glycosylation and antigenicity of gp120[J]. Proc Natl Acad Sci U S A, 2018, 115(10): 2443-2448. DOI:10.1073/pnas.1722627115 |
| [36] |
OOMENS A G P, WERTZ G W. trans-complementation allows recovery of human respiratory syncytial viruses that are infectious but deficient in cell-to-cell transmission[J]. J Virol, 2004, 78(17): 9064-9072. DOI:10.1128/JVI.78.17.9064-9072.2004 |
| [37] |
SCHLENDER J, ZIMMER G, HERRLER G, et al. Respiratory syncytial virus (RSV) fusion protein subunit F2, not attachment protein G, determines the specificity of RSV infection[J]. J Virol, 2003, 77(8): 4609-4616. DOI:10.1128/JVI.77.8.4609-4616.2003 |
| [38] |
LAWLOR H A, SCHICKLI J H, TANG R S. A single amino acid in the F2 subunit of respiratory syncytial virus fusion protein alters growth and fusogenicity[J]. J Gen Virol, 2013, 94(Pt 12): 2627-2635. |
| [39] |
LÓPEZ J A, PEÑAS C, GARCÍA-BARRENO B, et al. Location of a highly conserved neutralizing epitope in the F glycoprotein of human respiratory syncytial virus[J]. J Virol, 1990, 64(2): 927-930. DOI:10.1128/jvi.64.2.927-930.1990 |
| [40] |
CALDER L J, GONZÁLEZ-REYES L, GARCÍA-BARRENO B, et al. Electron microscopy of the human respiratory syncytial virus fusion protein and complexes that it forms with monoclonal antibodies[J]. Virology, 2000, 271(1): 122-131. DOI:10.1006/viro.2000.0279 |
| [41] |
COLLINS P L, HUANG Y T, WERTZ G W. Nucleotide sequence of the gene encoding the fusion (F) glycoprotein of human respiratory syncytial virus[J]. Proc Natl Acad Sci U S A, 1984, 81(24): 7683-7687. DOI:10.1073/pnas.81.24.7683 |
| [42] |
SUN Z W, PAN Y B, JIANG S B, et al. Respiratory syncytial virus entry inhibitors targeting the F protein[J]. Viruses, 2013, 5(1): 211-225. DOI:10.3390/v5010211 |
| [43] |
MAGRO M, ANDREU D, GÓMEZ-PUERTAS P, et al. Neutralization of human respiratory syncytial virus infectivity by antibodies and low-molecular-weight compounds targeted against the fusion glycoprotein[J]. J Virol, 2010, 84(16): 7970-7982. DOI:10.1128/JVI.00447-10 |
| [44] |
BLAIS N, GAGNÉ M, HAMURO Y, et al. Characterization of Pre-F-GCN4t, a modified human respiratory syncytial virus fusion protein stabilized in a noncleaved prefusion conformation[J]. J Virol, 2017, 91(13): e02437-16. |
| [45] |
OOMENS A G P, MEGAW A G, WERTZ G W. Infectivity of a human respiratory syncytial virus lacking the SH, G, and F proteins is efficiently mediated by the vesicular stomatitis virus G protein[J]. J Virol, 2003, 77(6): 3785-3798. DOI:10.1128/JVI.77.6.3785-3798.2003 |
| [46] |
OOMENS A G P, BEVIS K P, WERTZ G W. The cytoplasmic tail of the human respiratory syncytial virus F protein plays critical roles in cellular localization of the F protein and infectious progeny production[J]. J Virol, 2006, 80(21): 10465-10477. DOI:10.1128/JVI.01439-06 |
| [47] |
MESHRAM C D, BAVISKAR P S, OGNIBENE C M, et al. The respiratory syncytial virus phosphoprotein, matrix protein, and fusion protein carboxy-terminal domain drive efficient filamentous virus-like particle formation[J]. J Virol, 2016, 90(23): 10612-10628. DOI:10.1128/JVI.01193-16 |
| [48] |
ZIMMER G, TROTZ I, HERRLER G. N-glycans of F protein differentially affect fusion activity of human respiratory syncytial virus[J]. J Virol, 2001, 75(10): 4744-4751. DOI:10.1128/JVI.75.10.4744-4751.2001 |
| [49] |
LOPES B R P, DA SILVA G S, DE LIMA MENEZES G, et al. Serine proteases in neutrophil extracellular traps exhibit anti-respiratory syncytial virus activity[J]. Int Immunopharmacol, 2022, 106: 108573. DOI:10.1016/j.intimp.2022.108573 |
| [50] |
LEEMANS A, BOEREN M, VAN DER GUCHT W, et al. Removal of the N-glycosylation sequon at position N116 located in p27 of the respiratory syncytial virus fusion protein elicits enhanced antibody responses after DNA immunization[J]. Viruses, 2018, 10(8): 426. DOI:10.3390/v10080426 |
| [51] |
MAS V, NAIR H, CAMPBELL H, et al. Antigenic and sequence variability of the human respiratory syncytial virus F glycoprotein compared to related viruses in a comprehensive dataset[J]. Vaccine, 2018, 36(45): 6660-6673. DOI:10.1016/j.vaccine.2018.09.056 |
| [52] |
CRUNKHORN S. Viral diseases: zeroing in on RSV vaccine design[J]. Nat Rev Drug Discov, 2014, 13(1): 17. DOI:10.1038/nrd4207 |
| [53] |
LEVELY M E, BANNOW C A, SMITH C W, et al. Immunodominant T-cell epitope on the F protein of respiratory syncytial virus recognized by human lymphocytes[J]. J Virol, 1991, 65(7): 3789-3796. DOI:10.1128/jvi.65.7.3789-3796.1991 |
| [54] |
VAN BLEEK G M, POELEN M C, VAN DER MOST R, et al. Identification of immunodominant epitopes derived from the respiratory syncytial virus fusion protein that are recognized by human CD4 T cells[J]. J Virol, 2003, 77(2): 980-988. DOI:10.1128/JVI.77.2.980-988.2003 |
| [55] |
KAPLAN B S, HOFSTETTER A R, MCGILL J L, et al. Identification of a DRB3*011:01-restricted CD4+ T cell response against bovine respiratory syncytial virus fusion protein[J]. Front Immunol, 2023, 14: 1040075. DOI:10.3389/fimmu.2023.1040075 |
| [56] |
TAYLOR G, RIJSEWIJK F A M, THOMAS L T, et al. Resistance to bovine respiratory syncytial virus (BRSV) induced in calves by a recombinant bovine herpesvirus-1 expressing the attachment glycoprotein of BRSV[J]. J Gen Virol, 1998, 79(Pt 7): 1759-1767. |
| [57] |
MARTÍNEZ I, MELERO J A. Enhanced neutralization of human respiratory syncytial virus by mixtures of monoclonal antibodies to the attachment (G) glycoprotein[J]. J Gen Virol, 1998, 79(Pt 9): 2215-2220. |
| [58] |
JONES B G, SEALY R E, SURMAN S L, et al. Sendai virus-based RSV vaccine protects against RSV challenge in an in vivo maternal antibody model[J]. Vaccine, 2014, 32(26): 3264-3273. DOI:10.1016/j.vaccine.2014.03.088 |
| [59] |
ZHAN X Y, SLOBOD K S, JONES B G, et al. Sendai virus recombinant vaccine expressing a secreted, unconstrained respiratory syncytial virus fusion protein protects against RSV in cotton rats[J]. Int Immunol, 2015, 27(5): 229-236. DOI:10.1093/intimm/dxu107 |
| [60] |
GRIEVES J L, YIN Z W, GARCIA-SASTRE A, et al. A viral-vectored RSV vaccine induces long-lived humoral immunity in cotton rats[J]. Vaccine, 2018, 36(26): 3842-3852. DOI:10.1016/j.vaccine.2018.04.089 |
| [61] |
OLMEDILLAS E, CANO O, MARTÍNEZ I, et al. Chimeric Pneumoviridae fusion proteins as immunogens to induce cross-neutralizing antibody responses[J]. EMBO Mol Med, 2018, 10(2): 175-187. DOI:10.15252/emmm.201708078 |
| [62] |
LI H, REN H, ZHANG Y, et al. Intranasal vaccination with a recombinant protein CTA1-DD-RBF protects mice against hRSV infection[J]. Sci Rep, 2021, 11(1): 18641. DOI:10.1038/s41598-021-97535-6 |
| [63] |
REN H, LI H, CAO L, et al. Intranasal immunization with HRSV prefusion F protein and CpG adjuvant elicits robust protective effects in mice[J]. Vaccine, 2022, 40(47): 6830-6838. DOI:10.1016/j.vaccine.2022.09.071 |
| [64] |
LI H, REN H, CAO L, et al. Comparison of the efficacy and safety of different immunization routes induced by human respiratory syncytial virus F protein with CpG adjuvant in mice[J]. Biochem Biophys Res Commun, 2022, 618: 54-60. DOI:10.1016/j.bbrc.2022.06.015 |
| [65] |
LI H, REN H, ZHOU Y Z, et al. HRSV prefusion-F protein with Adju-Phos adjuvant induces long-lasting Th2-biased immunity in mice[J]. PLoS One, 2022, 17(1): e0262231. DOI:10.1371/journal.pone.0262231 |
| [66] |
MCGILL J L, KELLY S M, KUMAR P, et al. Efficacy of mucosal polyanhydride nanovaccine against respiratory syncytial virus infection in the neonatal calf[J]. Sci Rep, 2018, 8(1): 3021. DOI:10.1038/s41598-018-21292-2 |
| [67] |
MADHI S A, POLACK F P, PIEDRA P A, et al. Respiratory syncytial virus vaccination during pregnancy and effects in infants[J]. N Engl J Med, 2020, 383(5): 426-439. DOI:10.1056/NEJMoa1908380 |
| [68] |
YAZICI Z, OZAN E, TAMER C, et al. Circulation of indigenous bovine respiratory syncytial virus strains in turkish cattle: the first isolation and molecular characterization[J]. Animals, 2020, 10(9): 1700. DOI:10.3390/ani10091700 |
| [69] |
KUMAGAI A, KAWAUCHI K, ANDOH K, et al. Sequence and unique phylogeny of G genes of bovine respiratory syncytial viruses circulating in Japan[J]. J Vet Diagn Invest, 2021, 33(1): 162-166. DOI:10.1177/1040638720975364 |
| [70] |
HOPPE I B A L, DE MEDEIROS A S R, ARNS C W, et al. Bovine respiratory syncytial virus seroprevalence and risk factors in non-vaccinated dairy cattle herds in Brazil[J]. BMC Vet Res, 2018, 14(1): 208. DOI:10.1186/s12917-018-1535-8 |
| [71] |
KLEM T B, RIMSTAD E, STOKSTAD M. Occurrence and phylogenetic analysis of bovine respiratory syncytial virus in outbreaks of respiratory disease in Norway[J]. BMC Vet Res, 2014, 10: 15. DOI:10.1186/1746-6148-10-15 |
(编辑 白永平)



