2. 百欧派(天津)生物技术有限公司, 天津 300350
2. BaiOuPai (Tianjin) Biotechnology Co., Ltd, Tianjin 300350, China
糖尿病(diabetes mellitus,DM)是一种由于遗传、生活方式及外界刺激等多种因素导致胰岛β细胞受损无法正常产生胰岛素,或者靶组织细胞对胰岛素敏感性降低而引发系列代谢紊乱的综合征,通常表现为机体血糖水平升高且无法自行恢复[1]。随着人们物质和精神需求的日益增长,犬、猫等伴侣动物已经成为许多家庭的重要“成员”,且因为犬、猫等的生存环境、饲养方式及生活模式也颇为“拟人化”,完全按照人类惯用的模式进行,所以犬、猫等伴侣动物中糖尿病的患病率、发病率及死亡率也在逐年增加。作为一种临床常见、容易诱导并发症的内分泌代谢类疾病,犬糖尿病的常用治疗方式与人类相似,多为胰岛素注射搭配降糖药物口服,但是存在操作难度大、无法给予有效反馈、治疗效果无法稳定维持、降糖药物存在一定毒性等问题,无法对犬类糖尿病起到很好的控制或者从根本上治疗等作用。所以寻找一种安全、方便且高效的治疗方式可谓是迫在眉睫。
间充质干细胞(mesenchymal stem cells,MSCs)是一类组织来源十分广泛的成体干细胞,具有干细胞的所有共性,即自我更新和多向分化能力,且增殖能力强、免疫原性小,极具临床应用价值。在临床中,MSCs在血液系统、心血管系统、神经系统,内分泌代谢系统等多方面的疾病治疗中发挥极大的潜力[2-4]。对于糖尿病及其相关疾病,MSCs能够通过多种途径起到良好的治疗作用,其途径主要包括:缓解胰岛素抵抗[5-7]、促进胰岛再生[8-11]、减轻炎症[12-14]、分泌营养因子[15-17]、减少细胞凋亡[18-20]。但是MSCs仍存在体外培养时间过长易衰老、移植到体内后作用时间短等问题,所以探索一种能够提高ADMSCs治疗效果的新方法十分必要。
米托蒽醌甲磺酸盐(mitoquinone mesylate,MitoQ)是由剑桥大学和奥塔哥大学的科学家于2000年最先发现的一种泛醌衍生物,其由三苯基磷阳离子(triarylphosphines,TPP+)与辅酶Q 10(CoQ 10)的苯醌部分通过1个十碳脂肪链共价结合构成[21-22]。MitoQ的分子式是C37H46O4PBr,其分子量为665.65[23]。CoQ 10作为一种内源性合成的脂溶性抗氧化剂,是组成呼吸链的必需成分,在线粒体内参与机体所有细胞产生能量的过程,保护细胞免受自由基的氧化损伤[24]。MitoQ作为一种强大的抗氧化剂,在前期研究中已被证明能够有效减轻氧化应激,应用潜力大,能够对细胞损伤、组织损伤及各类疾病起到很好的治疗和恢复作用[25-30]。然而其研究尚缺乏一些关键的体内模型试验以及特异性的关键作用通路,针对MitoQ进行进一步探索,可以为由于氧化应激和线粒体功能障碍而导致的各类疾病治疗提供科学依据,同时,为各种重大疾病提供有效的防控措施。总之,MitoQ的相关研究已经证明了它的强大应用前景,将MitoQ与间充质干细胞相结合,可能极大促进临床中的应用,为疾病治疗提供新对策和新方案。
1 材料与方法 1.1 细胞复苏传代取出ADMSCs,置于15 mL离心管中,1 500 r·min-1离心5 min,弃上清,加入新鲜配置的α-MEM+培养液,移入培养皿,“十”字法混匀,置于37 ℃恒温培养箱中培养。
镜下观察,待细胞贴壁培养增殖至80%时,加入胰蛋白酶,37 ℃恒温培养箱静置5 min,待ADMSCs形状变圆且飘起时,终止消化,1 500 r·min-1离心3 min,观察到细胞团块后,弃上清,按照所需接种比例转移至新的培养皿中,并按照不同培养皿的规格添加不同剂量的培养液,继续进行细胞培养。
本试验中,MitoQ-ADMSCs为P3代ADMSCs,经正常复苏后,待培养至80%时,按照1 ∶6比例传代至新的培养基中,并使用含MitoQ的α-MEM+培养基进行后续培养,MitoQ在培养基中的浓度为1 μmol·L-1。
1.2 姬姆萨(Giemsa)染色去除培养液,使用PBS清洗2次;加入新鲜的甲醇固定5 min;取Giemsa原液与PBS按照1 ∶9比例进行充分混合,作为工作液备用,待固定后,弃甲醇,加入Giemsa工作液,染色20 min;使用PBS清洗,镜下观察拍照,正常可见细胞核被染成紫红色或蓝紫色,细胞质则被染成浅红色。
1.3 细胞生长曲线绘制取正常培养的ADMSCs和MitoQ-ADMSCs,使用0.25%胰蛋白酶进行消化,后取细胞计数板进行计数,将ADMSCs和MitoQ-ADMSCs以每孔5×103个的密度接种于24孔板进行培养,每24 h随机抽取2孔细胞进行消化、离心、重悬、计数,每孔重复2次,连续7 d。细胞计数结果以培养时间为横轴,细胞数为纵轴,描绘后连成曲线即为两种细胞的生长曲线。
1.4 乙基脱氧尿苷(EdU)染色取正常培养的ADMSCs和MitoQ-ADMSCs,吸取1×105个细胞接种于96孔板中;EdU溶液稀释后,进行染色,孵育2 h,PBS清洗;细胞固定液孵育30 min,清洗后加入2 mg·mL-1甘氨酸,孵育5 min,PBS清洗;加入Apollo染色液,避光孵育30 min,弃液;加入渗透剂清洗,弃液;按照100 ∶1的比例稀释Hoechst 33342避光孵育1 h,PBS清洗;观察、拍照、数据分析。
1.5 细胞迁移试验取生长状态良好的ADMSCs和MitoQ-ADMSCs,接种于6孔板中培养至正常生长状态;观察细胞增殖至90%左右时,进行划痕制作确保划到底壁,PBS洗涤,确保划痕区域无残留;继续培养,分别在12和24 h进行显微镜下拍照记录。
1.6 细胞总RNA提取、cDNA合成及real-time PCR取生长状态良好的ADMSCs和MitoQ-ADMSCs,用Trozol法进行细胞RNA的提取。吸弃细胞中的α-MEM+培养基,加入1 mL Trizol后立刻进行混匀;吸取200 μL三氯甲烷充分混合,静置5 min,4 ℃、12 000 r·min-1离心15 min,吸取无色上清;加入异丙醇,上下翻转后静置10 min,4 ℃、12 000 r·min-1离心10 min,吸弃上层液体,保留下层沉淀;加入75%乙醇,4 ℃、7 500 r·min-1离心5 min,去除残存液体;RNA干燥后,加入DEPC水,进行浓度检测,测定结果浓度偏高且无RNA降解时置于-80 ℃冰箱保存;按照cDNA反转录试剂盒得到cDNA,-20 ℃冰箱中保存。qRT-PCR体系按照说明书进行配制,相关引物见表 1。
|
|
表 1 qRT-PCR引物 Table 1 qRT-PCR primer |
根据试剂说明书,稀释活性氧荧光探针(2′, 7′-dichlorodihydrofluorescein diacetate, DCFH-DA),并加入到培养基中,细胞浓度为1×106·mL-1,37 ℃恒温培养箱内孵育20 min。每隔3~5 min吹打混匀1次。洗涤3次后,荧光显微镜下观察、拍照。
1.8 动物试验及处理选用48只8周龄雄性昆明(KM)小鼠及12只中华田园犬。经1周适应性饲喂后,对所有小鼠及犬进行随机分组:1)正常对照组(NC组);2)糖尿病模型组(Diabetes组);3)ADMSCs单独治疗组(ADMSCs组);4)MitoQ-ADMSCs联合治疗组(MitoQ-ADMSCs组)。每组12只小鼠或3只犬。NC组全程使用普通饲料饲喂,其他三组均改用高糖高脂饲料进行为期3周的饲喂,后对其进行为期16 h的禁食,并注射链脲佐菌素(streptozotin,STZ),其中小鼠腹腔注射剂量为40 mg·kg-1,1次·周-1,连续3周;犬皮下注射剂量为20 mg·kg-1,1次·d-1,连续3 d。注射1周后,对动物血糖水平进行为期3 d的连续监测,3次空腹血糖测量值均高于7.6 mmol·L-1,随机血糖测量值高于11.1 mmol·L-1,视为糖尿病动物模型成功建立,若未成功建立,重复STZ注射,直至成功建立。后进行细胞移植治疗,ADMSCs及MitoQ-ADMSCs联合治疗组(MitoQ处理ADSMCs剂量为1 μmol·L-1) 注射剂量:小鼠尾静脉注射2×106个,犬前肢静脉注射1×107个。NC组和Diabetes组则注射同等剂量的PBS,连续治疗3周。详见表 2。在此过程中,持续监测动物模型精神状态、体重、采食量、饮水量、血糖水平、葡萄糖耐量等变化。治疗结束1周后,禁食16 h,使用盐酸赛拉嗪注射液对犬进行肌肉注射麻醉、采血、静推氯化钾注射处死、采集样本。
|
|
表 2 动物试验 Table 2 Animal experiment |
在动物糖尿病模型的制作过程及细胞移植治疗期间,使用血糖仪对血糖水平进行监测。
葡萄糖耐量(OGTT)试验可以正确反映动物对血糖的调节能力,经12 h禁食,在葡萄糖水溶液灌注前进行空腹血糖检测,记为0 h血糖水平,之后对小鼠进行葡萄糖水溶液的灌胃,对犬进行诱导使其主动喝下,在2 h内进行4次检测,绘制OGTT曲线。
1.10 体重监测在动物糖尿病模型的制作过程及细胞移植治疗期间,对小鼠和犬的体重进行持续监测,小鼠使用高精准度克重量器,犬使用小型台称,由人保定进行称量。
1.11 采血与血清分离小鼠摘除眼球采血;犬后心采血,收集血清备用。
1.12 肝和脂质代谢及氧化应激指标测定按照南京建成公司生化检测试剂盒的说明书步骤,分别测定标准品及血清样品在试剂盒对应的波长下的吸光度OD值,首先按照标准品的结果制作标准曲线,后将样品的OD值带入标准曲线进行计算,从而计算样品的实际浓度。血清肝代谢指标测定包括天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT);脂质代谢指标包括总胆固醇(TC)和甘油三酯(TG);胰腺组织氧化应激指标包括过氧化氢(H2O2)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)。
1.13 组织样采集、石蜡切片制备与HE染色所有实验动物在试验结束1周后处死,小鼠使用颈部脱臼方式,犬通过静脉注射氯化钾方式安乐死,采集胰腺、肝、肾、腹部皮下脂肪组织,置于4%多聚甲醛溶液(4% PFA)中固定,留存备用。固定好的组织块标记,送至西安依科生物技术有限公司包埋,切成5 μm厚度的组织切片。
进行常规HE组织染色。
1.14 免疫荧光染色通风橱内,石蜡切片常规脱蜡至水;微波炉中使用pH 9.0的抗原修复液修复;1%牛血清白蛋白(1% BSA)室温孵育2 h;胰岛素抗体,按照1 ∶100比例用1% BSA进行稀释4 ℃孵育过夜,PBS清洗;荧光二抗37 ℃避光孵育1 h,PBS洗涤(5 min×3次);Hoechst33342适量处理,荧光显微镜下观察、拍照。
1.15 免疫组化染色通风橱内,石蜡切片常规脱蜡至水;微波炉中使用pH 9.0的抗原修复液修复;内源性过氧化物酶阻断剂处理;滴加适量一抗,放置于37 ℃恒温条件下孵育1 h,PBS洗涤(5 min×3次);滴加增强酶标羊抗小鼠/兔lgG聚合物于组织表面,室温条件下孵育;PBS洗涤(5 min×3次);新鲜配制DAB显色液孵育5~10 min;苏木素染色液,分化2 min、冲洗返蓝;二甲苯Ⅱ和二甲苯Ⅰ分别浸泡2 min;风干,中性树脂封片,拍照。
1.16 过碘酸雪夫(PAS)染色通风橱内,石蜡切片常规脱蜡至水;将过碘酸溶液平衡至室温,吸取过碘酸溶液滴加于组织上,避光反应8 min,转移至蒸馏水中洗涤10 min;擦拭掉多余的液体,吸取Schiff试剂滴加在组织上,置于37 ℃黑暗环境中1 h,去除染色液,浸泡于蒸馏水中并置于摇床洗涤5 min;取出切片,滴加100 μL苏木素染色液,待颜色发生变化时用自来水进行冲洗;将切片按照与水化阶段完全相反的顺序进行浸泡,每个浓度3 min后,在二甲苯Ⅱ和二甲苯Ⅰ分别浸泡2 min;风干,中性树脂封片,拍照。
1.17 马松(Masson)染色石蜡切片常规脱蜡至水;Weigert氏铁苏木素染5 min,自来水冲洗;1%盐酸酒精分化;丽春红酸性复红染色液8 min;0.2%冰醋酸溶液2 min,甩干重复3次;适量的磷钼酸水溶液2 min;冰醋酸水溶液处理,观察切片;将切片按照与水化阶段完全相反的顺序进行浸泡,每个浓度3 min,二甲苯Ⅱ和二甲苯Ⅰ分别浸泡2 min;风干切片,中性树脂封片,拍照。
1.18 代谢组学检测收集犬NC组、Diabetes组、ADMSCs组和MitoQ-ADMSCs组血清,送至上海中科新生命生物科技有限公司进行代谢组学检测,数据分析使用XCMS软件。
1.19 数据处理选用GraphPad Prism 9软件对数据进行整理、分析,显著性差异分析选用T检验,各数据结果均为“平均值±标准差”,差异显著性表示:*.P < 0.05,**.P < 0.01,***.P < 0.001,ns表示无显著差异。
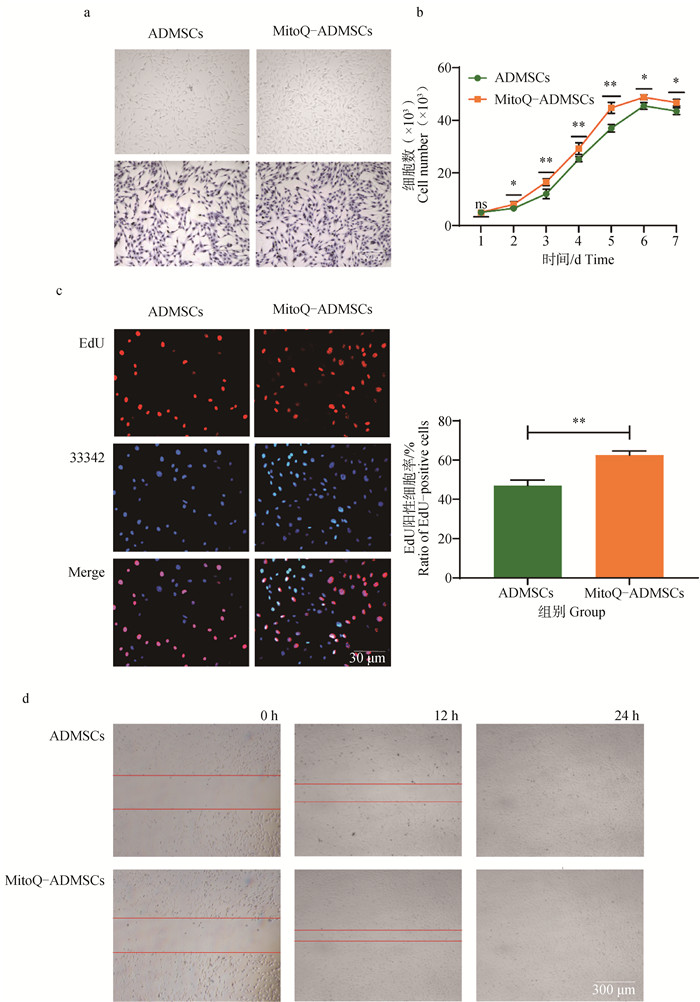
2 结果 2.1 MitoQ-ADMSCs和ADMSCs形态、生长、增殖及迁移能力差异与同时复苏的ADMSCs相比,MitoQ-ADMSCs形态未发生明显变化,均为立体的梭状结构,且细胞边缘清晰可见(图 1a);对ADMSCs和MitoQ-ADMSCs进行为期7 d的细胞计数,结果显示,MitoQ-ADMSCs的生长速度显著优于ADMSCs,MitoQ-ADMSCs的群体倍增时间短于ADMSCs,且两种细胞增长速度的差异在第3~5天最为明显(图 1b);通过EdU细胞增殖试验观察到MitoQ-ADMSCs的增殖速率远高于ADMSCs,可以看到同面积内MitoQ-ADMSCs处于增殖阶段的细胞(红色)更多(图 1c);此外,对二组在24 h内的迁移速度进行观察,发现MitoQ-ADMSCs迁移速度显著快于ADMSCs,尤其在12 h时最为明显,MitoQ-ADMSCs具有明显的迁移优势(图 1d)。
|
a. Giemsa染色; b.细胞生长曲线; c.EdU染色; d.细胞迁移试验。*.P < 0.05,**.P < 0.01,***.P < 0.001,ns.P>0.05 a. Giemsa staining; b. Cell growth curve; c. EdU staining; d. Cell migration test.*.P < 0.05, **.P < 0.01, ***.P < 0.001, ns.P>0.05 图 1 ADMSCs和MitoQ-ADMSCs细胞形态及生长特征 Fig. 1 Morphology and growth characteristics of ADMSCs and MitoQ-ADMSCs |
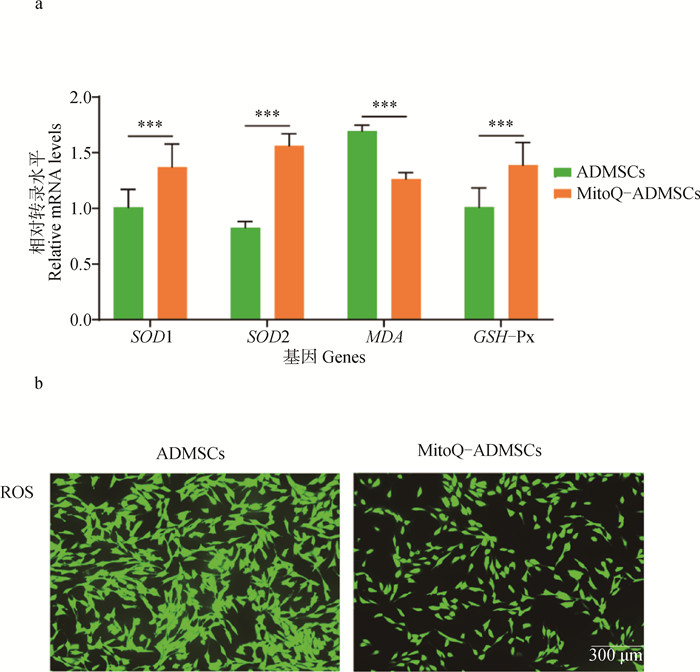
qRT-PCR技术检测MitoQ-ADMSCs和ADMSCs中SOD1、SOD2、MDA、GSH-Px的相对表达量发现:MitoQ-ADMSCs与ADMSCs相比,抗氧化相关的超氧化物歧化酶(SOD1、SOD2)、谷胱甘肽过氧化物酶GSH-Px转录量显著升高,氧化损伤相关的丙二醛(MDA)转录量显著下降,提示MitoQ预处理提升了ADMSCs在体外培养过程中的抗氧化能力(图 2a);利用荧光探针DCFH-DA对MitoQ-ADMSCs和ADMSCs进行检测,活性氧可以氧化DCFH变成有荧光的DCF,观察可见同一视野中ADMSCs的荧光量显著多于MitoQ-ADMSCs,证明ADMSCs中的活性氧水平更高,提示MitoQ处理减少了ADMSCs活性氧水平,抗氧化能力显著提升(图 2b)。
|
a. qRT-PCR试验; b. ROS染色。*.P < 0.05,**.P < 0.01,***.P < 0.001,ns.P>0.05 a. qRT-PCR experiment; b.ROS staining. *.P < 0.05, **.P < 0.01, ***.P < 0.001, ns.P>0.05 图 2 ADMSCs和MitoQ-ADMSCs细胞抗氧化及抗衰老特征 Fig. 2 Antioxidant and antiaging characteristics of ADMSCs and MitoQ-ADMSCs |
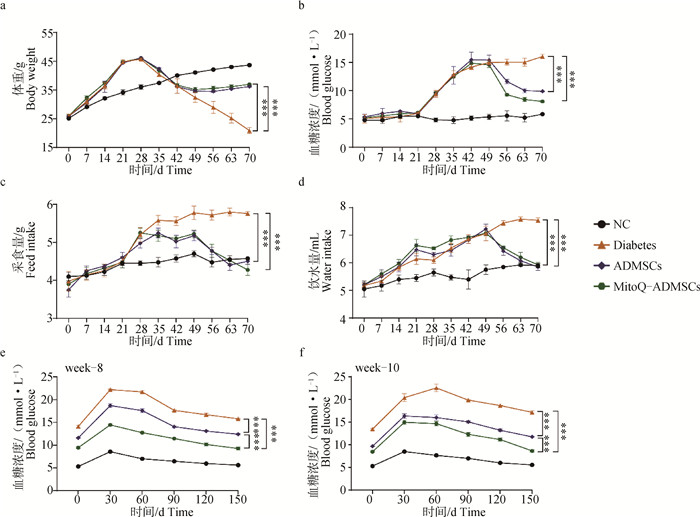
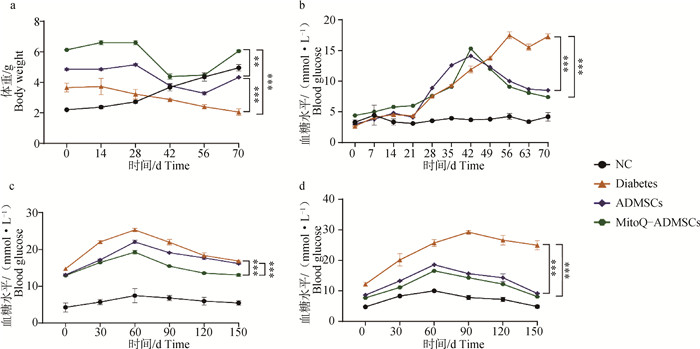
对8周龄昆明(KM)小鼠进行1周适应性饲喂后,除NC组外的所有小鼠均改用高糖高脂饲料进行为期3周的饲喂,观察到小鼠体重显著上升,但血糖水平没有明显的变化,后对达到40 g以上的小鼠使用STZ连续3周注射,1次·周-1,在此过程中可观察到小鼠的体重水平呈现出明显的下降趋势,血糖水平则呈现出明显的上升趋势,且多饮多食现象逐渐加剧,被毛也变得粗糙凌乱,垫料中尿液和粪便味道极大,甚至有几只出现了便血,注射结束后1周,即在第7周时对小鼠进行了再次的检测,结果发现造模的小鼠空腹血糖水平稳定维持在11.1 mmol·L-1以上,表明成功建立小鼠糖尿病模型。在第8周时,对ADMSCs组和MitoQ-ADMSCs小鼠进行细胞移植治疗,连续3周,1次·周-1在治疗过程后,发现经细胞移植的小鼠血糖水平显著下降,采食和饮水量也有所下降,体重水平则有所回升,且MitoQ-ADMSCs的细胞移植效果要优于ADMSCs移植组(图 3a~d),可见MitoQ促进了ADMSCs对小鼠糖尿病临床症状的恢复作用。为检查小鼠机体血糖调节能力是否有所恢复,在治疗的第1、3周分别对小鼠进行了葡萄糖耐量的检测,发现NC组的小鼠在葡萄糖灌注后的2 h内血糖虽然升高,但是不显著;而Diabetes组小鼠的血糖水平显著升高,在30 min时甚至达到了20 mmol·L-1;ADMSCs移植治疗的小鼠血糖水平虽然没有恢复到正常情况,但是相较于模型组小鼠其下降效果明显,且MitoQ-ADMSCs组小鼠的血糖变化幅度低于ADMSCs组,说明MitoQ可能促进了糖尿病小鼠胰岛β细胞功能和机体血糖调节能力的恢复(图 3e、f)。
|
a.体重变化;b.空腹血糖变化;c.采食量变化;d.饮水量变化;e.治疗第1周葡萄糖耐量;f.治疗第3周葡萄糖耐量。*.P < 0.05,**.P < 0.01,***.P < 0.001,ns表示无显著差异 a. Weight change; b. Changes in fasting blood glucose; c. Changes in food intake; d. Changes in water consumption; e. Glucose tolerance in the first week of treatment; f. Glucose tolerance at the third week of treatment. *.P < 0.05, **.P < 0.01, ***P < 0.001, ns.P>0.05 图 3 小鼠模型建立及临床指标检测 Fig. 3 Establishment of mouse models and detection of clinical indicators |
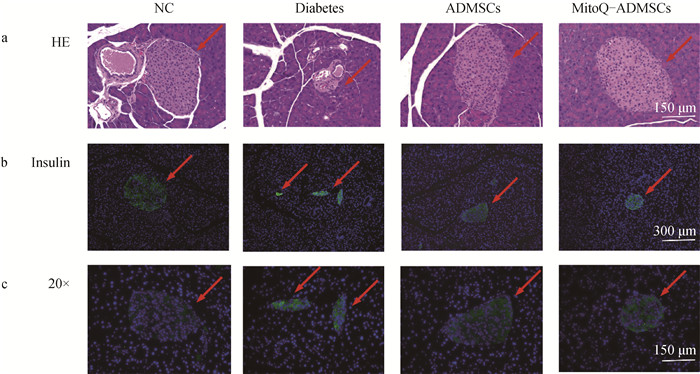
对NC组、Diabetes组、ADMSCs组、MitoQ-ADMSCs组小鼠进行胰腺组织取样后,HE染色,结果表明,NC组的胰岛边界清晰可见,而Diabetes组小鼠胰腺中胰岛结构受损,呈现出破损状态;经ADMSCs和MitoQ-ADMSCs移植治疗后,胰岛结构有所恢复,除小部分胰岛因破坏严重较难修复外,有正常结构、边界清晰的胰岛结构存在(图 4a);对小鼠的胰腺进行胰岛素的免疫荧光染色,可见NC组小鼠的胰岛能够正常分泌胰岛素,Diabetes组小鼠胰岛结构内胰岛素荧光只能在小部分碎片化的胰岛结构中观察到,而ADMSCs和MitoQ-ADMSCs则明显改善了这一效果,可见胰岛结构胰岛素的分泌量增加,且MitoQ-ADMSCs胰岛素分泌基本恢复到正常水平,揭示ADMSCs能够促进胰岛结构中β细胞的功能恢复,且MitoQ能够促进ADMSCs的这一效果(图 4b、c)。
|
a.胰腺HE染色(20×);b.胰腺组织胰岛素免疫荧光染色(10×);c.胰腺组织胰岛素免疫荧光染色(20×) a. HE staining of pancreas (20×); b. Pancreatic tissue Insulin immunofluorescence staining (10×); c. Pancreatic tissue Insulin immunofluorescence staining (20×) 图 4 小鼠糖尿病模型胰腺组织治疗效果评价 Fig. 4 Evaluation of therapeutic effect of pancreatic tissue in mouse model of diabetes |
作为机体内调节血糖的有效器官,肝在葡萄糖的吸收、储存、生产和代谢方面起重要作用,当糖尿病发生时,葡萄糖代谢紊乱会导致继发性肝损害。相关血清学检测显示,Diabetes组小鼠的血清ALT和AST明显高于NC组,经细胞移植治疗后,ALT和AST的检测结果均有所下降,且MitoQ显著促进ADMSCs降低AST和ALT水平的能力,结果显示,ADMSCs具有减轻肝代谢障碍的作用,而MitoQ能够进一步增强这一效果(图 5a、b);当糖尿病发生时,脂肪的分解和代谢会明显快于正常水平,加重肝等的负担,使脂质代谢相关的指标有所上升,对小鼠TC和TG水平进行检测后,可见ADMSCs移植促进了血清中TC和TG水平的恢复,MitoQ-ADMSCs则进一步增强了这一作用,证明ADMSCs能够减轻因糖尿病造成的高脂血症,而MitoQ能够进一步促进ADMSCs的治疗效果(图 5c、d)。
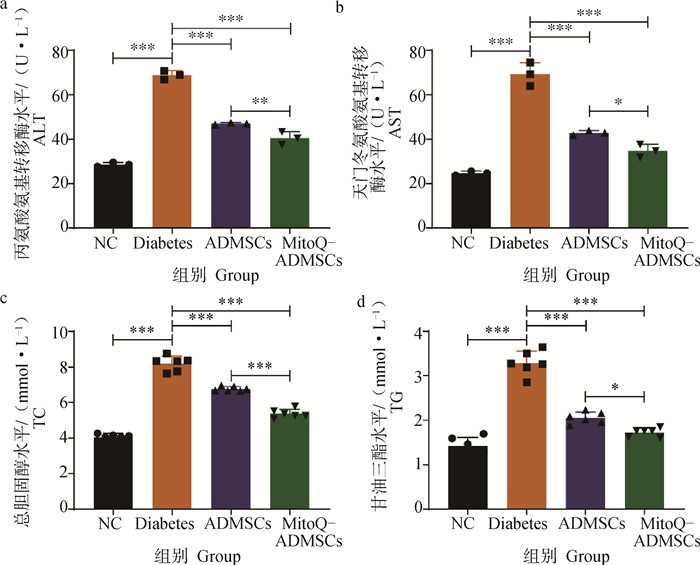
|
a.丙氨酸氨基转移酶;b.天门冬氨酸氨基转移酶;c.总胆固醇; d.甘油三酯。*.P < 0.05,**.P < 0.01,***.P < 0.001,ns.P>0.05 a. ALT; b. AST; c. TC; d.TG. *.P < 0.05, **.P < 0.01, ***.P < 0.001, ns.P>0.05 图 5 小鼠肝和血脂生化指标结果 Fig. 5 Results of liver and lipid biochemical indexes in mice |
为了进一步验证MitoQ和ADMSCs联合治疗对糖尿病小鼠氧化应激代谢指标的影响,作者进行了相关试验。发现Diabetes组小鼠的MDA和H2O2水平远高于NC组,而CAT和SOD水平明显低于NC组,ADMSCs虽然在一定程度上恢复因糖尿病导致的机体抗氧化能力的下降及氧化应激损伤,但是效果十分有限,而MitoQ则能够进一步提高机体的抗氧化能力,使其基本恢复到正常水平,避免因氧化应激导致疾病的进一步加重(图 6a ~d)。综上所述,ADMSCs可以一定程度恢复因糖尿病导致的氧化损伤,而MitoQ能够极大促进ADMSCs对糖尿病小鼠的氧化损伤修复作用,使得机体的抗氧化能力基本恢复到正常水平。
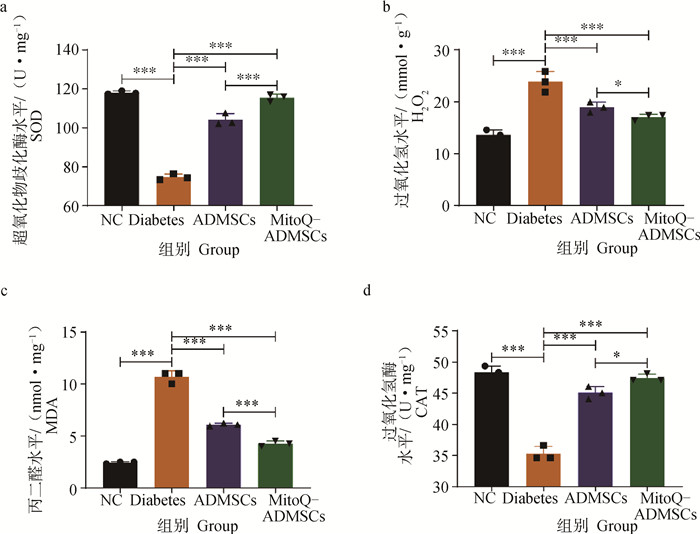
|
a.超氧化物歧化酶;b.过氧化氢;c.丙二醛;d.过氧化氢酶。*.P < 0.05,**.P < 0.01,***.P < 0.001,ns.P>0.05 a. SOD; b.H2O2; c. MDA; d.CAT. *.P < 0.05, **.P < 0.01, ***. P < 0.001, ns.P>0.05 图 6 小鼠血清氧化应激指标结果 Fig. 6 Results of changes in serum oxidative stress index in mice |
肝组织H&E结果显示,NC组肝组织细胞索结构排列较为规整,形态完整且清晰,Diabetes组小鼠的肝则呈现出明显的坏死,可见组织呈现出弥漫性出血、炎性细胞浸润及较大面积肝细胞呈现空泡化变性,经细胞移植后,可见细胞空泡化情况显著减少、组织弥漫性出血减少,形态结构有所恢复,且MitoQ-ADMSCs相比于ADMSCs组肝细胞排列更加整齐,炎性细胞浸润程度减轻(图 7a);除此之外,为检测肝组织糖原积累、纤维化程度,进行系列染色,包括PAS染色和Masson染色,肝经PAS染色后糖原呈紫红色,经Masson染色肌纤维呈红色、胶原纤维为蓝色,结果显示,ADMSCs组移植恢复了糖尿病诱发的糖原合成障碍,降低了肝纤维化程度,而MitoQ能够进一步促进这些治疗作用的提升(图 7b、c)。这些结果表明,ADMSCs可减轻糖尿病引起的肝纤维化,减轻糖原合成障碍,而MitoQ可以更好地促进相关指标的改进。MitoQ预处理ADSMCs可通过减轻糖原合成障碍和肝纤维化,从而为维持血糖平衡提供有效支持。
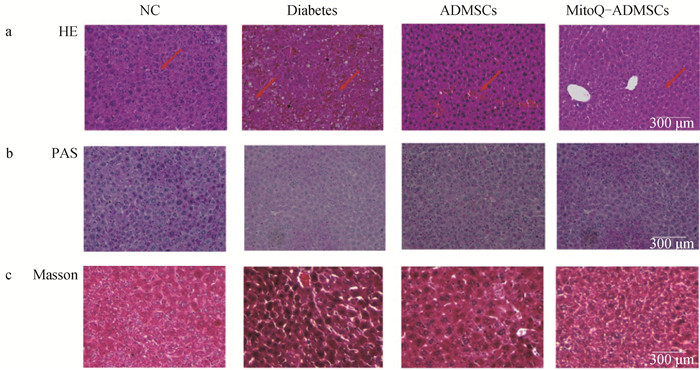
|
a. HE染色(10×);b. PAS染色(10×);c. Masson染色(20×) a. HE staining (10×); b. PAS staining (10×); c. Masson staining (20×) 图 7 小鼠肝组织损伤修复结果 Fig. 7 Repair results of liver tissue damage in mice |
经过1周适应性饲喂后,开始相关试验,NC组试验犬全程使用普通饲料饲喂,其他三组选用普通犬粮搭配馒头、米饭等含糖量较高的食物饲喂3周,禁食16 h后进行STZ注射,20 mg·kg-1,1次·d-1,连续3 d,1周后,也就是试验的第31天时进行血糖水平的检测,犬出现呕吐、被毛粗糙、精神沉郁和个别体重下降的情况,但是血糖水平变化不明显,未达到造模标准,所以继续进行为期3 d的STZ注射,1周后,即第42天,再次进行血糖水平的检测,随机血糖水平基本维持在11.1 mmol·L-1以上,且各组的体重水平均呈现出明显的下降趋势,视为成功建立糖尿病模型;后对犬进行为期3周的细胞移植,移植剂量为1×107·只-1,可见血糖水平随着细胞移植时间的延长,呈现明显的下降趋势,其中,MitoQ-ADMSCs组犬的血糖水平基本恢复到糖尿病初期的水平,且体重水平也随着细胞移植治疗有所恢复,糖尿病相关的临床症状有所恢复,犬在治疗期间生命体征平稳,未出现死亡、晕厥及精神沉郁状况,结果表明,细胞移植后,犬的临床症状得到改善,体重和血糖水平也得到恢复,特别是经MitoQ预处理的ADMSCs进一步促进了治疗效果(图 8a、b);对治疗后第1、3周犬的葡萄糖耐量水平进行检测,可见细胞移植后葡萄糖耐量的变化幅度有所下降,但是ADMSCs和MitoQ-ADMSCs之间的差异不是很明显(图 8c、d)。
|
a.体重变化;b.随机血糖变化;c.治疗第1周葡萄糖耐量;d.治疗第3周葡萄糖耐量。*.P < 0.05,**.P < 0.01,***.P < 0.001,ns.P>0.05 a. Weight change; b. Changes in blood glucose; c. Glucose tolerance in the first week of treatment; d. Glucose tolerance at week 3 of treatment. *.P < 0.05, **.P < 0.01, ***.P < 0.001, ns.P>0.05 图 8 犬模型建立及临床治疗效果评价 Fig. 8 Effect evaluation of canines model establishment and clinic treatment |
对NC组、Diabetes组、ADMSCs组、MitoQ-ADMSCs组犬进行胰腺组织取样后,进行了HE染色,可见NC组胰腺结构十分健全,胰岛可见,Diabetes组犬的胰腺观察到组织受损、胰岛破碎、炎症浸润及弥漫性出血,ADMSCs移植后可以观察到胰岛出现重建迹象,但是受损严重的胰岛修复效果不明显,而MitoQ-ADMSCs对于胰岛结构修复效果较好,除小部分胰岛因破坏严重修复较难外,可以看见有正常结构、边界清晰的胰岛结构存在(图 9a);除此之外,还进行了胰岛素的免疫荧光染色,可见NC组犬的胰岛能够正常分泌胰岛素,Diabetes组犬的胰岛素荧光只能在小部分碎片化的胰岛结构中观察到,而ADMSCs和MitoQ-ADMSCs则改善了这一效果,可见到胰岛结构中胰岛素的分泌量增加,且MitoQ-ADMSCs组胰岛素分泌基本恢复到正常水平,揭示ADMSCs能够促进胰岛结构中β细胞的功能恢复,且MitoQ能够促进ADMSCs的这一效果(图 9b)。肝组织HE染色结果显示,NC组肝组织细胞索结构排列较为规整,形态完整且清晰,Diabetes组的肝则呈现出明显的坏死,可见组织呈现出弥漫性出血、炎性细胞浸润及较大面积肝细胞呈现空泡化变性,经ADMSCs移植后,可见弥漫性出血情况虽然有所改善,但是空泡化情况改善并不明显,而MitoQ-ADMSCs显著提升了这一修复作用;除此之外,为检测肝组织糖原积累、纤维化程度,进行了系列染色,包括PAS染色、Masson染色,结果显示,ADMSCs移植虽然在一定程度上恢复了糖尿病引起的糖原合成障碍,降低了肝纤维化程度,促进了血糖平衡的维持,但是治疗效果不明显,而MitoQ-ADMSCs治疗效果极大提升(图 9c~e)。这些结果表明,ADMSCs可减轻糖尿病引起的肝损伤,增强肝的糖代谢和脂质代谢功能,而MitoQ可以更好地促进相关指标的改善。MitoQ预处理ADSMCs可通过修复肝损伤,有效减少糖脂代谢紊乱,从而为维持血糖平衡提供有效支持。

|
a.胰腺HE染色(20×);b.胰腺胰岛素免疫荧光染色(10×);c.肝HE染色(10×);d.肝PAS染色(10×);e.肝Masson染色(20×) a. HE staining of pancreas (20×); b. Insulin immunofluorescence staining of pancreas (10×); c. Liver HE staining (20×); d. PAS staining of liver (10×); e. Liver Masson staining (20×) 图 9 犬细胞移植后胰腺及肝组织变化 Fig. 9 Changes of pancreatic and liver injury after canine cell transplantation |
糖尿病发生时,除胰腺组织的结构和功能会受损外,对其他靶组织也会造成损伤,尤其肝损伤较为严重。对血清学中与肝脏和脂质代谢相关的指标进行检测,结果显示,Diabetes组犬血清的ALT和AST水平明显高于NC组,经细胞移植治疗后,ALT和AST的检测结果均有所下降,且MitoQ进一步促进了ADMSCs降低AST和ALT水平的能力(图 10a、b);除此之外,对犬脂质代谢相关的指标TC和TG水平进行检测,可见ADMSCs移植促进了血清中TC和TG水平的恢复,MitoQ则进一步增强了这一作用,证明ADMSCs能够有效减轻因糖尿病造成的肝和脂质代谢障碍,恢复肝组织对葡萄糖调节的协助作用,而MitoQ能够进一步促进ADMSCs的治疗作用,以达到更好的治疗效果(图 10c、d);对糖尿病的靶组织胰腺中的氧化应激相关指标进行检测,可见Diabetes组犬的MDA和H2O2的水平远高于NC组,而SOD水平明显低于NC组,ADMSCs在一定程度上恢复因糖尿病导致的机体抗氧化能力的下降及氧化应激损伤,但MitoQ能够更进一步减轻机体的氧化应激,使得几项指标基本恢复到正常水平,并且避免因氧化应激导致疾病的进一步加重(图 10e~g)。综上所述,MitoQ预处理ADMSCs可减轻糖尿病引起的肝损伤和脂质代谢紊乱,有效保护机体免受氧化应激损伤。
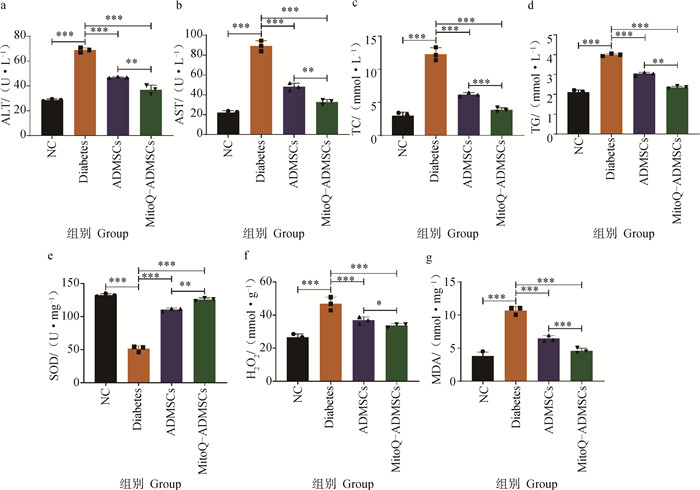
|
a.丙氨酸氨基转移酶;b.天门冬氨酸氨基转移酶;c.总胆固醇;d.甘油三酯;e.超氧化物歧化酶;f.过氧化氢;g.丙二醛。*.P < 0.05,**.P < 0.01,***.P < 0.001,ns.P>0.05 a. ALT; b. AST; c.TC; d. TG; e. SOD; f. H2O2; g. MDA. *.P < 0.05, **.P < 0.01, ***.P < 0.001, ns.P>0.05 图 10 犬血清水平肝脂质代谢及胰腺组织氧化应激指标变化 Fig. 10 Changes of serum liver lipid metabolism and pancreas oxidative stress indexes in canines |
对12个血清样本和QC样本进行PCA分析,可见正、负离子模式下QC样本均呈聚集状态,证明各试验组内差异较小,结果可靠(图 11a、b);针对差异代谢物的化学分类进行了分析并制成饼图,共13个分类,其中,脂质分子类别占比最多(图 11e);针对正负离子模式下筛选到的各组之间差异代谢物的重叠情况,进行了Venn图展示,可观察到不同对比组之间显著性差异代谢物的变化(图 11c、d);对各组间的差异代谢物进行对比后,观察到其中有10个显著变化的代谢物与氧化应激存在较大关联,分别是琥珀酸盐(succinate)、帽柱木碱(mitragynine)、肌酸(creatine)、N-乙酰-L-亮氨酸(L-leucine,n-acetyl)、尿囊素(allantoin)、奥昔嘌醇(oxypurinol)、海藻糖(trehalose)、龙胆苦苷(gentiopicroside)、环鸟甘酸(3′,5′-cyclic inosine monophosphate)、蓖麻油酸(ricinoleic acid),除琥珀酸盐外,其余代谢物均与氧化损伤减少、抗氧化能力加强相关,在MitoQ-ADMSCs组和NC组中表现出相似水平,而Diabetes组犬血清中相关代谢物则呈现出显著下调的趋势,且ADMSCs治疗并未对相关指标产生明显的上调影响,所以MitoQ促进ADMSCs对糖尿病治疗效果的提升可能是促进了ADMSCs抗氧化能力的提升,使得机体中的相关代谢物能够恢复到正常水平,从而有效减少疾病发展过程中因氧化应激造成的损伤。
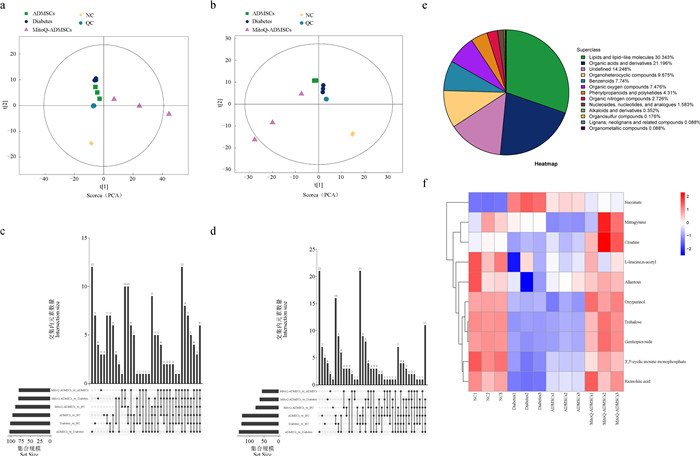
|
a.正离子模式总体样本PCA分析;b.负离子模式总体样本PCA分析;c.正离子模式Venn图;d.负离子模式Venn图;e.鉴定的代谢物在各化学分类的数量占比;f.差异代谢物聚类热图 a. PCA analysis of positive ion mode population samples; b. PCA analysis of negative ion mode population samples; c. Positive ion mode Venn diagram; d. Negative ion mode Venn diagram; e. The proportion of identified metabolites in each chemical classification; f. Differential metabolite clustering heat map 图 11 代谢组学分析结果 Fig. 11 Metabolomics analysis results |
糖尿病在犬等伴侣动物中的发生率逐年上升,对犬的健康造成极大威胁,有时还会因为严重的并发症导致重度疾病的发生,甚至死亡。究其原因,目前认为犬糖尿病的发生原因主要包括1)畜主的不正确饲喂方式,在饲养过程中给予过多高糖高脂食物;2)犬本身就存在糖脂代谢障碍等方面的疾病,先天出生时就缺乏胰岛素的生成能力[31]。虽然目前宠物糖尿病的诊断技术发展十分迅速,当犬出现症状时能够及时判定并进行干预治疗,但是治疗方式仍较为局限,主要还是胰岛素注射配以常规降糖药物,然而这些治疗方式无法起到控制疾病发展或者根治的效果,除此之外,多数降糖药物还会对肝、肾等器官造成负担。
干细胞疗法已成为当今医学领域备受关注的研究内容,并被广泛应用于临床治疗。MSCs是目前应用最为广泛的干细胞,除了具备多向分化和自我更新等共同特征外,还具有造血支持、免疫调节等特性。间充质干细胞的来源十分广泛,临床试验中常用的多为脐带、骨髓、脂肪等组织来源的细胞,在使用骨髓间充质干细胞(bone marrow derived mesenchymal stem cells, BMSCs)进行治疗时,发现外源性因素对细胞形态影响很大,导致细胞在体外培养阶段易发生变形、衰老和死亡。脐带间充质干细胞(umbilical cord mesenchymal stem cells,UCMSCs)虽然在体外培养状态较稳定,但是存在一定的伦理和法律纠纷。而ADMSCs,相对于其他组织来源的成体干细胞来说,分离方式极其方便,不会对动物机体造成很大损伤,且定向分化和恢复能力强、免疫原性低,无社会伦理问题等优点使得其成为MSCs临床试验中最为常见的类型[32-33]。
然而ADMSCs在临床治疗中仍存在一些不足,如在体外培养时间过长时,仍旧会发生形态改变、结构受损、衰老和凋亡情况的发生,细胞移植到机体内后无法保持长期有效的治疗作用,探索提高ADMSCs对糖尿病治疗潜力的方式十分重要。MitoQ作为一种强有用的抗氧化剂,已被大量试验证明可以延缓细胞衰老,减轻细胞氧化应激造成的损伤。所以探究MitoQ是否能够通过增强ADSMCs的抗氧化能力从而更好地治疗糖尿病十分重要。
本研究选用MitoQ对ADMSCs进行预处理,并进行细胞移植,在试验期间对动物模型的临床症状、肝脂质代谢水平、氧化应激指标、组织学水平、代谢组水平等进行检测。结果表明,MitoQ-ADMSCs与ADMSCs无显著形态差异,但MitoQ能够促进ADMSCs的生长速度、增殖效率及迁移能力的提升,并且能够提高ADMSCs的抗氧化和抗衰老能力,减缓细胞衰老;ADMSCs能够降低血糖、恢复体重、减少采食量和饮水量,恢复精神状态,且MitoQ能够进一步促进ADMSCs的治疗效果;MitoQ预处理ADMSCs能够有效恢复机体的血糖调节能力,促进胰岛素分泌量的增加;ADMSCs和MitoQ-ADMSCs均具有改善糖尿病相关肝和脂质代谢指标的作用,且MitoQ-ADMSCs的效果更胜一筹;针对胰腺氧化应激指标进行检测,可见抗氧化能力在MitoQ-ADMSCs组显著增加,且氧化损伤显著减轻;细胞移植后因糖尿病导致的组织损伤、胰岛结构破坏、肝纤维化等均有所恢复,且MitoQ能够进一步促进ADMSCs的治疗作用;代谢组学分析结果显示,MitoQ能够进一步促进ADMSCs治疗效果与抗氧化能力提升有关。因此,将MitoQ-ADMSCs可能会是宠物临床治疗的可靠手段和新制剂。
4 结论米托蒽醌甲磺酸盐能够通过提高脂肪间充质干细胞的抗氧化能力、加速组织损伤修复,从而更好地治疗小鼠及犬糖尿病。
| [1] |
ZHANG Z J, ZHU Y C, WANG Q F, et al. Global trends and research hotspots of exercise for intervening diabetes: a bibliometric analysis[J]. Front Public Health, 2022, 10: 902825. DOI:10.3389/fpubh.2022.902825 |
| [2] |
CHEN L, XIANG E, LI C Y, et al. Umbilical cord-derived mesenchymal stem cells ameliorate nephrocyte injury and proteinuria in a diabetic nephropathy rat model[J]. J Diabetes Res, 2020, 2020: 8035853. |
| [3] |
PAN Y, LIU L, YANG H, et al. Sacubitril/valsartan improves progression of early diabetic nephropathy in rats through inhibition of NLRP3 inflammasome pathway[J]. Diabetes Metab Syndr Obes, 2022, 15: 2479-2488. DOI:10.2147/DMSO.S366518 |
| [4] |
YAN Y, FANG J, WEN X Y, et al. Therapeutic applications of adipose-derived mesenchymal stem cells on acute liver injury in canines[J]. Res Vet Sci, 2019, 126: 233-239. DOI:10.1016/j.rvsc.2019.09.004 |
| [5] |
BOUSHRA A F, MAHMOUD R H, AYOUB S E, et al. The potential therapeutic effect of orexin-treated versus orexin-untreated adipose tissue-derived mesenchymal stem cell therapy on insulin resistance in type 2 diabetic rats[J]. J Diabetes Res, 2022, 2022: 9832212. |
| [6] |
AIERKEN A, LI B L, LIU P, et al. Melatonin treatment improves human umbilical cord mesenchymal stem cell therapy in a mouse model of type Ⅱ diabetes mellitus via the PI3K/AKT signaling pathway[J]. Stem Cell Res Ther, 2022, 13(1): 164. DOI:10.1186/s13287-022-02832-0 |
| [7] |
SUN X Y, HAO H J, HAN Q W, et al. Human umbilical cord-derived mesenchymal stem cells ameliorate insulin resistance by suppressing NLRP3 inflammasome-mediated inflammation in type 2 diabetes rats[J]. Stem Cell Res Ther, 2017, 8(1): 241. DOI:10.1186/s13287-017-0668-1 |
| [8] |
PUTRA A, SUWIRYO Z H, MUHAR A M, et al. The role of mesenchymal stem cells in regulating PDGF and VEGF during pancreatic islet cells regeneration in diabetic animal model[J]. Folia Med (Plovdiv), 2021, 63(6): 875-883. DOI:10.3897/folmed.63.e57636 |
| [9] |
HAO H J, LIU J J, SHEN J, et al. Multiple intravenous infusions of bone marrow mesenchymal stem cells reverse hyperglycemia in experimental type 2 diabetes rats[J]. Biochem Biophys Res Commun, 2013, 436(3): 418-423. DOI:10.1016/j.bbrc.2013.05.117 |
| [10] |
AZIZI Z, ABBASZADEH R, SAHEBNASAGH R, et al. Bone marrow mesenchymal stromal cells for diabetes therapy: touch, fuse, and fix?[J]. Stem Cell Res Ther, 2022, 13(1): 348. DOI:10.1186/s13287-022-03028-2 |
| [11] |
LI B L, CHENG X D, AIERKEN A, et al. Melatonin promotes the therapeutic effect of mesenchymal stem cells on type 2 diabetes mellitus by regulating TGF-β pathway[J]. Front Cell Dev Biol, 2021, 9: 722365. DOI:10.3389/fcell.2021.722365 |
| [12] |
HARRELL C R, PAVLOVIC D, DJONOV V, et al. Therapeutic potential of mesenchymal stem cells in the treatment of acute liver failure[J]. World J Gastroenterol, 2022, 28(28): 3627-3636. DOI:10.3748/wjg.v28.i28.3627 |
| [13] |
LI Y M, LIU J P, LIAO G N, et al. Early intervention with mesenchymal stem cells prevents nephropathy in diabetic rats by ameliorating the inflammatory microenvironment[J]. Int J Mol Med, 2018, 41(5): 2629-2639. |
| [14] |
XUE J, GAO J Q, GU Y L, et al. Human umbilical cord-derived mesenchymal stem cells alleviate insulin resistance in diet-induced obese mice via an interaction with splenocytes[J]. Stem Cell Res Ther, 2022, 13(1): 109. DOI:10.1186/s13287-022-02791-6 |
| [15] |
ZHU M M, HUA T Z, OUYANG T, et al. Applications of mesenchymal stem cells in liver fibrosis: novel strategies, mechanisms, and clinical practice[J]. Stem Cells Int, 2021, 2021: 6546780. |
| [16] |
ZHAO L F, HU C X, HAN F, et al. Regenerative abilities of mesenchymal stem cells via acting as an ideal vehicle for subcellular component delivery in acute kidney injury[J]. J Cell Mol Med, 2020, 24(9): 4882-4891. DOI:10.1111/jcmm.15184 |
| [17] |
HUANG Y L, YANG L N. Mesenchymal stem cells and extracellular vesicles in therapy against kidney diseases[J]. Stem Cell Res Ther, 2021, 12(1): 219. DOI:10.1186/s13287-021-02289-7 |
| [18] |
YANG Y J, LEI T, BI W Y, et al. The combined therapy of mesenchymal stem cell transplantation and resveratrol for diabetes: Future applications and challenges[J]. Life Sci, 2022, 301: 120563. DOI:10.1016/j.lfs.2022.120563 |
| [19] |
ABDELHAFEZ D, ABOELKOMSAN E, EL SADIK A, et al. The role of mesenchymal stem cells with ascorbic acid and N-acetylcysteine on TNF-α, IL 1β, and NF-κβ expressions in acute pancreatitis in albino rats[J]. J Diabetes Res, 2021, 2021: 6229460. |
| [20] |
ZHENG C X, SUI B, ZHANG X, et al. Apoptotic vesicles restore liver macrophage homeostasis to counteract type 2 diabetes[J]. J Extracell Vesicles, 2021, 10(7): e12109. DOI:10.1002/jev2.12109 |
| [21] |
RAMIS M R, ESTEBAN S, MIRALLES A, et al. Protective effects of melatonin and mitochondria-targeted antioxidants against oxidative stress: a review[J]. Curr Med Chem, 2015, 22(22): 2690-2711. DOI:10.2174/0929867322666150619104143 |
| [22] |
SMITH R A J, MURPHY M P. Animal and human studies with the mitochondria-targeted antioxidant MitoQ[J]. Ann N Y Acad Sci, 2010, 1201(1): 96-103. DOI:10.1111/j.1749-6632.2010.05627.x |
| [23] |
REDDY P H. Mitochondrial oxidative damage in aging and Alzheimer's disease: implications for mitochondrially targeted antioxidant therapeutics[J]. J Biomed Biotechnol, 2006, 2006: 031372. |
| [24] |
MANTLE D, HARGREAVES I P. Coenzyme Q10:role in less common age-related disorders[J]. Antioxidants (Basel), 2022, 11(11): 2293. DOI:10.3390/antiox11112293 |
| [25] |
ADISA R A, SULAIMON L A, OKEKE E G, et al. Mitoquinol mesylate (MITOQ) attenuates diethyl nitrosamine-induced hepatocellular carcinoma through modulation of mitochondrial antioxidant defense systems[J]. Toxicol Res, 2022, 38(3): 275-291. DOI:10.1007/s43188-021-00105-1 |
| [26] |
ESCRIBANO-LOPEZ I, DIAZ-MORALES N, ROVIRA-LLOPIS S, et al. The mitochondria-targeted antioxidant MitoQ modulates oxidative stress, inflammation and leukocyte-endothelium interactions in leukocytes isolated from type 2 diabetic patients[J]. Redox Biol, 2016, 10: 200-205. DOI:10.1016/j.redox.2016.10.017 |
| [27] |
GIOSCIA-RYAN R A, LAROCCA T J, SINDLER A L, et al. Mitochondria-targeted antioxidant (MitoQ) ameliorates age-related arterial endothelial dysfunction in mice[J]. J Physiol, 2014, 592(12): 2549-2561. DOI:10.1113/jphysiol.2013.268680 |
| [28] |
SHAN S L, LIU Z X, LIU Z D, et al. MitoQ alleviates carbon tetrachloride-induced liver fibrosis in mice through regulating JNK/YAP pathway[J]. Toxicol Res (Camb), 2022, 11(5): 852-862. DOI:10.1093/toxres/tfac062 |
| [29] |
XI Y, FENG D Y, TAO K, et al. MitoQ protects dopaminergic neurons in a 6-OHDA induced PD model by enhancing Mfn2-dependent mitochondrial fusion via activation of PGC-1α[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(9): 2859-2870. DOI:10.1016/j.bbadis.2018.05.018 |
| [30] |
YOUNG M L, FRANKLIN J L. The mitochondria-targeted antioxidant MitoQ inhibits memory loss, neuropathology, and extends lifespan in aged 3xTg-AD mice[J]. Mol Cell Neurosci, 2019, 101: 103409. DOI:10.1016/j.mcn.2019.103409 |
| [31] |
SANKARAN P S. High-fat-diet induced obesity and diabetes mellitus in Th1 and Th2 biased mice strains: A brief overview and hypothesis[J]. Chronic Dis Transl Med, 2023, 9(1): 14-19. |
| [32] |
MIKŁOSZ A, CHABOWSKI A. Adipose-derived mesenchymal stem cells therapy as a new treatment option for diabetes mellitus[J]. J Clin Endocrinol Metab, 2023, 108(8): 1889-1897. DOI:10.1210/clinem/dgad142 |
| [33] |
CHANG S Y, LEE J H, OH S C, et al. Human fibroblast growth factor-treated adipose-derived stem cells facilitate wound healing and revascularization in rats with streptozotocin-induced diabetes mellitus[J]. Cells, 2023, 12(8): 1146. DOI:10.3390/cells12081146 |
(编辑 白永平)



