2. 黑龙江省实验动物与比较医学重点实验室, 哈尔滨 150030
2. Heilongjiang Key Laboratory of Experimental Animals and Comparative Medicine, Harbin 150030, China
高脂饮食极易诱导氧化应激的产生[1-2],氧化应激在许多慢性肝疾病如非酒精性脂肪肝(NAFLD)、病毒性肝炎、肝纤维化和肝硬化的发生发展中起着至关重要的作用[3-6]。在正常动物机体中,肝组织的氧化和抗氧化系统处于动态平衡状态,当机体遭受各种有害刺激时,肝细胞内自由基产生和抗氧化反应之间稳态被打破,导致活性氧(ROS)水平升高,ROS过量会攻击肝细胞蛋白、脂质和核酸,导致细胞功能障碍从而诱发细胞病理变化引起各种疾病[7-9]。
氧化磷酸化(OXPHOS)是一种酶机器,线粒体通过其内膜上的NADH-辅酶Q还原酶(线粒体电子传递链复合物Ⅰ)、琥珀酸-辅酶Q还原酶(线粒体电子传递链复合物Ⅱ)、细胞色素C还原酶(线粒体电子传递链复合物Ⅲ)、细胞色素C氧化酶(线粒体电子传递链复合物Ⅳ)和ATP合酶(线粒体电子传递链复合物Ⅴ)这5个多聚体酶复合物构成的电子传递链(ETC)转移氢和电子,消耗氧气(O2)并产生ATP以供机体能量代谢[10]。细胞内的ROS主要由ETC产生,在基础水平上,ROS作为信号分子调节细胞增殖、分化等生物学过程,但当ROS超过细胞可承受范围时,ROS就会诱导氧化应激[11]。
橙皮苷(hesperidin,HDN),是一种在柑橘类水果中含量很高的类黄酮[12-13],是天然酚类化合物,具有广泛的生物活性,如抗炎、抗氧化、抗癌,降低胆固醇水平和血压,抗肥胖活性[14]。相关研究表明,HDN可以上调谷胱甘肽过氧化物酶(GSH-Px)、锰超氧化物歧化酶等抗氧化酶的表达发挥抗氧化作用[10, 15],但其作用机制鲜有报道。
转录组分析可以提供大量信息,已经有许多研究使用转录组分析来筛选差异表达的基因以及药物作用的相关机制[16-18]。在畜禽养殖过程中动物可能会由于受到饲料营养水平及环境条件改变等应激因素的刺激,在机体内产生过量的ROS,诱发氧化应激,从而使动物产能下降影响经济效益。因此,本研究对C57BL/6小鼠进行高脂饮食饲喂从而诱导肝氧化应激,之后通过转录组分析探究HDN对肝氧化应激影响的作用途径并进行验证。
1 材料与方法 1.1 试验材料HDN(含量≥ 98%)购自上海源叶生物科技有限公司(B20182);小鼠常规饲料和高脂饲料购自小黍有泰(北京)生物科技有限公司(D12450B、D12492);羧甲基纤维素钠(CMC-Na)购自默克化工技术(上海)有限公司(C5678);BCA蛋白定量/浓度测定试剂盒购自大连美仑生物技术有限公司(MA0082-2);总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)、总抗氧化能力(T-AOC)、丙二醛(MDA)试剂盒、ATP含量测试试剂盒购自南京建成生物工程研究所(A001-1-2、A005-1-1、A015-2-1、A003-1-2、A095-1-1);RT cDNA第一链合成试剂盒、Real-Time PCR试剂盒(SYBR Green)购自杭州博日科技有限公司(R233-01、BSB33 M1);Cox6a2(1 ∶1 000,TD10096)、Ndufb8(1 ∶1 000,T58290)、Ndufb10(1 ∶1 000,PHQ9642)、Atp6v0d2(1 ∶1 000,MG502166)购于艾比玛特生物医药有限公司;血液/细胞/组织DNA提取试剂盒购自天根生化科技有限公司(DP304)。
1.2 试验方法1.2.1 试验动物分组及处理 18只体重20~23 g SPF级雄性C57BL/6小鼠购自辽宁长生生物技术股份有限公司,预饲1周后开始试验。在试验期间所有小鼠处于相同的环境。小鼠随机分成3组(n=6),分别为control组、HFD组、HFD+HDN组。control组小鼠饲喂常规饲料(脂肪含量10%、碳水化合物含量70%、蛋白质含量20%)。HFD组小鼠饲喂高脂饲料(脂肪含量60%、碳水化合物含量20%、蛋白质含量20%)。HFD+HDN组在饲喂高脂饲料的同时每天灌胃给药HDN 300 mg·kg-1(HDN溶于0.5% CMC-Na中)。
各组在相应条件下饲喂16周,试验结束时腹腔注射3%戊巴比妥钠(60 mg·kg-1)麻醉小鼠后进行眼球采血,采血完毕后脱颈处死,解剖后取肝组织。血液离心取血清进行ALT和AST活性检测。肝组织液氮速冻后置于-80 ℃冰箱储存,用于后续试剂盒检测、RNA的提取以及实时荧光定量PCR(qRT-PCR)试验。
1.2.2 肝功能和氧化应激标志物的测定 将血液于4 ℃、3 000 r·min-1离心10 min后取上清,使用全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)检测ALT和AST活性。
按照试剂盒说明书要求测定小鼠肝组织中MDA、T-SOD、T-AOC和GSH-Px水平。
1.2.3 总RNA提取、转录组文库的建立、质检及测序 采用TRIzol法分别提取样品总RNA,通过Agilent 2100 bioanalyzer,检测RNA完整性和浓度,将一部分RNA保存用于后续qRT-PCR试验,将另一部分RNA交于北京诺禾致源科技股份有限公司构建文库,基于边合成边测序(Sequencing by Synthesis, SBS)的原理进行测序从而获得原始测序数据。去除原始测序数据中的低质量、未知碱基N含量过高以及接头污染的序列以获得高质量序列数据。
1.2.4 差异表达基因的筛选 将高质量序列数据与参考基因组序列进行比对,使用DESeq 2软件(1.20.0)进行两个比较组合之间的差异表达分析。使用Benjamini和Hochberg的方法来调整所得P值以控制错误发现率。以P≤0.05 & |log2(foldchange)|≥1为标准进行显著差异表达基因的筛选。
1.2.5 差异表达基因的KEGG富集分析 用ClusterProfile软件对HFD+HDN组与HFD组的差异表达基因集进行KEGG通路富集分析,以P < 0.05作为显著性富集的阈值,筛选出HDN影响最显著的信号通路。
1.2.6 qRT-PCR验证转录组结果 使用qRT-PCR对转录组测序结果进行验证,使用RT cDNA第一链合成试剂盒和Real-Time PCR试剂盒对细胞的总RNA进行逆转录和荧光定量分析。用于定量的引物由生工生物技术(上海)股份有限公司设计,以β-actin作为内参对照基因。mRNA引物序列见表 1。根据2-△△Ct法计算mRNA的相对表达量。
|
|
表 1 mRNA引物序列 Table 1 mRNA primer sequence |
1.2.7 肝组织蛋白提取及免疫蛋白印迹分析 肝组织称重后,每50 mg加入1 mL RIPA裂解液,组织研磨仪充分研磨,研磨液置于冰上裂解,4 ℃, 12 000 r·min-1离心15 min后取上清液,BCA试剂盒测定蛋白浓度,调整样品终浓度,变性煮沸,冷却后分装,-80 ℃保存。SDS-聚丙酰胺凝胶电泳分离目的蛋白,将目的蛋白转膜到NC膜上,封闭,一抗孵育,4 ℃过夜,二抗孵育,ECL发光液显影,曝光得到相应的蛋白条带。Image J软件量化蛋白条带。
1.2.8 mtDNA相对含量测定 将肝组织打碎,形成细胞悬液,10 000 r·min-1离心1 min后,倒尽上清,加入200 μL缓冲液GA摇荡。根据组织线粒体DNA提取试剂盒说明书提取,并计算DNA的纯度和浓度,选取mtDNA的Ctyb为目的基因,核基因28S为内参,mRNA引物序列见表 1,进行qRT-PCR检测,并计算各组Ct值,根据2-△△Ct法计算mtDNA相对含量。
1.2.9 肝组织ATP含量测定 使用ATP检测试剂盒检测肝组织ATP含量,按照说明书操作,称取肝组织,制成10%的匀浆液,再置于沸水浴中煮10 min,混匀,3 500 r·min-1离心10 min,取上清液进行测定。
1.3 数据处理使用GraphPad Prism 8.0进行数据差异性分析,数据采用单因素分析Tukey检验,均以“平均值±标准差(Mean±SD)”表示,P < 0.05认为有统计学差异。
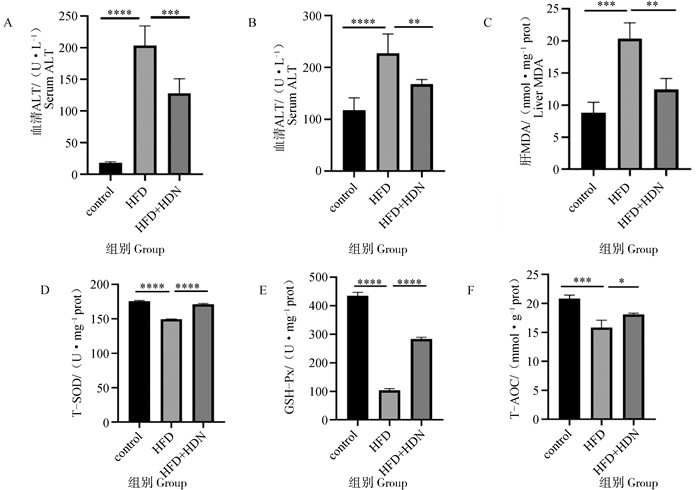
2 结果 2.1 HDN改善高脂饲喂诱导的小鼠肝功能及氧化应激水平根据肝功能检测结果显示,与control组相比,HFD组小鼠血清ALT和AST活性显著升高(P < 0.000 1);与HFD组相比,HFD+HDN组小鼠血清ALT和AST活性显著降低(P < 0.01,图 1A、1B)。根据氧化应激标志物的测定结果显示,与control组相比,HFD组小鼠肝组织MDA含量显著升高(P < 0.001,图 1C),T-SOD、GSH-Px和T-AOC水平显著降低(P < 0.001,图 1D~1F);与HFD组相比,HFD+HDN组小鼠肝组织MDA含量显著降低(P < 0.01,图 1C),T-SOD、GSH-Px和T-AOC水平显著升高(P < 0.05,图 1D~1F)。这些结果表明,HDN能够减轻高脂饲喂诱导的小鼠肝功能障碍和肝氧化应激。
|
A.血清丙氨酸转氨酶水平;B.血清天冬氨酸转氨酶水平;C.肝丙二醛水平;D.肝总超氧化物歧化酶水平;E.肝谷胱甘肽过氧化物酶水平;F.肝总抗氧化能力。*.P < 0.05,**.P < 0.01. ***,P < 0.001. ****.P < 0.000 1,下同 A. Serum ALT; B. Serum AST; C. Liver MDA; D. Liver T-SOD; E. Liver GSH-Px; F. Liver T-AOC.*.P < 0.05. **.P < 0.01. ***.P < 0.001. ****.P < 0.000 1, the same as below 图 1 HDN对高脂饮食小鼠肝功能与氧化应激指标的影响 Fig. 1 Effect of HDN on liver function and oxidative stress indicators in mice fed with high-fat diet |
本次转录组测序3组9个样品共获得58.55 Gb高质量序列数据用于后续分析,所有样本的样本测序数据质量汇总如表 2所示,每个样本平均产生数据约6.51 GB,高质量reads数目占比均在99%以上,Q 20和Q 30平均值分别为97.94%和94.20%,GC含量平均为47.89%,过滤后碱基数稳定,AT碱基与GC碱基数量基本相同,以上结果表明测序获得的数据质量较高, 数据可靠,满足后续生物信息学分析的条件。
|
|
表 2 样本测序数据质量汇总 Table 2 Summary of sample sequencing data quality |
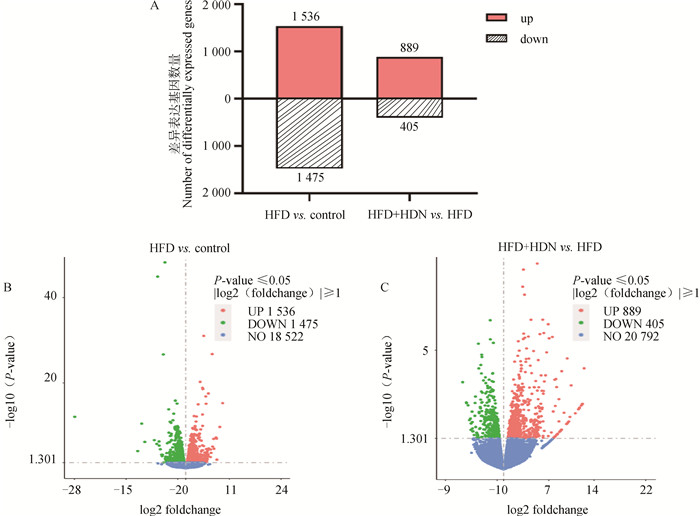
根据差异基因柱状图(图 2A)和火山图(图 2B、C)可以发现,HFD组与control组相比,一共有3 011个基因的表达出现显著变化(P < 0.05),其中1 536个基因呈上调表达(P < 0.05),1 475个基因呈下调表达(P < 0.05);HFD+HDN组与HFD组相比,共有1 294个基因的表达出现显著变化(P < 0.05),其中889个基因呈上调表达(P < 0.05),405个基因呈下调表达(P < 0.05)。
|
A.差异表达基因数量柱状图;B.HFD组vs. control组基因表达分布的火山图;C.HFD+HDN组vs. HFD组基因表达分布的火山图 A. Histogram of the number of differentially expressed genes; B. Volcano map of HFD group vs. control group gene expression distribution; C. Volcano map of HFD+HDN group vs. HFD group gene expression distribution 图 2 各组差异表达基因数量的统计结果 Fig. 2 Statistical results on the number of differentially expressed genes in each group |
对HFD+HDN组与HFD组的差异基因集进行KEGG信号通路富集分析,富集显著性排名前20的信号通路如图 3A所示。结果显示,OXPHOS途径最显著上调(P < 0.000 1)。在OXPHOS途径显著上调或下调的基因中(图 3B),复合物Ⅰ中有21个基因显著上调(mt-Nd41、Gm28438、Ndufv3、Ndufb7、Ndufa5,Ndufb10、Ndufa11、Gm10222、Ndufs5、Ndufa12、Ndufa6、Ndufb8、mt-Nd1、Ndufb4c、Ndufc2、Ndufb3、mt-Nd5、BC002163、Ndufb6、Ndufa13、Ndufa1,P < 0.05);复合物Ⅲ中有4个基因显著上调(mt-Cytb、Uqcrq、Uqcrb、Uqcr10,P < 0.05);复合物Ⅳ中8个基因显著上调(Cox6a2、Cox8b、Gm11273、Cox6b1、Cox7a1、Gm28437、mt-Co1、Cox4i1,P < 0.05),1个基因显著下调(Cox6c2,P < 0.05);复合物Ⅴ中5个基因显著上调(Gm10231、mt-Atp8、Atp5g2、Atp5o、Atp5e,P < 0.05);1个基因显著下调(Atp6v0d2,P < 0.05)。

|
A.富集显著性排名前20的信号通路;B. OXPHOS途径差异表达基因热图(红色表示基因上调,蓝色表示基因的下调) A. The top 20 signalling pathways in terms of enrichment significance; B. Heat map of differentially expressed genes in the oxidative phosphorylation pathway (red indicates up-regulation of genes, blue indicates down-regulation of genes) 图 3 差异表达基因的KEGG富集通路分析 Fig. 3 KEGG enrichment analysis results of differentially expressed genes |
通过qRT-PCR进一步证实转录组分析观察到的基因表达的变化,使用与上述转录组测序中相同的小鼠肝组织样品。使用qRT-PCR对转录组结果进行验证。从OXPHOS途径中选取10个具有显著差异的基因,进行mRNA水平分析。由图 4可知,HFD组与control组相比,Cox8b、Cox6a2、Gm10231、mt-Atp8、mt-Nd4 l、Gm11237、Ndufb8、Ndufb10的mRNA相对表达量显著下调(P < 0.05),Atp6v0d2、Cox6c2的mRNA的相对表达量显著上调(P < 0.05);HFD+HDN组与HFD组相比,Cox8b、Cox6a2、Gm10231、mt-Atp8、mt-Nd4 l、Gm11237、Ndufb8、Ndufb10的mRNA相对表达量显著上调(P < 0.05),Atp6v0d2、Cox6c2的mRNA的相对表达量显著下调(P < 0.05)。qRT-PCR分析表明,基因表达量与转录组测序结果在表达差异的方向和程度方面一致,验证了转录组分析的可靠性。

|
图 4 RT-PCR验证转录组结果 Fig. 4 RT-PCR validation of transcriptome results |
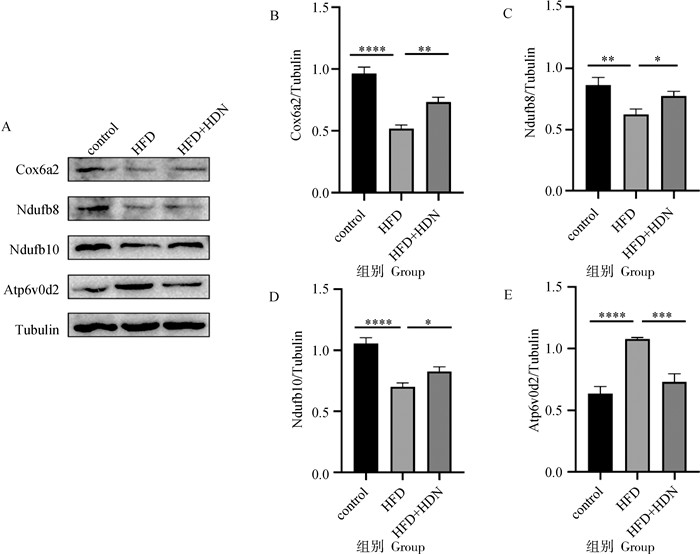
通过免疫蛋白印迹证实转录组结果。由图 5可知,HFD组与control组相比,Cox6a2、Ndufb8、Ndufb10蛋白表达量显著降低(P < 0.01),Atp6v0d2d蛋白表达量显著升高(P < 0.000 1);HFD+HDN组与HFD组相比,Cox6a2、Ndufb8、Ndufb10蛋白表达量显著升高(P < 0.05),Atp6v0d2d蛋白表达量表达量显著降低(P < 0.001)。蛋白表达量与转录组测序结果在表达差异的方向和程度方面一致,进一步验证了转录组分析的可靠性。
|
A. Cox6a2、Ndufb8、Ndufb10、Atp6v0d2蛋白免疫印迹条带;B. Cox6a2蛋白相对表达量;C. Ndufb8蛋白相对表达量;D. Ndufb10蛋白相对表达量;E. Atp6v0d2蛋白相对表达量 A. Immunoblot of Cox6a2, Ndufb8, Ndufb10, Atp6v0d2; B. The protein expression of Cox6a2; C. The protein expression of Cox6a2; D. The protein expression of Ndufb8; E. The protein expression of Ndufb10; F. The protein expression of Atp6v0d2 图 5 蛋白免疫印迹验证转录组结果 Fig. 5 Western blot validation of transcriptome results |
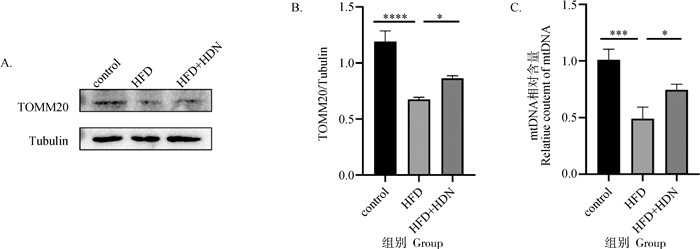
由图 6可知,通过蛋白免疫印迹检测发现,HFD组与control组相比,线体体外膜蛋白TOMM20表达量明显降低(P < 0.000 1),HFD+HDN组与HFD组相比,TOMM20蛋白表达量明显升高(P < 0.05);通过qRT-PCR检测发现,HFD组与control组相比,mtDNA相对含量显著降低(P < 0.001);HFD+HDN组与HFD组相比,mtDNA相对含量显著升高(P < 0.05)。
|
A.TOMM20蛋白免疫印迹条带;B.TOMM20蛋白相对表达量;C.mtDNA相对含量 A.Immunoblot of TOMM20;B.The protein expression of TOMM20;C.Folf chenges of mtDNA 图 6 线粒体数量变化 Fig. 6 Changes in mitochondrial number |
由图 7可知,HFD组与control组相比,ATP含量显著降低(P < 0.01),HFD+HDN组与HFD组相比,ATP含量显著升高(P < 0.05)。
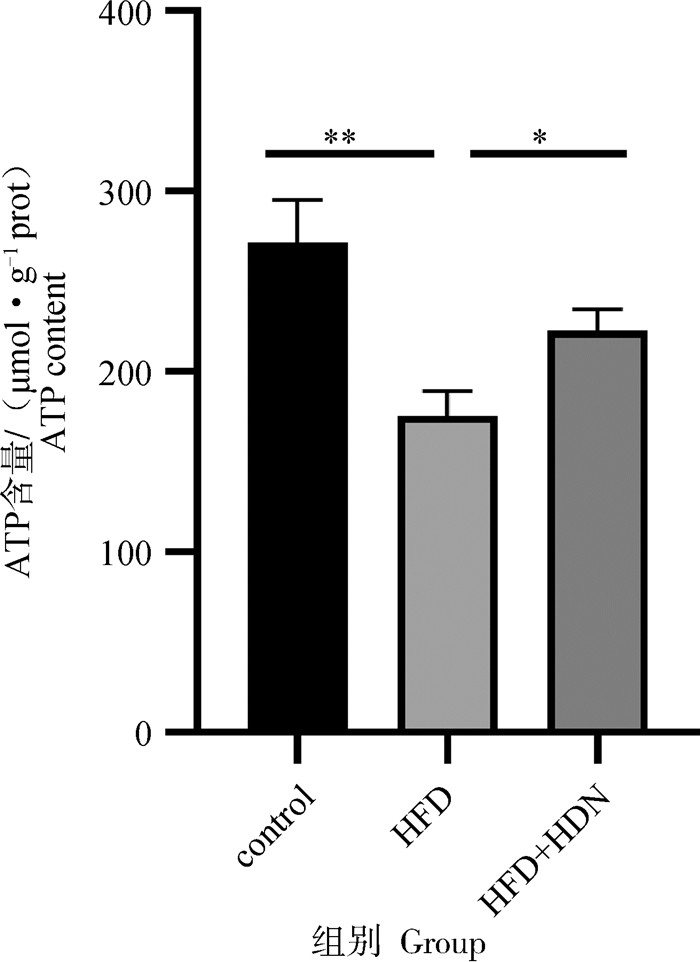
|
图 7 肝组织ATP含量 Fig. 7 ATP content of liver |
已有证据表明,高脂饮食会导致ROS水平增加,从而诱导氧化应激[19]。抑制肝氧化应激是慢性肝疾病预防和治疗的关键[20-22]。因此,增强机体抗氧化防卫系统来保护细胞免受自由基侵害,缓解肝氧化应激是治疗和预防慢性肝疾病的重要途径。本研究基于转录组学,探究HDN对肝氧化应激影响的作用途径并进行验证。
很多研究已经表明,各种天然黄酮类化合物,如黄芩甙、汉黄芩素、杨梅素和白杨素可以通过提高抗氧化蛋白的表达和活性来改善肝氧化应激[23-27]。机体通过抗氧化系统(酶促和非酶促系统)来保护动物机体免受ROS的影响。酶系统包括SOD和GSH-Px等;非酶系统涵盖了广泛的分子,如谷胱甘肽(GSH),硫氧还蛋白、尿酸、维生素E等。这些非酶分子的总浓度称为T-AOC[28]。SOD作为对抗氧化应激的第一道防线,将超氧阴离子自由基转化为过氧化氢(H2O2)和O2。GSH-Px通过消耗GSH清除过量的H2O2。当自由基产生和抗氧化反应之间的平衡被打破时,自由基过度产生,就会导致脂质过氧化从而改变细胞膜完整性,引起组织损伤。MDA作为脂质过氧化反应的终产物,其含量反映氧化应激受损程度[29]。本研究显示,HDN能显著降低高脂饮食诱导的氧化应激模型小鼠血清中ALT和AST酶活性,改善肝功能,肝MDA含量显著减少,抗氧化系统酶活性显著升高(GSH-Px和T-SOD),T-AOC显著升高,这与先前的研究一致[30],表明HDN可有效减轻高脂饮食诱导的小鼠的肝功能障碍和肝氧化应激。
线粒体调节细胞代谢,是ROS的重要来源,在线粒体OXPHOS过程中,O2作为ETC的终端电子受体,在参与OXPHOS反应生成ATP以维持机体能量代谢的同时,还会有部分O2被还原,形成ROS[23]。ROS过量会导致细胞功能障碍从而诱发细胞病理变化引起各种疾病。肝作为体内代谢的核心器官,有着丰富的线粒体,由于其代谢活性,使其对氧化应激特别敏感。先前有研究表明,与未患NAFLD的小鼠相比,患有NAFLD小鼠OXPHOS复合物活性均有所降低,ETC功能受损,ATP生成减少,ROS形成增加[31]。本研究使用转录组学中KEGG信号通路富集分析方法探索HDN减轻肝氧化应激的作用机制。结果显示,HFD+HDN组和HFD组之间存在着大量差异表达的基因。线粒体OXPHOS通路是HDN干预后最显著上调的信号通路,该通路是一条重要的能量代谢通路,参与OXPHOS的体系主要以复合物(Ⅰ-Ⅴ)形式分布于线粒体的内膜上,构成ETC,而ETC驱动ATP的产生。因此,OXPHOS通路所涉及的相关基因也也主要与这些复合物相关。本研究结果显示,HFD组control组相比,复合物Ⅰ中有21个基因显著下调;复合物Ⅲ中有4个基因显著下调;复合物Ⅳ中8个基因显著下调,1个基因显著上调;复合物Ⅴ中5个基因显著下调;1个基因显著上调。HDN干预后,与HFD组相比,这些基因上调、下调的程度明显改善。之后从OXPHOS途径差异表达基因的结果中,随机选取10个关键基因进行qRT-PCR验证,随机选取4个关键基因对应编码的蛋白进行蛋白免疫印迹分析,结果均与转录组学结果一致,表明分析结果准确可信。
线粒体是除细胞核外唯一具有自身遗传信息的细胞器。线粒体基因组为小型环状DNA,每个线粒体中含有多个拷贝的大约16.6 kb的环状mtDNA,平均每个线粒体含有大约2~10个拷贝数的mtDNA,因此mtDNA的拷贝数与线粒体数量呈正比[32]。ETC驱动ATP的产生,然后用作几乎所有细胞过程中的主要能量载体[33],线粒体数量减少、ETC损伤会使线粒体合成ATP的功能发生障碍,OXPHOS功能受损,在本研究中,经HDN干预后,TOMM20蛋白表达量显著升高,mtDNA相对含量显著升高(P < 0.05),肝中ATP含量显著升高,以上结果说表明与HFD组相比,HDN干预后使高脂饮食诱导的小鼠线粒体数量增多,OXPHOS水平升高。
综上所述,本研究表明,HDN通过改变线粒体呼吸链复合物上相关基因的表达,调节线粒体OXPHOS途径,从而减轻了高脂饲喂诱导的小鼠的肝氧化应激。
4 结论HDN通过调节线粒体OXPHOS途径,减轻高脂饲喂诱导的小鼠的氧化应激。
| [1] |
TAN B L, NORHAIZAN M E. Effect of high-fat diets on oxidative stress, cellular inflammatory response and cognitive function[J]. Nutrients, 2019, 11(11): 2579. DOI:10.3390/nu11112579 |
| [2] |
REUTER S, GUPTA S C, CHATURVEDI M M, et al. Oxidative stress, inflammation, and cancer: how are they linked?[J]. Free Radic Biol Med, 2010, 49(11): 1603-1616. DOI:10.1016/j.freeradbiomed.2010.09.006 |
| [3] |
赵永伟, 牛玉, 何进田, 等. 双氢青蒿素对脂多糖诱导的断奶仔猪肝氧化应激的影响[J]. 畜牧兽医学报, 2019, 50(10): 2139-2146. ZHAO Y W, NIU Y, HE J T, et al. Effects of dihydroartemisinin on oxidative stress in liver of weaned piglets induced by lipopolysaccharide[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(10): 2139-2146. DOI:10.11843/j.issn.0366-6964.2019.10.021 (in Chinese) |
| [4] |
汪东辉, 蒋素文, 胡爱荣, 等. 桑葚改善大鼠非酒精性脂肪性肝病的氧化应激损伤[J]. 中国临床药理学与治疗学, 2023, 28(6): 609-616. WANG D H, JIANG S W, HU A R, et al. Mulberry exerts antioxidant stress effect in rats with nonalcoholic fatty liver disease[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2023, 28(6): 609-616. (in Chinese) |
| [5] |
TAN B L, NORHAIZAN M E, LIEW W P P. Nutrients and oxidative stress: Friend or foe?[J]. Oxid Med Cell Longev, 2018, 2018: 9719584. |
| [6] |
CICHO?-LACH H, MICHALAK A. Oxidative stress as a crucial factor in liver diseases[J]. World J Gastroenterol, 2014, 20(25): 8082-8091. DOI:10.3748/wjg.v20.i25.8082 |
| [7] |
RANI V, DEEP G, SINGH R K, et al. Oxidative stress and metabolic disorders: Pathogenesis and therapeutic strategies[J]. Life Sci, 2016, 148: 183-193. DOI:10.1016/j.lfs.2016.02.002 |
| [8] |
RAJENDRAN P, NANDAKUMAR N, RENGARAJAN T, et al. Antioxidants and human diseases[J]. Clin Chim Acta, 2014, 436: 332-347. DOI:10.1016/j.cca.2014.06.004 |
| [9] |
WANG Y, LIU Z H, MA J, et al. Lycopene attenuates the inflammation and apoptosis in aristolochic acid nephropathy by targeting the Nrf2 antioxidant system[J]. Redox Biol, 2022, 57: 102494. DOI:10.1016/j.redox.2022.102494 |
| [10] |
李琳, 郭怡婷, 秦鸿楠, 等. 不同海拔牦牛骨骼肌线粒体呼吸链复合酶活性及氧化应激指标的差异分析[J]. 黑龙江畜牧兽医, 2023(11): 121-125, 130. LI L, GUO Y T, QIN H N, et al. Differential analysis of mitochondrial complex enzyme activity and oxidative stress indexes of yak skeletal muscle at different altitudes[J]. Heilongjiang Animal Science and Veterinary Medicine, 2023(11): 121-125, 130. (in Chinese) |
| [11] |
范艺凡, 冯志伟, 范阔海, 等. 猪重组NK-lysin抑制肝细胞性肝癌的转移: 基于下调FKBP3表达、抑制氧化磷酸化和糖酵解[J]. 南方医科大学学报, 2023, 43(7): 1116-1126. FAN Y F, FENG Z W, FAN K H, et al. Procine recombinant NK-lysin inhibits hepatocellular carcinoma metastasis by downregulating FKBP3 and inhibiting oxidative phosphorylation and glycolysis: a proteomic analysis[J]. Journal of Southern Medical University, 2023, 43(7): 1116-1126. (in Chinese) |
| [12] |
何邵平, 呙于明, 郭吉余. 橙皮苷的生理功能及在家禽生产中的应用[J]. 中国饲料, 2023(7): 148-152. HE S P, GUO Y M, GUO J Y. Biological functions of hesperidin and its application in poultry production[J]. China Feed, 2023(7): 148-152. (in Chinese) |
| [13] |
蒲鹏. 橙皮苷改善肥胖小鼠糖脂代谢的机制研究[J]. 中国中药杂志, 2016, 41(17): 3290-3295. PU P. Protection mechanisms of hesperidin on mouse with insulin resistance[J]. China Journal of Chinese Materia Medica, 2016, 41(17): 3290-3295. (in Chinese) |
| [14] |
赵文轩, 吴建民, 党苗苗, 等. 橙皮苷与迷迭香酸组合对育肥猪盲肠肠道形态、抗氧化功能、菌群结构及屏障功能的影响[J]. 微生物学报, 2023, 63(11): 4356-4371. ZHAO W X, WU J M, DANG M M, et al. Combination of hesperidin and rosmarinic acid affects cecal morphology, antioxidant function, microbiota structure, and barrier function of finishing pigs[J]. Acta Microbiologica Sinica, 2023, 63(11): 4356-4371. (in Chinese) |
| [15] |
HAJIALYANI M, HOSEIN FARZAEI M, ECHEVERRÍA J, et al. Hesperidin as a neuroprotective agent: A review of animal and clinical evidence[J]. Molecules, 2019, 24(3): 648. DOI:10.3390/molecules24030648 |
| [16] |
王嘉阳, 胡英, 许玉珍, 等. 高原低氧抑制PPAR通路诱导小鼠脾脏铁死亡发生[J/OL]. 中国免疫学杂志, 1-14. [2023-11-29]. http://kns.cnki.net/kcms/detail/22.1126.R.20230721.1715.008.html. WANG J Y, HU Y, XU Y Z, et al. Plateau hypoxia inhibits PPAR pathway-induced iron death occurrence in mouse spleen[J/OL]. Chinese Journal of Immunology, 1-14. [2023-11-29]. http://kns.cnki.net/kcms/detail/22.1126.R.20230721.1715.008.html. (in Chinese) |
| [17] |
曹威荣, 王燕飞, 张若男, 等. 基于RNA-seq对复合益生菌作用于肉鸡回肠中新转录本预测及可变剪接、SNP分析[J/OL]. . 中国饲料: 1-8[2023-11-29]. https://doi.org/10.15906/j.cnki.cn11-2975/s.2022100027-07. CAO W R, WANG Y F, ZHANG R N, et al. RNA-seq-based prediction of new transcripts and variable splicing and SNP analysis of compound probiotic action in broiler ileum[J]. China Feed: 1-8[2023-11-29]. https://doi.org/10.15906/j.cnki.cn11-2975/s.2022100027-07. (in Chinese). |
| [18] |
XIA J H, YUAN J, XIN L L, et al. Transcriptome analysis on the inflammatory cell infiltration of nonalcoholic steatohepatitis in bama minipigs induced by a long-term high-fat, high-sucrose diet[J]. PLoS ONE, 2014, 9(11): e113724. DOI:10.1371/journal.pone.0113724 |
| [19] |
曹文瀞, 刘爽, 李嘉丽, 等. 茶籽皂苷联合有氧运动改善高脂饮食诱导的肥胖小鼠脂代谢及氧化应激水平[J]. 食品科学, 2023, 44(11): 106-114. CAO W J, LIU S, LI J L, et al. Tea seed saponin combined with aerobic exercise ameliorated lipid metabolism and oxidative stress in high-fat diet-fed mice[J]. Food Science, 2023, 44(11): 106-114. (in Chinese) |
| [20] |
LEE J, PARK J S, ROH Y S. Molecular insights into the role of mitochondria in non-alcoholic fatty liver disease[J]. Arch Pharm Res, 2019, 42(11): 935-946. DOI:10.1007/s12272-019-01178-1 |
| [21] |
ARAB J P, ARRESE M, TRAUNER M. Recent insights into the pathogenesis of nonalcoholic fatty liver disease[J]. Annu Rev Pathol, 2018, 13: 321-350. DOI:10.1146/annurev-pathol-020117-043617 |
| [22] |
YOUNOSSI Z, ANSTEE Q M, MARIETTI M, et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(1): 11-20. DOI:10.1038/nrgastro.2017.109 |
| [23] |
NOLFI-DONEGAN D, BRAGANZA A, SHIVA S. Mitochondrial electron transport chain: Oxidative phosphorylation, oxidant production, and methods of measurement[J]. Redox Biol, 2020, 37: 101674. DOI:10.1016/j.redox.2020.101674 |
| [24] |
SUN W L, LIU P P, WANG T Q, et al. Baicalein reduces hepatic fat accumulation by activating AMPK in oleic acid-induced HepG2 cells and high-fat diet-induced non-insulin-resistant mice[J]. Food Funct, 2020, 11(1): 711-721. DOI:10.1039/C9FO02237F |
| [25] |
SONG Y, WU W F, SHENG L, et al. Chrysin ameliorates hepatic steatosis induced by a diet deficient in methionine and choline by inducing the secretion of hepatocyte nuclear factor 4α-dependent very low-density lipoprotein[J]. J Biochem Mol Toxicol, 2020, 34(7): e22497. DOI:10.1002/jbt.22497 |
| [26] |
CHEN J, LIU J, WANG Y, et al. Wogonin mitigates nonalcoholic fatty liver disease via enhancing PPARα/AdipoR2, in vivo and in vitro[J]. Biomed Pharmacother, 2017, 91: 621-631. DOI:10.1016/j.biopha.2017.04.125 |
| [27] |
房国梁, 崔凯茵, 赵杰修, 等. 有氧运动对APP/PS1小鼠大脑皮质和海马组织线粒体氧化磷酸化功能的影响[J]. 中国运动医学杂志, 2020, 39(10): 789-796. FANG G L, CUI K Y, ZHAO J X, et al. Effects of aerobic exercise on oxidative phosphorylation of mitochondria in the cortex and hippocampus of APP/PS1 mice[J]. Chinese Journal of Sports Medicine, 2020, 39(10): 789-796. DOI:10.3969/j.issn.1000-6710.2020.10.006 (in Chinese) |
| [28] |
PHANIENDRA A, JESTADI D B, PERIYASAMY L. Free radicals: properties, sources, targets, and their implication in various diseases[J]. Indian J Clin Biochem, 2015, 30(1): 11-26. DOI:10.1007/s12291-014-0446-0 |
| [29] |
彭昭, 吴娜, 牛志涛, 等. 卡维地洛对溃疡性结肠炎大鼠脂质过氧化产物和炎症因子的影响[J]. 河北北方学院学报: 自然科学版, 2022, 38(8): 1-5, 10. PENG Z, WU N, NIU Z T, et al. Effects of carvedilol on lipid peroxidation products and inflammatory factors in rats with ulcerative colitis[J]. Journal of Hebei North University: Natural Science Edition, 2022, 38(8): 1-5, 10. (in Chinese) |
| [30] |
LI J D, WANG T Q, LIU P P, et al. Hesperetin ameliorates hepatic oxidative stress and inflammation via the PI3K/AKT-Nrf2-ARE pathway in oleic acid-induced HepG2 cells and a rat model of high-fat diet-induced NAFLD[J]. Food Funct, 2021, 12(9): 3898-3918. DOI:10.1039/D0FO02736G |
| [31] |
PÉREZ-CARRERAS M, DEL HOYO P, MARTÍN M A, et al. Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis[J]. Hepatology, 2003, 38(4): 999-1007. |
| [32] |
张言坤. ZHX2调控线粒体氧化磷酸化抑制肝再生的作用及机制研究[D]. 济南: 山东大学, 2022. ZHANG Y K. ZHX2 regulates mitochondrial oxidative phosphorylation to inhibit hepatic regeneration and mechanism[D]. Ji'nan: Shandong University, 2022. (in Chinese) |
| [33] |
VERCELLINO I, SAZANOV L A. The assembly, regulation and function of the mitochondrial respiratory chain[J]. Nat Rev Mol Cell Biol, 2022, 23(2): 141-161. |
(编辑 范子娟)



