2. 华中农业大学生猪健康养殖协同创新中心, 武汉 430070;
3. 华中农业大学农业微生物资源发掘与利用国家重点实验室, 武汉 430070;
4. 天康生物制药有限公司, 乌鲁木齐 830011
2. The Cooperative Innovation Center for Sustainable Pig Production, Wuhan 430070, China;
3. State Key Laboratory of Agricultural Microbial Resources Exploitation and Utilization, Huazhong Agricultural University, Wuhan 430070, China;
4. Tiankang Biopharmaceutical Co., Ltd., Urumqi 830011, China
牛支原体是牛呼吸道疾病综合征(bovine respiratory disease,BRD)的主要病原之一[1],能够引起牛的肺炎、中耳炎、关节炎及乳房炎等[2-3],发病率最高可达100%,死亡率可达50%[4],给养牛业造成了巨大的经济损失。自1961年首次被发现以来[5],牛支原体病已在世界范围内广泛传播;我国自2008年首次在湖北随州的牛肺组织中分离到该病原[6],之后在多地出现了该病的报道[7]。牛支原体可感染各个年龄段甚至各种品种的牛[8],其中肉牛和奶牛最为易感,犊牛病情相对严重,病死率较高[9]。牛支原体可在牛群中水平及垂直传播[10]。
目前, 牛支原体尚无特效治疗药物。一方面由于缺乏细胞壁[11],青霉素类的抗生素对其敏感性较差。另一方面,抗生素的滥用也导致了新型耐药菌株的不断出现[12]。因此,疫苗免疫无疑是一个最佳的选择。我国目前尚无牛支原体的疫苗问世[13],疫苗评估是疫苗研制过程中的重要环节之一,宿主动物免疫攻毒保护试验是必不可缺的,因此制备疫苗可再现的攻毒模型是必要的。本体动物牛的成本较高,寻求合适的小动物替代攻毒模型是牛支原体疫苗中必不可缺的步骤之一[14]。
目前,虽然有部分学者在进行小动物模型的研究[15-17],但操作上存在有一定的差别。大多数仅用牛支原体对动物进行直接攻毒。而事实上牛支原体条件致病,在不同免疫条件下动物的临床发病会存在有差别。因此,为系统研究牛支原体小动物感染模型,本研究以日本大耳白兔为研究对象,不仅采用了牛支原体的单独感染,同时模拟了免疫抑制及刺激免疫状态,即用地塞米松降低兔免疫力;利用免疫刺激物巯基乙酸盐[18]和孔蓝蛋白(KLH)[19],刺激免疫,因此能够更好地模拟临床上的真实情况。为牛支原体疫苗的研发提供了重要的技术储备。
1 材料与方法 1.1 材料1.1.1 主要试剂 血蓝蛋白(Keyhole Limpet Hemocyanin,KLH)、最低基本培养基(minimum essential medium,MEM)、丙酮酸钠购自美国Sigma公司;琼脂糖、PPLO肉汤粉、酵母粉购自美国BD公司;酚红购自上海沪试有限公司;青霉素钠购自红宝兽药有限责任公司;马血清购自hyclone公司。
1.1.2 菌种、蛋白及实验动物 牛支原体HB0801株由本实验室分离保存。抗体检测用P579蛋白为本实验室制备并保存。
健康雄性2月龄日本大耳白兔(约1.5 kg)购于华中农业大学实验动物中心。通过PCR方法检测确认无支气管败血波氏杆菌、巴氏杆菌、肺炎克雷伯菌以及牛支原体。于试验前进行7天的安静饲养,缓解应激。动物试验经由华中农业大学科学伦理委员会审批符合动物实验伦理审查要求(伦理编号:HZAURAB-2022-0003)。
1.1.3 PPLO培养基配制 液体培养基:PPLO10.5 g,酵母粉2.5 g,丙酮酸钠0.5 g,加单蒸水定容至440 mL,121 ℃灭菌15 min,待培养基冷却后,加入马血清50 mL,灭菌10×MEM 5 mL,无菌4万单位·mL-1青霉素钠溶液5 mL。
固体培养基:PPLO10.5 g,酵母粉2.5 g,丙酮酸钠0.5 g,琼脂粉7.5 g,加单蒸水定容至440 mL,121 ℃灭菌15 min,待培养基温度降至45 ℃左右,加入马血清50 mL,灭菌10×MEM 5 mL,无菌8万单位·mL-1青霉素钠溶液5 mL,然后倾倒平板。
1.2 方法1.2.1 HB0801攻毒菌株的复苏及计数 将原代HB0801菌株冻干粉接种于液体PPLO培养基中培养36 h后再以1 ∶100的比例转接至PPLO液体培养基中。37 ℃静置培养48 h后以1 ∶1 000比例再次转接至PPLO液体培养基中。自24 h起每隔12 h进行倍比稀释至109,用颜色改变单位(CCU)及平板菌落计数法CFU进行计数[20]。
将培养好的牛支原体高速离心浓缩至1010后置于4 ℃保存,以备攻毒使用。
1.2.2 常见呼吸道病原菌的检测 利用PCR方法对多杀性巴氏杆菌[21]、肺炎克雷伯菌[22]以及支气管败血波氏杆菌[23]进行检测。
用牛支原体Uvrc(GenBank登录号: AF003 959.1)特异性片段对牛支原体进行普通PCR检测[24]。用设计的引物和探针进行荧光定量PCR检测[25],引物见表 1,反应条件及体系见表 2。
|
|
表 1 PCR引物 Table 1 PCR primers |
|
|
表 2 PCR反应的体系及条件 Table 2 System and conditions of PCR reaction |
1.2.3 分组及攻毒 将11只日本大耳白兔分为4组,除对照组2只兔外,攻毒组均为3只。
组1为仅攻击HB0801组:气管注射1010 CFU·mL-1 HB0801株,1 mL·只-1,连续攻击3 d。
组2为注射地塞米松后攻击HB0801组:连续5 d肌肉注射地塞米松0.5 mg·kg-1后,第6天开始气管注射1010 CFU·mL-1 HB0801株1 mL·只-1,连续攻击3 d。
组3为攻击HB0801后注射免疫刺激物KLH和巯基乙酸盐培养基组:气管注射1010CFU·mL-1 HB0801株,1 mL·只-1,连续攻击3 d后,再连续3 d肌肉注射KLH 0.1 mg·只-1,同时腹腔注射巯基乙酸盐培养基1 mL·只-1。
组4为空白对照组:气管注射PPLO液体培养基连续3 d。
1.2.4 观察并记录临床症状 每日观察各组日本大耳白兔精神状态、呼吸状况,口鼻分泌物等临床症状,记录体温。
1.2.5 鼻拭子排菌情况检测 隔天采集兔鼻拭子至无菌PPLO液体培养基中,充分混匀后用0.45 μm[26]滤器过滤,取滤液500 μL接种至等体积PPLO液体培养基中,于37 ℃ CO2培养箱培养2~3 d。将菌液离心后取上清煮沸作为模板PCR扩增Uvrc片段检测牛支原体。
1.2.6 血清中抗体的检测 采用本实验室前期所建立的ELISA抗体检测法对完成安静饲养后,进行试验操作前1天的血清及攻毒后第7、14、21天以及第31天的血清进行抗体检测[27]。
具体步骤如下:包被P579蛋白0.1 μg·孔-1,4 ℃过夜后充分洗涤,加入50 μL待检血清/阴阳性对照以及50 μL酶标单抗,充分混匀后置37 ℃温育60 min。充分洗涤后加入底物进行显色,10 min后进行终止。OD450 nm读数。按照以下计算公式,计算阻断率(PI值)。
PI值=(1-S/N)×100%,其中,S=样品OD450 nm值;N=阴性对照血清OD450 nm平均值。
判定:试验成立的条件阴性对照血清OD450 nm平均值>0.65,且<2.0,阳性对照血清PI值均>60%,则判为试验成立。
结果判定:待检样品PI值≥40%时,判为阳性;待检样品PI值<40%时,判为阴性。
1.2.7 肺部病理变化的评分及病理切片的制作 于攻毒后第31天将所有日本大耳白兔进行剖杀。观察并记录大体病变情况,并依据实变型肺部评分标准(LLS)对肺组织进行评分[28]。
评分标准:在LLS方案中,根据肺叶的大小,每个肺叶被分成几个三角形(每个尖叶和中叶7个,每个膈叶19个,附属叶8个)。每叶受影响的三角形数乘以5,再除以每叶的三角形数(完全受这些病变影响的叶的得分为5)。LLS的最高分为30分(每叶5分)。兔肺包括左尖叶、左膈叶、右尖叶、右中叶、右膈叶和心叶。
在眼观变化明显的组织交界处无菌采集约为1 cm3的肺部组织4%多聚甲醛-PBS缓冲液中进行固定后制作HE染色切片。
1.2.8 肺组织中牛支原体的检测 无菌条件下,取病变肺组织0.5 g进行充分匀浆,离心后取上清过滤,接种至PPLO液体培养基中,置于37 ℃含有5% CO2 培养箱中培养72 h后观察培养基颜色变化。
2 结果 2.1 HB0801攻毒菌株的复苏及计数复苏后的牛支原体于36 h时可达到109 CCU·mL-1及3.67×109 CFU·mL-1。符合攻毒浓度要求。
2.2 临床症状的观察各攻毒组兔均表现为精神状态变差,食欲下降,体温无显著变化。对照组兔均表现正常。
攻毒组中,组2临床变化最为显著,一只明显流涕(图 1A),另一只鼻腔出现肉眼可见白色分泌物(图 1B)。

|
A. 流涕;B. 鼻腔有白色分泌物 A. Runny nose; B. White nasal discharge 图 1 组2兔出现明显临床症状 Fig. 1 Group 2 rabbits presented with obvious clinical signs |
隔天对鼻拭子中牛支原体的排菌情况进行检测。检测结果如表 3所示。PCR结果显示,各攻毒组于攻毒后第1天均可以检测到牛支原体,组1表现为间歇性排菌,虽然第1天有2/3的兔检测为阳性,但第3~5天均为阴性,第7~11天也仅有1/3的兔检测为阳性。表明该模型不能有效诱导稳定的排菌。
|
|
表 3 PCR检测鼻拭子中牛支原体 Table 3 PCR positive rate of Mycoplasma in rabbit nasal swab |
组2虽然仅在攻毒后第1和3天检测到阳性,但所有的兔均表现为排菌,表明该模型稳定性较好。
组3仅第1天和第9天有1/3的兔检测到了牛支原体。
空白组均未检测到牛支原体。
2.4 血清中抗体的检测对攻毒前及攻毒后第7、14、21、31天的血清进行抗体检测,结果显示(表 4),组1自攻毒后第7天有1只兔开始检测到抗体,至第21天所有兔均为抗体阳性。
|
|
表 4 血清ELISA检测结果 Table 4 Serum ELISA results |
组2自攻毒后第7天开始,有2只兔检测为抗体阳性,随后所有兔转阳。表明该模型能够诱导较好的抗体水平。
组3抗体水平呈现波动,仅第7、21和31天能够检测到部分兔的抗体。
空白对照组均为抗体检测阴性。
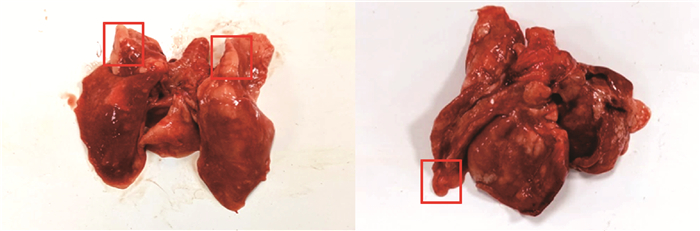
2.5 肺部病理变化于攻毒后第31天对所有兔进行剖杀。发现各攻毒组兔肺均出现不同程度的病变。组1中各组兔均有不同程度的淤血,组2除有明显出血外,有2只兔有明显肉变(图 2)。组3除1只兔有肉样变化外,其它仅有淤血。组4肺部无显著病理变化。依据评分标准对各肺脏进行评分,结果显示(表 5),在各攻毒组中,组2评分最高,为2.82分。
|
图 2 组2兔肺部多处出现肉样病变 Fig. 2 Multiple fleshy lesions in the lungs of group 2 rabbits |
|
|
表 5 各组兔肺脏得分 Table 5 Lung scores of rabbits in each group |
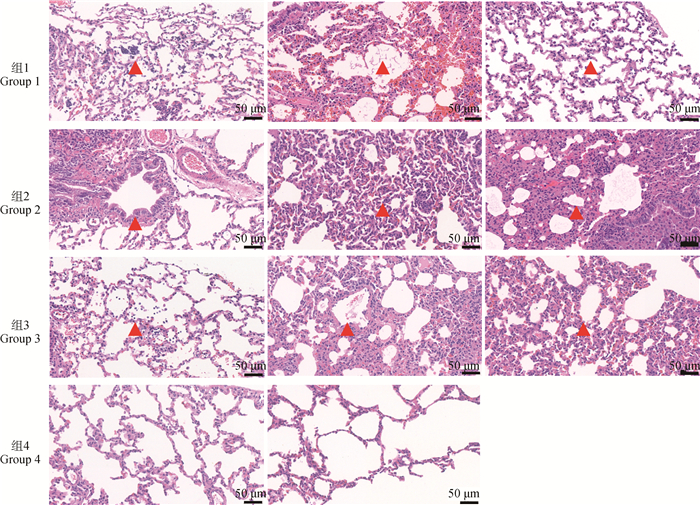
进一步的病理切片结果(图 3)显示,各攻毒组均表现为肺泡壁增厚,肺泡Ⅱ型上皮细胞增生,大量炎性细胞聚集,巨噬细胞浸润,有炎性渗出物,符合牛支原体造成的间质性肺炎的病变特征[29]。
|
图 3 各组兔肺病理切片 Fig. 3 Pathological sections of the lungs from rabbits of each group |
该部分研究结果显示,用地塞米松诱导后再进行牛支原体的攻毒能够引起最显著的病理变化。
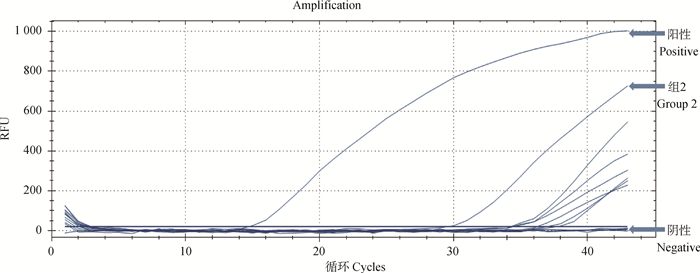
2.6 肺组织中牛支原体的检测在肺组织中,各组兔均未检测到多杀性巴氏杆菌、肺炎克雷伯菌以及支气管败血波氏杆菌。仅组2的一只兔用PCR及荧光定量PCR检测均为阳性。其他组均未检测到阳性。详见图 4。
|
图 4 荧光定量PCR结果 Fig. 4 The result of qPCR |
牛支原体对于宿主的特异性要求较高,动物模型复制成为制约牛支原体疫苗研究的瓶颈问题。前期的研究显示,用鸡胚作为替代动物,虽有较好的致死性,但是缺乏较好的评价指标,临床症状、抗体水平等不明显。小鼠作为动物模型既不能引起明显的临床症状,也无显著病理变化[30]。选用兔作为牛支原体的代替模型,相较于其他动物有较好的易感性和临床意义[16]。
本试验采取气管注射的方法攻毒兔,设置地塞米松免疫抑制组和KLH和巯基乙酸盐培养基作为免疫刺激物的组别,模拟在实际情况中,牛支原体作为条件致病菌,常在应激条件下由于免疫力下降时造成的继发感染[31]。利用药物降低动物的免疫力达到一定的攻毒效果,是之前试验均没有尝试过的,这样做是为了尽可能地贴合实际情况,诱发更为典型的病理变化。
综合临床症状、排菌、抗体及大体病变等各项指标,用地塞米松诱导后再进行HB0801攻毒确实表现出了稳定的攻毒效果,能够诱导出流涕、鼻腔出现白色分泌物等临床症状,能够导致尖叶和心叶的肉样变,使得肺泡壁增厚,Ⅱ型肺泡细胞增生,出现纤维素性渗出以及巨噬细胞浸润等病理现象;病原和免疫反应方面,能够出现稳定的排菌和较长的抗体持续时间。但与自然感染患牛相比,体温未出现明显升高,肺部的实质性病变也不够明显[32]。
4 结论综合本研究结果,得出以下结论:1)日本大耳白兔感染牛支原体模型建立成功。2)地塞米松造成免疫抑制后连续3 d,每天每只兔气管攻毒1 mL浓度为1010CFU·mL-1的牛支原体HB0801株的感染模型最好。
| [1] |
刘庆国. 新疆南疆地区牛支原体的分离鉴定及致病性研究[D]. 阿拉尔: 塔里木大学, 2022. LIU Q G. Isolation, identification and pathogenicity of Mycoplasma bovis in southern Xinjiang[D]. Alaer: Tarim University, 2022. (in Chinese) |
| [2] |
朱志刚, 蒋向君, 孙田. 犊牛支原体病的诊断与防控措施[J]. 中国乳业, 2020(11): 50-51. ZHU Z G, JIANG X J, SUN T. Diagnosis, prevention and control measures of mycoplasmosis in calves[J]. China Dairy, 2020(11): 50-51. (in Chinese) |
| [3] |
彭清洁, 胡长敏, 陈颖钰, 等. 一例奶牛牛支原体乳房炎的诊断[C]//中国奶业协会第26次繁殖学术年会暨国家肉牛牦牛/奶牛产业技术体系第3届全国牛病防治学术研讨会论文集. 兰州: 全国牛病大会组委会, 2011: 493-496. PENG Q J, HU C M, CHEN Y Y, et al. Diagnosis of a case of bovine mycoplasma mastitis in a dairy cow[C]//The 26th annual meeting of China Dairy Association and the 3rd National Symposium on Bovine Disease Control of National Beef Yak/Dairy Cattle Industrial Technology System. Lanzhou: Organizing Committee of the National Bovine Disease Conference, 2011: 493-496. (in Chinese) |
| [4] |
张建华, 曹希亮, 刘超, 等. 我国奶牛牛支原体流行情况调查[J]. 中国奶牛, 2017(3): 23-26. ZHANG J H, CAO X L, LIU C, et al. Prevalence investigation of Mycoplasma bovis in China[J]. China Dairy Cattle, 2017(3): 23-26. (in Chinese) |
| [5] |
HALE H H, HELMBOLDT C F, PLASTRIDGE W N, et al. Bovine mastitis caused by a Mycoplasma species[J]. Cornell Vet, 1962, 52: 582-591. |
| [6] |
辛九庆, 李媛, 郭丹, 等. 国内首次从患肺炎的犊牛肺脏中分离到牛支原体[J]. 中国预防兽医学报, 2008, 30(9): 661-664. XIN J Q, LI Y, GUO D, et al. First isolation of Mycoplasma bovis from calf lung with pneumonia in China[J]. Chinese Journal of Preventive Veterinary Medicine, 2008, 30(9): 661-664. (in Chinese) |
| [7] |
石磊, 龚瑞, 尹争艳, 等. 肉牛传染性牛支原体肺炎流行的初步诊断[J]. 华中农业大学学报, 2008, 27(4): 572. SHI L, GONG R, YIN Z Y, et al. Preliminary diagnosis of cattle infectious Mycoplasma bovis pneumonia[J]. Journal of Huazhong Agricultural University, 2008, 27(4): 572. DOI:10.3321/j.issn:1000-2421.2008.04.029 (in Chinese) |
| [8] |
NICHOLAS R A J, AYLING R D. Mycoplasma bovis: disease, diagnosis, and control[J]. Res Vet Sci, 2003, 74(2): 105-112. DOI:10.1016/S0034-5288(02)00155-8 |
| [9] |
胡长敏, 石磊, 龚瑞, 等. 牛支原体病研究进展[J]. 动物医学进展, 2009, 30(8): 73-77. HU C M, SHI L, GONG R, et al. Progress on bovine mycoplasmosis[J]. Progress in VeterinaryMedicine, 2009, 30(8): 73-77. (in Chinese) |
| [10] |
王天宇, 李继东, 张志诚, 等. 牛支原体病流行病学及其诊断技术研究进展[J]. 畜牧与兽医, 2021, 53(12): 134-139. WANG T Y, LI J D, ZHANG Z C, et al. Progress in research on the molecular technology of Mycoplasma bovis and its epidemic status[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(12): 134-139. (in Chinese) |
| [11] |
ADAMU J Y, WAWEGAMA N K, BROWNING G F, et al. Membrane proteins of Mycoplasma bovis and their role in pathogenesis[J]. Res Vet Sci, 2013, 95(2): 321-325. DOI:10.1016/j.rvsc.2013.05.016 |
| [12] |
贺承光, 孔令聪, 孙喆. 牛支原体抗生素耐药性的研究进展[J]. 吉林畜牧兽医, 2018, 39(12): 11-13. HE C G, KONG L C, SUN Z. Research progress on antibiotic resistance of Mycoplasma bovis[J]. Jilin Animal Husbandry and Veterinary Medicine, 2018, 39(12): 11-13. (in Chinese) |
| [13] |
BOKMA J, VEREECKE N, NAUWYNCK H, et al. Genome-wide association study reveals genetic markers for antimicrobial resistance in Mycoplasma bovis[J]. Microbiol Spectr, 2021, 9(2): e0026221. DOI:10.1128/Spectrum.00262-21 |
| [14] |
东笑, 陶攀, 王贵平, 等. 牛支原体疫苗研究进展[J]. 中国动物传染病学报, 2023. DONG X, TAO P, WANG G P, et al. Research progress of bovine Mycoplasma vaccine[J]. Chinese Journal of Animal Infectious Diseases, 2023. DOI:10.19958/j.cnki.cn31-2031/s.20211126.010 (in Chinese) |
| [15] |
范媛, 陈忠琼, 谢光武, 等. 6株牛支原体分离株对鸡胚和小鼠的致病性研究[J]. 中国预防兽医学报, 2012, 34(12): 963-966. FAN Y, CHEN Z Q, XIE G W, et al. Pathogenicity of Mycoplasma bovis isolates in experimental infected chick embryos and mice[J]. Chinese Journal of Preventive Veterinary Medicine, 2012, 34(12): 963-966. (in Chinese) |
| [16] |
雷元元, 何生虎, 马烨, 等. 牛支原体感染家兔试验[J]. 动物医学进展, 2015, 36(10): 53-59. LEI Y Y, HE S H, MA Y, et al. Experiment on Mycoplasma bovis infection in rabbits[J]. Progress in Veterinary Medicine, 2015, 36(10): 53-59. (in Chinese) |
| [17] |
牛家强. 西藏牦牛源牛支原体生物学特性及感染兔肺脏转录组学研究[D]. 武汉: 华中农业大学, 2021. NIU J Q. Biological characteristics of isolated Mycoplasma bovis from yaks in Tibet and transcriptomics of lungs in infected rabbits[D]. Wuhan: Huazhong Agricultural University, 2021. (in Chinese) |
| [18] |
TURYNA B, BOS ' M, JUREK J. The influence of in vivo stimulation on functional activity of rat macrophages[J]. Folia Histochem Cytobiol, 1994, 32(2): 101-105. |
| [19] |
CHU C Y, LEE S C, LIU S S, et al. Cytosine-phosphate-guanine oligodeoxynucleotides containing GACGTT motifs enhance the immune responses elicited by keyhole limpet hemocyanin antigen in dairy cattle[J]. Nucleic Acid Ther, 2011, 21(5): 323-332. DOI:10.1089/nat.2010.0275 |
| [20] |
郭大城, 马彦民, 许玉玲, 等. 支原体菌落形成单位与颜色改变单位定量关系研究[J]. 中国卫生检验杂志, 2020, 30(4): 405-407. GUO D C, MA Y M, XU Y L, et al. Study on quantitative relationship between colony formation unit and color changing unit for mycoplasma[J]. Chinese Journal of Health Laboratory Technology, 2020, 30(4): 405-407. (in Chinese) |
| [21] |
TOWNSEND K M, BOYCE J D, CHUNG J Y, et al. Genetic organization of Pasteurella multocida cap Loci and development of a multiplex capsular PCR typing system[J]. J Clin Microbiol, 2001, 39(3): 924-929. DOI:10.1128/JCM.39.3.924-929.2001 |
| [22] |
王贵升, 尹斐斐. 肺炎克雷伯氏菌PCR检测方法的建立[J]. 山东畜牧兽医, 2017, 38(4): 6-7. WANG G S, YIN F F. Establishment of PCR detection method for Klebsiella pneumoniae[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2017, 38(4): 6-7. (in Chinese) |
| [23] |
HOZBOR D, FOUQUE F, GUISO N. Detection of Bordetella bronchiseptica by the polymerase chain reaction[J]. Res Microbiol, 1999, 150(5): 333-341. DOI:10.1016/S0923-2508(99)80059-X |
| [24] |
THOMAS A, DIZIER I, LINDEN A, et al. Conservation of the uvrC gene sequence in Mycoplasma bovis and its use in routine PCR diagnosis[J]. Vet J, 2004, 168(1): 100-102. DOI:10.1016/S1090-0233(03)00186-2 |
| [25] |
徐恩红, 祁明普, 项志杰, 等. 牛呼吸疾病综合征七病原联合检测多重qPCR方法的建立[J]. 华中农业大学学报, 2023, 42(2): 38-47. XU E H, QI M P, XIANG Z J, et al. Establishment of multiple qPCR for simultaneous detection of 7 pathogens causing bovine respiratory diseases complex[J]. Journal Huazhong Agricultural University, 2023, 42(2): 38-47. (in Chinese) |
| [26] |
石刚. 牛支原体灭活疫苗佐剂的筛选与培养基的改良[D]. 石河子: 石河子大学, 2013. SHI G. Screening adjuvant for the inactivated vaccine of Mycoplasma bovis and the improvement of Mycoplasma bovis medium[D]. Shihezi: Shihezi University, 2013. (in Chinese) |
| [27] |
胡长敏, 郭爱珍, 张文劲, 等. 抗牛支原体MbovP579蛋白的单克隆抗体及其应用: 中国, 110746504A[P]. 2020-02-04. HU C M, GUO A Z, ZHANG W J, et al. Monoclonal antibody against Mycoplasma bovis MbovP579 protein and its application: CN, 110746504A[P]. 2020-02-04. (in Chinese) |
| [28] |
SIBILA M, ARAGÓN V, FRAILE L, et al. Comparison of four lung scoring systems for the assessment of the pathological outcomes derived from Actinobacillus pleuropneumoniae experimental infections[J]. BMC Vet Res, 2014, 10: 165. DOI:10.1186/1746-6148-10-165 |
| [29] |
庞方圆, 李洪林, 隋丽英. 一例犊牛支原体性肺炎和关节炎的病理学观察[J]. 中国畜禽种业, 2022, 18(10): 132-134. PANG F Y, LI H L, SUI L Y. Pathological observations on a case of mycoplasma pneumonia and arthritis in a calf[J]. The Chinese Livestock and Poultry Breeding, 2022, 18(10): 132-134. (in Chinese) |
| [30] |
范媛. 牛支原体生长特性及其致病性研究[D]. 重庆: 西南大学, 2011. FAN Y. The study on growth properties and pathogenesis of Mycoplasma bovis[D]. Chongqing: Southwest University, 2011. (in Chinese) |
| [31] |
张晓宇. 奶牛犊牛主要呼吸道疾病流行病学调查及牛支体肺炎防治的研究[D]. 呼和浩特: 内蒙古农业大学, 2018. ZHANG X Y. Investigation on pathogens of main respiratory infectious diseases in dairy cows in China and rasearch on main pathogen control[D]. Hohhot: Inner Mongolia Agricultural University, 2018. (in Chinese) |
| [32] |
周玉森. 肉牛支原体肺炎的流行病学、临床症状、诊断与防治[J]. 现代畜牧科技, 2018(3): 104. ZHOU Y S. Epidemiology, clinical symptoms, diagnosis and prevention of Mycoplasma pneumonia in beef cattle[J]. Modern Animal Husbandry Science & Technology, 2018(3): 104. (in Chinese) |
(编辑 白永平)



