2. 精华药业(成都)有限公司, 成都 641423
2. Essence Pharmaceutical (Chengdu) Co., Ltd, Chengdu 641423, China
伪结核棒状杆菌(Corynebacterium pseudotuberculosis,Cp)是一种兼性胞内寄生革兰阳性菌,能引起小反刍动物,尤其是绵羊和山羊患病,是慢性传染病干酪性淋巴结炎(CLA)的主要病原[1]。CLA以引起被感染动物头颈部体表淋巴结及肝、脾、肺和肾等内脏器官的脓肿及干酪样病变为特征,严重损害动物身体健康和动物肉制品质量[2]。Cp感染致病病程长,发展缓慢,经常会伴随终生。一旦该病在某一地区发生,Cp就会通过各种方式扩散,从而导致该地环境出现持续性污染[3],极难根除,给养羊业造成巨大经济损失。因此,研究对该病原菌感染的有效防控措施具有重要意义。目前,主要有三种手段防控Cp感染:1)接种疫苗。虽然接种疫苗可有效降低Cp感染率,但是我国目前尚无有效的商品化疫苗可用;2)手术治疗。这种方法仅针对出现体表淋巴结脓肿的病例,需将脓肿组织切开排脓[4],但其操作繁琐且排出的脓液极易造成环境的污染,增加其他易感羊的发病率;3)药物防治。虽然Cp对多种化学药物和抗生素敏感,但这些药物不易进入脓肿部位,临床治疗效果较差,且我国自2020年7月1日畜禽饲料“禁抗令”规定,饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料,因此寻找新型的饲料添加剂成为预防Cp感染新的思路。
植物精油(essentials oils,EOs)是一类具有挥发性的油状物质,属植物次生代谢物质,主要从芳香植物的花、叶、根、茎、种子、果实或皮中提取获得[5]。EOs具有显著的选择性抗菌活性,它作为一种新型饲料添加剂可起部分替代抗生素的作用,具有较好的应用前景。研究发现,葡萄柚精油对金黄色葡萄球菌、单增李斯特菌具有较强的抗菌活性[6]。薄荷精油对金黄色葡萄球菌具有较强的抗菌和抗生物膜活性[7]。甜橙精油对枯草芽胞杆菌和金黄色葡萄球菌均有抑制作用[8]。目前,EOs是否具有Cp的活性尚不明确,因此筛选能有效抑杀Cp的植物精油对该病原防控有重要价值。本试验选取4种来源广泛的EOs,进行Cp抑菌效果研究,并筛选出抗菌活性较强的香柠檬精油(bergamot essential oil,BEO),进一步评价其体内外抗Cp效果及机制,为后期临床上通过添加BEO,以降低Cp对家畜的感染和危害提供参考。
1 材料与方法 1.1 动物、细胞及主要试剂昆明系(KM)小鼠购自重庆莱比特生物技术有限公司;J774A.1小鼠巨噬细胞由四川大学李和贤博士馈赠;RNAiso Plus、PrimeScriptTM RT reagent kit和TB Green Premix Ex Taq Ⅱ均购自TaKaRa公司;香柠檬精油(生产批号:S21-08375)、甜橙精油(生产批号:S20-07005)、柠檬精油(生产批号:2105190218)、肉桂醛(生产批号:21CAL030E)均购自南京九隆汇香料有限公司;刃天青购自酷尔化学科技(北京)有限公司。
1.2 试验菌株及培养Cp ATCC19410购自广东微生物菌种保藏中心,Cp万州株(WZ)和宣汉株(XH02)由实验室前期分离保存,表达超折叠绿色荧光蛋白菌株(ATCC19410-pXMJ19-sfGFP)由实验室前期构建保存。将Cp接种到含5%兔血的LB平板上,37 ℃培养48 h,挑取单个菌落于BHI肉汤培养24 h,使用浊度仪测定并调整细菌浓度备用。
1.3 体外筛选能高效抑杀Cp的EOs1.3.1 不同EOs对Cp的抑菌作用 参考文献报道的方法[9],采用滤纸片法检测柠檬精油(lemon essential oil,LEO)、甜橙精油(orange essential oil,OEO)、香柠檬精油(bergamot essential oil,BEO)、肉桂醛(cinnamaldehyde,CA)对Cp抑菌效果。取100 μL Cp WZ (1×107 CFU ·mL-1)菌悬液均匀涂布在血琼脂平板上,其上等距放置空白药敏纸片,向纸片上缓慢滴加10 μL精油,对照组滴加等量灭菌PBS,37 ℃恒温培养48 h,观察抑菌效果。选择抑菌效果最优的精油进行后续试验。
1.3.2 BEO对Cp最小抑菌浓度测定 参考文献报道的方法[10],以刃天青显色法测定BEO对Cp的最小抑菌浓度(MIC)。将BEO溶于含1% Tween 80的BHI肉汤中,于第2列加入180 μL、第3~9列每孔加入100 μL BHI肉汤;同时于第2列中加入20 μL BEO溶液,混匀,取100 μL加入到第3列孔,混匀后,取100 μL加入第4列孔,按此法依次稀释至第8列,第8列每孔弃去100 μL;取100 μL Cp菌悬液(1×105 CFU ·mL-1)加入第2~8列孔,即得BEO体积分数分别为50.00、25.00、12.50、6.25、3.13、1.56、0.78 μL ·mL-1的培养液。第9列孔加入菌悬液作为阳性对照,第10列加入BHI肉汤作为阴性对照。37 ℃恒温培养24 h;向所有孔内加入20 μL刃天青溶液(终浓度为25 μg ·mL-1),37 ℃恒温孵育2 h,观察颜色变化。
1.4 BEO对Cp体外感染小鼠巨噬细胞的影响按照CCK8试剂盒说明书检测BEO对小鼠巨噬细胞J774A.1活性的影响。在96孔板中按5×103细胞·孔-1铺板,过夜贴壁培养。弃去培养液,以PBS洗涤细胞,换新鲜培养液;设置无细胞的空白对照组、BEO不同浓度处理组(终浓度为2.4、2.8、3.2 μL ·mL-1)和未处理对照组,37 ℃、5% CO2培养12 h,加入10 μL CCK-8溶液,孵育1 h,测定OD450 nm。按公式计算:
| $ 细胞存活率 (\%) =\\试验孔吸光度 - 空白孔吸光度对照孔吸光度 - 空白孔吸光度 \times 100 $ |
将J774A.1按2×105细胞·孔-1接种于24孔板,过夜培养,弃去培养液,用PBS洗涤细胞,以ATCC19410-pXMJ19-sfGFP按感染复数为1(MOI=1)感染J774A.1,1 h后弃培养液,以PBS液洗3次,以含或不含BEO (1 MIC)的培养液培养5 h,弃培养液后,PBS液洗3次。在荧光显微镜下照相观察,统计被ATCC19410-pXMJ19-sfGFP感染J774A.1的比例。
1.5 BEO对Cp体内感染小鼠的影响1.5.1 BEO对Cp感染小鼠脏器载菌量及抗菌肽表达的影响 将KM小鼠随机分Control、BEO、Tween 80+Cp和BEO+Cp共4组,每组3只。BEO组和BEO+Cp组小鼠灌胃BEO 600 mg ·(kg ·d)-1,Tween 80+Cp和Control组灌胃2% Tween 80,连续灌胃5 d。BEO+Cp组和Tween 80+Cp组腹腔接种WZ 1×106 CFU ·(0.2 mL ·只)-1,BEO组和Control组注射0.2 mL生理盐水。参考文献[11]方法,攻毒3 d后,无菌采集脾(仅用于提取RNA)、肝、肾和腹水,采用涂布平板法检测肝、肾和腹水中的Cp水平。按试剂盒说明书,用qPCR检测脾组织中小鼠β防御素1~4(mBD1-4)、Cathelicidin相关抗菌肽(Cramp)和杀菌渗透性增强蛋白1(Bpifa1)的mRNA的表达量。qPCR的体系为10 μL,反应程序:95 ℃ 60 s;95 ℃5 s, 60 ℃30 s, 40个循环。以β-actin为内参基因,按2-ΔΔCt计算目的基因mRNA相对表达量。
1.5.2 BEO对Cp感染小鼠生存曲线的影响 将28只KM小鼠随机分为未感染(UI)组、Tween 80+Cp组、LBEO(低浓度BEO)+Cp组和HBEO(高浓度BEO)+Cp组,每组7只。UI组和Tween 80+Cp组灌胃2% Tween 80,LBEO+Cp组和HBEO+Cp组分别灌胃300 mg ·(kg ·d)-1和1 200 mg ·(kg ·d)-1的BEO,均连续灌胃5 d;除UI组注射0.2 mL生理盐水外,其余组小鼠均腹腔接种WZ 1×106 CFU ·(0.2 mL ·只)-1。连续观察20 d,记录每组小鼠存活情况。
1.6 BEO抗Cp机制初步探索1.6.1 BEO作用对Cp菌体形态的影响 参考文献[12]方法,用不同浓度BEO(1/2和1 MIC)在37 ℃下处理Cp WZ 6 h,将菌悬液在3 500 r ·min-1离心10 min,弃上清液,加入2.5%戊二醛固定液,悬浮固定。后续步骤由里来生物科技有限公司完成,方法如下:固定好的样本经ddH2O清洗3次,经1%锇酸固定1 h,再经ddH2O清洗3次,分别使用30%、50%和70%的乙醇依次梯度脱水15 min。最后,用70%的乙醇浸泡过夜。用90%乙醇再次洗涤,然后分别用无水乙醇和叔丁醇洗涤3次,持续15 min。将样品进行喷镀处理,用扫描电子显微镜观察细菌的形态变化。
1.6.2 BEO作用Cp释放DNA到上清液中的测定 参考文献[13]方法,调整对数生长期的WZ菌悬液浓度为1×108 CFU ·mL-1,分别用1/2、1和2 MIC的BEO处理,未经BEO处理的细菌作为对照。在37 ℃下培养2、4、6 h后,4 ℃下离心(8 000×g)5 min,收集上清液。使用Nano Drop 2000紫外-可见分光光度计在260 nm处,测定释放到上清液中的DNA含量。
1.6.3 BEO作用对Cp毒力基因表达水平的影响 挑取WZ株单菌落,接种于含0.1% Tween 80的BHI肉汤培养20 h,然后按1 ∶50将菌液接种于50 mL BHI肉汤,37 ℃、200 r ·min-1震荡培养12 h。离心弃上清,分别用含或不含BEO(1 MIC)的BHI肉汤培养6 h,4 000 r ·min-1离心10 min,弃上清。按试剂盒说明书,利用RNAiso Plus提取Cp总RNA,以PrimeScriptTM RT Reagent Kit反转录为cDNA。参考文献及引物[14-15],利用TB Green Premix Ex Taq Ⅱ以qPCR检测磷脂酶D (pld,89 bp)、耐铜蛋白C(copC,242 bp)、寡肽透过酶A(oppA,237 bp)、锌依赖性超氧化物歧化酶(sodC,270 bp)编码基因的mRNA表达水平,以16S rRNA(92 bp)为内参,按2-ΔΔCt计算目的基因mRNA相对表达量。
1.7 数据分析采用Graph Pad Prism 9.0做图,以双尾非配对t检验进行统计分析,其中生存曲线以log-rank检验。试验结果用“平均数±标准误(x±sx)”表示。ns.P>0.05,差异不显著;*.P<0.05,差异显著;**.P<0.01,差异极显著。
2 结果 2.1 BEO对Cp抑菌圈的测定如图 1所示,滴加BEO和肉桂醛精油组血琼脂平板上无Cp生长,其抑菌圈直径在60 mm以上。滴加甜橙精油、柠檬精油抑菌结果与PBS对照组相似,无抑菌作用。表明BEO和肉桂醛精油对Cp有较好的抑杀效果,而柠檬精油和甜橙精油对Cp无抑菌作用。
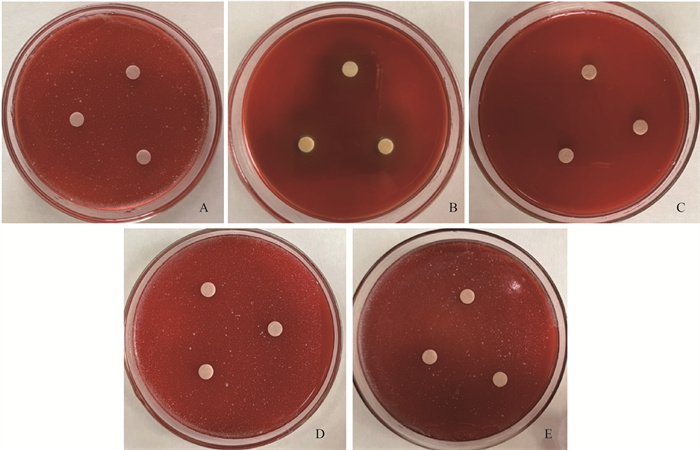
|
A. PBS; B. 肉桂醛; C. 香柠檬精油; D. 甜橙精油; E. 柠檬精油 A. PBS; B. Cinnamaldehyde; C. Bergamot essential oil; D. Orange essential oil; E. Lemon essential oil 图 1 不同植物精油对Cp抑菌效果 Fig. 1 Effect of different essentials oils against C. pseudotuberculosis |
利用刃天青显色法检测发现,BEO对所检测Cp菌株的最小抑菌浓度(MIC)为0.78~1.56 μL ·mL-1,其中对XH02抑菌效果最好,MIC为0.78 μL ·mL-1,对ATCC19410和WZ抑菌效果相似,MIC均为1.56 μL ·mL-1(图 2)。
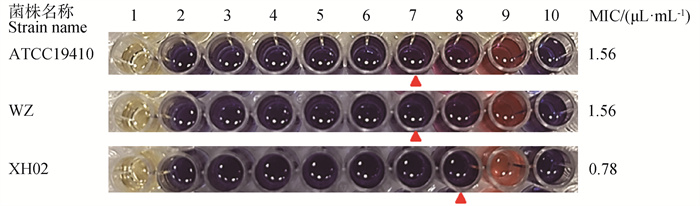
|
以刃天青显色法测定BEO对Cp的最小抑菌浓度(MIC);1. BHI肉汤;2~8. BEO的体积分数分别为50.00、25.00、12.50、6.25、3.13、1.56和0.78 μL ·mL-1;9.不含BEO的菌液对照;10. 不含菌BHI肉汤对照;三角形表示相应菌株的MIC孔 The minimum inhibitory concentration (MIC) of BEO on Cp was determined by resazurin; 1. BHI broth; 2-8.The volume fractions of BEO were 50.00, 25.00, 12.50, 6.25, 3.13, 1.56, and 0.78 μL ·mL-1, respectively; 9. Bacterial solution without BEO; 10. Non bacterial BHI broth control; Triangles represent the MIC pores of the corresponding strains 图 2 BEO对Cp最小抑菌浓度测定结果 Fig. 2 Results of minimum inhibitory concentration of BEO on Cp |
用含不同浓度BEO的培养基培养J774A.11巨噬细胞12 h,CCK-8检测发现,与对照组相比,BEO处理组J774A.1细胞活力无显著变化(图 3A),表明以所用浓度的BEO对J774A.1细胞活性无明显影响。进一步检测Cp感染巨噬细胞比例,发现以1 MIC的BEO处理后,与未处理对照组相比,Cp感染巨噬细胞比例显著下降(图 3B、C)。
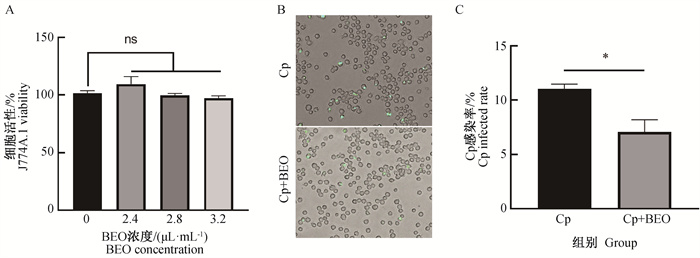
|
A. 不同浓度BEO对J774A.1细胞活性影响;B. 在有或无BEO条件下ATCC19410-pXMJ19-sfGFP感染J774A.1后,在明场和荧光下照相的merge图片;C. BEO对Cp感染J774A.1比例统计结果;Cp. ATCC19410-pXMJ19-sfGFP;ns.差异不显著;*.P<0.05,差异显著 A. Effect of BEO with different concentration on viability of J774A.1;B. Merge images of ATCC19410-pXMJ19-sfGFP infection of J774A. 1 under bright field and fluorescence conditions with or without BEO; C. Effect of BEO on rate of J774A.1 infected by Cp; Cp ATCC19410-pXMJ19-sfGFP; ns. Not significant; *.P < 0.05, significant difference 图 3 BEO对Cp体外感染J774A.1巨噬细胞的影响 Fig. 3 The effect of BEO on C. pseudotuberculosis infection in J774A. 1 macrophages in vitro |
与Tween 80+Cp相比,BEO处理后极显著降低被感染小鼠腹水和脏器中Cp水平,其中BEO处理组肝中Cp数量降低99.06%,肾中Cp数降低99.95%,腹水中Cp数降低93.37%(图 4)。
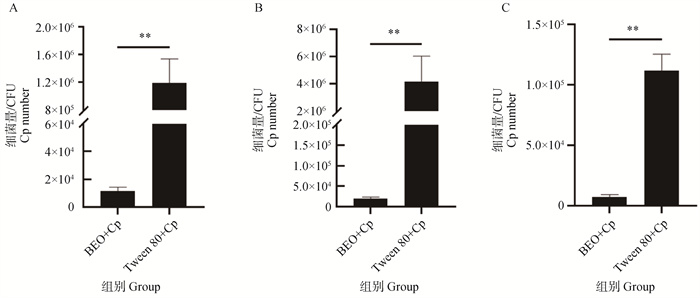
|
A. 肝;B. 肾;C. 腹水;BEO.香柠檬精油;Cp.伪结核棒状杆菌WZ株;**.P<0.01,差异极显著 A. liver; B. kidney; C. ascites; BEO.Bergamot essential oil; Cp.C. pseudotuberculosis WZ strain; **.P < 0.01, significant difference 图 4 BEO对Cp感染小鼠腹水及脏器细菌量的影响 Fig. 4 Effect of BEO on bacterial load in ascites and organs of mice infected with C. pseudotuberculosis |
与空白组相比,BEO组抗菌肽基因Bpifal 1、mBD2、mBD3的mRNA表达水平显著增加(P<0.05,P<0.01),提示小鼠灌胃BEO能上调上述抗菌肽基因的表达。与Tween+Cp组相比,BEO+Cp组Cramp、Bpifal 1、mBD2、mBD3的mRNA表达水平显著增加(P<0.01),提示小鼠灌胃BEO能上调Cp感染小Cramp、Bpifa 1、mBD2、mBD3和mBD4的mRNA表达水平(图 5)。
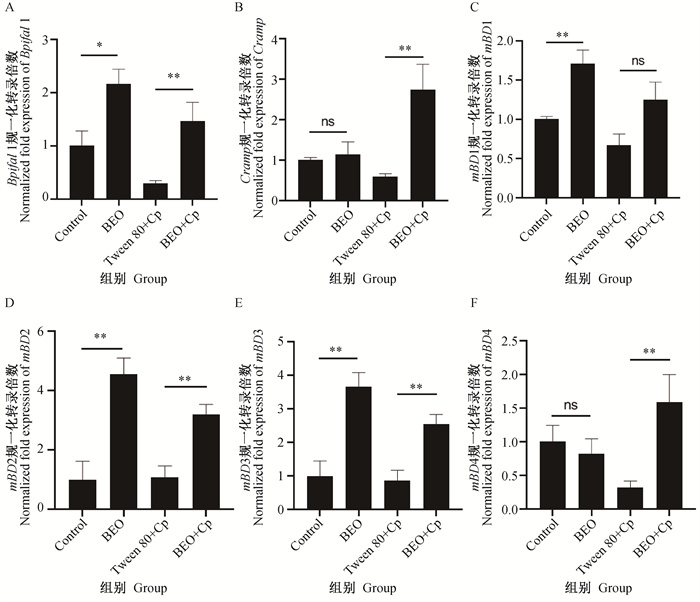
|
A. 杀菌渗透性增强蛋白1(Bpifa1); B. Cathelicidin相关抗菌肽(Cramp); C~F. 小鼠β防御素1~4 (mBD1-4); BEO. 香柠檬精油;Cp. 伪结核棒状杆菌WZ株;ns. 差异不显著;**.P<0.01和*.P<0.05,差异显著 A. Bactericidal-permeability increasing protein 1 (Bpifa1); B. Cathelicidin-related antimicrobial peptide (Cramp); C-F. mouseβ-defensin 1-4 (mBD1-4); BEO. Bergamot essential oil; Cp. C. pseudotuberculosis WZ strain; ns. Not significant; **.P < 0.01 and *.P < 0.05: significant difference 图 5 BEO对Cp感染小鼠脾组织抗菌肽mRNA表达的影响 Fig. 5 Effect of BEO on gene expression of antibacterial peptide in spleen of mice infected with C. pseudotuberculosis |
为进一步评价BEO对宿主抵御Cp感染的作用,本研究观察了BEO灌胃对Cp感染小鼠的生存曲线的影响。结果显示,灌胃低浓度BEO小鼠在感染后20 d内死亡率为14.29%(1/7);灌胃高浓度BEO小鼠在感染后20 d内死亡率为0%(0/7);灌胃Tween 80在感染后20 d内死亡率为57.14%(4/7)(图 6),提示BEO可显著降低Cp感染KM小鼠的死亡率。
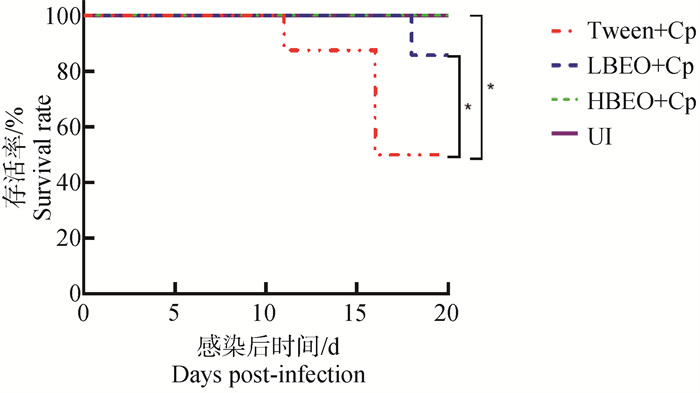
|
LBEO. 低浓度香柠檬精油;HBEO. 高浓度香柠檬精油;Cp. 伪结核棒状杆菌WZ株;UI. 未感染对照组;*.P<0.05,差异显著 LBEO. Low concentration of Bergamot essential oil; HBEO. High concentration of Bergamot essential oil; Cp.C. pseudotuberculosis WZ strain; *.P < 0.05: significant difference 图 6 BEO对Cp感染后小鼠存活率的影响 Fig. 6 Effect of BEO on survival rate of mice infected with C. pseudotuberculosis |
扫描电镜观察发现,对照组Cp呈棒状或线状,长度均一,菌体结构饱满,未见皱缩,细胞膜表面光滑、平整。1/2 MIC BEO处理组部分Cp呈豆状,长度略显变短,小部分菌体结构皱缩,大部分菌体结构饱满。1 MIC BEO处理组Cp大部分呈豆状,长度明显变短,约50%菌体皱缩,局部细胞膜轻度凹陷,细胞膜表面略显粗糙(图 7)。表明BEO对Cp的菌体形态破坏作用明显,使细胞膜受到不同程度的损伤。
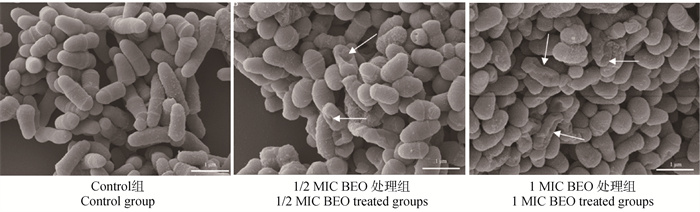
|
箭头表示Cp菌体(WZ株)皱缩、细胞膜凹陷或破坏;放大倍数为20 000× Arrows indicate shrinkage, cell membrane depression, or destruction of C. pseudotuberculosis WZ strain; magnification times, 20 000× 图 7 BEO对Cp菌体形态的影响 Fig. 7 Effect of Bergamot essential oil on C. pseudotuberculosis morphology |
当细菌细胞膜受损时,细胞质内容物如小离子、蛋白质和核苷酸会浸出细胞膜外。与对照组相比,加入不同浓度的BEO处理2、4、6 h,Cp泄漏到上清液中DNA均显著增高,其中BEO处理Cp在最初的2 h内立即迅速增加,且BEO浓度越高,Cp泄漏DNA程度越明显(图 8)。
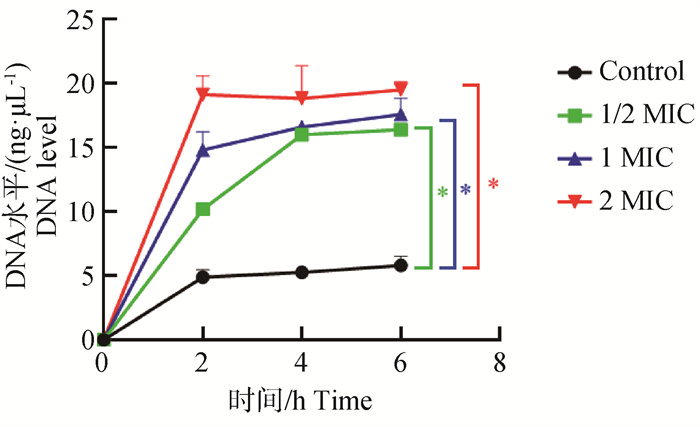
|
MIC. 最小抑菌浓度;*.P<0.05,差异显著 MIC. Minimum Inhibitory Concentration; *.P < 0.05, significant difference. 图 8 BEO作用Cp后上清液中DNA浓度的变化 Fig. 8 Leakage of DNA from Cp treated with BEO |
毒力基因转录水平检测显示,与Cp WZ株相比,BEO处理Cp的CopC、SodC和OppA mRNA表达水平无显著差异,但是pld的mRNA表达水平极显著降低(P<0.01)(图 9)。
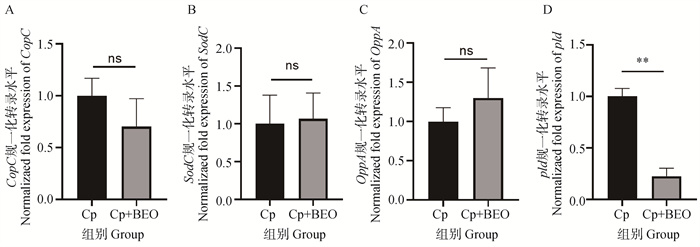
|
Cp. 伪结核棒状杆菌WZ株;**.P<0.01,差异极显著;ns. 差异不显著 Cp. C. pseudotuberculosis WZ strain; **.P < 0.01, significant difference; ns. Not significant 图 9 BEO对Cp部分毒力基因mRNA表达影响结果 Fig. 9 Effect of virulence gene mRNA expression of Cp treated with BEO |
本研究首先采用纸片扩散法筛选出对Cp具有抑菌效果的BEO,进一步以刃天青指示剂微量肉汤稀释法测定了其对Cp标准株ATCC19410和临床分离株(WZ和XH02)的MIC值。刃天青是一种无毒的氧化还原染料,可在多种还原酶的作用下由蓝色态被还原为红色,在该过程中,刃天青的减少与细菌数量的增加存在直接关系[16],因此广泛用于细菌的药物敏感性评价研究中[10, 16-17]。据报道刃天青在2.5~40.0 μg ·mL-1浓度范围内,吸光值变化与其浓度呈正相关关系[16]。本研究选择1×105 CFU ·mL-1的Cp菌液浓度、25 μg ·mL-1的刃天青终浓度和2 h的显色时间,即可灵敏检测出BEO的抗菌效果。本研究证实BEO具有抗Cp的活性,其MIC值为0.78~1.56 μL ·mL-1,这与已有研究报道BEO对常见的胃肠道或皮肤疾病的细菌(如幽门螺杆菌、空肠弯曲杆菌、大肠杆菌0157、单核细胞增多性李斯特菌、蜡样芽胞杆菌和金黄色葡萄球菌)具有抗菌作用的结果相似[18]。
Cp是一种兼性胞内寄生菌,该病原在巨噬细胞内存活和扩散传播是其重要特征。本研究发现BEO可显著降低Cp对巨噬细胞J774A.1的感染比例,这可能与BEO抑杀Cp减少了该病原从J774A.1释放并再次感染新的巨噬细胞有关。进一步的体内试验发现,BEO可降低被感染小鼠的腹水、肝和肾中的Cp数量,提高被感染小鼠的成活率,提示BEO可抑制Cp体内感染的致病作用。BEO的活性化学成分包括α-蒎烯、月桂烯、柠檬烯、α-香柠檬亭、β-甜没药烯、芳樟醇、乙酸芳樟酯、橙花醇、橙花醇乙酸酯、香叶醇、香茅醇乙酸酯和α-松醇等物质[19],具体是哪种(些)活性成分发挥抗Cp作用尚待进一步研究。
3.2 BEO抗Cp作用机制探讨EOs的成分大多为脂溶性,这些成分特性可对细菌细胞膜和胞内物质产生不利影响,如渗透细菌细胞壁和细胞膜,从而导致细胞膜生物特性发生改变,破坏细胞膜或致使胞内重要物质外漏,进而达到抗菌效果[20-21]。崔海英等[22]报道丁香精油能溶解单核细胞增生性李斯特菌细胞膜,导致细胞膜破损,内容物流出。Song等[21]报道柑橘精油处理后,金黄色葡萄球菌的细胞膜表现出不可逆的损伤。本研究发现BEO可以破坏Cp菌体的完整结构,表现为菌体皱缩、细胞膜凹陷或破裂,导致被处理Cp的DNA的泄漏,且BEO浓度越高对Cp影响越大,这与Tang等[12]报道EOs以剂量依赖的形式使细菌表面发生不可逆的皱缩和粗糙,即破坏细菌的细胞形状以及内外结构而导致细菌死亡相似。Cp致病与其携带多种毒力因子有关,其中PLD是Cp最关键的毒力因子之一[23],本文发现BEO作用显著降低的该病原pld mRNA表达水平,但对CopC、和OppA mRNA表达水平无显著影响。综上提示,BEO可能通过破坏Cp的菌体形态,使其细胞膜受到不同程度的损伤,使胞内DNA泄漏,从而造成Cp死亡,同时可降低该病原pld基因表达水平,从而减轻Cp对被感染小鼠的致病作用。
此外,本文还评价了BEO对Cp感染小鼠抗菌肽表达的影响。抗菌肽是机体经诱导产生的小分子量、抗菌活性广、具有免疫调节性能的多肽[24],是机体抵御病菌感染过程中不可或缺的“化学屏障”。郭志强等[25]研究发现,饲喂添加抗菌肽的日粮,能显著提高肉鸡IgM、IgG和补体C3含量从而提高机体免疫力;Chong等[26]研究发现小鼠抗菌肽mBD4降低了甲型流感病毒的传染性,并增强了病毒感染后的先天免疫力。抗菌肽在宿主抵抗Cp感染过程中也发挥了重要的作用,韩晓芳[27]报道抗菌肽可以降低Cp感染引起皮下脓肿的严重程度;Zhou等[14]报道给予丁酸钠的Cp感染小鼠脾Cramp表达显著上调从而减轻感染。本研究发现,BEO可上调Cp感染小鼠脾脏抗菌肽Bpifa1、mBD2和mBD3的mRNA水平,提示BEO可能通过上调相关抗菌肽基因的表达提高小鼠对该病原的抵御能力。
综上,本文首先发现BEO对Cp具有良好的抗菌作用,其原因可能有:1)BEO损伤Cp的细胞膜促进其DNA释放,以及降低毒力基因pld表达,从而致死或降低Cp致病力;2)BEO通过上调机体抗菌肽表达从而增强机体免疫力。其次,作者发现BEO能显著提高Cp感染后小鼠的存活率,提示BEO极具畜牧生产中应用于防控Cp感染的潜力。BEO成分的挥发性是其应用于动物临床时需要重点关注的问题,如何确保其稳定性?以何种剂型给予才能更好地发挥其抑菌作用是需要进一步探索的问题。
4 结论香柠檬精油能抑杀伪结核棒状杆菌(Cp),改善Cp对小鼠的感染程度,其机制可能与BEO损伤Cp细胞膜造成DNA泄漏并降低毒力基因pld的mRNA表达,以及促进Cp感染小鼠抗菌肽Cramp、Bpifal 1、mBD2、mBD3和mBD4的表达有关。
| [1] |
DORELLA F A, PACHECO L G, SEYFFERT N, et al. Antigens of Corynebacterium pseudotuberculosis and prospects for vaccine development[J]. Expert Rev Vaccines, 2009, 8(2): 205-213. DOI:10.1586/14760584.8.2.205 |
| [2] |
STING R, GEIGER C, RIETSCHEL W, et al. Corynebacterium pseudotuberculosis Infections in alpacas (Vicugna pacos)[J]. Animals (Basel), 2022, 12(13): 1612. |
| [3] |
BAIRD G J, FONTAINE M C. Corynebacterium pseudotuberculosis and its role in ovine caseous lymphadenitis[J]. J Comp Pathol, 2007, 137(4): 179-210. DOI:10.1016/j.jcpa.2007.07.002 |
| [4] |
曹启航, 姜悦才, 张天亮, 等. 山羊伪结核棒状杆菌病流行现状和防控技术研究进展[J]. 动物医学进展, 2022, 43(7): 74-78. CAO Q H, JIANG Y C, ZHANG T L, et al. Progress on epidemic status, prevention and control techniques of caseous lymphadenitis in goats[J]. Progress in Veterinary Medicine, 2022, 43(7): 74-78. (in Chinese) |
| [5] |
DOSOKY N S, SETZER W N. Biological activities and safety of Citrus spp. essential oils[J]. Int J Mol Sci, 2018, 19(7): 1966. DOI:10.3390/ijms19071966 |
| [6] |
陈红丽, 刘可, 杨小爱, 等. 葡萄柚精油及其分子蒸馏组分的抗菌活性研究[J]. 赣南师范大学学报, 2017, 38(3): 81-84. CHEN H L, LIU K, YANG X A, et al. Antibacterial activities of grapefruit oil and its molecular distillation fraction[J]. Journal of Gannan Normal University, 2017, 38(3): 81-84. (in Chinese) |
| [7] |
KANG J M, JIN W Y, WANG J F, et al. Antibacterial and anti-biofilm activities of peppermint essential oil against Staphylococcus aureus[J]. LWT, 2019, 101: 639-645. DOI:10.1016/j.lwt.2018.11.093 |
| [8] |
吴均, 杨德莹, 李抒桐, 等. 甜橙精油的化学成分、抑菌和抗氧化活性研究[J]. 食品工业科技, 2016, 37(14): 148-153. WU J, YANG D Y, LI S T, et al. Study on chemical components, antimicrobial and antioxidant activity of essential oil from Citrus sinensis[J]. Science and Technology of Food Industry, 2016, 37(14): 148-153. (in Chinese) |
| [9] |
李娜. 紫苏精油提取及其防腐复合材料的制备和性能研究[D]. 太原: 中北大学, 2018. LI N. Study on extraction of perilla essential oil, preparation and properties of corresponding anticorrosive compounds[D]. Taiyuan: North University of China, 2018. (in Chinese) |
| [10] |
朱梅芳, 唐宇, 郑琴, 等. 不同提取方式对连翘、荆芥、薄荷挥发油成分及抗菌活性的影响[J]. 中草药, 2018, 49(12): 2845-2854. ZHU M F, TANG Y, ZHENG Q, et al. Effects of different extraction methods on composition and antibacterial activity of volatile oil from Forsythiae Fructus, Schinzonepetae Herba, and Menthae Haplocalycis Herba[J]. Chinese Traditional and Herbal Drugs, 2018, 49(12): 2845-2854. (in Chinese) |
| [11] |
TAN J M, YI W Y, WANG Z Y, et al. TRIM21 negatively regulates Corynebacterium pseudotuberculosis-induced inflammation and is critical for the survival of C. pseudotuberculosis infected C57BL6 mice[J]. Vet Microbiol, 2021, 261: 109209. DOI:10.1016/j.vetmic.2021.109209 |
| [12] |
TANG C L, CHEN J L, ZHANG L X, et al. Exploring the antibacterial mechanism of essential oils by membrane permeability, apoptosis and biofilm formation combination with proteomics analysis against methicillin-resistant staphylococcus aureus[J]. Int J Med Microbiol, 2020, 310(5): 151435. DOI:10.1016/j.ijmm.2020.151435 |
| [13] |
WU Y P, BAI J R, ZHONG K, et al. A dual antibacterial mechanism involved in membrane disruption and DNA binding of 2R, 3R-dihydromyricetin from pine needles of Cedrus deodara against Staphylococcus aureus[J]. Food Chem, 2017, 218: 463-470. DOI:10.1016/j.foodchem.2016.07.090 |
| [14] |
ZHOU Z Y, YANG H Y, LI H X, et al. Sodium butyrate ameliorates Corynebacterium pseudotuberculosis infection in RAW264. 7 macrophages and C57BL/6 mice[J]. Microb Pathog, 2019, 131: 144-149. DOI:10.1016/j.micpath.2019.04.008 |
| [15] |
LI H X, YANG H Y, ZHOU Z Y, et al. Isolation, antibiotic resistance, virulence traits and phylogenetic analysis of Corynebacterium pseudotuberculosis from goats in southwestern China[J]. Small Rumin Res, 2018, 168: 69-75. DOI:10.1016/j.smallrumres.2018.09.015 |
| [16] |
崔乃菠, 马境谦, 余河水, 等. 基于刃天青微平板法检测金黄色葡萄球菌对天然产物的敏感性[J]. 天津中医药大学学报, 2022, 41(6): 774-779. CUI N B, MA J Q, YU H S, et al. Susceptibility tests of Staphylococcus aureus to natural products using the resazurin method[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(6): 774-779. (in Chinese) |
| [17] |
李宙阳, 周英. 刃天青显色法检测铜绿假单胞菌对几种抗菌药物的敏感性[J]. 山地农业生物学报, 2010, 29(3): 237-241. LI Z Y, ZHOU Y. A Resazurin-based assay for evaluation of anti-pseudomonas aeruginosa drugs sensitivity[J]. Journal of Mountain Agriculture and Biology, 2010, 29(3): 237-241. DOI:10.3969/j.issn.1008-0457.2010.03.010 (in Chinese) |
| [18] |
CIRMI S, BISIGNANO C, MANDALARI G, et al. Anti-infective potential of Citrus bergamia risso et poiteau (bergamot) derivatives: a systematic review[J]. Phytother Res, 2016, 30(9): 1404-1411. DOI:10.1002/ptr.5646 |
| [19] |
VALUSSI M, DONELLI D, FIRENZUOLI F, et al. Bergamot oil: botany, production, pharmacology[J]. Encyclopedia, 2021, 1(1): 152-176. DOI:10.3390/encyclopedia1010016 |
| [20] |
张卓, 聂德超, 赵琛, 等. 柑橘类植物精油的抗菌活性及其作用机制[J]. 动物营养学报, 2022, 34(2): 758-764. ZHANG Z, NIE D C, ZHAO C, et al. Antibacterial activity of citrus essential oils and its mechanism[J]. Chinese Journal of Animal Nutrition, 2022, 34(2): 758-764. DOI:10.3969/j.issn.1006-267x.2022.02.010 (in Chinese) |
| [21] |
SONG X Y, LIU T, WANG L, et al. Antibacterial effects and mechanism of mandarin (Citrus reticulata L.) essential oil against Staphylococcus aureus[J]. Molecules, 2020, 25(21): 4956. DOI:10.3390/molecules25214956 |
| [22] |
崔海英, 周慧, 宋方平, 等. 丁香精油对单核细胞增生性李斯特菌的抗菌性能及杀菌机制研究[J]. 中国食品添加剂, 2015(12): 65-69. CUI H Y, ZHOU H, SONG F P, et al. Antibacterial activity and mechanism of clove oil against Listeria monocytogenes[J]. China Food Additives, 2015(12): 65-69. (in Chinese) |
| [23] |
周作勇, 李和贤, 杨浩钺, 等. 伪结核棒状杆菌毒力因子的研究进展[J]. 中国人兽共患病学报, 2017, 33(12): 1115-1119. ZHOU Z Y, LI H X, YANG H Y, et al. Research advances on the virulence factors of Corynebacterium pseudotuberculosis[J]. Chinese Journal of Zoonoses, 2017, 33(12): 1115-1119. DOI:10.3969/j.issn.1002-2694.2017.12.012 (in Chinese) |
| [24] |
LAKSHMAIAH NARAYANA J, CHEN J Y. Antimicrobial peptides: possible anti-infective agents[J]. Peptides, 2015, 72: 88-94. DOI:10.1016/j.peptides.2015.05.012 |
| [25] |
郭志强, 杨奉珠, 雷岷, 等. 抗菌肽对肉兔小肠黏膜形态、盲肠菌群和免疫功能的影响[J]. 动物营养学报, 2012, 24(9): 1778-1784. GUO Z Q, YANG F Z, LEI M, et al. Effects of antibacterial peptides on intestinal mucosal morphology, caecal microflora and immune function of meat rabbits[J]. Chinese Journal of Animal Nutrition, 2012, 24(9): 1778-1784. DOI:10.3969/j.issn.1006-267x.2012.09.022 (in Chinese) |
| [26] |
CHONG K T, THANGAVEL R R, TANG X H. Enhanced expression of murine β-defensins (MBD-1, -2, -3, and-4) in upper and lower airway mucosa of influenza virus infected mice[J]. Virology, 2008, 380(1): 136-143. |
| [27] |
韩晓芳. 羊皮下脓肿病原分离鉴定及天蚕素AD防治试验[D]. 杨凌: 西北农林科技大学, 2021. HAN X F. Isolation and identification of pathogen of subskin abscess and control of cecropin AD[D]. Yangling: Northwest A&F University, 2021. (in Chinese) |
(编辑 白永平)



