猪圆环病毒2型(porcine circovirus type 2,PCV2)是导致猪圆环病毒相关疾病(porcine circovirus associated disease,PCVAD)的主要病原,该病毒能导致感染猪免疫功能抑制,从而引发猪断奶后的多系统衰竭综合征、猪呼吸道疾病综合征、皮炎与肾病综合征、肉芽肿性肠炎、母猪繁殖障碍、仔猪先天性震颤等疾病[1-2]。PCV2的衣壳蛋白(capsid protein,Cap)由PCV2的ORF2基因编码,是其主要的免疫原性蛋白[3]。副猪革拉瑟菌(Glaesserella parasuis, GPS)是一种常见于猪上呼吸道的条件致病菌,能引起猪的革拉瑟病(Glasser’s disease),临床特征主要为猪的多发性浆膜炎、胸膜炎、关节炎、脑膜炎、腹膜炎和心包炎[4-6]。PCV2和GPS在临床上常混合感染,给我国养猪业造成巨大经济损失[7]。
细菌菌影(bacterial ghosts,BGs)是通过化学法、基因工程法或物理方法在细菌包膜上形成跨膜通道,并将核酸、细胞质等内容物释放到细菌体外所形成的一个细菌空壳,可作疫苗、佐剂和抗原(核酸疫苗、亚单位疫苗)载体使用[8-9]。菌影疫苗温和的灭活方式保留了细菌完整的抗原结构,不存在耐药或毒力返强的风险,具有佐剂的固有特性,内部空间还可以装载大量质粒DNA[10-11]。由于菌影表面保留了完整的形态结构,因此菌影易被机体免疫细胞(如RAW264.7细胞)识别并捕获,装载入菌影的DNA疫苗可以通过3种机制到达作用部位:第一,菌影附着在免疫细胞上,静电结合的DNA疫苗被微环境pH破坏后在作用部位释放;第二,菌影与免疫细胞的细胞膜发生融合,DNA疫苗进入细胞质,在细胞质中释放并表达;第三,菌影被内体摄取后并在溶酶体降解之前逃离内体,将DNA疫苗释放进入细胞质后表达[12]。Wen等[13]利用菌影这一特性将pEGFP-N1真核质粒装载入沙门菌菌影后转染RAW264.7细胞,荧光显微镜观察到几乎所有细胞均表达绿色荧光。化学法是目前制备菌影最常用的方法之一,其中NaOH是最常用的化学物质,适宜浓度的NaOH可以水解细菌包膜上的部分蛋白,在细菌外壳上形成跨膜孔道结构,使菌影的内容物排出,NaOH能够安全地在短时间内简单地以低成本有效生产大量菌影[8, 14],目前已经成功制备了猪链球菌[15]、猪胸膜肺炎放线杆菌[16]、李斯特菌[17]以及金黄色葡萄球菌[18]等多种菌影疫苗,均展示了较好的免疫保护效果。DNA疫苗具有安全稳定、易于构建、价格低廉等优势[19],Sylla等[20]将PCV2的ORF2基因插入pEGFP-N1质粒,制备PCV2 DNA疫苗,免疫小鼠后攻毒,结果显示,小鼠的临床症状和病理变化明显减轻。
当前PCV2和GPS混合感染的情况普遍存在,二联苗在一针两防的同时,还具有减少猪群免疫压力和应激,降低疫病防控成本等优势。基于此,本研究首先制备GPS菌影,再将连有PCV2 ORF2基因的真核质粒装载其中,构建PCV2-GPS二联菌影疫苗,探究其对小鼠的免疫保护效果,为新型安全有效的PCV2、GPS二联商品化疫苗的开发和应用提供生物材料和实验数据。
1 材料与方法 1.1 试验菌株、毒株、质粒、细胞系及实验动物副猪革拉瑟菌5型SH0165菌株由四川农业大学猪病研究中心保存;大肠杆菌(Trelief 5α Chemically Competent Cell)购自擎科生物;猪圆环病毒2型CHN SC0413毒株,真核表达质粒pEGFP-N1,小鼠单核巨噬细胞(RAW264.7细胞)、猪肾细胞(PK-15细胞)、人胚肾细胞(HEK 293 T细胞)由四川农业大学猪病研究中心保存;4周龄雌性无特定病原体(SPF)小鼠(BALB/c)购自成都达硕实验动物有限公司。
1.2 主要试剂胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)均购自美国BD-Difco公司;烟酰胺腺嘌呤二核苷酸(NAD)购自美国Sigma公司;胎牛血清、新生牛血清购自NEWZERUM;猪PCV2阳性血清,大肠杆菌表达的PCV2重组Cap蛋白,由实验室(制备)保存;羊抗猪IgG二抗(HRP标记),羊抗鼠IgG二抗(HRP标记)购自Solarbio科技有限公司;商品化疫苗(PCV2、GPS二联灭活疫苗)购自某公司;小鼠IFN-γ、IL-12酶联免疫试剂盒(ELISA)购自联科生物。
1.3 GPS菌影制备与鉴定将SH0165菌落数调整为1×109 CFU·mL-1,将起始浓度为10 mg·mL-1的NaOH溶液两倍梯度稀释后分别与菌体共孵育24 h,通过涂板活菌计数和浑浊度观察测定NaOH对GPS的最低抑菌浓度(MIC);将MIC的NaOH与菌体在37 ℃条件下孵育,每隔10 min取样,通过涂板活菌计数检测每个时间点的活菌数,未检测到活菌的最短时间为制备菌影的最佳时间;将GPS菌影和未处理的GPS在扫描电子显微境下观察形态学差异,通过琼脂糖凝胶电泳和SDS聚丙烯酰胺凝胶电泳检测菌影内容物(DNA和蛋白质)的排出情况。
1.4 GPS菌影诱导RAW264.7细胞因子的转录将RAW264.7细胞铺于6孔细胞培养板中(每孔2 mL,106个细胞)。用GPS活菌和菌影(浓度均为108 CFU·mL-1)分别与RAW264.7细胞共孵育,并设置脂多糖(LPS,浓度为25 μg·mL-1)阳性对照和空白对照,分别于3、6、9 h时收集细胞,按照细胞总RNA提取试剂盒操作说明提取RAW264.7细胞的总RNA,然后按照反转录试剂盒说明书将RNA反转录为cDNA。以GAPDH作为内参基因,用2-ΔΔCt相对荧光定量PCR方法检测细胞因子(IL-1α、IL-1β、IL-6、IL-10、TNF-α、iNOS)的转录水平。细胞因子的荧光定量引物信息如表 2所示。
|
|
表 1 荧光定量PCR引物序列和片段大小 Table 1 Primer sequences and fragment sizes of the targeted genes in real-time PCR |
|
|
表 2 小鼠分组与免疫程序 Table 2 Grouping of mice and immunization program |
根据GenBank公布的PCV2 CHN SC0413毒株全基因组(OP922507)中ORF2序列,设计同源重组扩增引物(pEGFP-ORF2-F:5′-gagctcaagcttc-gaattcATGACGTATCCAAGGAGGC-3′、pEGFP-ORF2-R:5′-atggtggcgaccggtggatcccgAGGGTTA-AGTGGGGGGTCT-3′),通过PCR扩增ORF2基因片段,pEGFP-N1利用EcoRⅠ和BamHⅠ进行双酶切,将ORF2基因片段和酶切产物纯化后连接,连接产物转化至大肠杆菌感受态细胞中,通过PCR、双酶切及测序进行鉴定,随后进行去内毒素提取质粒并按照转染试剂操作说明将重组质粒pEGFP-ORF2转染至HEK 293 T细胞中,同时设置空载体pEGFP-N1和未处理细胞作为对照组,2 d后收集细胞利用Western blot检测并分析蛋白表达情况。
1.6 PCV2-GPS二联菌影疫苗制备及免疫1.6.1 疫苗制备 将菌影与pEGFP-ORF2质粒缓冲液混合至终浓度为25 mmol·L-1的CaCl2溶液,充分混匀后,37 ℃震荡孵育2 h,5 000 r·min-1离心收集沉淀,用PBS清洗3遍后离心重悬,命名为猪圆环病毒2型-副猪革拉瑟菌二联菌影疫苗,随后将其转染至RAW264.7细胞,转染步骤:待RAW264.7细胞长到细胞瓶底面积的80%时,调整RAW264.7细胞密度至106·mL-1,接种于6孔细胞板,37 ℃ 5% CO2培养12 h。将PCV2-GPS二联菌影疫苗(菌影与细胞个数之比1 000 ∶1)与RAW264.7细胞混匀,同时设置pEGFP-ORF2质粒和未处理的RAW264.7细胞作为对照组,37 ℃孵育8 h后,更换培养液,继续培养16 h后吸取细胞培养液并加入适量DAPI,对细胞核染色,最后在荧光显微镜下观察绿色荧光。
1.6.2 疫苗免疫 将120只4周龄SPF BALB/c雌鼠适应性饲养2~3 d后,随机分为6组,皮下免疫,具体分组和免疫情况见表 2。
1.7 间接ELISA检测PCV2和GPS特异性抗体将纯化的大肠杆菌表达的PCV2 Cap蛋白或GPS全菌体分别用包被液稀释成浓度为750 ng·100 μL-1或2×107 CFU·100 μL-1,加入96孔高吸附酶标板(100 μL·孔-1),37 ℃孵育1 h后4 ℃孵育12 h。洗涤、拍干孔内液体,再加入5%的脱脂牛奶(200 μL·孔-1),37 ℃孵育2 h,洗涤、拍干孔内液体,用5%的脱脂牛奶对免疫后采集的血清进行稀释(1 ∶1 600),加入酶标板中(100 μL·孔-1),同时设置阴性对照,37 ℃孵育1 h。洗涤、拍干孔内液体,将酶标二抗(HRP-羊抗小鼠IgG)按1 ∶5 000进行稀释,加到酶标板中(100 μL·孔-1),37 ℃孵育30 min。避光向酶标板加入TMB显色液,100 μL·孔-1,室温反应15 min后加入ELISA终止液,50 μL·孔-1。最后使用酶标仪测定酶标板各孔的OD450 nm值。
1.8 血清杀菌试验采集两次免疫7 d后的小鼠血清,用0.22 μm的滤膜过滤除菌,取100 μL的细菌悬液(灭活血清组细菌数为8×107 CFU,未灭活血清组细菌数为8×108 CFU)分别与各组血清混合,37 ℃孵育1 h,将混合物10倍倍比稀释后取100 μL涂布于培养基上,37 ℃培养48 h后进行菌落计数,计算血清杀菌率,血清杀菌率=(1-血清处理后活菌数/初始活菌数)×100%。
1.9 GPS攻毒保护试验二免后第14天,各试验组和PBS对照组的小鼠均采用致死剂量的SH0165菌株(6×109 CFU)进行攻毒,每只小鼠腹腔注射200 μL菌液,攻毒后连续观察一周,记录小鼠的发病状况和死亡情况,绘制小鼠的生存曲线。
1.10 PCV2中和抗体检测PK-15细胞按2×104·孔-1铺于96孔板;各组小鼠血清于56 ℃,30 min灭活后用DMEM培养液从21连续稀释至29;将稀释后的血清和病毒液等体积混合(50 μL: 50 μL),37 ℃孵育1 h;将血清和病毒的混合液接种于PK-15细胞,同时设置PCV2阳性对照和DMEM空白对照,每组重复3个孔,继续孵育2 h;吸去混合液,每孔加入200 μL细胞维持液,继续培养72 h;过氧化物酶单层细胞试验:弃去培养液,PBS洗3遍;加入无水乙醇(100 μL·孔-1),室温固定30 min,PBST洗3遍;加入ddH2O和甲醇(体积比为1 ∶9)(100 μL·孔-1),室温孵育10 min,PBST洗3遍;加入5%的脱脂牛奶(200 μL·孔-1),室温封闭2 h,PBST洗3遍;加入PCV2的猪阳性血清(1 ∶200)(100 μL·孔-1),4 ℃孵育过夜,PBST洗3遍;加入HRP标记的山羊抗猪IgG(1 ∶5 000)(100 μL·孔-1),37 ℃孵育1 h,PBST洗3遍;加入100 μL AEC显色液作用10~20 min,最后置于光学显微镜下计数红色阳性细胞。结果判读:与只接种PCV2阳性对照孔相比,将阳性细胞减少≥50%的血清最高稀释倍数判定为该血清的中和抗体滴度。
1.11 小鼠脏器病毒载量检测二免后第14天采用2×104.5 TCID50的PCV2 CHN SC0413毒株进行腹腔攻毒,于攻毒后7 d采集小鼠的肺和淋巴结,根据TIANGEN组织/细胞/血液基因组提取试剂盒说明书提取组织中的核酸,用PCV2特异性引物(F:5′-CATCTTCAACACCCGCCTCT-3′,R:5′-GCAGGGCCAGAATTCAACCTT-3′),通过荧光定量PCR检测病毒载量,反应体系:采用20 μL反应体系:10 μL qPCR Master Mix,2 μL模板,上、下游引物各0.4 μL,DEPC水7.2 μL。反应程序:95 ℃预变性30 s,95 ℃,10 s;60 ℃,30 s共40个循环;熔解曲线为:95 ℃,15 s;60 ℃,60 s;95 ℃,15 s。
1.12 IFN-γ和IL-12分泌水平检测本研究选择采用IFN-γ和IL-12作为细胞免疫的指标。对二免后7 d分离的各组小鼠血清进行细胞因子IFN-γ和IL-12的测定,参考小鼠细胞因子检测试剂盒说明书,采用双抗体夹心ELISA方法测定各免疫组小鼠血清中IFN-γ和IL-12的水平。
1.13 数据分析本研究使用统计软件SPSS对数据进行分析,采用Graphpad Prism 8.1绘图。数据统计为平均值±标准偏差。数据分析采用t检验分析和单因素方差分析,P < 0.05为有统计学意义(差异显著)。
2 结果 2.1 GPS菌影的制备将109 CFU的菌液与NaOH作用后,通过涂板活菌计数和浑浊度观察检测NaOH处理后细菌的存活情况,结果表明:制备菌影的NaOH最低抑菌浓度为1.25 mg·mL-1,并用该浓度的NaOH作用80 min时未检测到活菌,即制备菌影的最佳时间为80 min,如图 1所示。
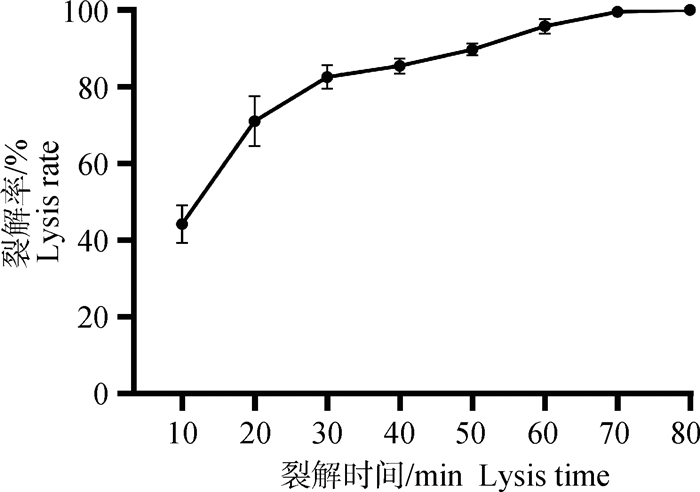
|
图 1 副猪革拉瑟菌与NaOH(1.25 mg·mL-1)作用后裂解曲线 Fig. 1 Lysis curve of G. parasuis after interaction with NaOH(1.25 mg·mL-1) |
菌影鉴定结果显示,未处理的副猪革拉瑟菌(图 2A)保持完整的杆状形态;制备的菌影(图 2B)表面形成了跨膜孔道结构(红色箭头指向),大部分细菌形态未发生明显改变,保持完整杆状。检测菌影基因组排出情况:未处理的GPS基因组保留完整,菌影内部基因组逐渐减少,在第80分钟时基本排尽(图 2C);未处理的GPS上清中无基因组存在,菌影上清检测到明显的DNA条带,由于NaOH对核酸具有裂解作用,上清中的细菌基因组被裂解成了200 bp左右的片段(图 2D)。检测菌影细胞质蛋白排出情况:与未处理的GPS菌体相比,菌影菌体缺乏部分蛋白质(红色箭头指示活菌与菌影蛋白质差异明显条带),表明细胞质的蛋白成功外排到胞外(图 2E);检测上清中蛋白质的情况(图 2F),未处理的GPS培养上清中未检测到蛋白质,而菌影培养的上清中检测到不同大小的蛋白条带,表明在NaOH处理后由于细胞质与外界培养液之间的渗透压,细胞质中的蛋白外排到上清中。
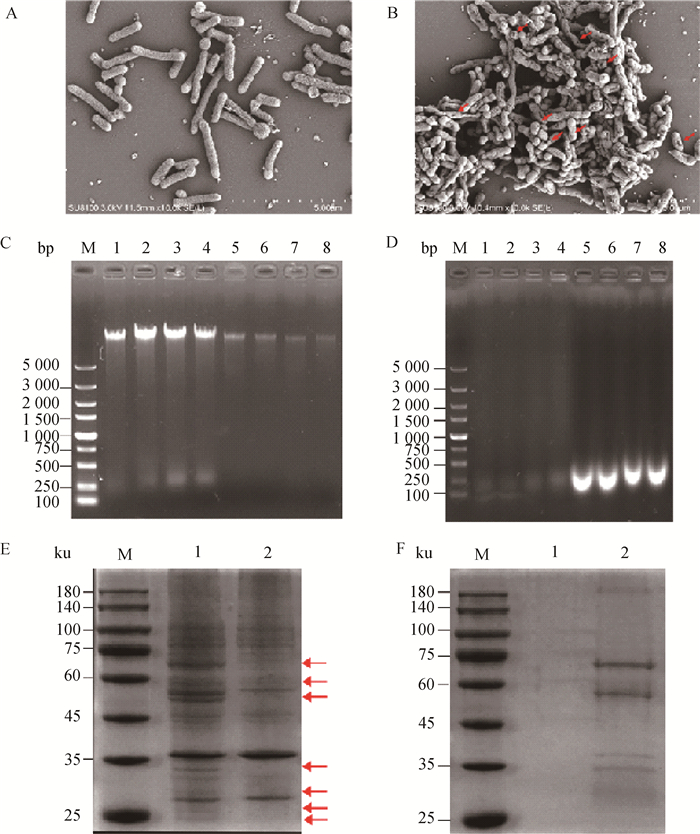
|
A.副猪革拉瑟菌扫描电镜图;B.副猪革拉瑟菌菌影扫描电镜图;C.在第20、40、60和80分钟提取菌体基因组的电泳图(1~4.未处理的GPS;5~8.菌影;M.DNA相对分子质量标准);D.在第20、40、60和80分钟提取上清基因组的电泳图(1~4.未处理的GPS;5~8.菌影;M.DNA相对分子质量标准);E.第80分钟提取菌体总蛋白的SDS-PAGE(1.未处理的GPS;2.菌影;M.蛋白质相对分子质量标准);F.第80分钟提取上清总蛋白的SDS-PAGE(1.未处理的GPS;2.菌影;M.蛋白质相对分子质量标准) A. Scanning electron micrograph of G.parasuis; B. Scanning electron micrograph of G.parasuis ghosts; C. 1% Agarose gel electrophoretic analysis of bacterial genome extracted at the 20th, 40th, 60th and 80th minute (lanes 1-4. Untreated G.parasuis; lanes 5-8. BGs; M. 5 kb marker ladder); D. 1% Agarose gel electrophoretic analysis of supernatant genome extracted at the 20th, 40th, 60th and 80th minute (lanes 1-4. Untreated G.parasuis; lanes 5-8. BGs; M. 5 kb marker ladder); E. 12% SDS-PAGE analysis of total proteins extracted from culture pellets at 80th minutes; F. 12% SDS-PAGE analysis of total proteins extracted from culture supernatants at the 80th minute. (lane 1. Untreated G.parasuis; lane 2. BGs; M. Protein marker) 图 2 副猪革拉瑟菌菌影鉴定 Fig. 2 Identification of G. parasuis ghosts |
通过荧光定量PCR检测LPS、GPS和BG分别与RAW264.7细胞共孵育3、6和9 h后细胞因子的转录水平,结果如图 3所示,促炎性细胞因子IL-1α、IL-1β、IL-6和TNF-α,抗炎性细胞因子IL-10以及促炎性细胞因子诱导的iNOS的转录水平均显著提高,表明菌影和GPS均能激活巨噬细胞分泌促炎和抗炎细胞因子,菌影能够产生与活菌相似的先天性免疫激活反应。
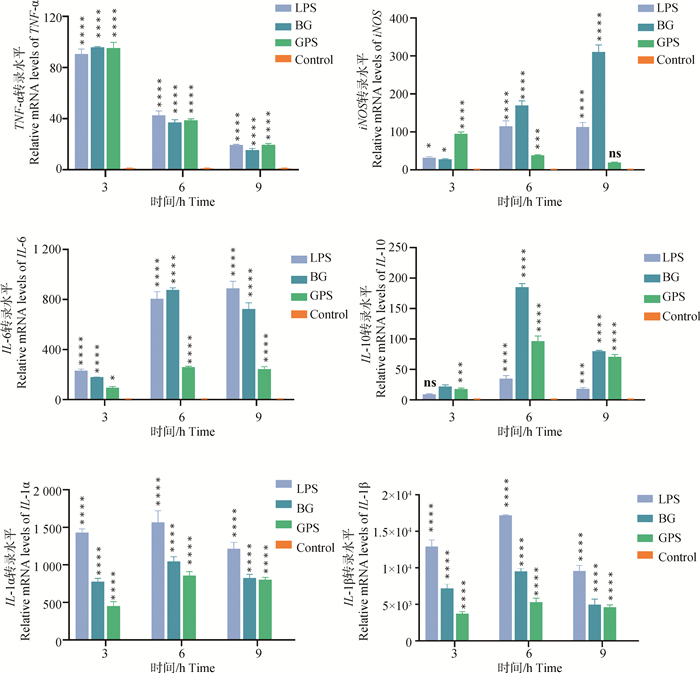
|
*. P < 0.05;**. P < 0.01;***. P < 0.001;****. P < 0.000 1,P值表示各组与对照组的差异性,ns表示无显著差异 *. P < 0.05; **. P < 0.01; ***. P < 0.001; ****. P < 0.000 1, P value indicates the difference between experimental groups and control group. ns means no significant difference 图 3 副猪革拉瑟菌及其菌影刺激RAW264.7细胞促炎和抗炎细胞因子转录水平的检测 Fig. 3 Detection of transcription levels of pro-inflammatory and anti-inflammatory cytokines in RAW264.7 cells stimulated by G.parasuis and G.parasuis ghosts |
结果显示,将PCV2 ORF2基因片段扩增纯化后,在699 bp处出现目的条带(图 4A),与pEGFP-N1质粒连接,转化大肠杆菌DH5α,将鉴定成功的阳性菌液抽取质粒后进行双酶切鉴定,在4 700和699 bp处有两条清晰条带(图 4B),将质粒送往有康生物科技有限公司进行测序,测序比对结果正确;pEGFP-ORF2质粒转染HEK 293 T细胞后,WB鉴定结果如图 4C所示,泳道1在53 ku左右有特异性目的条带,表明pEGFP-ORF2表达成功。

|
A、B. ORF2基因PCR扩增及pEGFP-ORF2双酶切鉴定的电泳图(M. DNA相对分子质量标准;1. pEGFP-ORF2;2.pEGFP-N1空载);C. pEGFP-ORF2在HEK 293T细胞中的过表达鉴定的SDS-PAGE(M.蛋白质相对分子质量标准;1. pEGFP-ORF2;2.pEGFP-N1空载;3.空白细胞对照) A, B. PCR and digestion identification of pEGFP-ORF2 by 1% Agarose gel electrophoretic analysis (M. DNA marker; 1. pEGFP-ORF2; 2. pEGFP-N1); C. 12% SDS-PAGE analysis of identification of pEGFP-ORF2 overexpression in HEK 293T cells (M. Protein marker; 1. pEGFP-ORF2; 2. pEGFP-N1; 3. MOCK) 图 4 重组质粒pEGFP-ORF2的构建与过表达鉴定 Fig. 4 Construction and overexpression identification of the recombinant plasmid pEGFP-ORF2 |
结果如图 5,pEGFP-ORF2装载入GPS菌影(pEGFP-ORF2→BG)转染后的大部分RAW264.7细胞中观察到较强绿色荧光信号,少部分细胞内荧光强度较弱;而pEGFP-ORF2组和MOCK组中RAW264.7细胞未见绿色荧光,说明菌影装载的pEGFP-ORF2在RAW264.7细胞中成功表达,表明PCV2-GPS二联菌影疫苗构建成功。
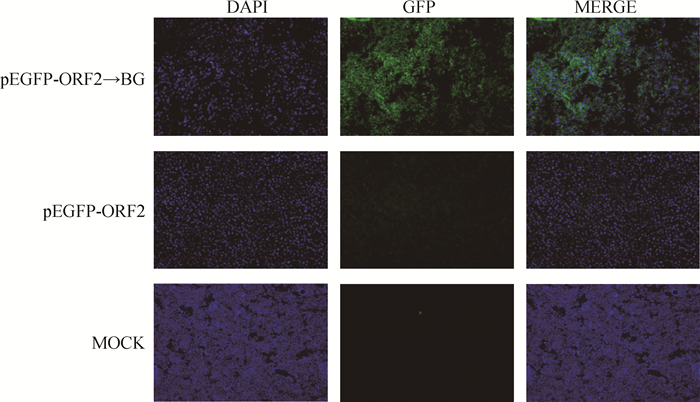
|
图 5 RAW264.7细胞绿色荧光观察(200×) Fig. 5 Green fluorescence observation of RAW264.7 cells(200×) |
每次免疫7 d后的小鼠血清采用间接ELISA方法测定血清中特异性IgG抗体水平。结果如图 6所示,免疫组GPS的抗体水平与PBS组相比(图 6A),小鼠血清中特异性IgG抗体水平显著增高,且在二免后呈增长现象,商品化疫苗组、二联菌影疫苗组和菌影单苗组三组的水平无显著差异。免疫组PCV2的抗体水平与PBS组相比(图 6B),商品化疫苗组和二联菌影疫苗组测定的Cap蛋白抗体水平显著提高,而质粒单苗组的抗体水平在一免后7 d与PBS组相比没有显著差异,在二免后显著提高。
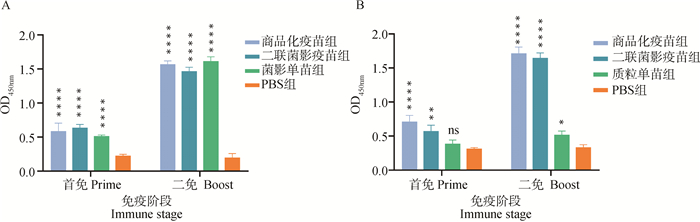
|
A.GPS; B.PCV2。*. P < 0.05;**. P < 0.01;***. P < 0.001;****. P < 0.000 1,P值表示各组与PBS组的差异性,ns表示无显著差异 A.GPS; B.PCV2.*. P < 0.05; **. P < 0.01; ***. P < 0.001; ****. P < 0.000 1, P value indicates the difference between experimental groups and PBS group. ns means no significant difference 图 6 小鼠血清中特异性IgG抗体水平 Fig. 6 Level of IgG in mouse serum |
检测各组小鼠的血清对GPS的杀菌活性,结果显示:未灭活血清组(图 7A)中,商品化疫苗组在一免后对GPS的平均杀菌率达到97.70%,二免后达到99.29%,二联菌影疫苗组和菌影单苗组一免后对GPS的平均杀菌率分别为74.47%和67.62%,二免后达到91.72%和88.04%,PBS组的阴性血清两次免疫后对GPS的平均杀菌率分别为25.48%和32.83%。灭活血清组(图 7B)中,商品化疫苗组在一免后对GPS的平均杀菌率达到64.58%,二免后达到87.79%,二联菌影疫苗组和菌影单苗组一免后对GPS的平均杀菌率分别为27.92%和29.70%,二免后分别达到70.34%和66.29%,PBS组的阴性血清两次免疫后对GPS的平均杀菌率分别为12.92%和23.53%。
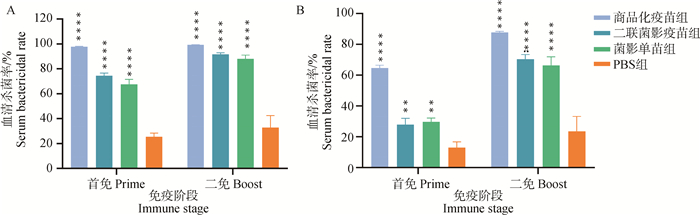
|
A. 未灭活血清;B. 灭活血清。*. P < 0.05;**. P < 0.01;***. P < 0.001;****. P<0.000 1,P值表示各组与PBS组的差异性 A. Uninactivated serum; B. Inactivated serum. *. P < 0.05; **. P < 0.01; ***. P < 0.001; ****. P<0.000 1, P value indicates the difference between experimental groups and PBS group 图 7 血清杀菌试验 Fig. 7 Serum bactericidal assay |
采用致死剂量的SH0165菌株腹腔攻毒,小鼠生存曲线如图 8,PBS组所有小鼠均在12 h内死亡,病程短,发病急;商品化疫苗组存活率为90%(9/10),二联菌影疫苗组和菌影单苗组的小鼠存活率均为70%(7/10)。
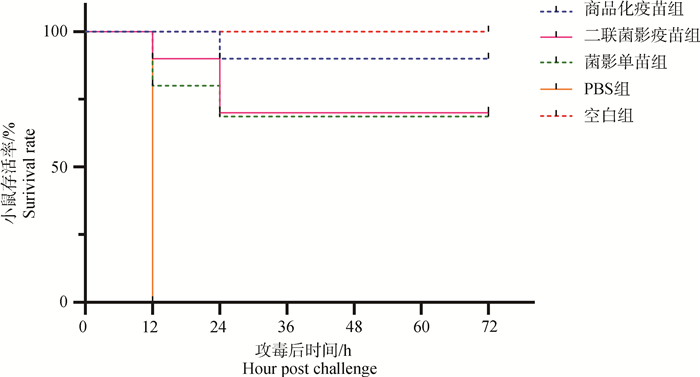
|
图 8 小鼠的生存曲线 Fig. 8 The Survival rate of mice |
分别检测各组小鼠首免后第7天和二免后第7、第14天血清中PCV2中和抗体水平,结果见图 9:首免后第7天、二免后第7天中和抗体水平为商品化疫苗组和二联菌影疫苗组最高且没有显著差异,均大于质粒单苗组,而PBS组未检测到PCV2中和抗体,二免后第14天中和抗体水平从高到低依次为商品化疫苗组、二联菌影疫苗组、质粒单苗组,PBS组未检测到PCV2中和抗体。
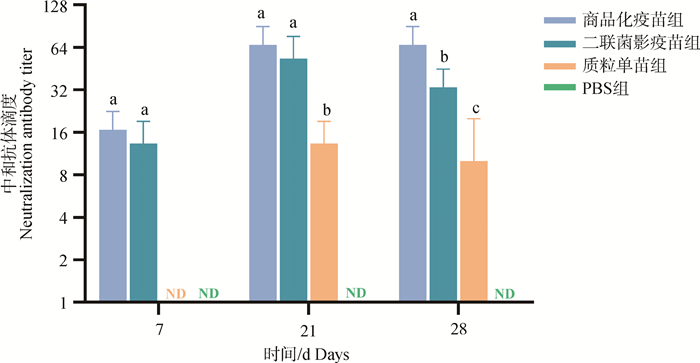
|
不同字母(a、b和c)代表相同时间点各组间差异显著(P < 0.05),ND表示没有检测到中和抗体 Different letters (a, b and c) represent statistically significant differences between the indicated groups at the same time point (P < 0.05). ND indicates that neutralization antibody is not detected 图 9 PCV2中和抗体水平 Fig. 9 The level of PCV2 neutralization antibody |
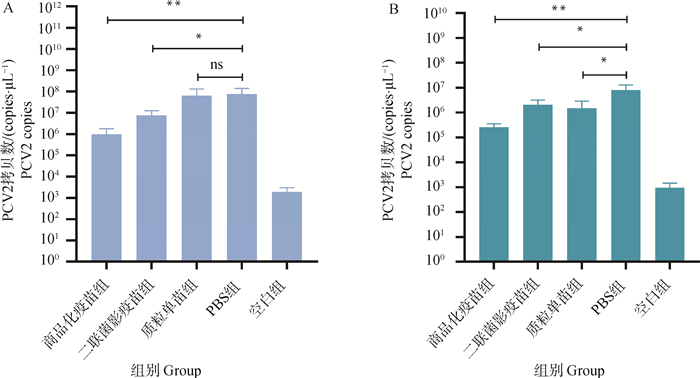
PCV2攻毒小鼠后在第7 d采集小鼠的淋巴结、肺,检测各组小鼠组织脏器中的病毒载量,结果如图 10所示,商品化疫苗组和二联菌影疫苗组小鼠淋巴结和肺病毒载量与PBS组相比均显著降低。
|
A.淋巴结; B.肺。*. P < 0.05;**. P < 0.01;P值表示各组与空白组的差异性,ns表示无显著差异 A.Lymphnode; B.Lung. *. P < 0.05; **. P < 0.01; P value indicates the difference between experimental groups and blank group. ns means no significant difference 图 10 PCV2病毒载量分析 Fig. 10 Viral Load Analysis of PCV2 |
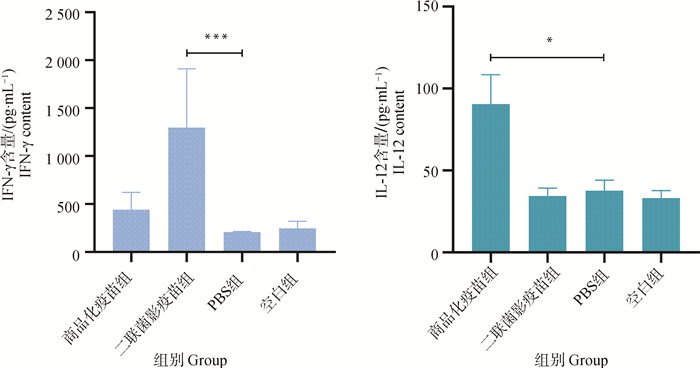
测定各组小鼠血清中IFN-γ和IL-12的水平,结果见图 11,二联菌影疫苗组小鼠血清中分泌了高水平的IFN-γ,商品化疫苗组小鼠血清中IL-12水平较高,其它组与空白组小鼠相比,没有显著性差异,表明PCV2-GPS二联菌影疫苗能够通过Th1型免疫反应分泌IFN-γ来激活细胞免疫,且与商品化疫苗激活的细胞免疫的机制存在差异。
|
*. P < 0.05;**. P < 0.01;***. P < 0.001;P值表示各组与PBS组的差异性 *. P < 0.05; **. P < 0.01; ***. P < 0.001; P value indicates the difference between experimental groups and PBS group 图 11 小鼠血清中IFN-γ、IL-12的含量 Fig. 11 Level of IFN-γ and IL-12 in serum of mice |
随着现代养猪场的规模化和集约化,PCV2和GPS常混合感染,对二者的防控压力巨大,目前,关于PCV2和GPS联合疫苗的研究报道较少,随着现代养殖业的不断发展,减抗限抗政策的实施,因此为了减少猪群免疫压力、促进猪的生长发育健康、提升猪场养殖效益,研发新型安全高效的PCV2、GPS联合疫苗具有重要意义。
本研究选择NaOH制备GPS菌影疫苗,相较于传统的甲醛灭活,NaOH灭活更加温和,抗原保持更完整,安全性也更高,是制备菌影的最佳化合物之一[21]。副猪革拉瑟菌5型是国内主要流行的血清型[22],因此选择5型高毒力菌株SH0165作为疫苗株,同时SH0165作为常用的模式菌株,对其毒力和免疫原性的研究非常广泛,已知SH0165菌株的多种外膜蛋白对小鼠或仔猪均能产生较好的保护作用[23-24],而菌影保留了完整的细菌外膜,且没有细菌内部无效抗原的干扰,能够诱导更高水平的中和抗体。DNA疫苗能够引发细胞毒性T细胞应答,还可以激活B细胞产生抗体,诱导机体的细胞免疫应答和体液免疫应答[25]。本研究采用皮下免疫,通过菌影递送DNA疫苗的方式,使其不会受到皮下DNA酶的影响,使DNA疫苗在机体内缓慢释放,持续刺激机体的免疫应答。佐剂是疫苗重要的组成部分,常用的猪用疫苗佐剂包括油性佐剂和水佐剂等[26],本研究未使用佐剂,因为菌影具有佐剂特性,将菌影作为pEGFP-ORF2核酸疫苗的载体,不仅弥补了DNA疫苗免疫效果差的缺陷,同时也降低了疫苗成本。
在评价二联菌影疫苗针对PCV2的免疫保护效果中,免疫PCV2-GPS二联菌影疫苗的小鼠PCV2血清IgG抗体水平和中和抗体水平都优于单独免疫pEGFP-ORF2质粒,攻毒后的病毒载量也低于PBS攻毒组,说明菌影作为pEGFP-ORF2的载体增强了其免疫保护效果,但免疫效果略低于商品化疫苗,分析其原因:1.通过基因序列比对分析,商品化疫苗的PCV2疫苗株SH株与本研究的PCV2 CHN SC0413分离株基因序列略有差异,其中全基因序列差异性有0.8%,ORF2基因序列差异性有1.1%,两者在基因上的微弱差异可能是导致二联菌影疫苗保护效果略低于商品化疫苗的原因;2.二者是不同类型的疫苗(商品化为灭活苗,本研究为核酸疫苗),选择免疫剂量的标准不同,使其在体内产生的免疫反应程度不同,导致最后呈现的保护效果略有差异。免疫二联菌影疫苗的小鼠血清中IFN-γ的水平显著上调,IFN-γ是疫苗诱导细胞免疫应答的重要因子,也在诱导抗病毒免疫中起着重要作用[27]。而商品化疫苗组IL-12显著上调,IFN-γ没有显著变化,说明二联菌影疫苗通过Th1型免疫反应分泌IFN-γ来激活细胞免疫,且与商品化疫苗激活的细胞免疫的机制存在差异。在评价针对GPS的免疫保护效果中,二联菌影疫苗的免疫效果稍逊于商品化疫苗,因为二联菌影疫苗未使用佐剂,而商品化疫苗采用了水佐剂,佐剂增强了商品化疫苗的免疫保护效果,因此在采用5型高毒力菌株攻毒后,商品化疫苗为小鼠提供了更好的保护。总的来说,PCV2-GPS二联菌影疫苗对感染PCV2和GPS的小鼠能够提供较好的免疫保护,但在猪体上的免疫保护作用还有待验证,因此本研究后续会持续优化该疫苗的制备工艺、免疫方式等因素,并在猪体上开展相关试验的研究。
4 结论成功构建PCV2-GPS二联菌影疫苗,并用此苗在BALB/c小鼠模型上进行免疫和攻毒保护试验,证明该苗显著激活了小鼠对PCV2和GPS的体液免疫反应和细胞免疫反应,且能够抑制PCV2在小鼠体内的增殖,对感染GPS的小鼠达到较好的保护效果。
| [1] |
MUKHERJEE P, KARAM A, CHAKRABORTY A K, et al. Identification of a novel cluster of PCV2 isolates from Meghalaya, India indicates possible recombination along with changes in capsid protein[J]. Infect Genet Evol, 2019, 71: 7-15. DOI:10.1016/j.meegid.2019.02.026 |
| [2] |
CHEN S, LI X, ZHANG L Y, et al. Phylogenetic and structural analysis of porcine circovirus type 2 from 2016 to 2021 in Jilin Province, China[J]. Microorganisms, 2023, 11(4): 983. DOI:10.3390/microorganisms11040983 |
| [3] |
莫荣君. 猪圆环病毒病的流行病学分析及防控措施[J]. 畜禽业, 2020, 31(8): 91-92. MO R J. Epidemiological analysis and prevention measures of porcine circovirus disease[J]. Livestock and Poultry Industry, 2020, 31(8): 91-92. (in Chinese) |
| [4] |
代科. 副猪嗜血杆菌PotD蛋白的毒力相关性及其通过TLR4诱导先天性免疫的通路研究[D]. 雅安: 四川农业大学, 2020. DAI K. Studies on virulence regulation and innate immunity pathway of Glaesserella parasuis polyamine transporter PotD[D]. Yaan: Sichuan Agricultural University, 2020. (in Chinese) |
| [5] |
陈娟. 副猪嗜血杆菌贵州株的分离鉴定及生物学特性研究[D]. 贵阳: 贵州大学, 2020. CHEN J. Isolation, identification and biological characteristics research of Haemophilus parasuis Guizhou strain[D]. Guiyang: Guizhou University, 2020. (in Chinese) |
| [6] |
何绿琴, 闫雪锋, 文心田, 等. 副猪嗜血杆菌qseB、qseC双基因缺失株的构建及生物学特性[D]. 畜牧兽医学报, 2022, 53(2): 529-537. HE L Q, YAN X F, WEN X T, et al. Construction and biological characteristic of Glaesserella parasuis strain with qseB, qseC double gene deletion[D]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(2): 529-537. (in Chinese) |
| [7] |
吕茂杰. 猪圆环病毒2型-猪肺炎支原体-副猪嗜血杆菌三联灭活疫苗的研制[D]. 长春: 吉林大学, 2022. LV M J. Development of the triple inactivated vaccine against porcine circovirus type 2, Mycoplasma hyopneumoniae and Haemophilus parasuis[D]. Changchun: Jilin University, 2022. (in Chinese) |
| [8] |
BATAH A M, AHMAD T A. The development of ghost vaccines trials[J]. Expert Rev Vaccines, 2020, 19(6): 549-562. DOI:10.1080/14760584.2020.1777862 |
| [9] |
SALEH N, MAHMOUD H E, ELTAHER H, et al. Prodigiosin-functionalized probiotic ghosts as a bioinspired combination against colorectal cancer cells[J]. Probiotics Antimicrob Proteins, 2023, 15(5): 1271-1286. DOI:10.1007/s12602-022-09980-y |
| [10] |
HAJAM I A, DAR P A, WON G, et al. Bacterial ghosts as adjuvants: mechanisms and potentia[J]. Vet Res, 2017, 48(1): 37. DOI:10.1186/s13567-017-0442-5 |
| [11] |
SOLEYMANI S, TAVASSOLI A, HASHEMI TABAR G, et al. Design, development, and evaluation of the efficacy of a nucleic acid-free version of a bacterial ghost candidate vaccine against avian pathogenic E. coli (APEC) O78:K80 serotype[J]. Vet Res, 2020, 51(1): 144. DOI:10.1186/s13567-020-00867-w |
| [12] |
HARISA G I, SHERIF A Y, YOUSSOF A M E, et al. Bacteriosomes as a promising tool in biomedical applications: immunotherapy and drug delivery[J]. AAPS PharmSciTech, 2020, 21(5): 168. DOI:10.1208/s12249-020-01716-x |
| [13] |
WEN J, YANG Y, ZHAO G Y, et al. Salmonella typhi Ty21a bacterial ghost vector augments HIV-1 gp140 DNA vaccine-induced peripheral and mucosal antibody responses via TLR4 pathway[J]. Vaccine, 2012, 30(39): 5733-5739. DOI:10.1016/j.vaccine.2012.07.008 |
| [14] |
VINOD N, NOH H B, OH S, et al. A Salmonella typhimurium ghost vaccine induces cytokine expression in vitro and immune responses in vivo and protects rats against homologous and heterologous challenges[J]. PLoS One, 2017, 12(9): e0185488. DOI:10.1371/journal.pone.0185488 |
| [15] |
LI S Y, WANG D, GUO C Y, et al. Study on preparation of a Streptococcus suis ghost vaccine[J]. Microb Pathog, 2021, 154: 104865. DOI:10.1016/j.micpath.2021.104865 |
| [16] |
王丹丹, 倪艳秀, 祝昊丹, 等. 应用NaOH制备胸膜肺炎放线杆菌菌影方法的建立[J]. 中国兽医科学, 2017, 38(8): 999-1004. WANG D D, NI Y X, ZHU H D, et al. Establishment of a novel preparation method for Actinobacillus pleuropneumoniae ghost by sodium hydroxide[J]. Chinese Veterinary Science, 2017, 38(8): 999-1004. (in Chinese) |
| [17] |
JI S, MOON E S, NOH H B, et al. Protective immunity against Listeria monocytogenes in rats, provided by HCl- and NaOH-induced Listeria monocytogenes bacterial ghosts (LMGs) as vaccine candidates[J]. Int J Mol Sci, 2022, 23(4): 1946. DOI:10.3390/ijms23041946 |
| [18] |
VINOD N, OH S, PARK H J, et al. Generation of a novel Staphylococcus aureus ghost vaccine and examination of its immunogenicity against virulent challenge in rats[J]. Infect Immun, 2015, 83(7): 2957-2965. DOI:10.1128/IAI.00009-15 |
| [19] |
PORTER K R, RAVIPRAKASH K. DNA vaccine delivery and improved immunogenicity[J]. Curr Issues Mol Biol, 2017, 22: 129-138. |
| [20] |
SYLLA S, CONG Y L, SUN Y X, et al. Protective immunity conferred by porcine circovirus 2 ORF2-based DNA vaccine in mice[J]. Microbiol Immunol, 2014, 58(7): 398-408. DOI:10.1111/1348-0421.12158 |
| [21] |
WU X Y, JU X R, DU L H, et al. Production of bacterial ghosts from gram-positive pathogen Listeria monocytogenes[J]. Foodborne Pathog Dis, 2017, 14(1): 1-7. DOI:10.1089/fpd.2016.2184 |
| [22] |
WANG Z H, ZHAO Q, WEI H L, et al. Prevalence and seroepidemiology of Haemophilus parasuis in Sichuan province, China[J]. PeerJ, 2017, 5: e3379. DOI:10.7717/peerj.3379 |
| [23] |
FU S L, ZHANG M M, XU J, et al. Immunogenicity and protective efficacy of recombinant Haemophilus parasuis SH0165 putative outer membrane proteins[J]. Vaccine, 2013, 31(2): 347-353. DOI:10.1016/j.vaccine.2012.11.003 |
| [24] |
YUAN F Y, FU S L, HU J, et al. Evaluation of recombinant proteins of Haemophilus parasuis strain SH0165 as vaccine candidates in a mouse model[J]. Res Vet Sci, 2012, 93(1): 51-56. DOI:10.1016/j.rvsc.2011.04.020 |
| [25] |
周鹏. 鹦鹉热衣原体MOMP、MIP重组核酸菌影疫苗的免疫保护作用[D]. 衡阳: 南华大学, 2018. ZHOU P. Immunoprotective effects of recombinant E. coli ghosts expressing Chlamydia psittaci MOMP and MIP[D]. Hengyang: University of South China, 2018. (in Chinese) |
| [26] |
CHARERNTANTANAKUL W. Adjuvants for swine vaccines: mechanisms of actions and adjuvant effects[J]. Vaccine, 2020, 38(43): 6659-6681. |
| [27] |
周伃欣, 何久香, 全纹萱, 等. 登革病毒多价DNA疫苗构建及免疫保护效果验证[J]. 免疫学杂志, 2023, 39(1): 70-77. ZHOU Y X, HE J X, QUAN W X, et al. Construction and immune protection verification of dengue virus multivalent DNA vaccine[J]. Immunological Journal, 2023, 39(1): 70-77. (in Chinese) |
(编辑 白永平)



