2. 西北农林科技大学动物医学院, 杨凌 712100;
3. 塔里木大学动物科学与技术学院, 阿拉尔 843300
2. College of Veterinary Medicine, Northwest A & F University, Yangling 712100, China;
3. College of Animal Science and Technology, Tarim University, Alaer 843300, China
由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)感染所致的猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS)是除非洲猪瘟(African swine fever, ASF)外最重要的猪病毒性传染病之一[1]。PRRSV是套式病毒目(Nidovirales),动脉炎病毒科(Arterivirus),动脉炎病毒属(Arteriviridae family)的有包膜的单股正链RNA病毒[2]。根据基因组差异可将PRRSV分为基因Ⅰ型(欧洲型)和基因Ⅱ型(美洲型),我国主要流行基因Ⅱ型PRRSV[3]。PRRSV基因组长度约为15 000个核苷酸(nt),由5’端甲基化帽子结构、重叠的开放性阅读框(open reading frame, ORF)和3′端多聚腺苷酸(Poly A)尾巴组成[4],编码16种非结构蛋白和8种结构蛋白[5]。
PRRSV基质蛋白(membrane protein, M protein)是由ORF6基因编码的非糖基化Ⅲ类膜蛋白,相对分子质量为18~19 ku[6]。Ⅰ型PRRSV和Ⅱ型PRRSV的M蛋白分别由173和174个氨基酸残基组成,包含一个由16个氨基酸残基组成的短N末端外结构域、三个跨膜结构域和一个由84个氨基酸残基组成的C末端内结构域[7]。非糖基化M蛋白的氨基酸序列在PRRSV中保守性最高[8],其在欧洲型和美洲型毒株间的相似性为75.2%~81.6%[7]。M蛋白是PRRSV的主要结构蛋白,M蛋白可与PRRSV GP5蛋白通过二硫键形成异源二聚体,在PRRSV侵入宿主完成病毒组装后出芽的过程中发挥重要的作用[9]。PRRSV进入细胞首先通过其M蛋白与硫酸乙酰肝素蛋白聚糖结合,随后PRRSV GP5蛋白被唾液黏附素(CD169)识别,促使病毒吸附在细胞上[10]。PRRSV M蛋白免疫原性较强[11],其抗原表位也被表征[6, 12-13]。
有研究发现删除M蛋白后不能产生具有感染性的PRRSV病毒粒子[14],这表明M蛋白对于PRRSV完成生命周期发挥不可或缺的作用。深入探究M蛋白的生物学功能对于解析PRRSV致病机制,开发有效的PRRS防控产品等具有重要意义。体外高效表达M蛋白是探究M蛋白功能的重要手段,然而利用真核瞬时转染方式表达M蛋白成功率较低且表达量不高,限制了对M蛋白生物学功能的进一步探究。因此,本研究利用慢病毒包装系统成功构建了稳定表达PRRSV M蛋白的MARC-145ORF6细胞系,评估了过表达M蛋白对细胞系Ⅰ型干扰素相关基因的影响,进一步探究了其对PRRSV复制的影响,以期为进一步研究M蛋白的生物学功能提供重要的生物材料和研究基础。
1 材料与方法 1.1 细胞、质粒和病毒非洲绿猴胚胎肾细胞(MARC-145)和人胚胎肾细胞(HEK293T)由本实验室保存;MARC-145Flag细胞系为本实验室前期通过慢病毒包装系统构建(Flag标签沉默,利用嘌呤霉素抗性基因筛选获得);慢病毒表达载体Lenti-CMV-Puro-Flag、包装质粒psPAX2和包膜质粒pMD2G均由本实验室保存;PRRSV SD-YL1712毒株(MT708500.1)和仙台病毒(Sendai virus, SeV)均由本实验室保存;PRRSV SD-YL1712毒株全基因组感染性克隆质粒[15]由本实验室构建并保存。
1.2 主要材料和试剂PrimeSTAR® GXL DNA Polymerase和限制性核酸内切酶购自宝日医生物技术(北京)有限公司;ClonExpress II One Step Cloning Kit购自南京诺唯赞生物科技股份有限公司;DMEM高糖培养基、Opti-MEM培养基、聚乙烯亚胺转染试剂(PEI)、TRIzolTM Reagent和Goat anti-Mouse IgG (H+L) Secondary Antibody, HRP购自赛默飞世尔科技公司;TransSerum® FQ Fetal Bovine Serum(FBS)购自北京全式金生物技术有限公司;Flag tag Mouse Monoclonal Antibody购自安诺伦(北京)生物科技有限公司;Fluorescein (FITC)-AffiniPure Goat Anti-Mouse IgG (H+L)购自Jackson ImmunoResearch公司;亚细胞结构蛋白提取试剂盒购自生工股份有限公司;CCK-8购自Abmole公司。
1.3 引物设计和合成根据PRRSV SD-YL1712全基因组感染性克隆质粒设计ORF6的特异性扩增引物(ORF6-F和ORF6-R)及鉴定引物(JD-ORF6-F和JD-ORF6-R)。内参基因actin、Ⅰ型干扰素及其调节基因的特异性扩增引物均由北京擎科生物科技股份有限公司西安分公司合成,如表 1所示。
|
|
表 1 引物序列 Table 1 Sequences of primers |
以PRRSV SD-YL1712全基因组感染性克隆质粒为模板,使用表 1中扩增引物ORF6-F和ORF6-R扩增ORF6基因片段。将慢病毒表达载体Lenti-CMV-Puro-Flag用限制性内切酶Nhe Ⅰ和Xho Ⅰ线性化。目的片段和酶切载体经同源重组酶连接,连接产物转化到DH5α感受态细胞,之后将其涂布至含有氨苄抗性的LB固体平板培养基,挑取单克隆菌落进行PCR鉴定。将鉴定正确的阳性菌液送至北京擎科生物科技股份有限公司西安分公司进行测序。测序正确的菌液扩大培养,保菌并提取质粒,获得重组慢病毒质粒Lenti-CMV-Puro-Flag-ORF6,置于-20 ℃保存。
1.5 重组慢病毒质粒Lenti-CMV-Puro-Flag-ORF6的包装将生长状态良好的HEK293T细胞均匀铺到6孔细胞培养板中,待细胞单层密度达到70%~80%,按照PEI转染试剂说明书,将重组慢病毒质粒Lenti-CMV-Puro-Flag-ORF6与辅助质粒psPAX2和pMD2G按1 μg:1 μg:0.5 μg的比例共转染至HEK293T细胞中,转染12 h后更换维持液,继续培养48 h后收集细胞上清,过滤后分装,保存于-80 ℃。
1.6 慢病毒转导及筛选表达M蛋白的MARC-145ORF6细胞系将生长状态良好的MARC-145细胞均匀铺到6孔细胞培养板中,待细胞单层密度达到70%~80%,弃去六孔板中的培养基,加入1 mL重组慢病毒感染液,继续培养,同时设置不转接慢病毒感染液的阴性对照组。慢病毒感染4 h后弃去感染液,更换维持液。96 h后,将培养基更换成预筛选好的含有效浓度嘌呤霉素的细胞生长液以进行筛选;待阴性对照组细胞完全死亡终止筛选,此时获得初筛阳性细胞。将初筛阳性细胞按约1个细胞·孔-1铺到96孔细胞板中,用含有效嘌呤霉素的生长液培养14 d,选取96孔细胞板中生长状态良好的细胞进行扩繁。按照上述方法对扩繁的细胞再进行两次亚克隆纯化筛选并扩大培养,收集细胞样品提取总RNA,反转录成cDNA,利用表 1引物JD-ORF6-F/R进行鉴定。
1.7 细胞活力和生长曲线测定按照CCK8试剂盒说明书测定细胞增殖活力。将MARC-145ORF6细胞系、MARC-145Flag细胞系和MARC-145细胞每孔104个细胞均匀铺至96孔板中,于12、24、36、48和60 h在每孔中加入10 μL CCK8溶液并于37 ℃的5% CO2培养箱反应2 h,使用酶标仪在450 nm波长下测定样品的吸光度以评估细胞增殖情况。
将MARC-145细胞、MARC-145ORF6细胞系和MARC-145Flag细胞系按每孔104个细胞均匀铺至12孔细胞培养板中,利用细胞计数仪,每12 h取3孔细胞消化后计数并取平均值,连续监测96 h,以时间为横坐标,细胞数为纵坐标,绘制MARC-145细胞、MARC-145ORF6细胞系和MARC-145Flag细胞系的生长曲线,比较不同细胞系的生长速度。
1.8 MARC-145ORF6细胞系传代稳定性的鉴定分别利用RT-PCR、Western blot和IFA鉴定MARC-145ORF6细胞系ORF6基因和M蛋白的传代稳定性。收集P1、P5、P10代次MARC-145ORF6细胞系、MARC-145Flag细胞系和MARC-145细胞的细胞样品,首先提取总RNA,反转录得到cDNA。利用表 1中鉴定引物JD-ORF6-F和JD-ORF6-R进行PCR扩增,RT-PCR试验鉴定MARC-145ORF6细胞系ORF6基因的传代稳定性。收集上述细胞样品,加入RIPA进行裂解,5×Loading buffer处理后进行SDS-PAGE,恒压湿法转印至PVDF膜,PVDF膜置于5%脱脂奶粉中室温封闭2 h,Flag单克隆抗体作为一抗室温孵育2 h;HRP标记的Goat anti-Mouse IgG (H+L) Secondary Antibody作为二抗室温孵育1 h,用WesternBright ECL发光底物显色,利用自动凝胶成像系统分析结果,Western blot鉴定MARC-145ORF6细胞系M蛋白的传代稳定性。收集P3、P5、P10代次MARC-145ORF6细胞系、MARC-145Flag细胞系和MARC-145细胞的细胞样品,将上述细胞分别按每孔1×105个细胞均匀铺到96孔板,待细胞长满后用4%多聚甲醛溶液固定15 min,0.25% Trition-X-100溶液破膜15 min,5%脱脂奶粉37 ℃封闭1 h,Flag单克隆抗体作为一抗37 ℃孵育1 h,Fluorescein (FITC)标记的AffiniPure Goat Anti-Mouse IgG (H+L)作为二抗37 ℃孵育1 h,DAPI染色5 min,最后置于荧光显微镜下观察结果,IFA试验鉴定MARC-145ORF6细胞系M蛋白的传代稳定性。
1.9 检测MARC-145ORF6细胞系中M蛋白的亚细胞定位分别收集约1×106个MARC-145ORF6细胞、MARC-145Flag细胞和MARC-145细胞样品,根据亚细胞结构蛋白抽提试剂盒说明书依次提取细胞质蛋白、细胞膜和细胞器膜蛋白及其核蛋白,将分离得到的各蛋白组分进行Western blot,方法如步骤“1.8”所示,分别利用Flag单克隆抗体、ATPase单克隆抗体、Tubulin单克隆抗体和Histone H3单克隆抗体作为一抗进行检测。
1.10 稳定过表达M蛋白的MARC-145ORF6细胞系对Ⅰ型干扰素及调节基因的影响将MARC-145Flag细胞与MARC-145ORF6细胞均匀铺至24孔板中,待单层细胞密度达到80%左右,换成维持液,向孔里加入10 μL仙台病毒(Sendai virus, SeV),12 h后收集细胞样品提取总RNA,反转录的cDNA作为模板,利用表 1中的actin-F/R、mIFNβ-qF/qR、mIFIT1-qF/qR、mIFIT2-qF/qR、mISG15-qF/qR、mMX2-qF/qR和mOAS3-qF/qR引物进行RT-qPCR。
1.11 稳定过表达M蛋白的MARC-145ORF6细胞系对PRRSV增殖能力的影响同时将生长状态良好的MARC-145ORF6细胞系、MARC-145Flag细胞系和MARC-145细胞均匀铺到12孔细胞板中,待单层细胞密度长至70%~80%时按MOI=1接毒PRRSV,2 h后弃去培养基,换成维持液继续培养;收取感染后12 h(hours post infection,hpi)、24 hpi、36 hpi、48 hpi、60 hpi和72 hpi的细胞上清并保存于-80 ℃。将生长状态良好的MARC-145细胞均匀铺至96孔细胞板中,待单层细胞密度长至70%~80%时分别测定上述不同时间点收取上清的病毒滴度,按Karber法计算病毒样品的TCID50并利用GraphPad Prism软件进行数据处理并绘制多步生长曲线,比较PRRSV在三种细胞上生长曲线的异同。
2 结果 2.1 Lenti-CMV-Puro-Flag-ORF6重组慢病毒质粒的构建和鉴定扩增获得ORF6基因片段(图 1A),将其连接至载体上,菌液PCR可见符合预期大小的条带(图 1B)。阳性菌液测序结果经SnapGene软件比对,显示重组质粒无碱基突变,表明重组质粒均构建成功(图 1C)。重组质粒用NheⅠ和XhoⅠ限制性内切酶对质粒进行双酶切鉴定(图 1D)。上述结果表明重组慢病毒质粒Lenti-CMV-Puro-Flag-ORF6构建成功。
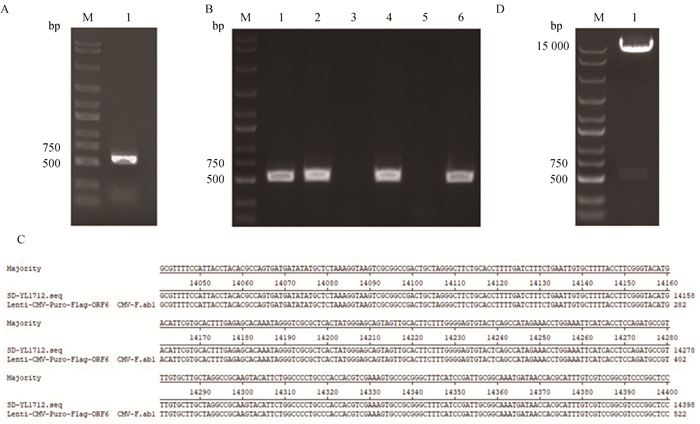
|
A. ORF6基因PCR扩增;B. Lenti-CMV-Puro-Flag-ORF6重组质粒的PCR鉴定;C. Lenti-CMV-Puro-Flag-ORF6阳性菌液测序结果;D. Lenti-CMV-Puro-Flag-ORF6重组质粒酶切鉴定 A. PCR amplification of ORF6 gene; B. PCR identification of Lenti-CMV-Puro-Flag-ORF6 recombinant plasmids; C. Lenti-CMV-Puro-Flag-ORF6 positive bacterial sequencing results; D. Enzyme digestion identification of Lenti-CMV-Puro-Flag-ORF6 recombinant plasmid 图 1 Lenti-CMV-Puro-Flag-ORF6重组慢病毒质粒的构建和鉴定 Fig. 1 Construction and identification of Lenti-CMV-Puro-Flag-ORF6 recombinant lentiviral plasmids |
CCK8试验结果显示,MARC-145ORF6细胞系与MARC-145细胞和MARC-145Flag细胞系的生长活力差异不显著,MARC-145细胞和MARC-145Flag细胞系的生长活力差异不显著(图 2A),表明M蛋白过表达的MARC-145ORF6细胞系细胞活力未受明显影响。进一步绘制MARC-145细胞、MARC-145ORF6细胞系和MARC-145Flag细胞系的生长曲线并比较三者的生长速度,试验结果表明三种细胞系生长速度无明显差异(图 2B)。
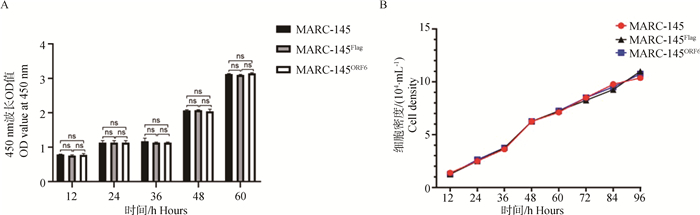
|
A. MARC-145细胞、MARC-145ORF6细胞系、MARC-145Flag细胞系的活力测定;B. MARC-145细胞、MARC-145ORF6细胞系、MARC-145Flag细胞系的生长曲线。ns. P>0.05 A. Determination of viability of MARC-145 cells, MARC-145ORF6 cell line, and MARC-145Flag cell line; B. Growth curves of MARC-145 cells, MARC-145ORF6 cell line, and MARC-145Flag cell line. ns. P>0.05 图 2 M蛋白稳定过表达对MARC-145细胞活力和生长速度的影响 Fig. 2 Effects of stable overexpression of M protein on viability and growth rate of MARC-145 cells |
RT-PCR结果显示P1、P5、P10代次的MARC-145ORF6细胞系均可扩增出符合预期大小的单一条带(图 3A),Western blot结果可见到大小约为18 ku的清晰条带(图 3B),IFA结果显示在倒置荧光显微镜下可以观察到MARC-145Flag细胞系和MARC-145细胞没有阳性荧光信号,P3、P5、P10代次的MARC-145ORF6细胞可观察到明显的阳性荧光信号(图 3C),以上结果表明MARC-145ORF6细胞系稳定表达ORF6基因和M蛋白。
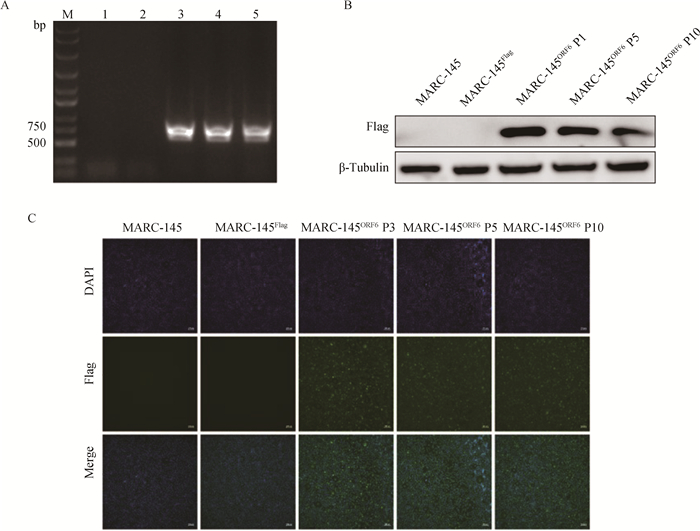
|
A. RT-PCR检测MARC-145ORF6细胞系P1、P5、P10代次中ORF6基因表达情况;B. Western blot检测MARC-145ORF6细胞系P1、P5和P10代次中M蛋白表达情况;C. IFA检测MARC-145ORF6细胞系P3、P5和P10代次中M蛋白表达情况;M.DNA相对分子质量标准;1. MARC-145细胞;2. MARC-145Flag细胞系;3~5. MARC-145ORF6细胞系P1、P5和P10代次 A. The expression of ORF6 gene in P1, P5 and P10 generations of MARC-145ORF6 cell line was detected by RT-PCR; B. The expression of ORF6 gene in P1, P5 and P10 generations of MARC-145ORF6 cell line was detected by Western blot; C. IFA detected ORF6 gene expression in the P3, P5 and P10 passages of MARC-145ORF6 cell line; M. DNA relative molecular mass standard; 1. MARC-145 cells; 2. MARC-145Flag cell line; 3-5. P1, P5 and P10 generations of MARC-145ORF6 cell lines 图 3 MARC-145ORF6细胞系传代稳定性的鉴定 Fig. 3 Identification of passage stability of the MARC-145ORF6 cell line |
分别对抽提的细胞质蛋白、细胞膜和细胞器膜蛋白及其核蛋白进行Western blot检测,结果显示M蛋白主要定位在MARC-145ORF6细胞系的膜蛋白上(图 4B)。
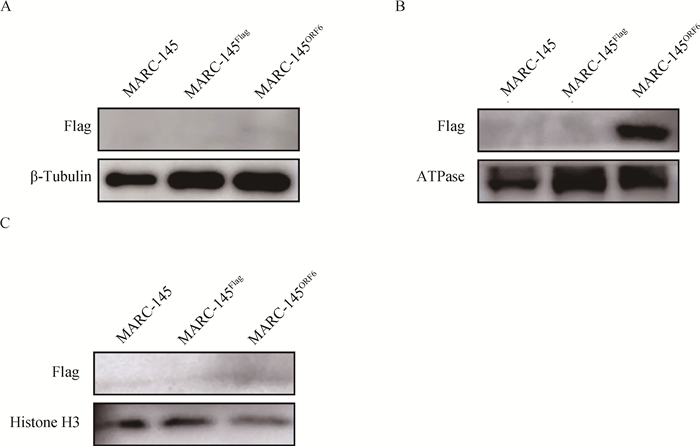
|
A. MARC-145ORF6细胞系细胞质蛋白中M蛋白的表达情况;B. MARC-145ORF6细胞系细胞膜和细胞器膜蛋白中M蛋白的表达情况;C. MARC-145ORF6细胞系核蛋白中M蛋白的表达情况 A. Expression of M protein in cytoplasmic protein of MARC-145ORF6 cell line; B. Expression of M protein in membrane and organelle membrane proteins of MARC-145ORF6 cell line; C. Expression of M protein in nuclear protein of MARC-145ORF6 cell line 图 4 MARC-145ORF6细胞系中M蛋白的亚细胞定位 Fig. 4 Subcellular localization of M protein in MARC-145ORF6 cell line |
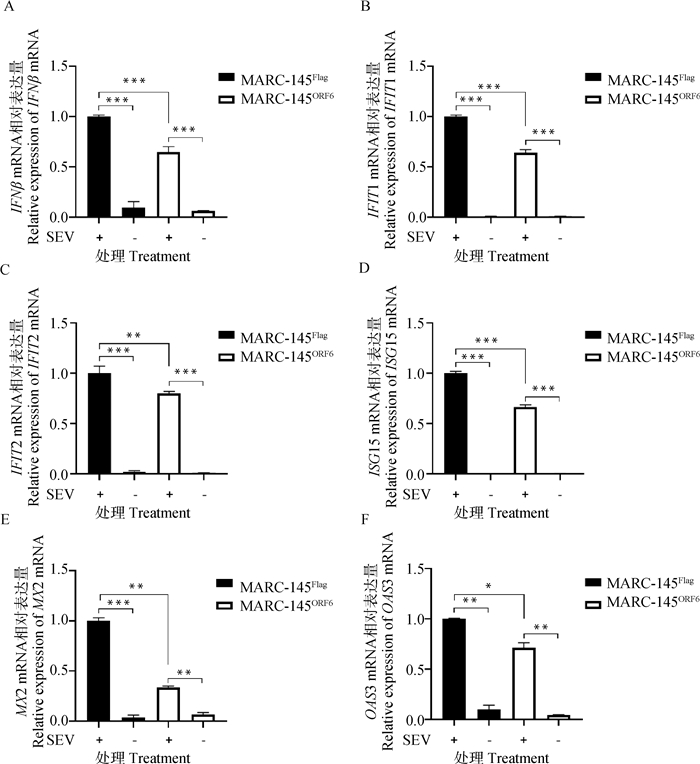
RT-qPCR结果显示(图 5),MARC-145ORF6细胞系的IFNβ、IFIT1、IFIT2、ISG15、MX2和OAS3的mRNA水平均显著低于MARC-145Flag细胞系,表明稳定过表达M蛋白显著下调了MARC-145ORF6细胞系的Ⅰ型干扰素及其相关调节基因水平。
|
A.IFNβ的mRNA表达水平;B. IFIT1的mRNA表达水平;C. IFIT2的mRNA表达水平;D.ISG15的mRNA表达水平;E. MX2的mRNA表达水平;F. OAS3的mRNA表达水平;*.P < 0.05, **.P < 0.001, ***.P < 0.001 A. mRNA expression level of IFNβ; B. mRNA expression level of IFIT1; C. mRNA expression level of IFIT2; D. mRNA expression level of ISG15; E. mRNA expression level of MX2; F. mRNA expression level of OAS3; *.P < 0.05, **.P < 0.001, ***.P < 0.001 图 5 稳定过表达M蛋白的MARC-145ORF6细胞系对Ⅰ型干扰素的影响 Fig. 5 Effect of stable overexpressing M-protein MARC-145ORF6 cell line on type Ⅰ interferons |
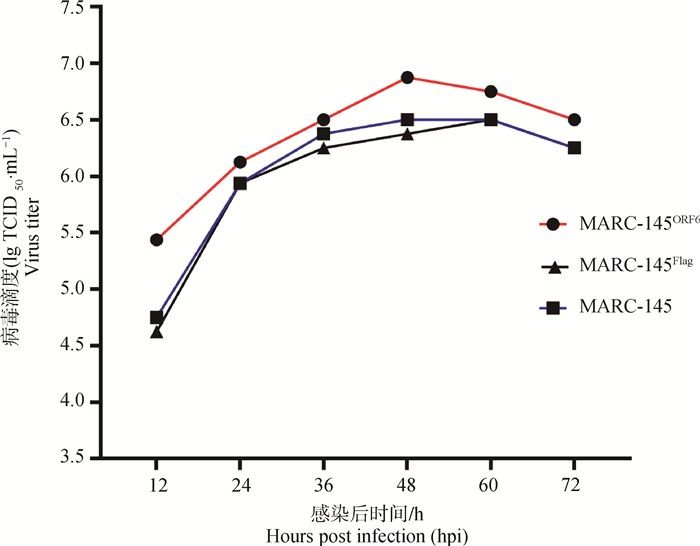
多步生长曲线(图 6)结果显示,PRRSV在MARC-145ORF6细胞系的病毒载量峰值为106.875TCID50·mL-1,出现在48 hpi;PRRSV在MARC-145Flag细胞系和MARC-145细胞上的病毒载量的峰值为106.5 TCID50·mL -1,均出现在48 hpi;结果显示相比于MARC-145Flag细胞系和MARC-145细胞,MARC-145ORF6细胞系各个时间点的病毒滴度均更高,表明过表达M蛋白的MARC-145ORF6细胞系对PRRSV的增殖有促进作用。
|
图 6 PRRSV在MARC-145细胞、MARC-145ORF6细胞系和MARC-145Flag细胞系上的多步生长曲线 Fig. 6 Multistep growth curves of PRRSV on MARC-145 cell line, MARC-145ORF6 cell line and MARC-145Flag cell line |
PRRS是一种严重危害世界猪业经济的传染病,最早于1987年在美国发现[16],由于其传播能力强、速度快以及流行范围广泛,在欧洲和美国迅速传播开来[17]。目前PRRS的商用疫苗免疫效果欠佳[18],PRRSV对猪产生持续性感染导致病毒在猪群中长期存在,而且PRRS在养殖场中常继发混合感染[19-21],使得猪的死亡率升高,这些问题都给PRRS的防控带来了艰巨的任务,并且严重危害我国畜牧业的发展[22]。
本实验室前期研究发现,构建高效表达PRRSV结构蛋白的真核质粒难度较大,其中表达PRRSV M蛋白的真核质粒在瞬时转染后难以表达或表达量很低,不利于开展针对M蛋白的生物学功能的研究。因此,本研究利用慢病毒包装系统,将编码PRRSV M蛋白的ORF6基因高效整合至宿主细胞染色体上,以实现外源基因的稳定和持久表达,最终成功建立稳定表达PRRSV M蛋白的MARC-145ORF6细胞系,为进一步研究M蛋白的生物学功能提供了重要试验材料。
天然免疫系统是机体抵抗外界病原体的第一道防线,干扰素是早期免疫应答的重要成员,病毒侵入机体激活干扰素基因进而可以发挥抗病毒作用。然而,PRRSV是一种免疫抑制性病原体,尤其可抑制Ⅰ型干扰素产生。目前已鉴定出6种PRRSV病毒蛋白作为干扰素拮抗剂,包括非结构蛋白nsp1α、nsp1β、nsp2、nsp4、nsp11以及结构蛋白N[23],但关于其他病毒蛋白是否发挥免疫抑制功能的研究较少,鉴定新的免疫抑制分子对于阐明PRRSV致病机制和研发新型PRRS疫苗具有重要意义。因此,本研究在获得稳定表达PRRSV M蛋白细胞系的基础上,着重关注了其是否影响了干扰素通路和病毒复制。随后,本研究发现过表达PRRSV M蛋白可抑制MARC-145ORF6细胞系的Ⅰ型干扰素基因及其相关调控基因表达且促进PRRSV复制,表明编码M蛋白的ORF6基因可能是PRRSV潜在的干扰素抑制基因,为进一步深入研究M蛋白的生物学功能和解析PRRSV免疫抑制机制提供了新的研究思路。
4 结论本研究应用慢病毒包装系统结合嘌呤霉素筛选获得稳定过表达PRRSV M蛋白的MARC-145ORF6细胞系,且PRRSV ORF6基因的插入对MARC-145细胞生长无显著影响。进一步研究发现MARC-145ORF6细胞系的Ⅰ型干扰素水平显著下调且促进PPRSV复制,表明ORF6可能是PRRSV潜在的免疫抑制基因,为深入解析PRRSV免疫抑制机制提供了新的研究思路。本研究构建的MARC-145ORF6细胞系为进一步研究PRRSV M蛋白的生物学功能提供了重要的生物材料。
| [1] |
杨汉春, 周磊. 2022年猪病流行情况与2023年流行趋势及防控对策[J]. 猪业科学, 2023, 40(2): 58-60. YANG H C, ZHOU L. The epidemic situation of swine disease in 2022 and the epidemic trend and prevention and control measures in 2023[J]. Swine Industry Science, 2023, 40(2): 58-60. (in Chinese) |
| [2] |
FENG Y T, GUO X Y, TIAN H, et al. Induction of HOXA3 by porcine reproductive and respiratory syndrome virus inhibits type Ⅰ interferon response through negative regulation of HO-1 transcription[J]. J Virol, 2022, 96(3): e0186321. DOI:10.1128/JVI.01863-21 |
| [3] |
JIANG Y F, LI G X, YU L X, et al. Genetic diversity of porcine reproductive and respiratory syndrome virus (PRRSV) from 1996 to 2017 in China[J]. Front Microbiol, 2020, 11: 618. DOI:10.3389/fmicb.2020.00618 |
| [4] |
LI Y, JIAO D, JING Y, et al. Genetic characterization and pathogenicity of a novel recombinant PRRSV from lineage 1, 8 and 3 in China failed to infect MARC-145 cells[J]. Microb Pathog, 2022, 165: 105469. DOI:10.1016/j.micpath.2022.105469 |
| [5] |
ZHENG Z F, FU X L, LING X, et al. Host cells actively resist porcine reproductive and respiratory syndrome virus infection via the IRF8-MicroRNA-10a-SRP14 regulatory pathway[J]. J Virol, 2022, 96(7): e0000322-22. DOI:10.1128/jvi.00003-22 |
| [6] |
王梦婕, 张杰, 孙杨杨, 等. 猪繁殖与呼吸综合征病毒M蛋白单克隆抗体制备及抗原表位鉴定[J]. 畜牧与兽医, 2022, 54(6): 91-96. WANG M J, ZHANG J, SUN Y Y, et al. Monoclonal antibodies preparation and antigenic epitope identification of M protein of the porcine reproductive and respiratory syndrome virus[J]. Animal Husbandry & Veterinary Medicine, 2022, 54(6): 91-96. (in Chinese) |
| [7] |
孙琪, 许浒, 李超, 等. 欧洲型和美洲型PRRSV的最新分类及其差异的研究进展[J]. 中国预防兽医学报, 2022, 44(9): 1006-1013. SUN Q, XU H, LI C, et al. Advances in researches on classification and differences between PRRSV-1 and PRRSV-2[J]. Chinese Journal of Preventive Veterinary Medicine, 2022, 44(9): 1006-1013. (in Chinese) |
| [8] |
MARDASSI H, MOUNIR S, DEA S. Molecular analysis of the ORFs 3 to 7 of porcine reproductive and respiratory syndrome virus, Québec reference strain[J]. Arch Virol, 1995, 140(8): 1405-1418. DOI:10.1007/BF01322667 |
| [9] |
陶一墨, 解长占, 王鹏, 等. NADC30-like猪繁殖与呼吸综合征病毒样颗粒的制备与鉴定[J]. 微生物学通报, 2022, 49(12): 5287-5297. TAO Y M, XIE C Z, WANG P, et al. Preparation and verification of NADC30-like porcine reproductive and respiratory syndrome virus-like particles[J]. Microbiology China, 2022, 49(12): 5287-5297. (in Chinese) |
| [10] |
VEIT M, MATCZUK A K, SINHADRI B C, et al. Membrane proteins of arterivirus particles: structure, topology, processing and function[J]. Virus Res, 2014, 194: 16-36. DOI:10.1016/j.virusres.2014.09.010 |
| [11] |
YOON K J, ZIMMERMAN J J, SWENSON S L, et al. Characterization of the humoral immune response to porcine reproductive and respiratory syndrome (PRRS) virus infection[J]. J Vet Diagn Invest, 1995, 7(3): 305-312. DOI:10.1177/104063879500700302 |
| [12] |
周艳君, 田志军, 刘金霞, 等. 猪繁殖与呼吸综合征病毒M蛋白B细胞抗原表位的鉴定[J]. 中国预防兽医学报, 2009, 31(4): 251-255. ZHOU Y J, TIAN Z J, LIU J X, et al. Identification of a B cell epitope on matrix protein of porcine reproductive and respiratory syndrome virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2009, 31(4): 251-255. (in Chinese) |
| [13] |
WANG Q, CHEN J Z, PENG J M, et al. Characterisation of novel linear antigen epitopes on North American-type porcine reproductive and respiratory syndrome virus M protein[J]. Arch Virol, 2014, 159(11): 3021-3028. DOI:10.1007/s00705-014-2174-4 |
| [14] |
WISSINK E H J, KROESE M V, VAN WIJK H A R, et al. Envelope protein requirements for the assembly of infectious virions of porcine reproductive and respiratory syndrome virus[J]. J Virol, 2005, 79(19): 12495-12506. DOI:10.1128/JVI.79.19.12495-12506.2005 |
| [15] |
肖书奇, 李洋, 马志倩, 等. PRRSV SD-YL1712毒株及其感染性克隆的构建方法和应用: CN201910377451. X[P]. CN110229792A. XIAO S Q, LI Y, MA Z Q, et al. Construction method and application of PRRSV SD-YL1712 strain and its infectious clone: CN201910377451. X[P]. CN110229792A. (in Chinese) |
| [16] |
PATON D J, BROWN I H, EDWARDS S, et al. 'Blue ear' disease of pigs[J]. Vet Rec, 1991, 128(26): 617. DOI:10.1136/vr.128.26.617 |
| [17] |
ISEKI H, KAWASHIMA K, SHIBAHARA T, et al. Immunity against a Japanese local strain of porcine reproductive and respiratory syndrome virus decreases viremia and symptoms of a highly pathogenic strain[J]. BMC Vet Res, 2021, 17(1): 156. DOI:10.1186/s12917-021-02863-4 |
| [18] |
LI Y, XU L L, JIAO D, et al. Genomic similarity and antibody-dependent enhancement of immune serum potentially affect the protective efficacy of commercial MLV vaccines against NADC30-like PRRSV[J]. Virol Sin, 2023, 38(5): 813-826. DOI:10.1016/j.virs.2023.08.010 |
| [19] |
牛绪东, 任禾, 冯学俊, 等. 猪瘟、蓝耳病和圆环病毒病混合感染的诊断与防控[J]. 黑龙江畜牧兽医, 2018(12): 134-136, 247-248. NIU X D, REN H, FENG X J, et al. Diagnosis, prevention and control of mixed infection of CSF, PRRS and PCV2[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(12): 134-136, 247-248. (in Chinese) |
| [20] |
李鑫, 舒相华, 刘永波, 等. 一起猪繁殖与呼吸综合征病毒、猪瘟病毒和猪圆环病毒2型混合感染的诊断[J]. 黑龙江畜牧兽医, 2018(13): 118-120, 244. L1 X, SHU X H, LIU Y B, et al. Diagnosis of a mixed infection of PRRSV, CSFV and PCV2[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(13): 118-120, 244. (in Chinese) |
| [21] |
吴瑞通. 猪瘟与猪蓝耳病混合感染防控措施[J]. 畜牧兽医科学(电子版), 2020(4): 24-25. WU R T. Prevention and control measures of combined infection of CSF and PRRS[J]. Graziery Veterinary Science (Electronic Version), 2020(4): 24-25. (in Chinese) |
| [22] |
李洋, 高胜, 焦点, 等. PRRSV-VR2332减毒活疫苗不影响猪瘟疫苗和猪圆环病毒2型灭活疫苗诱导的抗体产生[J]. 畜牧兽医学报, 2021, 52(11): 3175-3184. LI Y, GAO S, JIAO D, et al. PRRSV-VR2332 modified live attenuated vaccine does not affect the antibody production induced by classical swine fever vaccine and inactivated porcine circovirus type 2 vaccine[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(11): 3175-3184. (in Chinese) |
| [23] |
AN T Q, LI J N, SU C M, et al. Molecular and cellular mechanisms for PRRSV pathogenesis and host response to infection[J]. Virus Res, 2020, 286: 197980. |
(编辑 白永平)



