2. 中国农业科学院北京畜牧兽医研究所 畜禽生物育种全国重点实验室, 北京 100193
2. State Key Laboratory of Animal Biotech Breeding, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
家禽是全球重要的农业资源,对家禽业可持续发展具有重要意义。然而,由于诸多因素,家禽种质资源正面临持续损失的风险。为了避免这种灾难性的损失,对种质资源的保护和利用技术的需求显得尤为迫切。精液储存是一种广泛应用的方法,可以长期保存优质种质资源,保持遗传多样性,还可以用于提高优良种禽繁殖利用效率。然而,家禽精液在储存过程中极易受到氧化损伤,导致精子质量下降和受精能力减弱。氧化损伤是由于自由基的生成超过机体抗氧化能力所引起的,它们具有高度反应性,可以直接或间接地对细胞结构和功能造成损害。
为了解决这一问题,研究人员开始探索外源添加抗氧化剂在家禽精液储存中的应用。抗氧化剂是一类能够中和自由基、抑制氧化反应的化合物,具有保护细胞免受氧化损伤的能力。维生素类、酶类、氨基酸类、植物提取物类抗氧化剂以及一些新型抗氧化产品被广泛研究利用,以提高精子的储存稳定性和质量。了解抗氧化剂在家禽精液储存中的应用和效果对于提高家禽生产和繁殖的效率具有重要意义。本文旨在综述现有的研究,以深入了解抗氧化剂在家禽精液储存中的应用,评估其对精液质量和受精能力的影响,并探索优化策略,为进一步研究和应用提供指导和参考。
1 家禽精液特性与精子结构特征家禽精子相比于哺乳动物更易受到氧化损伤,这是由家禽精液特性和独特的精子结构特征所致。公鸡的单次射精量较少,但精子密度却很高,每毫升精液可达数十亿个精子,这使得它成为单位体积精子密度最大的动物之一。在精液储存中精子产生的过氧化物等代谢产物聚集,精浆缓冲能力有限。此外,与哺乳动物的扁卵圆形精子头部不同,家禽精子是长圆柱形的,两端呈锥形,头部较哺乳动物要小很多,呈丝状,与精子尾部直径相似[1]。因此,家禽精子头部具有较低的细胞质体积,只可以累积相对较低的冷冻保护剂,不足以在精液冷冻储存中保护精子免受冷冻损伤。而且家禽精子顶体容易脱落,影响受精能力。家禽精子的尾部与哺乳动物相比非常长,约为头部的8倍,精子的活动受到了很大阻碍,这使得精子在稀释、冷冻和解冻过程中易断裂,并且可能导致精子细胞的超微结构(特别是线粒体)受损[2]。与其他动物相比,家禽精子细胞质膜富含不饱和脂肪酸,极易发生脂质过氧化(lipid peroxidation,LPO),导致精子活力和受精能力的下降并对DNA造成不可逆的损害[3]。
2 家禽精子储存及其氧化损伤家禽精子储存包括低温保存和冷冻保存。4 ℃低温储存可抑制精子的代谢活动[4],有利于精液的短期保存和运输。在精子低温储存中,最重要的一个变量就是储存时间的长短。精液在低温储存的最初几小时内并没有发现显著的有害效应[5]。随着储存时间延长,有害效应明显。在火鸡中,低温储存精液24 h,细胞内LPO的产物丙二醛(malondialdehyde,MDA) 增加了3倍[6]。低温储存48 h,由于精液发生过氧化,会导致精子失去作为呼吸活性的最重要的细胞内底物游离胆固醇和磷脂[7]。精液在4 ℃储存72 h后,总抗氧化能力(total antioxidant capacity,TAC)明显下降[8]。并且在4 ℃低温储存过程中,随着时间延长,精子的超微结构会出现严重受损,主要集中在质膜不完整、顶体破损和线粒体结构损伤[9],这些都可能是影响最终受精率的重要因素。
精液冷冻保存是指将精液经过适当稀释和保护处理后,利用液氮(-196 ℃)等冷源将精子长期保存在超低温的环境中,期间精子基本上不进行生命活动。精液冷冻技术实现了精液的长距离运输和长时间保存,使需要的遗传基因得以有效利用,利于珍稀濒危物种的保护。家禽精液冷冻过程复杂,包括筛选公鸡、精液采集、精液质量检测、稀释精液、添加冷冻保护剂、包装、程序化冷冻、解冻、去除冷冻保护剂和解冻精子评估等关键步骤。在冷冻和解冻过程中,精子暴露在温度变化的冲击下,细胞膜发生结构的改变以及膜脂质和蛋白质的重组,从而引起渗透性改变[10]。氧化损伤是精液低温和冷冻储存过程中导致精子死亡的重要因素[11]。精子细胞和体内其他细胞一样,依靠线粒体呼吸链式反应产生腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)。在线粒体呼吸过程中,电子通过由各种蛋白质复合物组成的电子传输链转移。尽管电子传输链是高效的,但有一小部分电子可以从链中泄漏,泄漏的电子可以直接与环境中氧气(O2)反应生成超氧阴离子(O2 ·-),最终形成活性氧物质(reactive oxygen species,ROS)[12]。此外,当细胞受到外来刺激时,会激活烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶,在细胞膜上组装形成NADPH氧化酶复合体,促进了依靠电子从细胞内的NADPH转移到细胞外的O2产生O2 ·-,最终形成ROS[13]。正常生理情况下,ROS的产生在调节精子活动的许多方面是必需的,如精子的运动、获能,精子-透明带相互作用,顶体反应和精子-卵子融合等[14]。然而,过多的ROS却会引起精子氧化应激,对精子造成损伤。ROS对精子的氧化损伤主要涉及LPO、蛋白质氧化和DNA氧化3个方面[15]。精子膜上富含多不饱和脂肪酸,ROS会攻击细胞膜磷脂双联甲基组,膜脂质的过氧化及其链式反应造成精子细胞膜损伤[16];ROS影响蛋白氧化修饰从而引起精子中蛋白结构和功能的变化,进而降低精子的运动能力、受精率和孵化率,例如增加的ROS会减少轴丝蛋白的磷酸化,导致细胞膜流动性下降[16],继而影响与卵母细胞结合;ROS可以直接作用于精子细胞核中的DNA分子,导致DNA的氧化损伤,影响精子的遗传信息传递[17];ROS引起的精子线粒体DNA改变,将影响其编码蛋白的正常合成,而这些蛋白可能是细胞中线粒体呼吸功能所必需的酶,其活性缺失导致精子活力下降[18]。
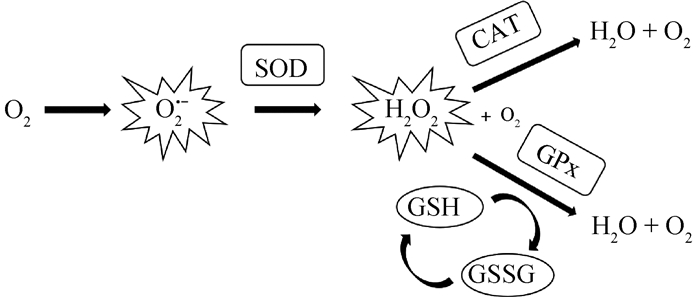
3 家禽精液抗氧化系统组成精子和精浆内都具有一定抗氧化能力的物质,其主要作用就是通过清除ROS来保护精子细胞免受结构和功能损伤。这些物质构成了家禽精液中的抗氧化防御系统,主要包括许多相互作用的抗氧化剂,任何一个缺乏都会影响TAC[11]。主要酶类抗氧化系统包括超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和过氧化氢酶(catalase,CAT)[19]。3种抗氧化酶之间相互作用,形成一个协同的抗氧化防御系统(图 1)。SOD和GPx的相互作用:SOD主要负责将细胞内产生的O2 ·-转化为过氧化氢(H2O2),而H2O2是一种中间物质;GPx则专门负责将H2O2和有机过氧化物转化为无害的水和相应的醇。SOD和CAT的相互作用:SOD主要将O2 ·-转化为H2O2,而CAT则负责催化分解H2O2为水和O2。因此,SOD和CAT共同参与了O2 ·-的清除和H2O2的分解过程。不仅仅是酶类抗氧化剂在精液中起保护作用,天然抗氧化物质如维生素E(vitamin E,VE)、维生素C(vitamin C,VC)和GSH(glutathione,GSH)等在减少精子氧化应激损伤上也起到很大作用。VE是一种脂溶性维生素,它能够捕捉和中和自由基。而且VE对线粒体磷脂以及网状组织磷脂等有很强的亲和力,与细胞膜上的磷脂结构相结合,可阻止LPO反应的发生从而保护精子[20]。VC是水溶性维生素,可直接消除ROS,也可间接促进其他抗氧化剂的再生,增强其抗氧化能力。GSH是细胞内含有巯基的非蛋白化合物,属于一种三肽,它通过巯基发挥抗氧化作用[21],在细胞内参与清除自由基、减少氧化应激和保护细胞免受氧化损伤。
|
SOD.超氧化物歧化酶;GPx.谷胱甘肽过氧化物酶;CAT.过氧化氢酶;GSH.谷胱甘肽;GSSG.氧化型谷胱甘肽 SOD. Superoxide dismutase; GPx. Glutathione peroxidase; CAT. Catalase; GSH. Glutathione; GSSG. Oxidized glutathione 图 1 生物体内主要酶类抗氧化系统(修改自[22]) Fig. 1 The main enzymes of the antioxidant system of organisms (modified from[22]) |
抗氧化防御系统中抗氧化酶活性和含量存在物种特异性差异。例如,与人、绵羊、公牛和兔子等哺乳动物相比,鸡精子中SOD活性最低[23]。在家禽中比较,鹅、鸡和火鸡精子中的SOD活性依次降低,而水禽精浆中的SOD活性要低于火鸡[24-26]。不仅如此,精子和精浆中SOD分布也不一致,鸡和火鸡精子中SOD含量高于精浆中SOD含量[11]。火鸡精浆中GPx活性高于鸭和鹅,而鹅精子和精浆中的GPx含量却高于鸡[25]。对于CAT的活性和含量关系,鸡精液中CAT活性尤其是精子细胞中的CAT活性低于鹅精液,而鹅精浆中的CAT含量高于公鸡[25]。在外来和本土印度鸡品种之间,CAT活性水平也存在差异[27]。总之,在家禽精液中,高抗氧化酶活性和高水平LPO表明精子处于氧化应激中,而这些酶并不能完全保护精子免受结构和功能损伤。在冷冻保存过程中,鸡精液中CAT、GPx和SOD的活性和含量也都受会到影响。有研究表明,在鸡精液低温保存过程中,精浆中的CAT减少了约14%[28]。也有研究发现,鸡精液冷冻保存过程中精子中的SOD活性下降,但精浆中的SOD活性却在增加[11]。相反,GPx在精浆中的活性较高,但在精子中没有变化[28]。然而,Nguyen等[16]却持不同观点,指出冷冻保存时精子中SOD和GPx活性显著下降,但CAT活性没有显著变化。冷冻状态下精子和精浆中抗氧化酶活性变化不同,这可能与它们的生理特性和应激响应有关。不同物种精液中其他物质含量也具有特异性。鸡精子中VE含量为0.25 μg ·10-9精子,精浆中为0.074 μg ·10-9精子[29],鸡精液的VE水平高于鸭精液。在鸡精液中,VC几乎均匀分布在精子和精浆中,其浓度是VE的100倍,GSH的浓度比VC少2.5倍[30]。不同物种精液抗氧化系统的组成差异可能与其精液储存过程中的抗氧化水平相关。
Bréque等[31]进一步总结了家禽精液中高效的抗氧化防御系统的3个层面:SOD与GPx和与金属相关的蛋白质共同构成了第一道防线,负责防止自由基的形成;天然抗氧化剂(VC、VE、GSH和类胡萝卜素等)与GPx结合,构成第二道防线,防止和限制过氧化物的产生和扩散;多种酶如磷脂酶、蛋白酶、转移酶组成了第三道防线,负责修复和清除精子细胞膜中的损伤。
4 抗氧化剂及其在家禽精液储存中的添加效果研究已明确了精液储存过程中的氧化应激对精子受精能力存在负面影响。在精液储存过程中,可在介质中添加额外的抗氧化剂来克服氧化应激的影响。抗氧化添加剂基本可以分为维生素类抗氧化剂、酶类抗氧化剂、氨基酸类抗氧化剂、植物提取物类抗氧化剂和新型抗氧化剂。其不同抗氧化剂对家禽精液的作用效果各不相同(表 1)。
|
|
表 1 鸡精液储存过程中抗氧化剂添加效果 Table 1 Effect of antioxidants on chicken sperm during semen storage |
VE、VC、烟酸和辅酶Q10是精液储存时常见的维生素类抗氧化剂。Bréque等[31]发现饲粮补充VE可以有效限制鸡和火鸡精子质膜发生过氧化。大量的研究也表明,在稀释液中添加适量的VE能够有效改善精子质量[29, 32-33],并且可以提高鸡精子膜完整性和存活率[34]。Blesbois等[29]也指出低温储存时补充8 μg ·mL-1 VE尽管不能改善鸡精子运动能力,却能显著提高受精率。也有研究发现,补充VE并不会减少火鸡精液中的LPO[6],这可能由于品种间差异产生的。还有研究发现,VE通过和硒结合,可以显著改善精子活力,并增强GPx和CAT的活性[35-36],因此,抗氧化剂和其他物质结合添加或许能加强抗氧化剂对家禽精液保存的效果。有研究发现,在冷冻保存的鸡精子中添加VC可以提高精子存活率[32]。Tabatabaei[37]也发现,在稀释液中添加10 mg ·mL-1 VC能够明显降低精子畸形率。辅酶Q10是唯一已知的动物细胞可以从头合成的脂溶性抗氧化剂,并且存在酶机制,可以从其氧化形式中再生抗氧化剂。Masoudi等[38-39]发现,不管是低温保存还是冷冻保存鸡精液,辅酶Q10都能改善精子质量,降低LPO,提高受精率,对于鸡精液低温保存,5 μmol ·L-1辅酶Q10的效果更好,而1和2 μmol ·L-1辅酶Q10对冷冻保存改善的效果更好。烟酸是维生素B3的一种形式,参与能量代谢和细胞生长。有研究表明,添加烟酸处理后的绵羊精子存活时间可以延长至120 h,能有效提升绵羊精子质量和低温保存效果[40]。然而其是否也能有效改善家禽精子质量还需要进一步研究。
4.2 酶类抗氧化剂酶类抗氧化剂主要包括CAT和SOD。CAT广泛存在于动植物以及微生物中,其酶促反应为机体提供了抗氧化能力。研究发现,在冷冻保存的鸡精液中添加CAT可以改善公鸡精液解冻后的质量[41]。Amini等[42]也发现,补充100 μg ·mL-1 CAT能提高精子的运动能力和存活率,并且MDA含量也显著降低。SOD催化O2 ·-转化为较稳定的O2和H2O2,减少其对精子的有害作用。精液中SOD的含量与精子的活力呈正相关[43]。也有研究表明,添加适量SOD能提高精子运动能力,改善精子质量[32],减少精子质膜中的LPO[44]。
4.3 氨基酸类抗氧化剂GSH、左旋肉碱(L-carnitine,LC)和半胱氨酸是在精液储存时常见的氨基酸类抗氧化剂。研究结果表明,添加2或4 mmol ·L-1 GSH会使得低温储存中家禽精子有更高的运动能力[45]、顶体完整率和受精率,并且还能降低精子LPO[46-47]。Izanloo等[8]指出,添加1 mmol ·L-1 GSH可增加CAT、SOD和GPx活性和TAC。不仅如此,最新研究指出0.4 mmol ·L-1 GSH能显著提高精子运动能力、质膜完整性和顶体完整性,并且显著改善DNA完整性[48]。然而,Donnelly等[49]发现添加GSH对精子运动能力和DNA完整性没有显著影响,尽管如此,GSH仍然可以显著减少H2O2诱导的ROS产生,对精子提供保护作用。因此,对于抗氧化剂GSH改善精子各参数的情况和其最适添加剂量还需进一步研究。LC是一种氨基酸衍生物,由赖氨酸和甲基化的组氨酸组成。它在能量代谢和抗氧化过程中起着关键的作用。LC的抗氧化特性包括清除自由基,破坏H2O2和金属螯合[50]。研究指出,LC能显著提高精子运动能力、存活率、膜完整性、线粒体活性和受精率[51],并且显著降低精子畸形率[52]和LPO[53],冷冻精液时最适添加浓度为1~2 mmol ·L-1。半胱氨酸是一种天然氨基酸,属于含硫非必需氨基酸,极易被氧化还原成胱氨酸,具有一定的抗氧化性。半胱氨酸参与GSH的合成过程,为细胞提供足够的GSH,从而增强细胞内的抗氧化能力[54]。因此,半胱氨酸在精液冷冻保存过程中,可以保护精子质膜免受氧化损伤[21]。相关研究也证实了这一点,添加半胱氨酸增加了精子运动能力和线粒体活性[44]。Sariözkan等[55]研究表明,添加半胱氨酸可以改善精子顶体损伤率,并且其SOD活性显著提高。不仅如此,半胱氨酸的衍生物N-乙酰-L-半胱氨酸(N-Acetyl-L-cysteine,NAC)也可以提高低温储存后的精子运动能力和存活率[56]。Partyka等[44]指出,5 mmol ·L-1 NAC可以显著保护冷冻后鸡精子的功能。其它氨基酸抗氧化剂如谷氨酰胺和丝氨酸,也被证实可以保护精子[57-58]。
4.4 植物提取物抗氧化剂植物提取物中含有丰富的抗氧化成分,如多酚类、类黄酮、维生素等。多项研究已经探索了不同植物提取物在家禽精液储存中的应用效果。槲皮素是一种天然的黄酮类化合物,属于植物次生代谢产物。槲皮素对O2 ·-、过氧基和羟基自由基具有很强的清除活性[59]。与VC和VE相比,槲皮素具有较高的抗氧化活性和较低的细胞毒性,可以通过抑制细胞膜上依赖钙调素的酶活性,如ATP酶和磷脂酶,影响细胞膜的通透性[60]。它广泛存在于许多水果、蔬菜、谷物、草药和茶叶中。研究表明,添加槲皮素可以显著改善冻后精液各参数指标,Rakha等[60]认为15 mmol ·L-1槲皮素可以显著改善冷冻保存后精子的运动能力、线粒体活性、顶体完整性和膜完整性。Siari等[61]指出添加10 mmol ·L-1槲皮素能改善冻后精子质量并且能降低精子的LPO损伤。Appiah等[62]却指出添加0.01 mg ·mL-1槲皮素能更好地改善精子各项参数指标。各研究其最适添加浓度不一致,这在很大程度上是受动物品种和品系的影响。番茄红素是一种亲脂性类胡萝卜素,其抗氧化特性能改善精子质量。研究已报道一定浓度的番茄红素对秦川牛精子在冷冻过程受到的结构损伤和繁殖性能降低具有良好的保护作用[63]。番茄红素能够最大限度地减少鸡精子LPO和DNA完整性的损失,并在一定程度上挽救鸡精子的结构损伤,维持精子活力[64],这与Mangiagalli等[65]的研究结果一致。白藜芦醇是一种天然产生于植物中的多酚类化合物。它能有效抑制蛋白质氧化和LPO,因其具有消除多种含有羟基和O2 ·-的ROS的潜力。在家禽精子培养基中补充白藜芦醇的有益作用已被报道,Najafi等[66]指出添加40 μmol ·L-1白藜芦醇可以提高冷冻解冻后公鸡精子的质量,具有更高的TAC和更低的MDA,然而,精子的形态特征和SOD含量不受白藜芦醇剂量的影响。另一项研究还表明,白藜芦醇可能是通过增加腺嘌呤核糖核苷酸(adenosine monophosphate,AMP)激活的蛋白激酶磷酸化来改善精子质量的[67],这还需大量研究验证。喻宗岗等[68]研究表明不同剂量白藜芦醇不会显著改善精子活力和降低LPO程度,但却能显著改善精子的线粒体膜电位。不仅如此,20 μg ·mL-1生姜提取物能够显著改善低温储存时鸡精子活力和运动能力,维持DNA完整性[69]。这可能是因为生姜中姜黄素的抗氧化效果[70]。另一项研究表明,咖啡因对火鸡精子的一些参数有积极的影响,一系列浓度(0.16~7.5 mg ·mL-1)的咖啡因可显著提高低温保存精子的活力,并具有提高受精率的潜力[71]。
4.5 其他抗氧化剂除了上述常见的抗氧化剂,还有很多具有抗氧化效应的物质也在研究的范围内。研究发现,石榴皮中多酚类化合物具有可以保护低温储存48 h的鸡精子免受氧化损伤的潜在能力[72],这与Sadeghi等[5]的研究结果一致。褪黑素可以保持线粒体的完整性,中和ROS的毒性。Mehaisen等[27]指出,褪黑素可以降低精液中的LPO,提高精子DNA完整性和精子活率,这与Yan等[73]的研究结果一致。Appiah等[74]的研究也表明,褪黑素可以通过降低氧化应激水平,提高冷冻鸡精液的质量,且其最佳浓度为0.25 mg ·mL-1。Nogueira等[75]还指出,单独添加褪黑素或者联合添加褪黑素和辅酶Q10都会降低马精液中的LPO,抗氧化剂之间的协同效应还需要进一步探索。
线粒体靶向抗氧化剂等新型抗氧化剂在家禽精液储存中备受关注。线粒体靶向抗氧化剂是一类具有特定结构或载体的化合物,能够进入线粒体并在其内部发挥抗氧化作用,包括MitoQ和Mito-TEMPO等。它们具有不同的化学结构和作用机制,但都具有针对线粒体的抗氧化特性[76]。Mito-TEMPO是一种由四甲基哌啶氧化物与三甲胺基乙醇结合而成的化合物。Kumar等[77]指出,补充Mito-TEMPO能降低精子的冷冻损伤。研究表明,添加5和50 μmol ·L-1 Mito-TEMPO能显著改善低温储存和冷冻储存家禽精子的膜功能、线粒体活性、顶体完整性、存活率和受精率[78]。最新研究还指出Mito-TEMPO能降低家禽精子的LPO[79]。MitoQ是一种由辅酶Q10与三乙胺基甲基苯酚结合而成的化合物。三乙胺基甲基苯酚的作用是使MitoQ能够靶向线粒体,并通过其亲脂性质进入线粒体内部。Nazari等[80]也指出,MitoQ能提高家禽精子的膜完整性、存活率、TAC和GPx活性,减少冷冻对精子的损伤。研究表明,150 nmol ·L-1 MitoQ不仅能通过恢复ATP水平和防止膜损伤来改善解冻后的家禽精子质量和运动参数,还能降低家禽精子过氧化水平和精子凋亡程度[81]。
纳米结构脂质载体(nanostructured lipid carriers,NLC)虽然不是抗氧化剂,但是因其可以保护药物免受降解和氧化作用,增强药物稳定性;提高药物溶解度和渗透性;靶向给药,降低副作用;制备方法简单等优点,它与抗氧化剂组合使用可以提升抗氧化剂的效用,使其成为当前精液储存研究中备受关注的一种可以降低精子氧化损伤的方法。Najafi团队通过NLC递送α-硫辛酸[82]、白藜芦醇[66]和γ-谷维素[83]作用于家禽精液冷冻储存,研究结果显示NLC可以通过增强药物的抗氧化作用来改善公鸡精子解冻后的质量。使用NLC载负30 μmol ·L-1的α-硫辛酸可显著降低细胞凋亡率和活化的caspase-3基因表达,提高受精率;NLC载负40 μmol ·L-1白藜芦醇可以显著降低MDA含量和提高TAC;NLC载负60和80 μmol ·L-1的γ-谷维素能够更好的提高解冻后精子质量。这些结果都暗示着NLC结合抗氧化剂在精液储存上有非常大的应用潜力。
5 展望由于精子低温生物学特性差异,家禽精液储存技术的发展水平和应用不如哺乳动物。在这篇综述中介绍了当前抗氧化剂在家禽精液储存中应用效果的研究进展。尽管部分抗氧化剂显示出了明显的保护效果。然而,家禽精液储存技术仍然存在许多挑战和未知领域,需要进一步深入研究。首先,不同种类的抗氧化剂在精液中的作用机制和效果尚不完全清楚,需要深入的研究来解析其作用途径。其次,抗氧化剂的添加剂量对精液质量的影响仍需要进一步的优化和研究。此外,精液储存条件和时间的优化以及抗氧化剂与其他辅助剂的协同效应也是需要探索的方向。另外,长期效果评估对于抗氧化剂的应用和实际储存中的可行性至关重要,现今大部分研究的周期不是很长,无法确保抗氧化剂对精液长期储存的影响,还需要加强长期应用效果的研究,确保其在精液储存中的应用是安全可靠的。
| [1] |
THURSTON R J, HESS R A. Ultrastructure of spermatozoa from domesticated birds: comparative study of turkey, chicken and guinea fowl[J]. Scanning Microsc, 1987, 1(4): 1829-1838. |
| [2] |
ABOUELEZZ F M K, SAYED M A M, SANTIAGO-MORENO J. Fertility disturbances of dimethylacetamide and glycerol in rooster sperm diluents: discrimination among effects produced pre and post freezing-thawing process[J]. Anim Reprod Sci, 2017, 184: 228-234. DOI:10.1016/j.anireprosci.2017.07.021 |
| [3] |
李春艳, 张彦, 吕春荣, 等. 褪黑素的抗氧化机制及其在哺乳动物精子冷冻保存中的应用研究进展[J]. 畜牧兽医学报, 2023, 54(11): 4468-4476. LI C Y, ZHANG Y, LV C R, et al. Research progress on antioxidant mechanisms of melatonin and its application in cryopreservation of mammalian spermatozoa[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(11): 4468-4476. (in Chinese) |
| [4] |
PARTYKA A, NIŻAŃSKI W. Advances in storage of poultry semen[J]. Anim Reprod Sci, 2022, 246: 106921. DOI:10.1016/j.anireprosci.2021.106921 |
| [5] |
SADEGHI S, DEL GALLEGO R, GARCÍA-COLOMER B, et al. Effect of sperm concentration and storage temperature on goat spermatozoa during liquid storage[J]. Biology (Basel), 2020, 9(9): 300. |
| [6] |
LONG J A, KRAMER M. Effect of vitamin E on lipid peroxidation and fertility after artificial insemination with liquid-stored turkey semen[J]. Poult Sci, 2003, 82(11): 1802-1807. DOI:10.1093/ps/82.11.1802 |
| [7] |
ZANIBONI L, CEROLINI S. Liquid storage of turkey semen: changes in quality parameters, lipid composition and susceptibility to induced in vitro peroxidation in control, n-3 fatty acids and alpha-tocopherol rich spermatozoa[J]. Anim Reprod Sci, 2009, 112(1-2): 51-65. DOI:10.1016/j.anireprosci.2008.04.002 |
| [8] |
IZANLOO H, SOLEIMANZADEH A, BUCAK M N, et al. The effects of varying concentrations of glutathione and trehalose in improving microscopic and oxidative stress parameters in Turkey semen during liquid storage at 5℃[J]. Cryobiology, 2021, 101: 12-19. DOI:10.1016/j.cryobiol.2021.07.002 |
| [9] |
韩亚雯, 赖贞霖, 张梦美, 等. 4 ℃液态保存对奶山羊精子超微结构的影响[J]. 畜牧兽医学报, 2022, 53(3): 964-971. HAN Y W, LAI Z L, ZHANG M M, et al. Effect of 4℃ liquid storage on ultrastructure of dairy goat spermatozoa[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(3): 964-971. (in Chinese) |
| [10] |
JANOSIKOVA M, PETRICAKOVA K, PTACEK M, et al. New approaches for long-term conservation of rooster spermatozoa[J]. Poult Sci, 2023, 102(2): 102386. DOI:10.1016/j.psj.2022.102386 |
| [11] |
PARTYKA A, NIŻAŃSKI W. Supplementation of avian semen extenders with antioxidants to improve semen quality-is it an effective strategy?[J]. Antioxidants (Basel), 2021, 10(12): 1927. DOI:10.3390/antiox10121927 |
| [12] |
SADEGHI N, BOISSONNEAULT G, TAVALAEE M, et al. Oxidative versus reductive stress: a delicate balance for sperm integrity[J]. Syst Biol Reprod Med, 2023, 69(1): 20-31. DOI:10.1080/19396368.2022.2119181 |
| [13] |
ORTIZ-GARCÍA C I, SALGADO-LUCIO M L, ROA-ESPITIA A L, et al. Calpain regulates reactive oxygen species production during capacitation through the activation of NOX2 and NOX4[J]. Int J Mol Sci, 2023, 24(4): 3980. DOI:10.3390/ijms24043980 |
| [14] |
GUALTIERI R, KALTHUR G, BARBATO V, et al. Sperm oxidative stress during in vitro manipulation and its effects on sperm function and embryo development[J]. Antioxidants (Basel), 2021, 10(7): 1025. DOI:10.3390/antiox10071025 |
| [15] |
JANCIAUSKIENE S. The beneficial effects of antioxidants in health and diseases[J]. Chronic Obstr Pulm Dis, 2020, 7(3): 182-202. |
| [16] |
NGUYEN T M D, SEIGNEURIN F, FROMENT P, et al. The 5'-AMP-activated protein kinase (AMPK) is involved in the augmentation of antioxidant defenses in cryopreserved chicken sperm[J]. PLoS One, 2015, 10(7): e0134420. DOI:10.1371/journal.pone.0134420 |
| [17] |
GUO H R, YANG Y, LOU Y B, et al. Apoptosis and DNA damage mediated by ROS involved in male reproductive toxicity in mice induced by Nickel[J]. Ecotoxicol Environ Saf, 2023, 268: 115679. DOI:10.1016/j.ecoenv.2023.115679 |
| [18] |
孙迎迎. 稀释液中添加槲皮素和白藜芦醇对绵羊精液低温保存效果的影响[D]. 晋中: 山西农业大学, 2020. SUN Y Y. Effects of quercetin and resveratrol supplementation in diluent on sheep semen quality during low temperature liquid storage[D]. Jinzhong: Shanxi Agricultural University, 2020. (in Chinese) |
| [19] |
YÁNEZ-ORTIZ I, CATALÁN J, RODRÍGUEZ-GIL J E, et al. Advances in sperm cryopreservation in farm animals: cattle, horse, pig and sheep[J]. Anim Reprod Sci, 2022, 246: 106904. DOI:10.1016/j.anireprosci.2021.106904 |
| [20] |
王丽云, 李艳华, 王彦平, 等. 家畜精液冷冻保存的抗氧化研究进展[J]. 中国奶牛, 2019(9): 24-27. WANG L Y, LI Y H, WANG Y P, et al. Research progress on the antioxidation of livestock semen cryopreservation[J]. China Dairy Cattle, 2019(9): 24-27. (in Chinese) |
| [21] |
张利坤, 井辛宇, 白腾, 等. 抗氧化剂对家畜精液冷冻保存效果的影响研究进展[J]. 畜牧兽医杂志, 2018, 37(5): 37-41. ZHANG L K, JING X Y, BAI T, et al. Research progress of effects of antioxidant on cryopreservatio of livestock semen[J]. Journal of Animal Science and Veterinary Medicine, 2018, 37(5): 37-41. DOI:10.3969/j.issn.1004-6704.2018.05.012 (in Chinese) |
| [22] |
PANDEY K B, RIZVI S I. Markers of oxidative stress in erythrocytes and plasma during aging in humans[J]. Oxid Med Cell Longev, 2010, 3(1): 565920. |
| [23] |
SURAI P F, FUJIHARA N, SPEAKE B K, et al. Polyunsaturated fatty acids, lipid peroxidation and antioxidant protection in avian semen[J]. Asian-Australas J Anim Sci, 2001, 14(7): 1024-1050. DOI:10.5713/ajas.2001.1024 |
| [24] |
FROMAN D P, THURSTON R J. Chicken and turkey spermatozoal superoxide dismutase: a comparative study[J]. Biol Reprod, 1981, 24(1): 193-200. DOI:10.1095/biolreprod24.1.193 |
| [25] |
PARTYKA A, ŁUKASZEWICZ E, NIŻAŃSKI W. Lipid peroxidation and antioxidant enzymes activity in avian semen[J]. Anim Reprod Sci, 2012, 134(3-4): 184-190. DOI:10.1016/j.anireprosci.2012.07.007 |
| [26] |
SURAI P F, BLESBOIS E, GRASSEAU I, et al. Fatty acid composition, glutathione peroxidase and superoxide dismutase activity and total antioxidant activity of avian semen[J]. Comp Biochem Physiol Part B: Biochem Mol Biol, 1998, 120(3): 527-533. DOI:10.1016/S0305-0491(98)10039-1 |
| [27] |
MEHAISEN G M K, PARTYKA A, LIGOCKA Z, et al. Cryoprotective effect of melatonin supplementation on post-thawed rooster sperm quality[J]. Anim Reprod Sci, 2020, 212: 106238. DOI:10.1016/j.anireprosci.2019.106238 |
| [28] |
PARTYKA A, ŁUKASZEWICZ E, NIŻAŃSKI W. Effect of cryopreservation on sperm parameters, lipid peroxidation and antioxidant enzymes activity in fowl semen[J]. Theriogenology, 2012, 77(8): 1497-1504. DOI:10.1016/j.theriogenology.2011.11.006 |
| [29] |
BLESBOIS E, GRASSEAU I, BLUM J C. Effects of vitamin E on fowl semen storage at 4℃[J]. Theriogenology, 1993, 39(3): 771-779. DOI:10.1016/0093-691X(93)90260-C |
| [30] |
SURAI P F, WISHART G J, MALDJIAN A, et al. Lipid peroxidation in avian semen: protective effect of seminal plasma[J]. Br Poult Sci, 1998, 39(Suppl): S57-S58. |
| [31] |
BRÉQUE C, SURAI P, BRILLARD J P. Roles of antioxidants on prolonged storage of avian spermatozoa in vivo and in vitro[J]. Mol Reprod Dev, 2003, 66(3): 314-323. DOI:10.1002/mrd.10347 |
| [32] |
AMINI M R, KOHRAM H, SHAHANEH A Z, et al. The effects of different levels of vitamin E and vitamin C in modified Beltsville extender on rooster post-thawed sperm quality[J]. Cell Tissue Bank, 2015, 16(4): 587-592. DOI:10.1007/s10561-015-9506-9 |
| [33] |
MOGHBELI M, KOHRAM H, ZARE-SHAHANEH A, et al. Are the optimum levels of the catalase and vitamin E in rooster semen extender after freezing-thawing influenced by sperm concentration?[J]. Cryobiology, 2016, 72(3): 264-268. DOI:10.1016/j.cryobiol.2016.03.008 |
| [34] |
DONOGHUE A M, DONOGHUE D J. Effects of water-and lipid-soluble antioxidants on turkey sperm viability, membrane integrity, and motility during liquid storage[J]. Poult Sci, 1997, 76(10): 1440-1445. DOI:10.1093/ps/76.10.1440 |
| [35] |
KOWALCZYK A M, KLEĆKOWSKA-NAWROT J, ŁUKASZEWICZ E T. Effect of selenium and vitamin E addition to the extender on liquid stored capercaillie (Tetrao urogallus) semen quality[J]. Reprod Domest Anim, 2017, 52(4): 603-609. DOI:10.1111/rda.12955 |
| [36] |
SAFA S, MOGHADDAM G, JOZANI R J, et al. Effect of vitamin E and selenium nanoparticles on post-thaw variables and oxidative status of rooster semen[J]. Anim Reprod Sci, 2016, 174: 100-106. DOI:10.1016/j.anireprosci.2016.09.011 |
| [37] |
TABATABAEI S. Effect of ascorbic acid on chicken semen quality during liquid storage[J]. Comp Clin Pathol, 2012, 21(5): 621-626. DOI:10.1007/s00580-010-1145-8 |
| [38] |
MASOUDI R, SHARAFI M, POURAZADI L. Improvement of rooster semen quality using coenzyme Q10 during cooling storage in the Lake extender[J]. Cryobiology, 2019, 88: 87-91. DOI:10.1016/j.cryobiol.2019.03.003 |
| [39] |
MASOUDI R, SHARAFI M, SHAHNEH A Z, et al. Supplementation of extender with coenzyme Q10 improves the function and fertility potential of rooster spermatozoa after cryopreservation[J]. Anim Reprod Sci, 2018, 198: 193-201. DOI:10.1016/j.anireprosci.2018.09.019 |
| [40] |
韩修远, 赵亮, 王闯, 等. 烟酸通过降低氧化应激水平提高绵羊精子低温保存效果[J]. 畜牧兽医学报, 2023, 54(5): 1979-1989. HAN X Y, ZHAO L, WANG C, et al. Nicotinic acid enhances low temperature preservation of sheep sperm by reducing oxidative stress levels[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(5): 1979-1989. (in Chinese) |
| [41] |
MOGHBELI M, KOHRAM H, ZARE-SHAHANEH A, et al. Effect of sperm concentration on characteristics and fertilization capacity of rooster sperm frozen in the presence of the antioxidants catalase and vitamin E[J]. Theriogenology, 2016, 86(6): 1393-1398. DOI:10.1016/j.theriogenology.2016.03.038 |
| [42] |
AMINI M R, KOHRAM H, ZARE-SHAHANEH A, et al. The effects of different levels of catalase and superoxide dismutase in modified Beltsville extender on rooster post-thawed sperm quality[J]. Cryobiology, 2015, 70(3): 226-232. DOI:10.1016/j.cryobiol.2015.03.001 |
| [43] |
余波澜, 陈康, 周华, 等. 精浆超氧化物歧化酶活性与精子活力的关联分析[J]. 中华临床医师杂志(电子版), 2012, 6(9): 2384-2387. YU B L, CHEN K, ZHOU H, et al. An association analysis of seminal SOD activity and sperm motility[J]. Chinese Journal of Clinicians (Electronic Edition), 2012, 6(9): 2384-2387. (in Chinese) |
| [44] |
PARTYKA A, NIŻAŃSKI W, BAJZERT J, et al. The effect of cysteine and superoxide dismutase on the quality of post-thawed chicken sperm[J]. Cryobiology, 2013, 67(2): 132-136. DOI:10.1016/j.cryobiol.2013.06.002 |
| [45] |
ZHANDI M, SEIFI-GHAJALO E, SHAKERI M, et al. Effect of glutathione supplementation to semen extender on post-thawed rooster sperm quality indices frozen after different equilibration times[J]. Cryo Lett, 2020, 41(2): 92-99. |
| [46] |
MASOUDI R, SHARAFI M, SHAHNEH A Z, et al. Effects of reduced glutathione on the quality of rooster sperm during cryopreservation[J]. Theriogenology, 2019, 128: 149-155. DOI:10.1016/j.theriogenology.2019.01.016 |
| [47] |
MASOUDI R, SHARAFI M, POURAZADI L, et al. Supplementation of chilling storage medium with glutathione protects rooster sperm quality[J]. Cryobiology, 2020, 92: 260-262. DOI:10.1016/j.cryobiol.2019.10.005 |
| [48] |
ZUHA S, RAKHA B A, AKHTER S, et al. The effect of adding different levels of reduced glutathione to extender on the quality of cooled ring-necked pheasant semen[J]. Biopreserv Biobank, 2023. DOI:10.1089/bio.2022.0201 |
| [49] |
DONNELLY E T, MCCLURE N, LEWIS S E M. Glutathione and hypotaurine in vitro: effects on human sperm motility DNA integrity and production of reactive oxygen species[J]. Mutagenesis, 2000, 15(1): 61-68. DOI:10.1093/mutage/15.1.61 |
| [50] |
漆淑华. 左旋肉碱盐酸盐的合成[D]. 桂林: 广西师范大学, 2000. QI S H. A novel synthesis of L-carnitine chloride[D]. Guilin: Guangxi Normal University, 2000. (in Chinese) |
| [51] |
FATTAH A, SHARAFI M, MASOUDI R, et al. L-carnitine is a survival factor for chilled storage of rooster semen for a long time[J]. Cryobiology, 2017, 74: 13-18. DOI:10.1016/j.cryobiol.2016.12.011 |
| [52] |
TABATABAEI S, AGHAEI A. Effect of L-carnitine on sperm quality during liquid storage of chicken semen[J]. Comp Clin Pathol, 2012, 21(5): 711-717. DOI:10.1007/s00580-010-1163-6 |
| [53] |
FATTAH A, SHARAFI M, MASOUDI R, et al. L-carnitine in rooster semen cryopreservation: flow cytometric, biochemical and motion findings for frozen-thawed sperm[J]. Cryobiology, 2017, 74: 148-153. DOI:10.1016/j.cryobiol.2016.10.009 |
| [54] |
杜媛媛, 王安生, 杨阳. 卵巢透明细胞癌从耐药机制到靶向药物选择的新进展[J]. 国际生殖健康/计划生育杂志, 2021, 40(4): 348-352. DU Y Y, WANG A S, YANG Y. New advances in ovarian clear cell carcinoma: from the mechanism of drug resistance to the selection of targeted drugs[J]. Journal of International Reproductive Health/Family Planning, 2021, 40(4): 348-352. (in Chinese) |
| [55] |
SARIÖZKAN S, BUCAK M N, TUNCER P B, et al. The influence of cysteine and taurine on microscopic-oxidative stress parameters and fertilizing ability of bull semen following cryopreservation[J]. Cryobiology, 2009, 58(2): 134-138. DOI:10.1016/j.cryobiol.2008.11.006 |
| [56] |
PARTYKA A, NIŻAŃSKI W, BRATKOWSKA M, et al. Effects of N-acetyl-L-cysteine and catalase on the viability and motility of chicken sperm during liquid storage[J]. Reprod Biol, 2015, 15(2): 126-129. DOI:10.1016/j.repbio.2015.03.001 |
| [57] |
THANANURAK P, CHUAYCHU-NOO N, THÉLIE A, et al. Different concentrations of cysteamine, ergothioneine, and serine modulate quality and fertilizing ability of cryopreserved chicken sperm[J]. Poult Sci, 2020, 99(2): 1185-1198. DOI:10.1016/j.psj.2019.10.040 |
| [58] |
KHIABANI A B, MOGHADDAM G, KIA H D. Effects of adding different levels of Glutamine to modified Beltsville extender on the survival of frozen rooster semen[J]. Anim Reprod Sci, 2017, 184: 172-177. DOI:10.1016/j.anireprosci.2017.07.013 |
| [59] |
孙丹彤. 槲皮素对蛋鸡生产性能、体内和体外抗氧化指标的影响[D]. 哈尔滨: 东北农业大学, 2015. SUN D T. Effects of quercetin on performance and antioxidant status in laying hens in vivo and in vitro[D]. Harbin: Northeast Agricultural University, 2015. (in Chinese) |
| [60] |
RAKHA B A, QURRAT UL A, ANSARI M S, et al. Effect of quercetin on oxidative stress, mitochondrial activity, and quality of Indian red jungle fowl (Gallus gallus murghi) sperm[J]. Biopreserv Biobank, 2020, 18(4): 311-320. DOI:10.1089/bio.2020.0007 |
| [61] |
SIARI S, MEHRI M, SHARAFI M. Supplementation of Beltsville extender with quercetin improves the quality of frozen-thawed rooster semen[J]. Br Poult Sci, 2022, 63(2): 252-260. DOI:10.1080/00071668.2021.1955331 |
| [62] |
APPIAH M O, LI W L, ZHAO J, et al. Quercetin supplemented casein-based extender improves the post-thaw quality of rooster semen[J]. Cryobiology, 2020, 94: 57-65. DOI:10.1016/j.cryobiol.2020.04.010 |
| [63] |
王萌, 杨超群, 吴斯林, 等. 番茄红素对秦川牛精液冷冻保存及鲜精品质影响[J]. 畜牧兽医学报, 2022, 53(12): 4507-4517. WANG M, YANG C Q, WU S L, et al. Impact of lycopene on semen cryopreservation and fresh semen quality of Qinchuan bull[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(12): 4507-4517. (in Chinese) |
| [64] |
ROSATO M P, CENTODUCATI G, SANTACROCE M P, et al. Effects of lycopene on in vitro quality and lipid peroxidation in refrigerated and cryopreserved turkey spermatozoa[J]. Br Poult Sci, 2012, 53(4): 545-552. DOI:10.1080/00071668.2012.716508 |
| [65] |
MANGIAGALLI M G, MARELLI S P, CAVALCHINI L G. Effect of lycopene on fowl sperm characteristics during in vitro storage[J]. Arch Geflugelkund, 2007, 71(1): 25-29. |
| [66] |
NAJAFI A, KIA H D, HAMISHEHKAR H, et al. Effect of resveratrol-loaded nanostructured lipid carriers supplementation in cryopreservation medium on post-thawed sperm quality and fertility of roosters[J]. Anim Reprod Sci, 2019, 201: 32-40. DOI:10.1016/j.anireprosci.2018.12.006 |
| [67] |
REZAIE F S, HEZAVEHEI M, SHARAFI M, et al. Improving the post-thaw quality of rooster semen using the extender supplemented with resveratrol[J]. Poult Sci, 2021, 100(9): 101290. DOI:10.1016/j.psj.2021.101290 |
| [68] |
喻宗岗, 蒋隽, 朱立军, 等. 品种、冷冻速率和白藜芦醇对鸡精液冷冻保存效果的影响[J]. 南方农业学报, 2020, 51(8): 1880-1887. YU Z G, JIANG J, ZHU L J, et al. Effects of breeding line, freezing rate and resveratrol on chicken semen cryopreservation[J]. Journal of Southern Agriculture, 2020, 51(8): 1880-1887. (in Chinese) |
| [69] |
NEMATI Z, DEHGANI P, KARIMI A, et al. Effects of ginger (Zingiber officinale) supplementation on testicular histology, semen characteristic, blood plasma parameters and reproductive performance in aged broiler breeder roosters[J]. J Anim Physiol Anim Nutr, 2023, 107(3): 907-919. DOI:10.1111/jpn.13779 |
| [70] |
ABDELNOUR S A, HASSAN M A E, MOHAMMED A K, et al. The effect of adding different levels of curcumin and its nanoparticles to extender on post-thaw quality of cryopreserved rabbit sperm[J]. Animals (Basel), 2020, 10(9): 1508. |
| [71] |
SLANINA T, MIŠKEJE M, TIRPÁK F, et al. Caffeine strongly improves motility parameters of turkey spermatozoa with no effect on cell viability[J]. Acta Vet Hung, 2018, 66(1): 137-150. DOI:10.1556/004.2018.013 |
| [72] |
GOPI M, BEULAH P V, PRABAKAR G, et al. Polyphenols as an antioxidant agent improves chicken sperm qualities during cold storage[J]. J Anim Plant Sci, 2020, 30(6): 1653-1658. |
| [73] |
YAN L Q, LI J Y, LI G D, et al. Type of the study: research article effect of melatonin on cryopreservation of Beijing You chicken (gallus gallus) spermatozoa[J]. Cryobiology, 2024, 114: 104794. DOI:10.1016/j.cryobiol.2023.104794 |
| [74] |
APPIAH M O, HE B B, LU W F, et al. Antioxidative effect of melatonin on cryopreserved chicken semen[J]. Cryobiology, 2019, 89: 90-95. DOI:10.1016/j.cryobiol.2019.05.001 |
| [75] |
NOGUEIRA B G, PEREIRA R R, BITENCOURT J L, et al. Coenzyme Q10 and melatonin protect cryopreserved equine sperm against lipoperoxidation[J]. Anim Reprod Sci, 2022, 243: 107027. DOI:10.1016/j.anireprosci.2022.107027 |
| [76] |
SHI L, SHI J J, FENG J J, et al. Proteomic analysis reveals the potential positive effects of Mito-TEMPO on ram sperm motility and fertility during cryopreservation[J]. Theriogenology, 2023, 205: 27-39. DOI:10.1016/j.theriogenology.2023.04.015 |
| [77] |
KUMAR A, KUMAR GHOSH S, KATIYAR R, et al. Supplementation of Mito TEMPO and acetovanillone in semen extender improves freezability of buffalo spermatozoa[J]. Andrology, 2022, 10(4): 775-788. DOI:10.1111/andr.13158 |
| [78] |
MASOUDI R, ASADZADEH N, SHARAFI M. Effects of freezing extender supplementation with mitochondria-targeted antioxidant Mito-TEMPO on frozen-thawed rooster semen quality and reproductive performance[J]. Anim Reprod Sci, 2021, 225: 106671. DOI:10.1016/j.anireprosci.2020.106671 |
| [79] |
ALIPOUR-JENAGHARD P, DAGHIGH-KIA H, MASOUDI R, et al. Mitochondria-targeted antioxidant "MitoQ" improves rooster's cooled sperm quality indicators and reproductive performance[J]. Theriogenology, 2023, 197: 26-30. DOI:10.1016/j.theriogenology.2022.11.034 |
| [80] |
NAZARI M, DAGHIGH-KIA H, MEHDIPOUR M, et al. Comparison of the performance of targeted mitochondrial antioxidant mitoquinone and non-targeted antioxidant pentoxifylline in improving rooster sperm parameters during freezing and thawing[J]. Poult Sci, 2022, 101(9): 102035. DOI:10.1016/j.psj.2022.102035 |
| [81] |
SUN L W, HE M Q, XU J H, et al. Does antioxidant mitoquinone (MitoQ) ameliorate oxidative stress in frozen-thawed rooster sperm?[J]. Animals (Basel), 2022, 12(22): 3181. |
| [82] |
NAJAFI A, KIA H D, HAMISHEHKAR H. Does alpha-lipoic acid-loaded nanostructured lipid carriers improve post-thawed sperm quality and ameliorate apoptosis-related genes of rooster sperm?[J]. Poult Sci, 2021, 100(1): 357-365. DOI:10.1016/j.psj.2020.10.007 |
| [83] |
NAJAFI A, DAGHIGH-KIA H, MEHDIPOUR M, et al. Comparing the effect of rooster semen extender supplemented with gamma-oryzanol and its nano form on post-thaw sperm quality and fertility[J]. Poult Sci, 2022, 101(3): 101637. DOI:10.1016/j.psj.2021.101637 |
(编辑 郭云雁)



