骨骼肌和脂肪是动物机体的主要组成部分,同时,骨骼肌发育及脂肪沉积也会直接影响畜禽的产品品质。动物骨骼肌发育和脂肪沉积都是复杂且有序的生理过程。骨骼肌的大小主要由肌纤维的数量以及肌纤维的肥大决定,肌纤维的数量在动物胚胎期就基本固定了,而肌纤维的肥大以及肌纤维的类型对畜禽的产肉性状起着重要作用[1]。脂肪沉积主要通过脂肪细胞的数量增加和体积增大来实现[2]。骨骼肌发育和脂肪沉积过程受到多种因素的调节,具体的调控机制尚不完全明了。脯氨酸羟化酶(proline hydroxylases,PHDs)是一类非血红素铁依赖性双加氧酶,可使靶蛋白的脯氨酸发生羟基化。近年的研究表明,PHD在肌肉发育和脂肪沉积过程中发挥着重要作用,其可以通过调控血管生成、肌肉纤维化、脂质代谢等多种生理过程,从而间接影响畜禽胴体品质和肉品质。
1 PHD的结构与功能及活性调节 1.1 PHD的结构与功能脯氨酸羟化酶(proline hydroxylases,PHDs)作为一类非血红素铁依赖性双加氧酶,是缺氧诱导因子(hypoxia inducible factor,HIF)信号通路的重要调控因子。此外,它还可以通过多种机制调节细胞内氧适应水平、细胞凋亡、细胞代谢和细胞转运等方面,从而参与多种生理活动的发生。现已发现4个家族成员,分别是PHD1、PHD2、PHD3和PHD4,已有的研究大多涉及PHD1、PHD2和PHD3的生理功能,对PHD4的研究报道较少[3]。这几种亚型的氨基酸序列相似性为42%~59%,在C末端结构域具有较高的序列同源性,在N端有明显不同[4]。因此,他们虽结构相近,但也有不同。PHD2在氨基端具有一个PHD1和PHD3都不具备的特殊催化结构——锌指结构,这个结构在线虫EGL-9(egg laying-9)基因中也存在。并且编码PHD1、2、3的基因与EGL-9基因同源[5-6]。可以推测PHD2与EGL-9的同源性更高,因此,PHD2具有和EGL-9蛋白相同的羟基化HIF蛋白的功能,且在PHDs家族中该成员生理活性最高。
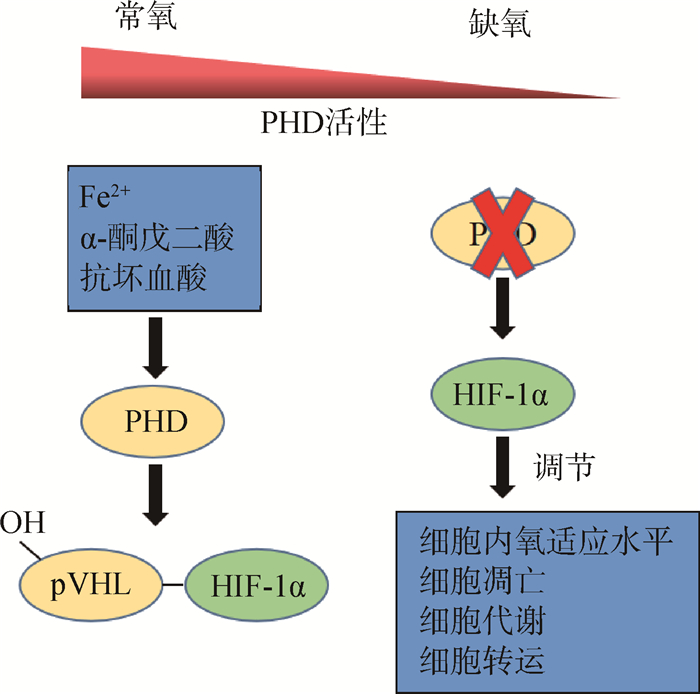
PHDs在动物机体内主要的生理功能为羟基化目标蛋白的脯氨酸残基,从而影响靶蛋白的稳定性和功能。最典型的就是羟基化HIF-1α,其中活性最强的是PHD2,PHD3次之,PHD1活性最小[5]。HIF-1是由α和β亚基组成的异源二聚体,常氧条件下,PHDs以O2和α-酮戊二酸为底物,以Fe2+作为辅助因子,可以识别HIF-1α上第402位和第564位的脯氨酸残基,使之发生羟基化,进而经希佩尔林道蛋白(von Hippel-lindau tumor suppressor protein,pVHL)介导而进行泛素化降解。在缺氧条件下,PHDs羟基化活性下降,阻碍了HIF-1α的降解,使HIF-1α稳定表达并积累,从而激活下游靶基因,开启相应的表达调控,如图 1所示[7-9]。此外,PHDs还可以羟基化其他蛋白,例如PHD2可以羟基化UCP1的Pro-33,133,232位点,以调控脂肪产热等。
|
图 1 脯氨酸羟化酶的生理功能 Fig. 1 Physiological function of proline hydroxylase |
研究表明,PHDs的活性受氧分压、铁的螯合物、抗坏血酸、α-酮戊二酸、一氧化氮(NO)、胰岛素、血管紧张素等多种因素的调节[9-11]。
PHD作为细胞氧感受器,活性受到氧气浓度的调节。有研究发现,在缺氧的条件下,PHD的活性下降,导致HIF-1α蛋白的累积,进而激活HIF信号通路,而持续激活的HIF信号通路,又会通过负反馈作用调控PHD的表达[12]。此外,NO对PHD的活性也有一定调控作用。在常氧条件下,NO通过稳定HIF来调节PHD活性[10]。
研究发现,在网织红细胞的裂解产物中,铁含量越少,PHD的活性就越大。铁与PHD之间的关联复杂,具体机制还有待进一步探究[13]。此外,一些二价金属离子,如Co2+、Ni2+、Mn2+等,也可以抑制PHD的活性[14]。
α-酮戊二酸作为PHD发挥酶活性重要的辅助因子起着关键作用。α-酮戊二酸可被谷氨酰胺酶和谷氨酸脱氢酶催化,这些酶可以协调Fe2+的活性,导致底物的电子氧化,激活PHD下游基因。α-酮戊二酸的类似物,如甲基乙二酰基甘氨酸(dimethyloxalglycine,DMOG),可竞争性抑制PHD的活性[10-11, 15-16]。此外,三羧酸循环的中间产物如延胡索酸、琥珀酸盐、草酰乙酸等的积累也可以抑制PHD的活性[17]。
抗坏血酸在常氧条件下可以减少HIF-1α的积累,但在用α-酮戊二酸类似物阻断PHD活性时其效果消失,这表明抗坏血酸与PHD活性有关[18]。
|
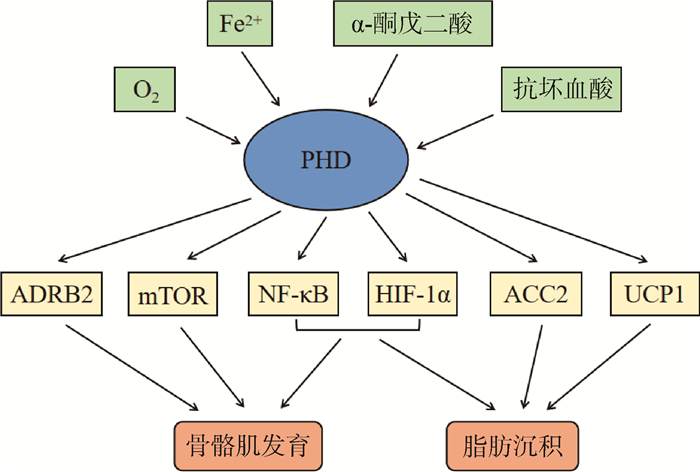
图 2 PHD调控骨骼肌发育和脂肪沉积的可能机制 Fig. 2 Possible mechanisms of PHD regulating skeletal muscle development and fat deposition |
骨骼肌是动物体的重要组成部分,在调控机体运动和代谢稳态方面起着非常重要的作用[19-20]。在畜禽生产当中,骨骼肌的发育直接决定了畜禽产品的产量及品质。动物骨骼肌的生长是一个较为复杂的生理过程,在胚胎期骨骼肌生长主要体现在肌纤维的生成和数量增加,而动物出生以后,骨骼肌的生长主要依靠肌纤维的肥大来实现[21]。动物骨骼肌的生长受到不同的内源性基因和转录因子的调控,此外,一些信号通路可以介导骨骼肌生长的调控,例如,Wnt信号通路[22]、PI3K-AKT信号通路[23]和HIF信号通路[24]等。
2.1 PHD对骨骼肌发育的调控骨骼肌的发育涉及成肌细胞的增殖、分化和肌纤维的形成等。PHD各个亚型在骨骼肌以及在C2C12成肌细胞中均有表达,并且,在C2C12分化的过程中,PHD3的表达水平增加[25]。成肌细胞培养过程中,氧分压变化可以影响成肌细胞的增殖分化能力[24],而PHD的活性受氧分压的调控。骨骼肌的形成主要由生肌调节因子(myogenic regulatory factors,MRFs)协调,包括肌细胞生成素(myogenin,MyoG)、成肌分化抗原(myogenic differentiation antigen,MyoD)、生肌因子5(myogenic factor 5,Myf5)和MRF4[26]。而据报道,PHD3可与这些调节因子相互作用[25],进一步证实了PHD3对骨骼肌生长的调控作用。
在PHD1敲除的小鼠中,肌肉质量减少[27]。PHD1敲除对亮氨酸的反应显示mTORC1(mechanistic target of rapamycin complex 1)激活受损,mTORC1是一种重要的肌肉质量调节器。PHD1促进mTORC1活性的能力与其羟基化活性无关[28],而与亮氨酰tRNA合成酶(LRS)亮氨酸传感器蛋白含量的降低有关[29]。PHD1在机制上与LRS相互作用并稳定LRS。这种相互作用在氧和氨基酸消耗期间被促进,并保护LRS免于降解。
此外,有一些研究指出,PHD可以通过调节毛细血管的密度参与调控肌纤维的生成。例如,PHD2缺失导致骨骼肌中肌纤维的转化,并且在I型纤维的比例增加的区域,其毛细血管密度也增加[30]。在该团队的后续研究中,对小鼠进行为期4周的跑步训练,发现与对照组相比,PHD2骨骼肌特异性敲除不仅增加了毛细血管的数量,骨骼肌中每个区域的肌纤维数量也有所增加[31]。
PHD还可以影响骨骼肌代谢,例如,PHD3可以通过ACC2的羟基化介导骨骼肌组织中脂肪酸的氧化,从而影响肌肉的运动能力。在高能量条件下,ACC2羟基化可以抑制脂肪酸氧化[32]。PHD3缺失的小鼠骨骼肌中ACC2羟基化缺失,从而导致脂肪酸氧化升高。AMPK在许多细胞类型的低营养条件下都很活跃,在低葡萄糖条件下ACC2磷酸化增加[33],而在ACC2中观察到的相反的羟基化则受AMPK负调控。ACC2物理结合PHD3[34],磷酸化ACC2会降低PHD3的活性。另外,PHD3可以介导AKG调节骨骼肌蛋白转换的过程,当PHD3过表达时,PHD3羟基化ADRB2,阻断AKG在C2C12肌管中的抗蛋白降解作用[35]。PHD3还可以通过羟基化NF-κB信号通路关键因子来调节肌肉发育过程中的蛋白质转化,从而抑制肌肉发育过程中的蛋白质合成[36]。
此外,本团队对猪不同骨骼肌组织中PHDs、骨骼肌生长相关信号分子的表达进行检测,猪腰大肌中PHD3表达水平远高于背最长肌。骨骼肌生长基因的表达与PHD3水平呈负相关,而骨骼肌蛋白质降解基因的表达与PHD3水平呈正相关(数据未发表)。说明PHD3可能在猪骨骼肌生长发育中发挥重要作用,提示PHDs可能参与肉品质调控。
2.2 PHD对骨骼肌损伤和再生的调控骨骼肌组织在肌外伤后具有很高的再生能力,机械性软组织创伤有缺血性和炎症性缺氧两种,这表明HIF在肌外伤中有一定作用[37]。而PHD作为HIF通路的重要调控因子,对骨骼肌的再生可能存在一定影响。确有研究证明,PHD1和PHD3的敲除可以通过激活HIF-1α,促进骨骼肌内的血管生成,并改善缺血性的骨骼肌损伤和炎症反应[38-39]。PHD2缺失可增强小鼠软组织创伤后骨骼肌组织的再生[40]。
而在PHD1敲除的小鼠中,PHD1氧传感器的丢失会减少肌肉质量[27]。此外,干扰PHD1或PHD3活性的小鼠表现出腓肠肌纤维化程度降低,并缓解缺血损伤后的肌肉质量损失[39]。类似的,肌肉注射红景天苷来抑制PHD3的转录活性,可激活骨骼肌细胞的旁分泌信号,进而激活骨骼肌细胞、内皮细胞和平滑肌细胞之间的通讯,促进内皮细胞和平滑肌细胞的活性[38]。
肥胖会导致肌肉质量下降和肌肉再生受损,据研究显示,在肥胖状态下病理性增加的PHD2会导致肌肉再生受损,同时观察到血管内皮生长因子(vascular endothelial growth factor,VEGF)表达水平显著下降,而在肥胖状态下抑制PHD2活性可使肌肉恢复再生潜力[41]。
综上所述,PHD缺失可以促进成肌细胞增殖分化、肌纤维类型转化、肌纤维数量增加以及骨骼肌再生等,对骨骼肌生长发育起着重要调控作用。
3 PHD对脂肪沉积的调控作用及机制脂肪组织是机体内重要的能量存储、内分泌以及代谢器官,对于维持机体能量稳态和产热供能具有重要作用。动物体内脂肪的沉积主要靠脂肪细胞数量增加、脂肪细胞肥大两种途径[42-43]。
3.1 PHD对脂肪生成与代谢的调控PHDs可能是脂肪细胞的成脂分化以及脂肪代谢过程中重要的调控因子。
在对脂肪细胞的研究中发现,在诱导3T3-L1前脂肪细胞成脂分化过程中,PHD的3个亚型均有表达。PHD1在脂肪生成早期表达,PHD2和PHD3则在脂肪生成晚期表达[44]。在脂肪生成的初始阶段,抑制PHD的活性,会降低PHD的基因表达,进而阻断脂肪细胞的形成[44]。还有研究探索了PHD在罗格列酮诱导的脂肪细胞分化期间所起的作用,发现在脂肪细胞分化期间,3种PHD亚型在脂肪细胞中表达上调,而抑制PHD可使抗脂肪生成蛋白如GATA-3、KLF-2的水平增加[45]。以上结果说明,PHD可能参与调控脂肪的生成。
在活体上,有研究表明,不论是在普通日粮还是在高脂日粮饲喂的条件下,PHD2敲除的小鼠与野生型小鼠相比,脂肪组织减少,脂肪细胞也相对更小。PHD2敲除小鼠白色脂肪组织(white adipose tissue,WAT)中脂解标记物Lipe和Pnpla2的mRNA水平增加[46]。此外,PHD抑制剂也可导致肥胖症小鼠WAT的质量显著降低,脂肪细胞大小减少,同时伴随着血浆脂联素的恢复以及脂质代谢的改善[47]。脂联素是脂肪细胞分泌的一种具有生物活性的蛋白质,其表达水平与胰岛素抵抗、肥胖和2型糖尿病呈负相关。有报道显示,PHD是脂联素产生和多聚化所必需的[48]。另外,PHD3缺失会激活促炎IKKβ/NF-κB信号通路,而减轻脂肪组织炎症可以介导脂质代谢的改善[47]。PHD3通过阻断IKKβ的磷酸化来抑制NF-κB信号,而这些磷酸化不依赖于羟基化。
此外,PHD可影响肝的脂肪沉积。缺氧影响肝脂质代谢并扰乱肝脂质积累,缺氧信号传导也是脂肪组织功能障碍的关键,会导致脂肪组织纤维化、炎症和胰岛素抵抗。而PHD作为主要的细胞氧传感器,自然也是关键调节因子[49]。PHD1敲除小鼠在正常饲喂条件下肝的重量降低,肝组织脂肪变性和炎症增加[50]。在PHD2或PHD3敲除的小鼠肝中,脂肪酸合成以及脂肪生成减少[46, 51-52]。
本团队对猪不同脂肪组织中PHDs、脂肪沉积相关信号分子的表达进行检测,发现PHD2在猪不同脂肪组织中的表达存在差异,且与脂质合成相关基因的表达呈正相关(数据未发表)。说明PHD2可能在猪脂肪沉积中发挥重要作用。
3.2 PHD对脂肪产热的调控目前,激活褐色脂肪产热被认为是减少肥胖的一种思路,通过激活脂肪产热来减少脂肪的沉积。褐色脂肪组织是哺乳动物体内非颤栗产热的主要来源,对于维持动物的体温和能量平衡起重要作用。解偶联蛋白1(uncoupling protein 1,UCP1)作为褐色脂肪产热的标志性蛋白,通过将氧化磷酸化与ATP合成解偶联,把底物氧化产生的能量转化为热能,以此促进棕色脂肪产热[53]。
而有研究表明,PHD2在褐色脂肪组织中的表达明显高于在白色脂肪组织中的表达,并且小鼠全身脂肪PHD2选择性敲除,通过激活HIF信号通路激活了小鼠的褐色脂肪并增加能量消耗[54]。不同的是,在本实验室的研究中,在活体小鼠褐色脂肪上特异性敲除PHD2,显著抑制了褐色脂肪的产热过程,发现PHD2可以直接与线粒体产热蛋白UCP1结合,通过促进UCP1蛋白的羟基化修饰,增加UCP1蛋白稳定性和表达,并协同AMPK信号通路促进褐色脂肪产热,以减少脂肪沉积[55]。然而,PHD对脂肪沉积的调控机制复杂多样,更多的调控路径仍有待进一步研究。
综上所述,抑制PHD可减少动物体脂肪沉积、脂肪酸摄取及脂肪变性等,PHD还可以参与褐色脂肪组织的产热,这为PHD作为营养调控靶点改善畜禽产品品质提供了科学依据。
4 小结本文在介绍PHD生理功能的基础上,阐述了其在骨骼肌发育及脂肪沉积方面的调控作用及可能机制,为生产上提高畜禽产品的产量以及品质提供了新的靶点。此外,PHD抑制剂也有望在畜禽生产中起到作用。目前的PHD抑制剂大多是广泛的抑制,但PHD家族各个成员的作用都有不同,其具体机制并不十分明确,有待进一步研究。因此,寻找PHD亚型特异性的抑制剂,或能为将来应用于生产开辟新的道路。
| [1] |
MOHAMMADABADI M, BORDBAR F, JENSEN J, et al. Key genes regulating skeletal muscle development and growth in farm animals[J]. Animals (Basel), 2021, 11(3): 835. |
| [2] |
GHABEN A L, SCHERER P E. Adipogenesis and metabolic health[J]. Nat Rev Mol Cell Biol, 2019, 20(4): 242-258. DOI:10.1038/s41580-018-0093-z |
| [3] |
夏冰清, 杨帆, 张硕. 脯氨酰羟化酶研究进展及其与肿瘤的关系[J]. 南通大学学报(医学版), 2010, 30(2): 142-145, 147. XIA B Q, YANG F, ZHANG S. Research progress of prolyl hydroxylase and the relationship with tumor[J]. Journal of Nantong University (Medical Sciences), 2010, 30(2): 142-145, 147. DOI:10.3969/j.issn.1674-7887.2010.02.024 (in Chinese) |
| [4] |
刘思雨, 任彩霞. 脯氨酸羟化酶在乳腺癌中的研究进展[J]. 中华肿瘤防治杂志, 2023, 30(14): 876-880, 886. LIU S Y, REN C X. Research progress of prolyl hydroxylase domain in breast cancer[J]. Chinese Journal of Cancer Prevention and Treatment, 2023, 30(14): 876-880, 886. (in Chinese) |
| [5] |
APPELHOFF R J, TIAN Y M, RAVAL R R, et al. Differential function of the prolyl hydroxylases PHD1, PHD2, and PHD3 in the regulation of hypoxia-inducible factor[J]. J Biol Chem, 2004, 279(37): 38458-38465. DOI:10.1074/jbc.M406026200 |
| [6] |
IVAN M, HABERBERGER T, GERVASI D C, et al. Biochemical purification and pharmacological inhibition of a mammalian prolyl hydroxylase acting on hypoxia-inducible factor[J]. Proc Natl Acad Sci U S A, 2002, 99(21): 13459-13464. DOI:10.1073/pnas.192342099 |
| [7] |
ELTZSCHIG H K, BRATTON D L, COLGAN S P. Targeting hypoxia signalling for the treatment of ischaemic and inflammatory diseases[J]. Nat Rev Drug Discov, 2014, 13(11): 852-869. DOI:10.1038/nrd4422 |
| [8] |
RABINOWITZ M H. Inhibition of hypoxia-inducible factor prolyl hydroxylase domain oxygen sensors: tricking the body into mounting orchestrated survival and repair responses[J]. J Med Chem, 2013, 56(23): 9369-9402. DOI:10.1021/jm400386j |
| [9] |
ZHAO Y C, XIONG W D, LI C F, et al. Hypoxia-induced signaling in the cardiovascular system: pathogenesis and therapeutic targets[J]. Signal Transduct Target Ther, 2023, 8(1): 431. DOI:10.1038/s41392-023-01652-9 |
| [10] |
KUROKAWA H, ITO H, TERASAKI M, et al. Nitric oxide regulates the expression of heme carrier protein-1 via hypoxia inducible factor-1α stabilization[J]. PLoS One, 2019, 14(9): e0222074. DOI:10.1371/journal.pone.0222074 |
| [11] |
FISCHER A P, MILES S L. Ascorbic acid, but not dehydroascorbic acid increases intracellular vitamin C content to decrease Hypoxia Inducible Factor-1 alpha activity and reduce malignant potential in human melanoma[J]. Biomed Pharmacother, 2017, 86: 502-513. DOI:10.1016/j.biopha.2016.12.056 |
| [12] |
LI L, SHEN S S, BICKLER P, et al. Searching for molecular hypoxia sensors among oxygen-dependent enzymes[J]. eLife, 2023, 12: e87705. DOI:10.7554/eLife.87705 |
| [13] |
OGAWA C, TSUCHIYA K, MAEDA K. Hypoxia-inducible factor prolyl hydroxylase inhibitors and iron metabolism[J]. Int J Mol Sci, 2023, 24(3): 3037. DOI:10.3390/ijms24033037 |
| [14] |
ASCHNER M, SKALNY A V, LU R Z, et al. The role of hypoxia-inducible factor 1 alpha (HIF-1α) modulation in heavy metal toxicity[J]. Arch Toxicol, 2023, 97(5): 1299-1318. DOI:10.1007/s00204-023-03483-7 |
| [15] |
FRUMP A L, SELEJ M, WOOD J A, et al. Hypoxia upregulates estrogen receptor β in pulmonary artery endothelial cells in a HIF-1α-dependent manner[J]. Am J Respir Cell Mol Biol, 2018, 59(1): 114-126. DOI:10.1165/rcmb.2017-0167OC |
| [16] |
NGUYEN T L, DURÁN R V. Prolyl hydroxylase domain enzymes and their role in cell signaling and cancer metabolism[J]. Int J Biochem Cell Biol, 2016, 80: 71-80. DOI:10.1016/j.biocel.2016.09.026 |
| [17] |
INFANTINO V, SANTARSIERO A, CONVERTINI P, et al. Cancer cell metabolism in hypoxia: role of HIF-1 as key regulator and therapeutic target[J]. Int J Mol Sci, 2021, 22(11): 5703. DOI:10.3390/ijms22115703 |
| [18] |
GLORIEUX C, CALDERON P B. Vitamin C (ascorbate) and redox topics in cancer[J]. Antioxid Redox Signal, 2021, 35(14): 1157-1175. DOI:10.1089/ars.2020.8233 |
| [19] |
BARROS D, MARQUES E A, MAGALHÃES J, et al. Energy metabolism and frailty: the potential role of exercise-induced myokines-A narrative review[J]. Ageing Res Rev, 2022, 82: 101780. DOI:10.1016/j.arr.2022.101780 |
| [20] |
SMITH J A B, MURACH K A, DYAR K A, et al. Exercise metabolism and adaptation in skeletal muscle[J]. Nat Rev Mol Cell Biol, 2023, 24(9): 607-632. DOI:10.1038/s41580-023-00606-x |
| [21] |
YAN X, ZHU M J, DODSON M V, et al. Developmental programming of fetal skeletal muscle and adipose tissue development[J]. J Genomics, 2013, 1: 29-38. DOI:10.7150/jgen.3930 |
| [22] |
RIM E Y, CLEVERS H, NUSSE R. The wnt pathway: from signaling mechanisms to synthetic modulators[J]. Annu Rev Biochem, 2022, 91: 571-598. DOI:10.1146/annurev-biochem-040320-103615 |
| [23] |
SHEN X M, TANG J, JIANG R, et al. CircRILPL1 promotes muscle proliferation and differentiation via binding miR-145 to activate IGF1R/PI3K/AKT pathway[J]. Cell Death Dis, 2021, 12(2): 142. DOI:10.1038/s41419-021-03419-y |
| [24] |
SAKUSHIMA K, YOSHIKAWA M, OSAKI T, et al. Moderate hypoxia promotes skeletal muscle cell growth and hypertrophy in C2C12 cells[J]. Biochem Biophys Res Commun, 2020, 525(4): 921-927. DOI:10.1016/j.bbrc.2020.02.152 |
| [25] |
FU J, MENZIES K, FREEMAN R S, et al. EGLN3 prolyl hydroxylase regulates skeletal muscle differentiation and myogenin protein stability[J]. J Biol Chem, 2007, 282(17): 12410-12418. DOI:10.1074/jbc.M608748200 |
| [26] |
付玉, 张博, 凌遥, 等. 骨骼肌生长发育过程及调控研究现状[J]. 中国畜牧兽医, 2021, 48(10): 3565-3574. FU Y, ZHANG B, LING Y, et al. Reviews on process and regulation of skeletal muscle growth and development[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(10): 3565-3574. (in Chinese) |
| [27] |
D'HULST G, SORO-ARNAIZ I, MASSCHELEIN E, et al. PHD1 controls muscle mTORC1 in a hydroxylation-independent manner by stabilizing leucyl tRNA synthetase[J]. Nat Commun, 2020, 11(1): 174. DOI:10.1038/s41467-019-13889-6 |
| [28] |
DESCHOEMAEKER S, DI CONZA G, LILLA S, et al. PHD1 regulates p53-mediated colorectal cancer chemoresistance[J]. EMBO Mol Med, 2015, 7(10): 1350-1365. DOI:10.15252/emmm.201505492 |
| [29] |
WOLFSON R L, SABATINI D M. The Dawn of the age of amino acid sensors for the mTORC1 pathway[J]. Cell Metab, 2017, 26(2): 301-309. DOI:10.1016/j.cmet.2017.07.001 |
| [30] |
SHIN J, NUNOMIYA A, KITAJIMA Y, et al. Prolyl hydroxylase domain 2 deficiency promotes skeletal muscle fiber-type transition via a calcineurin/NFATc1-dependent pathway[J]. Skelet Muscle, 2016, 6: 5. |
| [31] |
NUNOMIYA A, SHIN J, KITAJIMA Y, et al. Activation of the hypoxia-inducible factor pathway induced by prolyl hydroxylase domain 2 deficiency enhances the effect of running training in mice[J]. Acta Physiol (Oxf), 2017, 220(1): 99-112. DOI:10.1111/apha.12751 |
| [32] |
YOON H, SPINELLI J B, ZAGANJOR E, et al. PHD3 loss promotes exercise capacity and fat oxidation in skeletal muscle[J]. Cell Metab, 2020, 32(2): 215-228. DOI:10.1016/j.cmet.2020.06.017 |
| [33] |
LADEROUTE K R, AMIN K, CALAOAGAN J M, et al. 5'-AMP-activated protein kinase (AMPK) is induced by low-oxygen and glucose deprivation conditions found in solid-tumor microenvironments[J]. Mol Cell Biol, 2006, 26(14): 5336-5347. DOI:10.1128/MCB.00166-06 |
| [34] |
GERMAN N J, YOON H, YUSUF R Z, et al. PHD3 loss in cancer enables metabolic reliance on fatty acid oxidation via deactivation of ACC2[J]. Mol Cell, 2016, 63(6): 1006-1020. DOI:10.1016/j.molcel.2016.08.014 |
| [35] |
CAI X C, YUAN Y X, LIAO Z R, et al. α-Ketoglutarate prevents skeletal muscle protein degradation and muscle atrophy through PHD3/ADRB2 pathway[J]. FASEB J, 2018, 32(1): 488-499. DOI:10.1096/fj.201700670r |
| [36] |
LI F, YIN C, MA Z W, et al. PHD3 mediates denervation skeletal muscle atrophy through Nf-κB signal pathway[J]. FASEB J, 2021, 35(4): e21444. |
| [37] |
MERRICK M A. Secondary injury after musculoskeletal trauma: a review and update[J]. J Athl Train, 2002, 37(2): 209-217. |
| [38] |
ZHANG J, KASIM V, XIE Y D, et al. Inhibition of PHD3 by salidroside promotes neovascularization through cell-cell communications mediated by muscle-secreted angiogenic factors[J]. Sci Rep, 2017, 7: 43935. DOI:10.1038/srep43935 |
| [39] |
RISHI M T, SELVARAJU V, THIRUNAVUKKARASU M, et al. Deletion of prolyl hydroxylase domain proteins (PHD1, PHD3) stabilizes hypoxia inducible factor-1 alpha, promotes neovascularization, and improves perfusion in a murine model of hind-limb ischemia[J]. Microvasc Res, 2015, 97: 181-188. DOI:10.1016/j.mvr.2014.10.009 |
| [40] |
SETTELMEIER S, SCHREIBER T, MÄKI J, et al. Prolyl hydroxylase domain 2 reduction enhances skeletal muscle tissue regeneration after soft tissue trauma in mice[J]. PLoS One, 2020, 15(5): e0233261. DOI:10.1371/journal.pone.0233261 |
| [41] |
SINHA I, SAKTHIVEL D, OLENCHOCK B A, et al. Prolyl hydroxylase domain-2 inhibition improves skeletal muscle regeneration in a male murine model of obesity[J]. Front Endocrinol (Lausanne), 2017, 8: 153. DOI:10.3389/fendo.2017.00153 |
| [42] |
GHABEN A L, SCHERER P E. Adipogenesis and metabolic health[J]. Nat Rev Mol Cell Biol, 2019, 20(4): 242-258. DOI:10.1038/s41580-018-0093-z |
| [43] |
CHO Y K, LEE S, LEE J, et al. Lipid remodeling of adipose tissue in metabolic health and disease[J]. Exp Mol Med, 2023, 55(9): 1955-1973. DOI:10.1038/s12276-023-01071-4 |
| [44] |
FLOYD Z E, KILROY G, WU X Y, et al. Effects of prolyl hydroxylase inhibitors on adipogenesis and hypoxia inducible factor 1 alpha levels under normoxic conditions[J]. J Cell Biochem, 2007, 101(6): 1545-1557. DOI:10.1002/jcb.21266 |
| [45] |
KIM J, KWAK H J, CHA J Y, et al. The role of prolyl hydroxylase domain protein (PHD) during rosiglitazone-induced adipocyte differentiation[J]. J Biol Chem, 2014, 289(5): 2755-2764. DOI:10.1074/jbc.M113.493650 |
| [46] |
RAHTU-KORPELA L, KARSIKAS S, HÖRKKÖ S, et al. HIF prolyl 4-hydroxylase-2 inhibition improves glucose and lipid metabolism and protects against obesity and metabolic dysfunction[J]. Diabetes, 2014, 63(10): 3324-3333. DOI:10.2337/db14-0472 |
| [47] |
SUGAHARA M, TANAKA S, TANAKA T, et al. Prolyl hydroxylase domain inhibitor protects against metabolic disorders and associated kidney disease in obese type 2 diabetic mice[J]. J Am Soc Nephrol, 2020, 31(3): 560-577. DOI:10.1681/ASN.2019060582 |
| [48] |
ZHANG L, LI M M, CORCORAN M, et al. Essential roles of insulin, AMPK signaling and lysyl and prolyl hydroxylases in the biosynthesis and multimerization of adiponectin[J]. Mol Cell Endocrinol, 2015, 399: 164-177. DOI:10.1016/j.mce.2014.09.014 |
| [49] |
LEFERE S, VAN STEENKISTE C, VERHELST X, et al. Hypoxia-regulated mechanisms in the pathogenesis of obesity and non-alcoholic fatty liver disease[J]. Cell Mol Life Sci, 2016, 73(18): 3419-3431. DOI:10.1007/s00018-016-2222-1 |
| [50] |
THOMAS A, BELAIDI E, ARON-WISNEWSKY J, et al. Hypoxia-inducible factor prolyl hydroxylase 1 (PHD1) deficiency promotes hepatic steatosis and liver-specific insulin resistance in mice[J]. Sci Rep, 2016, 6: 24618. DOI:10.1038/srep24618 |
| [51] |
NASTESKA D, CUOZZO F, VILORIA K, et al. Prolyl-4-hydroxylase 3 maintains β cell glucose metabolism during fatty acid excess in mice[J]. JCI Insight, 2021, 6(16): e140288. DOI:10.1172/jci.insight.140288 |
| [52] |
TANIGUCHI C M, FINGER E C, KRIEG A J, et al. Cross-talk between hypoxia and insulin signaling through Phd3 regulates hepatic glucose and lipid metabolism and ameliorates diabetes[J]. Nat Med, 2013, 19(10): 1325-1330. DOI:10.1038/nm.3294 |
| [53] |
BERTHOLET A M, KIRICHOK Y. UCP1:a transporter for H+ and fatty acid anions[J]. Biochimie, 2017, 134: 28-34. DOI:10.1016/j.biochi.2016.10.013 |
| [54] |
GOMEZ SALAZAR M, PRUÑONOSA CERVERA I, WANG R L, et al. Adipocyte-specific deletion of the oxygen-sensor PHD2 sustains elevated energy expenditure at thermoneutrality[J]. bioRxiv, 2021, 1(5): 425401. |
| [55] |
LI F, ZHANG F L, YI X, et al. Proline hydroxylase 2 (PHD2) promotes brown adipose thermogenesis by enhancing the hydroxylation of UCP1[J]. Mol Metab, 2023, 73: 101747. DOI:10.1016/j.molmet.2023.101747 |
(编辑 郭云雁)



