2. 云南农业大学动物医学院, 昆明 650201;
3. 云南农业大学动物科学技术学院, 昆明 650201
2. College of Veterinary Medicine, Yunnan Agricultural University, Kunming 650201, China;
3. Faculty of Animal Science and Technology, Yunnan Agricultural University, Kunming 650201, China
细胞死亡是一个复杂的过程,可通过多种子程序执行。以往的研究已鉴定出多种细胞死亡形式,并将其分为细胞意外死亡和调节性细胞死亡(regulated cell death,RCD)[1]。相对于细胞意外死亡,调节性细胞死亡可由一系列分子机制和信号通路介导,包括凋亡[2]、焦亡[3]、坏死性凋亡[4]和自噬性死亡[5]等。铁死亡[6]和Science最近报道的铜依赖性细胞死亡[7]是新发现的调节性细胞死亡形式。结合本课题组对大肠杆菌诱导不同形式RCD及相关信号通路调控机制的研究[8],本文总结了铁死亡和铜死亡,并以铁死亡为参考提出了铜死亡的研究空白,为进一步探索铜死亡提供了研究方向。
1 铜死亡与铁死亡Tsvetkov等[7]在Science上发表的研究提出了一种由铜离子诱导的新型细胞死亡形式,他们发现,用于治疗肿瘤的铜离子载体-伊利司莫(Elesclomol,ES)包裹铜离子进入胞内后会杀死细胞,并具有Cu+剂量依赖性,而单独的ES进入胞内并不会诱导细胞死亡,表明细胞死亡是由过载的铜离子引起的。细胞内过量的铜离子会与线粒体三羧酸循环(tricarboxylic acid cycle,TCA cycle)有关的硫辛酸化二氢脂酰胺S-乙酰乙酰转移酶(dihydrolipoamide S-acetyltransferase,DLAT)结合并发生寡聚化,导致蛋白质毒性应激,引发一种可称为铜死亡(cuproptosis)的新型细胞死亡形式[7],这种类型的细胞死亡取决于线粒体呼吸受损和随后的线粒体蛋白应激,与线粒体氧化应激无关。
同为金属离子过载引起的铁死亡(ferroptosis)是依赖于胞内铁离子积累从而引起大量脂质过氧化的调节性细胞坏死[6]。铁死亡主要由铁依赖性磷脂过氧化驱动,并由多种代谢途径调节,这些代谢途径主要包括铁处理、线粒体活性、氧化还原稳态、氨基酸和脂质代谢,以及与各种疾病相关的信号通路[9-10]。铜死亡的诱因是胞内金属离子Cu+的大量积累,而铁死亡是由胞内铁的过载引起大量脂质过氧化造成的,二者主要由金属离子诱导,在形成机制上具有一定相似性。
1.1 铜死亡的形态学特征Tsvetkov等[7]对铜死亡的发生机制进行了研究,但遗憾的是该研究未对其形态特征做出具体的说明。研究表明,发生铁死亡的细胞线粒体形态发生了改变(图 1),发生铁死亡的细胞通常表现为质膜完整性丧失,细胞和细胞器肿胀以及染色质适度凝结;线粒体异常,如凝结或肿胀、膜密度增加、嵴减少或缺失及外膜破裂[11-12]。铜死亡的进程集中于线粒体,推测细胞线粒体发生了变化,其形态学变化可能类似于铁死亡的线粒体形态异常,具体有待进一步研究。
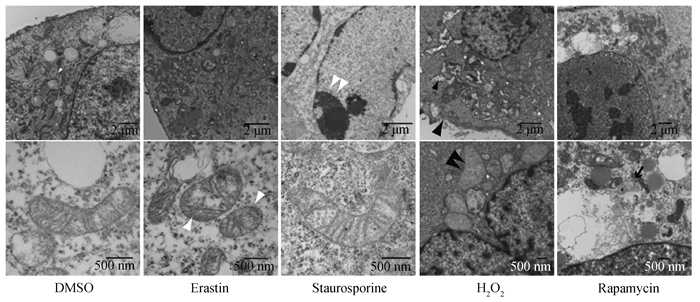
|
单一白色箭头指向线粒体萎缩;成对的白色箭头指向染色质凝结;成对黑色箭头指向细胞和线粒体肿大及质膜破裂;黑色箭头指向形成双膜囊泡 Single white arrows point to mitochondrial atrophy; Paired white arrows point to chromatin condensation; Paired black arrows point to cytoplasmic and organelle swelling and plasma membrane rupture; Single black arrow point to forming a double membrane vesicle 图 1 铁死亡超微形态学结构[11] Fig. 1 Ultramorphological structure of ferroptosis[11] |
研究表明, ATP7b碱基突变诱导的Wilson病发生了铜死亡[13],本文便以Wilson病的细胞病理变化来推测铜死亡的具体形态学特征。透射电子显微镜(transmission electron microscope, TEM)观察Wilson病患者的肝细胞发现线粒体外膜正常,嵴间隙狭窄、扭曲;线粒体浓缩,内外膜分离,基质密度增加或者由大的空泡取代;线粒体内存有不同大小的线粒体包裹体,包含无定形、松散排列的颗粒状物质;粗面内质网的囊体围绕着一些线粒体[14],铁死亡与铜死亡形态学比较见表 1。
|
|
表 1 铁死亡与铜死亡比较 Table 1 Comparison of ferroptosis and cuproptosis |
1.2.1 铜、铁离子的代谢 铁、铜是哺乳动物细胞内的两个重要微量元素,在许多重要的生理过程中起关键作用,如神经递质的传递、细胞呼吸、铁离子的摄取和抗氧化应激等,这些生理过程均依赖于铜、铁离子的存在[15-16]。细胞内铜、铁离子稳态失衡时,会触发多种疾病,铜离子水平下降会导致Menkes病、阿尔兹海默病等神经退行性疾病[17];在肝中,铜的累积会引起肝炎、Wilson病等[18-19]。铁代谢异常同样会导致诸多疾病,如铁过载症[20]、缺铁性贫血[21]等。
Cu+主要在肠道吸收,并通过铜转运蛋白1(copper transporter1,CTR1)转运进入胞内。铜转运ATP酶α(copper-transporting ATPase alpha,ATP7A)和β(ATP7b)在外周组织和肝细胞的Cu+转运中起不同作用,ATP7A将Cu+转运到门静脉,然后通过肠道吸收进入外周循环并到达肝[22];而在胞内,ATP7A将Cu+转运到反式高尔基体网络和囊泡中[15]。ATP7b则调节胞内铜离子的排泄,当胞内铜过载时,Cu+与抗氧化剂1铜伴侣蛋白(antioxidant 1 copper chaperone,ATOX1)结合,并通过ATP7b的N端金属结合域转移到胆管膜处,从而进入胆汁从体内排泄多余的铜[22]。细胞对铁的摄取主要依赖转铁蛋白受体(transferrin receptor,TFR)和二价金属离子转运体1(divalent metal transportor 1,DMT1)[23]。膜铁转运蛋白1(ferroportin 1,FPN1/SLC40A1)是细胞中唯一的铁外流通道,当细胞内的Fe2+到达基底侧,即可被FPN1转运至细胞外,并被膜铁转运辅助蛋白(hephaestin,HEPH)或铜蓝蛋白(ceruloplasmin,CP)氧化为Fe3+,随后进入体液循环中以转铁蛋白(transferrin,TF)复合物的形式存在,供给各组织器官[24-26]。图 2展示了肠上皮细胞铁和铜的吸收、转运以及分布机制。
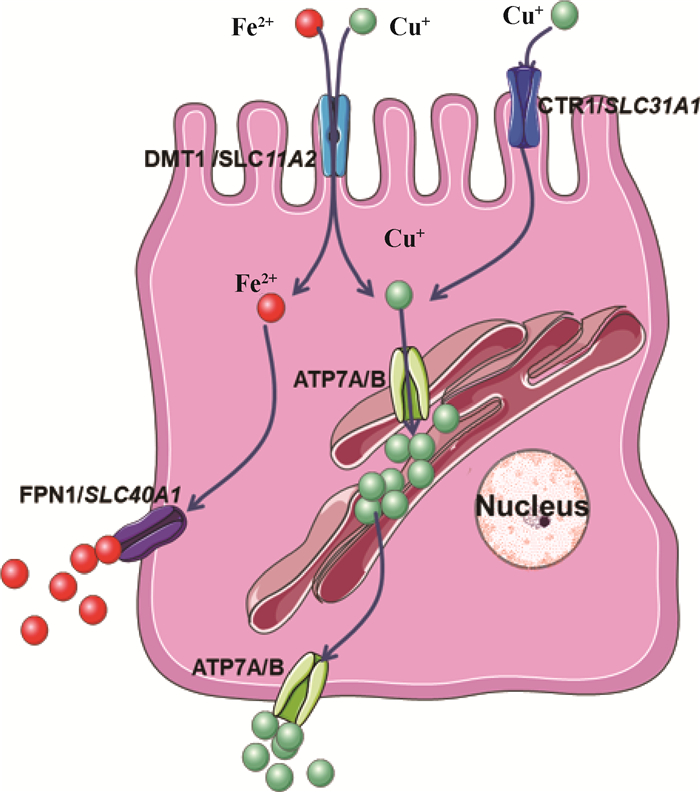
|
图 2 肠上皮细胞铁和铜的吸收、转运及分布机制[16] Fig. 2 Mechanisms of absorption, transport, and distribution of iron and copper in intestinal epithelial cells[16] |
1.2.2 铁死亡的机制 Erastin、RSL3是经典的铁死亡激活剂,通过增加胞内铁离子的积累从而诱导细胞铁死亡[11],而使用铁离子螯合剂可有效抑制铁死亡,这表明铁离子的稳态在铁死亡中扮演重要角色。铁能够通过芬顿反应直接产生过量的ROS,进而增加氧化损伤[11, 27],铁还能增加脂质过氧化和氧稳态酶的活性,如:脂氧合酶(lipoxygenase,ALOX)或EGLN脯氨酸羟化酶[28]。脂质过氧化是一种自由基驱动的反应,主要影响细胞膜中的多不饱和脂肪酸(polyunsaturatedfattyacids,PUFAs)[29-30],PUFA在ROS的攻击和脂氧合酶的作用下产生脂质过氧化物,最终导致细胞膜破裂进而死亡[31-32];而谷胱甘肽过氧化酶4(recombinant glutathione peroxidase 4,GPX4)可以通过其酶活性阻止脂质过氧化物的毒性,将脂质氢过氧化物还原为无毒脂质醇,维持膜脂质双分子层的稳态[33-34]。此外,前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)和参与脂肪酸代谢的酶酰基辅酶a合成酶长链家族成员4(Acyl-CoA synthetase long-chain family member 4,ACSL4)过表达被认为是铁死亡的生物标志[33]。铁死亡的分子机制和相关信号通路见图 3。
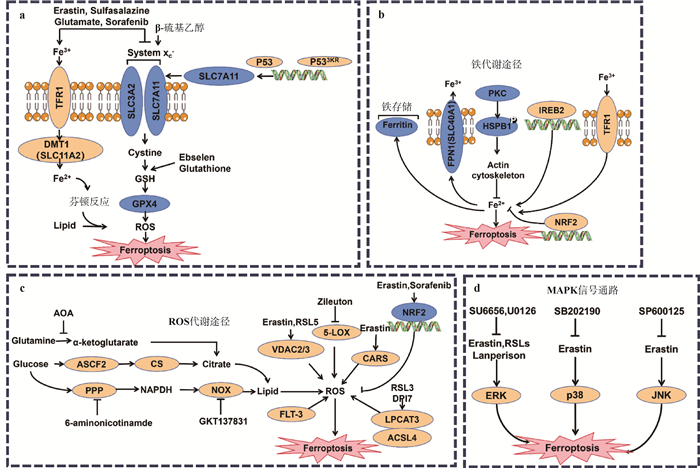
|
Erastin.埃拉斯汀-铁死亡激活剂;Sulfasalazine.氮磺胺吡啶-铁死亡激活剂;Glutamate.谷氨酸盐;Sorafenib.索拉非尼-铁死亡激活剂;Ebselen.依布硒-谷胱甘肽过氧化物酶模拟物;Glutathione.谷胱甘肽;AOA.氨基氧乙酸;Glutamine.谷氨酰胺;α-ketoglutarate.α-酮戊二酸;Glucose.葡萄糖;Citrate.柠檬酸盐;GKT137831.NOX1/NOX4双重抑制剂;Zileuton.5-脂氧合酶抑制剂;U0126.选择性的Src家族激酶抑制剂;U0126.选择性的MEK1和MEK2抑制剂;SB202190.选择性p38 MAPK抑制剂;SP600125.广谱JNK抑制剂。a. 铁死亡的核心调节因子;b~d. 铁代谢的作用:b. 铁代谢; c. ROS代谢; d. MAPK通路 Erastin.Ferroptosis activator; Sulfasalazine.Ferroptosis activator; Glutamate.Glutamate; Sorafenib.A ferroptosis activator; Ebselen. A glutathione peroxidase mimetic; Glutathione. Glutathione; AOA. Aminooxyacetic acid; Glutamine. Glutamine; α-ketoglutarate. α-ketoglutarate; Glucose. Glucose. Citrate. Citrate; GKT137831. NOX1/NOX4 dual inhibitor; Zileuton. 5-lipoxygenase inhibitor; U0126. Selective Src family kinase inhibitor; U0126. Selective inhibitor of MEK1 and MEK2; SB202190. A selective p38 MAPK inhibitor; SP600125. Broad-spectrum JNK inhibitor. a. Core regulators of ferroptosis; b-d. The role of iron metabolism: b. Iron metabolism; c. ROS metabolism; d. MAPK pathway 图 3 铁死亡的分子机制和信号通路[35] Fig. 3 Molecular mechanism and signaling pathway of ferroptosis[35] |
1.2.3 铜死亡的机制 研究发现,高度依赖线粒体呼吸的细胞对铜诱导的细胞死亡更为敏感,这反映了铜死亡与TCA循环的密切关联。对ES-Cu+诱导的细胞进行全基因组CRISPR筛选,鉴定了参与铜死亡的几个关键基因[7],包括铁氧还蛋白1基因(ferredoxin 1,FDX1)和编码硫辛酸途径相关酶的其他6个基因,如脂肪酸转移酶1基因(lipoyltran sferase-1,LIPT1),硫辛酸合酶基因(lipoic acid synthase,LIAS)、二氢硫辛酰胺脱氢酶基因(dihydrolipoamide dehydrogenase,DLD)和硫辛酸蛋白靶点,如丙酮酸脱氢酶(PDH)复合物,包括丙酮酸脱氢酶E1-α亚基基因(pyruvate dehydrogenase E1-alpha,PDHA1)、丙酮酸脱氢酶β亚基基因(PDHB)和二氢硫辛酰胺转乙酰基酶基因(DLAT)。
FDX1是蛋白质硫辛酸化的上游调节因子,可促进DLAT和DLST发生蛋白质硫辛酸化,当胞内铜离子过量时,会使得这种蛋白质硫辛酸化修饰减少,同时过量的Cu+会与硫辛酸化的DLAT结合,发生寡聚化生成低聚物,这种低聚物是不溶性的且对细胞具有毒性[36]。由于组成丙酮酸脱氢酶的DLAT发生了寡聚化,使得丙酮酸脱氢酶活性丢失,这抑制了丙酮酸到乙酰CoA的转化,并最终影响TCA循环。值得注意的是,在FDX1的调控下,细胞内过量的铜离子抑制了Fe-S簇蛋白的合成,导致Fe-S簇蛋白丢失[36]。目前,铜死亡可以分为生理状态下铜离子载体递送铜离子进入细胞诱导的铜死亡,及病理状态下铜离子转运蛋白表达失衡诱导的,如CTR1的过表达或ATP7b表达受抑制时,均会使得胞内铜离子过载,铜死亡分子机制见图 4。
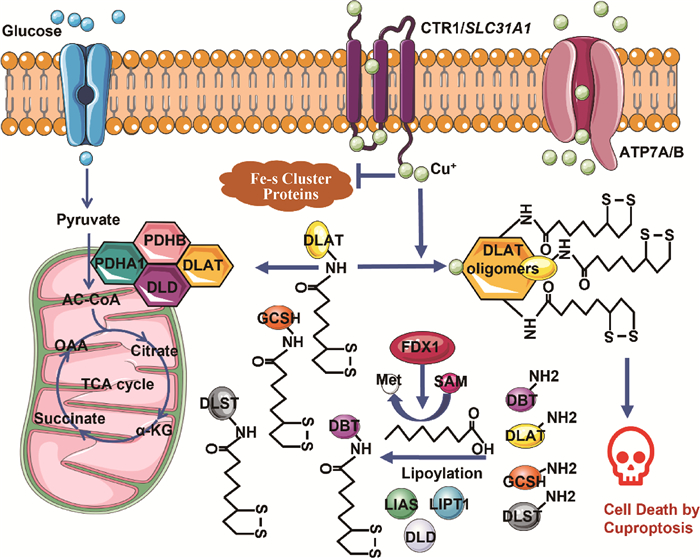
|
图 4 铜死亡分子机制 Fig. 4 Molecular mechanism of cuproptosis |
大肠杆菌(Escherichia coli,E. coli)是一种人畜易感的病原体,研究发现E.coli感染小鼠巨噬细胞后,FPN的表达降低,使得胞内亚铁含量升高,而三价铁含量无明显变化,脂质ROS含量增加,表明E.coli感染诱导了铁死亡[37]。有研究发现,能够引起人和多种动物结核病的结核分枝杆菌(mycobacterium tuberculosis,MTB)感染巨噬细胞后,会上升胞内Fe2+及脂质过氧化物水平并降低谷胱甘肽(glutathione,GSH)和谷胱甘肽过氧化物酶4(Glutathione peroxidase 4,GPX4)活性,最为关键的是在感染后使用Fer-1及铁螯合剂可以缓解细胞的死亡[38],此外,MTB分泌的蛋白酪氨酸磷酸酶A(protein tyrosine phosphatase A,PtpA)是MTB诱导铁死亡的关键因子[39]。人畜共患病原菌——铜绿假单胞菌(Pseudomonas aeruginosa,P. aeruginosa)分泌的脂氧合酶(lipoxygenase,pLoxA),可将宿主花生四烯酸-磷脂酰乙醇胺(arachidonic acid-phosphatidylethanolamines,AA-PE)氧化为15-氢过氧-AA-PE(15-hydroperoxy-AA-PE,15-HOO-AA-PE),并引发铁死亡[40]。
2.2 铁死亡与病毒感染蛋白质组学分析感染猪流感病毒(swine influenza virus,SIV)后的A549细胞,发现铁死亡通路最显著富集,并且下调了TF的表达,此外,SIV感染使得胞内Fe2+含量升高,ROS过量生成,重要的是Fer-1缓解了SIV感染引起的GSH下调[41];此外,使用铁死亡激活剂Erastin可以抑制猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)在Vero细胞中的复制[42]。新城疫病毒(Newcastle-disease-virus,NDV)感染会升高人胶质瘤细胞胞内亚铁水平,促进氧化应激,并通过p53-SLC7A11-GPX4途径诱导细胞发生铁死亡[43]。寨卡病毒(Zika virus,ZIKV)是一种蚊媒病毒,对ZIKV感染的小鼠大脑进行RNA-seq分析,发现铁死亡通路参与其中,并且ZIKV抑制了SLC40A1的表达,上调了TRF的表达,这使得胞内铁累积,从而诱导铁死亡[44]。单纯疱疹病毒1(Herpes simplex virus 1,HSV1)在感染星形胶质细胞和小胶质细胞后,会使得线粒体发生铁死亡的典型病变,同时使得Fe2+过载、ROS积累、GSH耗竭以及脂质过氧化的发生[45]。
3 铜死亡与疾病 3.1 Wilson病与铜死亡Wilson病(Wilson′s disease,WD)是由铜转运酶Atp7b编码基因的突变引起的[46-47]。Atp7b功能缺陷会导致胆汁铜排泄障碍和肝细胞内铜超载,引发肝细胞损伤。Atp7b-/-小鼠是Wilson病常用的评估模型,具有人类临床特征。新生的Atp7b-/-小鼠存在铜缺乏,5月龄时,肝、肾和脑中铜含量可高达正常水平的60倍[47]。研究表明,Atp7b-/-小鼠肝中出现了铜死亡现象,包括硫辛酸化相关蛋白和Fe-S簇蛋白的丢失以及Hsp70丰度的增加[7]。因此,Wilson病的治疗可以从铜死亡入手,如用低毒性的铜螯合剂四硫钼酸盐(tetrathiomolybdate,TTM)来减少铜离子在肝细胞的积聚,或使用CTR1抑制剂来降低细胞铜输入蛋白的活性,减少铜离子的输入并提高细胞活性。
3.2 癌症与铜死亡研究表明,相较于健康组织, 肿瘤细胞需要更高水平的铜,且癌细胞对铜的需求更为迫切[48]。报道指出,动物模型和多项癌症患者的肿瘤组织或血清中铜含量都升高,包括乳腺癌[49]、肺癌[50]和前列腺癌[51]等。此外,铜离子可直接激活多种促血管生成因子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)、肿瘤坏死因子(tumor necrosis factor,TNF)和白细胞介素1(interleukin-1,IL-1)[50],促进血管生成,进而辅助肿瘤的产生、生长及转移。
针对癌细胞对铜离子依赖性的现象,目前开展了两种治疗方法:一种是使用铜离子螯合剂来耗尽癌细胞内的铜离子池,另一种是补充铜离子载体来平衡癌细胞内的铜含量。其中,铜螯合剂——TTM可用于联合化疗,提高激酶抑制剂药物对BRAF驱动的MAPK等致癌信号通路的疗效,铜离子载体如双硫仑(disulfiram,DSF)或ES则可以靶向运输铜离子进入癌细胞线粒体,使癌细胞内铜稳态失衡,从而诱导铜离子相关的细胞死亡,长期临床试验表明,TTM可用于耗尽原发性肿瘤中的铜,阻止铜依赖的肿瘤转移,并不影响健康组织的功能[52]。
3.3 感染与铜死亡铜是一种很好的抑、杀菌剂[53-54],其抗菌作用已被广泛用于医疗保健和农业。当宿主受到病原体感染时,会调动大量铜离子到血液中,起到杀灭病原体的作用,这可能是机体的防御机制,通过铜离子的富集,对入侵的病原菌进行杀灭;另一方面,病原体可能为了逃逸铜离子的抑、杀作用,通过某种机制将富集的铜离子转运进入胞内使得铜离子失衡,从而诱导铜死亡。
白色念珠菌(Candida albicans,Cal)感染小鼠后使得血清和肝中铜离子含量升高[55];耐甲氧西林金黄色葡萄球菌、粪肠球菌、金黄色葡萄球菌、表皮葡萄球菌和腐生葡萄球菌引起的尿道感染会诱导尿铜和血浆铜蓝蛋白含量升高,且泌尿道中铜离子含量升高[56];感染新型隐球菌的小鼠肺泡免疫细胞内可见大量铜离子累积[57];此外,ZIKV感染星形胶质细胞后会使得铜释放的转运蛋白ATP7b表达下调,使用铜离子螯合剂可以缓解ZIKV感染引起的细胞活力下降[58]。基于这些报道,表明在病原体感染机体后会使得血浆或感染部位的铜离子含量升高,并且在ZIKV感染的细胞中检测到了ATP7b表达下调,这为胞内铜离子失衡提供了条件;虽然目前没有有力的证据表明病原体感染会诱导胞内铜离子失衡,但这些研究提示了感染存在诱导胞内铜离子失衡的的可能性,也为进一步诱导铜死亡提供了先决条件。
3.4 铜死亡的调节细胞发生铜死亡的关键因素是胞内铜离子的累积,这意味着可通过铜离子载体的靶向递送诱导铜死亡,或者是以铜离子螯合剂清除胞内过载的铜离子来缓解铜死亡。
ES是一种高效的铜离子载体,可将铜离子高效、靶向地运输到细胞线粒体内,减轻Menkes病的病理损伤和死亡率[59],并且ES的高效递送可以诱导细胞发生铜死亡[7]。TMT是经典的铜离子螯合剂,显示出高效的铜离子螯合作用和非常低的毒性,目前已被运用于WD的临床治疗[60],此外,TMT已被证明可以缓解铜死亡[7]。最近,研究人员开发了一种新的铜离子螯合剂透明质酸盐-二氨基己烷/黑磷(HA-DAH/BP),用于捕获肝中积累的铜离子以治疗WD,复合物显示出高肝细胞特异性靶向效率、选择性铜捕获能力,并对细胞具有低毒性[61],有望运用于铜死亡的抑制。
4 结论与展望在兽医研究中MTB[38]、P. aeruginosa[40]、SIV[41]、PEDV[42]、NDV[43]和ZIKV[44]是重要的病原体,均可引起人或动物的感染;前期的研究已表明这些病原体感染能够改变胞内亚铁离子的含量,促进氧化应激,并诱导铁死亡的发生。哺乳动物体内铜、铁离子的代谢具有一定的交集[16],病原体感染能够破坏胞内铁离子的稳态并诱导铁死亡,这期间可能影响了铜离子的稳态,然而铜死亡是否参与病原体感染还需进一步研究。目前已有证据表明,在感染性疾病中,宿主血液和感染部位中的铜含量都显著升高[57, 62],这是诱导胞内铜离子失衡的先决条件,然而在感染性疾病中细胞是否发生了铜死亡尚不清楚;大量的证据显示,病原体感染后能够上调胞内亚铁离子的水平,从而诱导铁死亡,目前对铁死亡的研究已经相对成熟,二者均由金属离子累积诱导,未来铜死亡的研究可以参照铁死亡的研究进行。
依赖胞内铜离子稳态的铜死亡,目前的研究仅限于生理状态下使用ES转运铜离子到线粒体、过表达CTR1导致铜累积以及病理状态下Wilson病模型鼠中ATP7b的功能缺失导致胞内铜过载。而对于铜死亡的研究尚有许多方面是不清楚的,如:过量铜离子诱导Fe-S簇蛋白丢失的具体作用机制是什么,其对最终的铜死亡有何作用;此外,虽已基本明了铜死亡分子机制,但其形态学标志和与其他细胞死亡方式有何差异目前尚不清楚。
| [1] |
GALLUZZI L, VITALE I, AARONSON S A, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018[J]. Cell Death Differ, 2018, 25(3): 486-541. DOI:10.1038/s41418-017-0012-4 |
| [2] |
SINGH R, LETAI A, SAROSIEK K. Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins[J]. Nat Rev Mol Cell Biol, 2019, 20(3): 175-193. DOI:10.1038/s41580-018-0089-8 |
| [3] |
SHARMA B R, KANNEGANTI T D. NLRP3 inflammasome in cancer and metabolic diseases[J]. Nat Immunol, 2021, 22(5): 550-559. DOI:10.1038/s41590-021-00886-5 |
| [4] |
SARHAN M, LAND W G, TONNUS W, et al. Origin and consequences of necroinflammation[J]. Physiol Rev, 2018, 98(2): 727-780. DOI:10.1152/physrev.00041.2016 |
| [5] |
HERZIG S, SHAW R J. AMPK: guardian of metabolism and mitochondrial homeostasis[J]. Nat Rev Mol Cell Biol, 2018, 19(2): 121-135. DOI:10.1038/nrm.2017.95 |
| [6] |
STOCKWELL B R, FRIEDMANN ANGELI J P, BAYIR H, et al. Ferroptosis: a regulated cell death nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171(2): 273-285. DOI:10.1016/j.cell.2017.09.021 |
| [7] |
TSVETKOV P, COY S, PETROVA B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins[J]. Science, 2022, 375(6586): 1254-1261. DOI:10.1126/science.abf0529 |
| [8] |
WANG H, SHAN C L, GAO B, et al. Yersiniabactin-producing E.coli induces the pyroptosis of intestinal epithelial cells via the NLRP3 pathway and promotes gut inflammation[J]. Int J Mol Sci, 2023, 24(14): 11451. DOI:10.3390/ijms241411451 |
| [9] |
JIANG X J, STOCKWELL B R, CONRAD M. Ferroptosis: mechanisms, biology and role in disease[J]. Nat Rev Mol Cell Biol, 2021, 22(4): 266-282. DOI:10.1038/s41580-020-00324-8 |
| [10] |
STOCKWELL B R, JIANG X J, GU W. Emerging mechanisms and disease relevance of ferroptosis[J]. Trends Cell Biol, 2020, 30(6): 478-490. DOI:10.1016/j.tcb.2020.02.009 |
| [11] |
DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [12] |
YAGODA N, VON RECHENBERG M, ZAGANJOR E, et al. RAS-RAF-MEK-dependent oxidative cell death involving voltage-dependent anion channels[J]. Nature, 2007, 447(7146): 864-868. |
| [13] |
CZŁONKOWSKA A, LITWIN T, DUSEK P, et al. Wilson disease[J]. Nat Rev Dis Primers, 2018, 4(1): 21. DOI:10.1038/s41572-018-0018-3 |
| [14] |
STERNLIEB I. Mitochondrial and fatty changes in hepatocytes of patients with Wilson's disease[J]. Gastroenterology, 1968, 55(3): 354-367. DOI:10.1016/S0016-5085(19)34045-4 |
| [15] |
KIM B E, NEVITT T, THIELE D J. Mechanisms for copper acquisition, distribution and regulation[J]. Nat Chem Biol, 2008, 4(3): 176-185. DOI:10.1038/nchembio.72 |
| [16] |
DOGUER C, HA J H, COLLINS J F. Intersection of iron and copper metabolism in the mammalian intestine and liver[J]. Compr Physiol, 2018, 8(4): 1433-1461. |
| [17] |
LUTSENKO S, BHATTACHARJEE A, HUBBARD A L. Copper handling machinery of the brain[J]. Metallomics, 2010, 2(9): 596-608. DOI:10.1039/c0mt00006j |
| [18] |
BREWER G J, ASKARI F, LORINCZ M T, et al. Treatment of Wilson disease with ammonium tetrathiomolybdate: IV.Comparison of tetrathiomolybdate and trientine in a double-blind study of treatment of the neurologic presentation of Wilson disease[J]. Arch Neurol, 2006, 63(4): 521-527. DOI:10.1001/archneur.63.4.521 |
| [19] |
MERLE U, EISENBACH C, WEISS K H, et al. Serum ceruloplasmin oxidase activity is a sensitive and highly specific diagnostic marker for Wilson's disease[J]. J Hepatol, 2009, 51(5): 925-930. DOI:10.1016/j.jhep.2009.06.022 |
| [20] |
FLEMING R E, PONKA P. Iron overload in human disease[J]. N Engl J Med, 2012, 366(4): 348-359. DOI:10.1056/NEJMra1004967 |
| [21] |
CAMASCHELLA C. Iron-deficiency anemia[J]. N Engl J Med, 2015, 372(19): 1832-1843. DOI:10.1056/NEJMra1401038 |
| [22] |
NARINDRASORASAK S, ZHANG X F, ROBERTS E A, et al. Comparative analysis of metal binding characteristics of copper chaperone proteins, Atx1 and ATOX1[J]. Bioinorg Chem Appl, 2004, 2: 196275. |
| [23] |
YANATORI I, KISHI F. DMT1 and iron transport[J]. Free Radic Biol Med, 2019, 133: 55-63. DOI:10.1016/j.freeradbiomed.2018.07.020 |
| [24] |
ZHANG Z Z, ZHANG F, AN P, et al. Ferroportin1 deficiency in mouse macrophages impairs iron homeostasis and inflammatory responses[J]. Blood, 2011, 118(7): 1912-1922. DOI:10.1182/blood-2011-01-330324 |
| [25] |
GAO G F, LI J, ZHANG Y T, et al. Cellular iron metabolism and regulation[M]//CHANG Y Z. Brain Iron Metabolism and CNS Diseases. Singapore: Springer, 2019: 21-32.
|
| [26] |
GAO M H, MONIAN P, QUADRI N, et al. Glutaminolysis and transferrin regulate ferroptosis[J]. Mol Cell, 2015, 59(2): 298-308. DOI:10.1016/j.molcel.2015.06.011 |
| [27] |
TANG D L, CHEN X, KANG R, et al. Ferroptosis: molecular mechanisms and health implications[J]. Cell Res, 2021, 31(2): 107-125. DOI:10.1038/s41422-020-00441-1 |
| [28] |
YU H C, YANG C C, JIAN L, et al. Sulfasalazine-induced ferroptosis in breast cancer cells is reduced by the inhibitory effect of estrogen receptor on the transferrin receptor[J]. Oncol Rep, 2019, 42(2): 826-838. |
| [29] |
PHADATARE P, DEBNATH J. Lysosomal lipid peroxidation mediates immunogenic cell death[J]. J Clin Invest, 2023, 133(8): e169240. DOI:10.1172/JCI169240 |
| [30] |
YIN H Y, XU L B, PORTER N A. Free radical lipid peroxidation: mechanisms and analysis[J]. Chem Rev, 2011, 111(10): 5944-5972. DOI:10.1021/cr200084z |
| [31] |
FARMER E E, MUELLER M J. ROS-mediated lipid peroxidation and RES-activated signaling[J]. Annu Rev Plant Biol, 2013, 64: 429-450. DOI:10.1146/annurev-arplant-050312-120132 |
| [32] |
WANG B Q, WANG Y, ZHANG J, et al. ROS-induced lipid peroxidation modulates cell death outcome: mechanisms behind apoptosis, autophagy, and ferroptosis[J]. Arch Toxicol, 2023, 97(6): 1439-1451. DOI:10.1007/s00204-023-03476-6 |
| [33] |
YANG W S, SRIRAMARATNAM R, WELSCH M E, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1-2): 317-331. DOI:10.1016/j.cell.2013.12.010 |
| [34] |
ZILKA O, SHAH R, LI B, et al. On the mechanism of cytoprotection by ferrostatin-1 and liproxstatin-1 and the role of lipid peroxidation in ferroptotic cell death[J]. ACS Cent Sci, 2017, 3(3): 232-243. DOI:10.1021/acscentsci.7b00028 |
| [35] |
XIE Y, HOU W, SONG X, et al. Ferroptosis: process and function[J]. Cell Death Differ, 2016, 23(3): 369-379. DOI:10.1038/cdd.2015.158 |
| [36] |
WANG Y Q, ZHANG L, ZHOU F F. Cuproptosis: a new form of programmed cell death[J]. Cell Mol Immunol, 2022, 19(8): 867-868. DOI:10.1038/s41423-022-00866-1 |
| [37] |
MA R N, FANG L, CHEN L, et al. Ferroptotic stress promotes macrophages against intracellular bacteria[J]. Theranostics, 2022, 12(5): 2266-2289. DOI:10.7150/thno.66663 |
| [38] |
AMARAL E P, COSTA D L, NAMASIVAYAM S, et al. A major role for ferroptosis in Mycobacterium tuberculosis-induced cell death and tissue necrosis[J]. J Exp Med, 2019, 216(3): 556-570. DOI:10.1084/jem.20181776 |
| [39] |
QIANG L H, ZHANG Y, LEI Z H, et al. A mycobacterial effector promotes ferroptosis-dependent pathogenicity and dissemination[J]. Nat Commun, 2023, 14(1): 1430. DOI:10.1038/s41467-023-37148-x |
| [40] |
DAR H H, TYURINA Y Y, MIKULSKA-RUMINSKA K, et al. Pseudomonas aeruginosa utilizes host polyunsaturated phosphatidylethanolamines to trigger theft-ferroptosis in bronchial epithelium[J]. J Clin Invest, 2018, 128(10): 4639-4653. DOI:10.1172/JCI99490 |
| [41] |
CHENG J H, TAO J, LI B Q, et al. Swine influenza virus triggers ferroptosis in A549 cells to enhance virus replication[J]. Virol J, 2022, 19(1): 104. DOI:10.1186/s12985-022-01825-y |
| [42] |
ZHANG H L, LI Y G, YANG R M, et al. Erastin inhibits porcine epidemic diarrhea virus replication in Vero cells[J]. Front Cell Infect Microbiol, 2023, 13: 1142173. DOI:10.3389/fcimb.2023.1142173 |
| [43] |
KAN X J, YIN Y C, SONG C P, et al. Newcastle-disease-virus-induced ferroptosis through nutrient deprivation and ferritinophagy in tumor cells[J]. iScience, 2021, 24(8): 102837. DOI:10.1016/j.isci.2021.102837 |
| [44] |
YAN Q, ZHENG W J, JIANG Y, et al. Transcriptomic reveals the ferroptosis features of host response in a mouse model of Zika virus infection[J]. J Med Virol, 2023, 95(1): e28386. DOI:10.1002/jmv.28386 |
| [45] |
XU X Q, XU T R, JI W T, et al. Herpes simplex virus 1-induced ferroptosis contributes to viral encephalitis[J]. mBio, 2023, 14(1): e0237022. DOI:10.1128/mbio.02370-22 |
| [46] |
ALA A, WALKER A P, ASHKAN K, et al. Wilson's disease[J]. Lancet, 2007, 369(9559): 397-408. DOI:10.1016/S0140-6736(07)60196-2 |
| [47] |
FERENCI P. Regional distribution of mutations of the ATP7B gene in patients with Wilson disease: impact on genetic testing[J]. Hum Genet, 2006, 120(2): 151-159. DOI:10.1007/s00439-006-0202-5 |
| [48] |
BLOCKHUYS S, CELAURO E, HILDESJÖ C, et al. Defining the human copper proteome and analysis of its expression variation in cancers[J]. Metallomics, 2017, 9(2): 112-123. DOI:10.1039/C6MT00202A |
| [49] |
DING X, JIANG M, JING H Y, et al. Analysis of serum levels of 15 trace elements in breast cancer patients in Shandong, China[J]. Environ Sci Pollut Res Int, 2015, 22(10): 7930-7935. DOI:10.1007/s11356-014-3970-9 |
| [50] |
OYAMA T, MATSUNO K, KAWAMOTO T, et al. Efficiency of serum copper/zinc ratio for differential diagnosis of patients with and without lung cancer[J]. Biol Trace Elem Res, 1994, 42(2): 115-127. DOI:10.1007/BF02785383 |
| [51] |
SALEH S A K, ADLY H M, ABDELKHALIQ A A, et al. Serum levels of selenium, zinc, copper, manganese, and iron in prostate cancer patients[J]. Curr Urol, 2020, 14(1): 44-49. DOI:10.1159/000499261 |
| [52] |
GE E J, BUSH A I, CASINI A, et al. Connecting copper and cancer: from transition metal signalling to metalloplasia[J]. Nat Rev Cancer, 2022, 22(2): 102-113. DOI:10.1038/s41568-021-00417-2 |
| [53] |
ZHANG B, ZHAO W W, GAO B, et al. Whole genome sequencing and biological characteristics of two strains of porcine Escherichia coli isolated from Saba pigs[J]. Curr Microbiol, 2022, 79(6): 182. DOI:10.1007/s00284-022-02873-x |
| [54] |
ZHANG B, WANG H D, ZHAO W W, et al. New insights into the construction of wild-type Saba pig-derived Escherichia coli irp2 gene deletion strains[J]. 3 Biotech, 2021, 11(9): 408. DOI:10.1007/s13205-021-02951-0 |
| [55] |
CULBERTSON E M, KHAN A A, MUCHENDITSI A, et al. Changes in mammalian copper homeostasis during microbial infection[J]. Metallomics, 2020, 12(3): 416-426. DOI:10.1039/c9mt00294d |
| [56] |
SAENKHAM-HUNTSINGER P, HYRE A N, HANSON B S, et al. Copper resistance promotes fitness of methicillin-resistant Staphylococcus aureus during urinary tract infection[J]. mBio, 2021, 12(5): e0203821. DOI:10.1128/mBio.02038-21 |
| [57] |
FESTA R A, HELSEL M E, FRANZ K J, et al. Exploiting innate immune cell activation of a copper-dependent antimicrobial agent during infection[J]. Chem Biol, 2014, 21(8): 977-987. DOI:10.1016/j.chembiol.2014.06.009 |
| [58] |
PUIG-PIJUAN T, SOUZA L R Q, DA S. G., PEDROSA C, et al. Copper regulation disturbance linked to oxidative stress and cell death during Zika virus infection in human astrocytes[J]. J Cell Biochem, 2022, 123(12): 1997-2008. DOI:10.1002/jcb.30323 |
| [59] |
GUTHRIE L M, SOMA S, YUAN S, et al. Elesclomol alleviates Menkes pathology and mortality by escorting Cu to cuproenzymes in mice[J]. Science, 2020, 368(6491): 620-625. DOI:10.1126/science.aaz8899 |
| [60] |
ALVAREZ H M, XUE Y, ROBINSON C D, et al. Tetrathiomolybdate inhibits copper trafficking proteins through metal cluster formation[J]. Science, 2010, 327(5963): 331-334. DOI:10.1126/science.1179907 |
| [61] |
KIM S J, HAN H H, HAHN S K. Hyaluronate/black phosphorus complexes as a copper chelating agent for Wilson disease treatment[J]. Biomater Res, 2021, 25(1): 20. DOI:10.1186/s40824-021-00221-x |
| [62] |
ACHARD M E S, STAFFORD S L, BOKIL N J, et al. Copper redistribution in murine macrophages in response to Salmonella infection[J]. Biochem J, 2012, 444(1): 51-57. DOI:10.1042/BJ20112180 |
(编辑 范子娟)



