2. 中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室, 哈尔滨 150069;
3. 兽用生物制品(泰州)国泰技术创新中心, 泰州 225300
2. State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069, China;
3. Guo Tai (Taizhou) Center of Technology Innovation for Veterinary Biologicals, Taizhou 225300, China
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起家猪及野猪的一种急性、热性、高度接触性传染病。ASFV的临床症状表现为发热、皮肤发绀和淋巴结、肾、胃肠黏膜明显出血,强毒株感染的病死率可高达100%[1]。2018年8月,我国辽宁省某养猪场首次暴发ASF疫情,而后迅速席卷全国,造成严重的经济损失[2-3]。目前,临床上流行的低毒力突变株产生亚急性型、且可造成长期潜伏感染,给ASF的精准预防和控制带来了很大的困难[4-6]。由于感染这些低毒力突变株的动物病毒载量低、间歇性排毒和个体差异大[4],采用qPCR检测ASFV是有限的。目前临床上已尝试同步检测抗原和抗体,以提高检测精度,但ASFV血清抗体检测技术还有待进一步提高,特别是早期诊断的灵敏度方面。
P30蛋白是ASFV粒子的主要诱导蛋白,由CP204 L基因编码,带有强的免疫原决定簇,可作为体液免疫反应非常有效的诱导蛋白。P30蛋白能在感染后早期表达和分泌,与世界动物卫生组织(Office International Des Epizooties,OIE)推荐的以CS-P为包被抗原的ELISA抗体检测方法相比,可以提前1周检测到ASFV特异性抗体,可用于感染后免疫反应的早期检测[7]。另外,ASFV主要以口鼻接触的方式感染,除了血清中产生特异性的IgG抗体外,还可从口腔液中检测特异性的黏膜sIgA抗体。sIgA抗体主要存在于口腔及呼吸道分泌液、唾液、泪液、乳汁、胃肠分泌液和泌尿生殖道分泌液中,是机体黏膜免疫的主要抗体,据报道,每100 mL人的唾液中IgA、IgG和IgM的含量分别仅为19.4、1.4和0.2 mg,明显低于血清中的含量,这使得以口腔液作为抗体检测对象时,IgA抗体检测极限没有血清抗体高,同时由于口腔液的均质性问题,检测值的均一稳定性也不如血清,但黏膜sIgA抗体也是病原体侵入后最先产生的免疫反应,常用作疾病感染早期诊断的检测指标[8-10]。许多学者将口腔液应用于不同猪病的抗体检测,如猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型病毒(PCV2)、猪瘟病毒、猪流感病毒和伪狂犬病病毒等[11-17],认为口腔液中的抗体水平可以满足免疫学诊断[11]。本课题组前期研究将呼吸道黏膜sIgA抗体作为猪肺炎支原体感染的诊断靶标,可实现感染后4 d即检测到转阳,比血清中IgG抗体转阳时间至少早14 d[18]。
因此,本研究拟建立一种不用采血,可以从口腔液中检测ASFV特异性sIgA抗体的方法,为ASFV的早期诊断提供技术手段。
1 材料与方法 1.1 试验材料1.1.1 材料 MiniBEST质粒纯化试剂盒、DNA凝胶回收试剂盒、BAC/PAC DNA Isolation Kit购自Omega公司;蛋白marker和质粒pFastBac1购自Thermo Fisher Scientific公司;X-tremeGENE HP DNA transfection转染试剂购自Roche公司;HRP-猪IgA单克隆抗体[19]由江苏省农业科学院兽医研究所制备与保存;Grace’s Insect Cell Culture购自Gibco公司;其他试剂均为分析纯。
1.1.2 参考血清 ASFV抗体阴性血清,收集自2017年以前健康猪,由江苏省农业科学院兽医研究所保存提供;ASFV抗体阳性血清,由中国农业科学院哈尔滨兽医研究所国家非洲猪瘟专业实验室提供,保存于-70 ℃。
1.1.3 参考口腔液 ASFV黏膜抗体阴性口腔液,采集自8~10周龄健康猪,其对应猪的血清经金诺百泰公司非洲猪瘟病毒ELISA抗体检测试剂盒(批号:20210646)鉴定为阴性,由江苏省农业科学院兽医研究所提供;感染ASFV后不同时间同一头猪的口腔液和血清样品由中国农业科学院哈尔滨兽医研究所国家非洲猪瘟专业实验室提供;猪瘟病毒(CSFV)抗体阳性口腔液、猪伪狂犬病病毒(PRV)抗体阳性口腔液和PRRSV抗体阳性口腔液分别采集自4~6周龄经口鼻免疫(滴鼻1头份,口服5头份)相应活疫苗(CSFV活疫苗(CVCC AV1412株)、PRV活疫苗(Bartha-K61株)和PRRSV活疫苗(JXA1-R株))后28 d的杜×长×大三元猪。三种抗体检测方法如下:分别在CSFV抗体检测试剂盒、PRV抗体检测试剂盒和PRRSV抗体检测试剂盒(均购自韩国金诺)的酶标板中每孔加入100 μL用试剂盒稀释液稀释一倍后的口腔液样品,37 ℃孵育2 h后洗涤3次,加再入1 ∶10 000稀释的HRP标记羊抗猪IgA(BETHYL公司产品),100 μL·孔-1,37 ℃孵育0.5 h后洗涤3次;加入底物TMB,37 ℃避光显色,测定OD450 nm值>2.1×未免对照组OD450 nm值;同时,同一头猪其对应时间的血清经相应的商品化ELISA抗体检测试剂盒鉴定也为阳性;以上样品均保存于-70 ℃。
1.1.4 临床样品 临床口腔液样品43份,其中30份采集自2018年以前屠宰场的屠宰猪,由江苏省农业科学研究院兽医研究所保存于-40 ℃。另13份采集自人工感染野毒变异株HLJ/HRB1/20后不同时间以及与感染猪同圈饲养猪,以及与口腔液样品对应的同一时间同一头猪的血清样品13份,由中国农业科学院哈尔滨兽医研究所国家非洲猪瘟专业实验室提供。
1.2 重组杆状病毒表达质粒SUMO-P30的构建1.2.1 密码子优化与基因合成 根据GenBank中已经发表的非洲猪瘟病毒P30基因序列CP204L(GenBank. NO. MH766894,124 770~125 375),采用分子生物学技术,根据昆虫细胞的密码子偏爱性,对ASFV的P30基因进行密码子优化,同时在P30的N′端添加6×His-SUMO标签。优化设计的基因6×His-SUMO-P30由通用生物系统(安徽)有限公司合成。
1.2.2 重组杆状病毒vBAC-P30的制备与鉴定 将上述合成的6×His-SUMO-P30基因通过BamHI和HindIII双酶切插入杆状病毒供体质粒pFastBac1,获得含SUMO-P30基因的重组杆状病毒供体质粒pFastBac-SUMO-P30。再转化E. coli DH10Bac感受态细胞,按X-tremeGENE HP DNA transfection说明书转染对数生长期的Sf9细胞;当细胞病变达80%时,离心收集培养上清即为重组杆状病毒vBAC-P30。用BAC/PAC DNA Isolation Kit提取重组Bacmid DNA,以其为模板采用引物S-p30(y-F2):5′-GGATCCACCATGTCCTACTACC-3′和S-p30(y-R2):5′-AAGCTTTTAGAACATCAGGTGC-3′进行PCR鉴定和测序。
1.3 重组SUMO-P30蛋白的表达与鉴定1.3.1 重组SUMO-P30蛋白的表达与纯化 将重组杆状病毒vBAC-P30株按1%的体积(V/V)感染sf9细胞,72~96 h后,1 000×g离心10 min,弃掉上清,收集细胞沉淀。用Binding buffer重悬细胞沉淀,超声破碎。4 ℃,12 000×g 15 min收获上清液。经0.22 μm滤膜过滤装载至Ni亲和柱。用10倍柱体积Binding buffer进行漂洗,用5倍柱体积Elution buffer进行洗脱,洗脱后的蛋白用蛋白浓缩超滤管(截留分子量10 000 MWCO)4 000× g离心,洗涤浓缩后即为SUMO-P30蛋白,分装,-70 ℃冻存备用。
1.3.2 重组SUMO-P30蛋白的Western blot鉴定 将纯化的SUMO-P30重组蛋白经SDS-PAGE电泳转印至NC膜,用5%脱脂乳(PBS稀释)37 ℃封闭2 h后,分别以500倍稀释(PBS)的ASFV抗体阳性血清和ASFV抗体阴性血清作为一抗,2~8 ℃孵育过夜;TBST洗涤3次,10 min·次-1。用TBST进行1 ∶20 000倍稀释的HRP-羊抗猪IgG酶标抗体,37 ℃孵育0.5 h。TBST洗涤3次,10 min·次-1。按ECL试剂盒说明书进行显色,观察特异蛋白条带。
1.4 ASFV间接ELISA黏膜sIgA抗体检测方法的条件优化及效果检验1.4.1 包被方案的确定及条件优化 用棋盘法对P30重组蛋白不同包被浓度(4~0.5 μg·mL-1)和口腔液样品稀释度(9 ∶1、8 ∶2、5 ∶5、2 ∶8、1 ∶9)进行优化;以最佳方案包被P30重组蛋白后,分别以5%脱脂乳、3%脱脂乳、1%水解乳蛋白、1%牛血清白蛋白(BSA)、1%酪蛋白(OXOID)和0.25%明胶作为封闭液,37 ℃封闭2 h后弃去,分别检测2份ASFV抗体阴性口腔液和2份ASFV抗体阳性口腔液样品,37 ℃温育30~120 min后弃去液体,洗涤酶标板3次后加入不同稀释比例的HRP-猪IgA单克隆抗体,置37 ℃温育30~90 min后弃去液体,洗涤酶标板3次,加入TMB显色液,37 ℃避光显色5~20 min后终止反应。读取OD450 nm值,计算P/N平均值。
1.4.2 临界值CUT-OFF的确定 按照优化好的方案检测219份健康猪口腔液样品(其中育肥猪169份、母猪20份、保育猪30份),与其对应同一头猪的血清样品经金诺百泰公司非洲猪瘟病毒ELISA抗体检测试剂盒鉴定为阴性,计算S/P值=(样品的OD450 nm值-阴性对照的OD450 nm平均值)/(阳性对照的OD450 nm平均值-阴性对照的OD450 nm平均值),再计算所有样品的S/P平均值(X)和3倍S/P值标准偏差(SD)之和,将X+3SD作为阴性血清的临界值,小于等于临界值判为阴性。大于临界值判为阳性。
1.4.3 敏感性检验 取ASFV黏膜抗体阳性口腔液,按2倍比稀释至128倍,利用本试验建立的ELISA方法进行检测,评估该ELISA方法的灵敏度。
1.4.4 特异性检验 利用本试验建立的间接ELISA方法分别检测CSFV、PRV、PRRSV黏膜抗体阳性口腔液,检测该方法的特异性。
1.4.5 重复性与稳定性检验 取2份ASFV黏膜抗体阳性口腔液作为强阳性样品、2份经16倍稀释(PBS)的ASFV黏膜抗体阳性口腔液作为弱阳性样品及4份阴ASFV黏膜抗体阴性口腔液作为阴性样品,使用同批次包被的酶标板进行5次重复试验,检验该方法的批次内稳定性;使用3个不同批次包被的酶标板进行检测,检验该方法的批次间稳定性;分别以OD450 nm读值计算出变异系数,分析该方法的稳定性。
1.4.6 抗体分泌规律检验 以本试验建立ASFV间接ELISA黏膜抗体检测方法检测2头经口鼻接种105 TCID50 ASFV强毒株HLJ/18后0、3、6 d的口腔液样品(2头试验猪均在感染后第8天死亡)和2头经口腔接种106 TCID50 ASFV人工致弱株HLJ/18-7GD后0、5、10、15、20、30、45、60 d的口腔液样品,同时用金诺百泰公司ASFV ELISA抗体检测试剂盒检测同一头猪的血清抗体,比较黏膜抗体和血清抗体的转阳时间。
1.4.7 临床样品的检测 用本研究建立的非洲猪瘟病毒间接ELISA黏膜抗体检测方法对43份临床口腔液样品进行检测,并将其中来自于人工感染猪的13份口腔液样品和13份血清样品,分别用本研究方法及商品化非洲猪瘟病毒血清抗体检测试剂盒进行检测并比较,计算符合率。
2 结果 2.1 重组质粒的PCR产物及酶切鉴定将人工合成的6×His-SUMO-P30基因克隆到pFastBac1载体上后,转染SF9细胞,构建重组杆状病毒vBAC-P30株。以提取的重组质粒为模板,通过PCR扩增获得了大小约为981 bp的特异性目的条带,与预期大小一致,测序结果通过比对显示插入序列无突变和缺失,结果表明正确构建了重组杆状病毒vBAC-P30株。
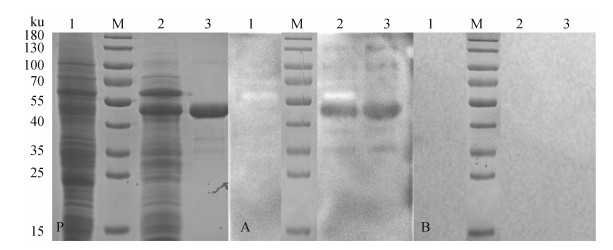
2.2 重组SUMO-P30蛋白的SDS-PAGE和Western blot鉴定重组杆状病毒vBAC-P30株在SF9细胞中传代两次后收获培养液上清,经Ni柱亲和纯化后,对纯化蛋白进行SDS-PAGE和Western blot鉴定。SDS-PAGE结果显示,纯化后出现一条约47 ku大小的单一条带,Western blot结果显示,其与ASFV抗体阳性血清在约47 ku大小左右位置出现特异性反应条带(图 1);而与ASFV抗体阴性血清没有出现特异性反应条带,由此证明该SUMO-P30重组表达蛋白能够被ASFV抗体识别,具有良好的反应原性。
|
P. 重组蛋白SUMO-P30纯化前后PAGE分析;A. 非洲猪瘟病毒抗体阳性血清;B. 非洲猪瘟病毒抗体阴性血清。泳道:1. 空载体pFastBac1-6×His-SUMO转染SF9细胞破碎蛋白;M. Protein Marker;2. 纯化前的感染SF9细胞破碎蛋白;3. 纯化后的SUMO-P30重组蛋白 P. PAGE analysis of recombinant protein SUMO-P30 before and after purification; A. ASFV antibody positive serum; B. ASFV antibody negative serum. Lane: 1. Empty plasmid pFastBac1-6×His SUMO transfected SF9 cell disruption protein; 2. Infected SF9 cell disruption protein before purification; 3. Purified SUMO-P30 recombinant protein 图 1 重组蛋白SUMO-P30的SDS-PAGE和Western blot分析 Fig. 1 SDS-PAGE and Western blot analysis of recombinant protein SUMO-P30 |
试验结果显示5%脱脂乳为最佳封闭液。P30重组蛋白的最佳包被浓度为1.0 μg·mL-1,口腔液样品与5%脱脂乳的最佳比例为8 ∶2,待检口腔液在37 ℃的最佳孵育时间为120 min;酶标抗体的最佳作用稀释度为1 ∶5 000,最佳反应时间为60 min;TMB底物的最佳显色时间为15 min。
2.4 临界值的确定按照优化好的方案检测219份健康猪口腔液样品(其中采集自育肥猪169份,母猪20份,保育猪30份,与其对应同一头猪的血清样品经金诺百泰公司ASFV ELISA抗体检测试剂盒检测为阴性),计算S/P值。结果显示,所有阴性口腔液样品的S/P平均值(X)为0.024,标准偏差(SD)为0.050,阴性样品的S/P平均值+3倍标准差为0.174,考虑到临床样品的复杂性,适当放宽阳性样品判定的临界值,即当样品的S/P值<0.2时判为阴性,当样品的S/P值≥0.2时判为阳性(图 2)。

|
图 2 阴性口腔液样品的黏膜sIgA抗体ELISA检测结果(n=219) Fig. 2 ELISA results of mucosal sIgA antibody in negative oral fluid samples(n=219) |
利用本研究建立的间接ELISA方法检测经PBS作1 ∶2、1 ∶4、1 ∶8、1 ∶16、1 ∶32、1 ∶64、1 ∶128稀释的ASFV黏膜sIgA抗体阳性口腔液,结果显示,2份ASFV黏膜sIgA抗体阳性口腔液的最大稀释倍数均为1 ∶32(图 3),表明该方法具有较好的敏感性。

|
图 3 敏感性试验结果 Fig. 3 Sensitivity test results |
利用本研究建立的间接ELISA方法分别检测CSFV、PRV、PRRSV黏膜sIgA抗体阳性口腔液,结果如表 1所示,该方法能够特异性检测ASFV黏膜sIgA抗体口腔液,具有良好的特异性。
|
|
表 1 特异性试验结果 Table 1 Specific test results |
利用建立的ASFV间接ELISA黏膜sIgA抗体检测方法对8份口腔液样本进行批次内及批次间重复试验,结果显示其变异系数均小于15%(表 2),表明该方法具有较好的稳定性。
|
|
表 2 ASFV间接ELISA黏膜sIgA抗体检测方法的重复性试验结果(OD450 nm值) Table 2 Repeatability test results of ASFV indirect ELISA mucosal sIgA antibody detection method(OD450 nm value) |
以本研究建立的ASFV间接ELISA黏膜sIgA抗体检测方法检测2头经口鼻感染ASFV强毒株HLJ/18后0、3、6 d的口腔液样品(2头试验猪均在感染后第8天死亡)和2头经口腔接种106 TCID50 ASFV人工致弱株HLJ/18-7GD后0、5、10、15、20、30、45、60 d的口腔液样品,同时用金诺百泰公司ASFV ELISA抗体检测试剂盒检测同一头猪的血清抗体,结果如图 4所示,感染ASFV强毒株HLJ/18后第3天就有1头猪可检测到口腔液中的ASFV特异性黏膜sIgA抗体转阳,到感染后第6天,两头猪均可检测到黏膜sIgA抗体转阳,而两头猪的血清抗体在感染后的第6天仍为阴性(图 4A)。感染人工致弱株HLJ/18-7GD后,口腔液中的ASFV特异性黏膜sIgA抗体最早在第5天就显著提升,30~45 d后可稳定检出抗体阳性;血清抗体在监测期内一直未检测到转阳(图 4B)。

|
A. 感染强毒株HLJ/18;B. 口腔接种人工致弱株HLJ/18-7GD。血清IgG抗体的判定标准:S/P值>0.4为阳性,S/P值≤0.4为阴性;黏膜sIgA抗体的判定标准:S/P值≥0.2为阳性,S/P值<0.2为阴性 A. Infected with virulent strain HLJ/18; B. Oral inoculation of artificially attenuated strain HLJ/18-7GD. The determination standard of serum IgG antibody: S/P value > 0.4 is positive, and S/P value ≤ 0.4 is negative; The determination standard of mucosal sIgA antibody: S/P value ≥ 0.2 is positive, and S/P value < 0.2 is negative 图 4 人工感染ASFV后黏膜抗体与血清抗体的分泌规律 Fig. 4 Secretion patterns of mucosal and serum antibodies after artificial infection with ASFV |
用本研究建立的非洲猪瘟病毒间接ELISA黏膜抗体检测方法对43份临床口腔液样品进行检测,其中采集自2018年以前的30份口腔液样品均为阴性;采集自人工感染猪的13份口腔液样品中有10份阳性,而对应的13份血清样品经商品化非洲猪瘟病毒血清抗体检测试剂盒检测出5份为阳性。本研究方法与商品化血清抗体检测试剂盒的检测阳性符合率为100%,阴性符合率为37.5%,总符合率为61.5%。
|
|
表 3 13份临床口腔液与13份血清样品检测结果符合率 Table 3 Compliance rate of 13 clinical oral fluid samples and 13 serum samples detection results |
ASF于2018年传入我国,是一种急性、热性、感染病死率高达100%的烈性传染病,给我国养猪业造成了严重的损失[2-3]。经过近4年的传播,国内出现了部分自然变异弱毒株,其致病力发生一定程度减弱,引起的临床症状不明显,传播不易引起注意,更容易造成大面积扩散,对其根除也将变得困难[20-21]。当猪被低毒力毒株感染时,高特异性与灵敏度的抗体诊断可能是监测被感染动物的最佳方法。目前,我国商品化的ASFV抗体检测试剂盒都是检测血清中的抗体,在ASFV的监测和防控工作中被应用,但其检测敏感性仍有待进一步提高[22-24]。而猪的机体在应答ASFV感染时,除了血清中产生特异性的IgG抗体外,在呼吸道与消化道黏膜还可产生特异性的sIgA抗体。sIgA抗体主要存在于呼吸道分泌液、唾液、泪液、乳汁、胃肠分泌液和泌尿生殖道分泌液中,是机体黏膜免疫的主要抗体,也是病原体通过侵入后最先产生的免疫反应。ASFV作为一种主要通过口鼻途径传播的病原,口腔液中的sIgA抗体非常适合作为早期检测的抗体样本。另外,以口腔液为检测样品而替代常规的血清样品,在样品采集的操作上更为方便,也更加符合动物福利的要求。
P30蛋白是ASFV较为保守的主要结构蛋白,在感染早期表达和分泌,感染后4 h即可在细胞浆中检测到P30,可用于感染早期的检测[25-27],是目前国内外最常选择的检测靶标蛋白之一[22, 28-33]。本研究选择利用昆虫细胞表达系统来表达P30蛋白,并且通过在目标蛋白前增加SUMO标签和His标签,使P30蛋白呈可溶性表达,且表达量可达每100 mL的SF细胞产出10 mg以上的纯化蛋白,大大提高了P30蛋白的产出。通过与ASFV阴、阳性血清的Western blot试验结果表明,SUMO和His标签不会影响试验的特异性。为之后产业化降低成本提供了可能。
在确定临界值的试验中,由于大量的临床阳性样品难以得到,本研究通过用大量的临床阴性样品的S/P平均值+3倍的标准差来确定,结果发现仍有个别样品的S/P值在0.174以上,考虑到临床样品的复杂性,将判定临界值确定为0.2以减少检测的假阳性。在特异性检验试验中,由于没有CSFV、PRV、PRRSV黏膜抗体阳性口腔液标准品,本研究通过检测接种相应的弱毒活疫苗后不同时间点的口腔液发现,免疫后28 d时,用相应病毒的商品化抗体检测试剂盒中的抗原包被板检测口腔液样品,以超过对照未免猪的口腔液检测值的2.1倍为阈值线,均可判为阳性,可作为CSFV、PRV、PRRSV黏膜抗体阳性口腔液样品使用。
在检测经口鼻接种ASFV强毒株HLJ/18后的口腔液样品结果显示,感染强毒株后第3天即可从口腔液中检测到的ASFV特异性黏膜sIgA抗体,而血清抗体在感染后的第6天仍为阴性。在检测口服接种ASFV基因缺失株HLJ/18-7GD后的抗体分泌规律试验中,有1头猪口腔液中的黏膜sIgA抗体最早感染后5 d,S/P值就显著提升,但在随后的10、15和20 d三个时间点不能稳定的检测到特异性黏膜抗体,直到接种后第30天以后才可稳定的检测到特异性黏膜抗体,这可能是由于口腔液中的黏膜抗体不均一,或采样前试验猪喝水导致口腔液被稀释等原因造成。本研究中,试验猪经口服接种ASFV基因缺失株HLJ/18-7GD后,血清抗体虽在监测末期出现提升,但在整个监测期内一直未检测到转阳,这与以前发表的报道中,以相同剂量肌肉注射14 d后出现血清抗体转阳不一致[34]。这可能与ASFV弱毒株以不同的接种方式感染后,在体内增殖效率及抗体应答能力的差异有关。
在检测口腔液中ASFV黏膜sIgA抗体分泌规律试验中,本研究只统计了2头试验猪的样品,数量较少,但表现出了一致的趋势。自然变异弱毒株的感染在目前临床上较为多见,给常规的核酸检测与血清抗体检测带来很大挑战。本研究建立的黏膜sIgA抗体检测方法在自然变异弱毒株感染的检测中,相比常规的血清抗体检测方法体现出更为敏感的优势,可实现ASFV感染的早期与敏感诊断。另外,在目前越来越注重ASFV精准防控和提高动物福利的大环境下,无需采集血清即可快速检测ASFV感染的方法具有广阔的应用前景。
4 结论本研究通过昆虫细胞系统表达了ASFV的SUMO-P30蛋白,并建立了ASFV黏膜sIgA抗体的间接ELISA检测方法,可从感染猪的口腔液中检测到特异性sIgA黏膜抗体,阳性口腔液的最大稀释度可达1 ∶32,且不与CSFV、PRV、PRRSV黏膜抗体阳性口腔液反应,感染ASFV后3~5 d,S/P值就显著提升,具有良好的敏感性和特异性。为ASFV的早期血清学诊断方法提供了新的思路,为ASFV的防控提供了科学工具。
| [1] |
ZAKARYAN H, REVILLA Y. African swine fever virus: current state and future perspectives in vaccine and antiviral research[J]. Vet Microbiol, 2016, 185: 15-19. DOI:10.1016/j.vetmic.2016.01.016 |
| [2] |
王清华, 任炜杰, 包静月, 等. 我国首例非洲猪瘟的确诊[J]. 中国动物检疫, 2018, 35(9): 1-4. WANG Q H, REN W J, BAO J Y, et al. The first outbreak of African swine fever was confirmed in China[J]. China Animal Health Inspection, 2018, 35(9): 1-4. DOI:10.3969/j.issn.1005-944X.2018.09.001 (in Chinese) |
| [3] |
扈荣良, 于婉琪, 陈腾. 非洲猪瘟及防控技术研究现状[J]. 中国兽医学报, 2019, 39(2): 357-369. HU R L, YU W Q, CHEN T. African swine fever and its current research status of prevention and control[J]. Chinese Journal of Veterinary Science, 2019, 39(2): 357-369. (in Chinese) |
| [4] |
GALLARDO C, SOLER A, NURMOJA I, et al. Dynamics of African swine fever virus (ASFV) infection in domestic pigs infected with virulent, moderate virulent and attenuated genotype Ⅱ ASFV European isolates[J]. Transbound Emerg Dis, 2021, 68(5): 2826-2841. DOI:10.1111/tbed.14222 |
| [5] |
SUN E C, HUANG L Y, ZHANG X F, et al. Genotype Ⅰ African swine fever viruses emerged in domestic pigs in China and caused chronic infection[J]. Emerg Microbes Infect, 2021, 10(1): 2183-2193. DOI:10.1080/22221751.2021.1999779 |
| [6] |
SUN E C, ZHANG Z J, WANG Z L, et al. Emergence and prevalence of naturally occurring lower virulent African swine fever viruses in domestic pigs in China in 2020[J]. Sci China Life Sci, 2021, 64(5): 752-765. DOI:10.1007/s11427-021-1904-4 |
| [7] |
PEREZ-FILGUEIRA D M, GONZALEZ-CAMACHO F, GALLARDO C, et al. Optimization and validation of recombinant serological tests for African Swine Fever diagnosis based on detection of the p30 protein produced in Trichoplusia ni larvae[J]. J Clin Microbiol, 2006, 44(9): 3114-3121. DOI:10.1128/JCM.00406-06 |
| [8] |
CORTHÉSY B. Recombinant secretory immunoglobulin A in passive immunotherapy: linking immunology and biotechnology[J]. Curr Pharm Biotechnol, 2003, 4(1): 51-67. DOI:10.2174/1389201033378020 |
| [9] |
WOOF J M, KERR M A. The function of immunoglobulin A in immunity[J]. J Pathol, 2006, 208(2): 270-282. DOI:10.1002/path.1877 |
| [10] |
GLEESON M, HALL S T, MCDONALD W A, et al. Salivary IgA subclasses and infection risk in elite swimmers[J]. Immunol Cell Biol, 1999, 77(4): 351-355. DOI:10.1046/j.1440-1711.1999.00839.x |
| [11] |
TSUNETSUGU-YOKOTA Y, ITO S, ADACHI Y, et al. Saliva as a useful tool for evaluating upper mucosal antibody response to influenza[J]. PLoS One, 2022, 17(2): e0263419. DOI:10.1371/journal.pone.0263419 |
| [12] |
PRICKETT J, SIMER R, CHRISTOPHER-HENNINGS J, et al. Detection of Porcine reproductive and respiratory syndrome virus infection in porcine oral fluid samples: a longitudinal study under experimental conditions[J]. J Vet Diagn Invest, 2008, 20(2): 156-163. DOI:10.1177/104063870802000203 |
| [13] |
姜斌, 任逸懿, 陈漪, 等. 猪血清与口腔液中猪瘟、O型口蹄疫、伪狂犬病毒疫苗免疫抗体检测结果的相关性研究[J]. 黑龙江畜牧兽医, 2018(14): 101-104. JIANG B, REN Y Y, CHEN Y, et al. Study on the correlation between the immune antibody detection results of swine fever, foot-and-mouth disease type O, and pseudorabies virus vaccines in pig serum and oral fluid[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(14): 101-104. (in Chinese) |
| [14] |
PRICKETT J R, JOHNSON J, MURTAUGH M P, et al. Prolonged detection of PCV2 and anti-PCV2 antibody in oral fluids following experimental inoculation[J]. Transbound Emerg Dis, 2011, 58(2): 121-127. DOI:10.1111/j.1865-1682.2010.01189.x |
| [15] |
KITTAWORNRAT A, WANG C, ANDERSON G, et al. Ring test evaluation of the repeatability and reproducibility of a Porcine reproductive and respiratory syndrome virus oral fluid antibody enzyme-linked immunosorbent assay[J]. J Vet Diagn Invest, 2012, 24(6): 1057-1063. DOI:10.1177/1040638712457929 |
| [16] |
LANGENHORST R J, LAWSON S, KITTAWORNRAT A, et al. Development of a fluorescent microsphere immunoassay for detection of antibodies against porcine reproductive and respiratory syndrome virus using oral fluid samples as an alternative to serum-based assays[J]. Clin Vaccine Immunol, 2012, 19(2): 180-189. DOI:10.1128/CVI.05372-11 |
| [17] |
位玉玲, 李沛东, 于少芳, 等. 猪群口腔液与血液中PRRSV和PCV2感染的病原和抗体消长规律调查[J]. 畜牧与兽医, 2017, 49(1): 80-85. WEI Y L, LI P D, YU S F, et al. Investigation on pathogen and antibody dynamics of PRRSV and PCV2 infection in oral fluid and serum of pigs[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(1): 80-85. (in Chinese) |
| [18] |
BAI Y, GAN Y, HUA L Z, et al. Application of a sIgA-ELISA method for differentiation of Mycoplasma hyopneumoniae infected from vaccinated pigs[J]. Vet Microbiol, 2018, 223: 86-92. DOI:10.1016/j.vetmic.2018.07.023 |
| [19] |
SONG W X, FENG Z X, BAI Y, et al. Monoclonal antibodies against porcine sIgA and their use in immunohistochemistry[J]. Monoclon Antib Immunodiagn Immunother, 2015, 34(6): 386-389. DOI:10.1089/mab.2015.0038 |
| [20] |
张艳艳, 张静远, 杨金金, 等. 1株非洲猪瘟病毒自然变异毒株的鉴定[J]. 中国兽医学报, 2021, 41(2): 199-207. ZHANG Y Y, ZHANG J Y, YANG J J, et al. Identification of a natural variant of African swine fever virus in China[J]. Chinese Journal of Veterinary Science, 2021, 41(2): 199-207. (in Chinese) |
| [21] |
宋浩, 张丽, 张交儿, 等. 非洲猪瘟流行病学及诊断技术研究进展[J]. 中国兽医学报, 2022, 42(5): 1066-1076. SONG H, ZHANG L, ZHANG J E, et al. Advances in epidemiology and diagnosis of African swine fever[J]. Chinese Journal of Veterinary Science, 2022, 42(5): 1066-1076. (in Chinese) |
| [22] |
LI D X, ZHANG Q, LIU Y T, et al. Indirect ELISA using multi-antigenic dominants of p30, p54 and p72 recombinant proteins to detect antibodies against African swine fever virus in pigs[J]. Viruses, 2022, 14(12): 2660. DOI:10.3390/v14122660 |
| [23] |
GAO Y, XIA T, BAI J, et al. Preparation of monoclonal antibodies against the viral p54 protein and a blocking ELISA for detection of the antibody against African swine fever virus[J]. Viruses, 2022, 14(11): 2335. DOI:10.3390/v14112335 |
| [24] |
YU X X, ZHU X J, CHEN X Y, et al. Establishment of a blocking ELISA detection method for against African swine fever virus p30 antibody[J]. Front Vet Sci, 2021, 8: 781373. DOI:10.3389/fvets.2021.781373 |
| [25] |
TULMAN E R, ROCK D L. Novel virulence and host range genes of African swine fever virus[J]. Curr Opin Microbiol, 2001, 4(4): 456-461. DOI:10.1016/S1369-5274(00)00235-6 |
| [26] |
HVBNER A, PETERSEN B, KEIL G M, et al. Efficient inhibition of African swine fever virus replication by CRISPR/Cas9 targeting of the viral p30 gene (CP204L)[J]. Sci Rep, 2018, 8(1): 1449. DOI:10.1038/s41598-018-19626-1 |
| [27] |
GIMÉNEZ-LIROLA L G, MUR L, RIVERA B, et al. Detection of African swine fever virus antibodies in serum and oral fluid specimens using a recombinant protein 30 (p30) dual matrix indirect ELISA[J]. PLoS One, 2016, 11(9): e0161230. DOI:10.1371/journal.pone.0161230 |
| [28] |
WANG M X, SONG J X, SUN J R, et al. Development of an effective double antigen sandwich ELISA based on p30 protein to detect antibodies against African swine fever virus[J]. Viruses, 2022, 14(10): 2170. DOI:10.3390/v14102170 |
| [29] |
ZHOU G J, SHI Z W, LUO J C, et al. Preparation and epitope mapping of monoclonal antibodies against African swine fever virus P30 protein[J]. Appl Microbiol Biotechnol, 2022, 106(3): 1199-1210. DOI:10.1007/s00253-022-11784-7 |
| [30] |
OH T, DO D T, LAI D C, et al. Chronological expression and distribution of African swine fever virus p30 and p72 proteins in experimentally infected pigs[J]. Sci Rep, 2022, 12(1): 4151. DOI:10.1038/s41598-022-08142-y |
| [31] |
NAH J J, KWON O K, CHOI J D, et al. Development of an indirect ELISA against African swine fever virus using two recombinant antigens, partial p22 and p30[J]. J Virol Methods, 2022, 309: 114611. DOI:10.1016/j.jviromet.2022.114611 |
| [32] |
周改静, 罗俊聪, 石正旺, 等. 非洲猪瘟病毒p30蛋白单克隆抗体的制备及阻断ELISA抗体检测方法的建立[J]. 畜牧兽医学报, 2022, 53(12): 4337-4345. ZHOU G J, LUO J C, SHI Z W, et al. Preparation of monoclonal antibody against African swine fever virus p30 protein and establishment of a blocking ELISA for detection of antibody against ASFV p30 protein[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(12): 4337-4345. (in Chinese) |
| [33] |
马俊, 王志远, 梁杏玲, 等. 基于非洲猪瘟病毒p30与p54蛋白表位串联多肽的间接ELISA抗体检测方法的建立[J]. 畜牧兽医学报, 2022, 53(12): 4325-4336. MA J, WANG Z Y, LIANG X L, et al. Development of an indirect ELISA antibodies detection method on tandem-epitope peptide of african swine fever virus p30 and p54 proteins[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(12): 4325-4336. (in Chinese) |
| [34] |
FAN Y Q, CHEN W Y, JIANG C G, et al. Host responses to live-attenuated ASFV (HLJ/18-7GD)[J]. Viruses, 2022, 14(9): 2003. DOI:10.3390/v14092003 |
(编辑 范子娟)



