2. 锦州医科大学畜牧兽医学院, 锦州 121000;
3. 山东畜牧兽医职业学院, 潍坊 261000;
4. 扬州优佳创生物科技有限公司, 扬州 225261
2. College of Animal Husbandry and Veterinary Medicine, Jinzhou Medicine University, Jinzhou 121000, China;
3. Shandong Vocational Animal Science and Veterinary College, Weifang 261000, China;
4. Yangzhou Youjiachuang Biotechnology Co., Ltd, Yangzhou 225261, China
鸡毒支原体(Mycoplasma gallisepticum,MG)又称为鸡败血支原体、鸡霉形体,是鸡慢性呼吸道疾病(chronic respiratory diseases,CRD)的主要病原[1]。受感染的鸡会出现流涕、呼吸啰音、叫声嘶哑、食减神郁、缩颈垂翅等,病程一般持续时间为1~2月,若无并发症其死亡率在10%左右。若与其它病原体混合感染,死亡率可迅速上升至60%[2]。MG主要有水平和垂直两种传播方式,感染该病原将会影响鸡群增重、生长发育和产蛋率,并且一般很难根治[3]。Osman等[4]对埃及鸡群的MG进行检测,发现MG在鸡群的感染率达到33.3%。Roussan等[5]对约旦鸡场进行了调查,发现MG的阳性率达到了6.6%,且MG和禽流感病毒的混合感染鸡场比例达到了5.7%。在我国,程倩倩[6]对太原、忻州两市的15个蛋鸡场的1 325份鸡血清进行平板凝集试验,结果显示这些鸡场MG抗体的阳性率平均为36.3%。姜兰兰等[7]对北京市127个养鸡场进行调查,发现MG抗体阳性率达80.6%。林琳[8]对闽北地区不同免疫背景及不同用途的90个白羽肉鸡养殖场采集1 800份喉气管拭子样品进行Real-time PCR检测,MG阳性场率为33.33%。由此可见,国内外MG感染情况十分严重。郭杨丽等[9]和魏津等[10]从MG感染的气囊病料中分离出MG;隋兆峰等[11]从病鸡肺、气囊中分离出MG;牛家强等[12]从疑似慢性呼吸道病感染的鸡气管中分离出MG;吴春琳等[13]从感染的鸡喉拭子中分离出MG。目前较少见从鸡胚中分离MG的报道。国内外对于MG的研究已开展百余年,但至今对支原体病的控制,尤其对MG感染的防控仍是现代集约化养禽业的重点。目前药物控制、疫苗免疫和加强管理是控制该病的主要措施。国内外禽支原体病治疗和预防过程中使用较为广泛的药物是大环内酯类、氟喹诺酮类、四环素类等抗菌药,但不同地区分离的菌株对抗生素的敏感性有差异,且耐药性问题也较为严重,由此造成MG感染防治困难,病情反复,威胁公共卫生安全。本研究对广东某禽业未出壳死胚进行分离培养、血清学试验、16S rRNA支原体通用引物序列鉴定及基于该基因序列的遗传进化分析、动物致病性及药物敏感性试验,为今后的鸡毒支原体诊断、治疗及疫苗研制提供了基础保障。
1 材料与方法 1.1 病料、菌株、试剂及实验动物病料来源于广东某禽业未出壳死胚;MG Rlow菌株、MG标准阳性鸡血清、MS标准阳性鸡血清、SPF鸡阴性血清均购自中国兽医药品监察所;支原体培养基基础购自青岛海博生物技术有限公司;马血清购自美国Gibco公司;琼脂购自英国Oxoid公司;胶回收试剂盒购自美国Thermo Fisher Scientific公司;2×Taq Master Mix、DM2000 DNA Marker、青霉素和氯化钠购自上海生工生物工程有限股份公司;绿如蓝核酸染料购自泽叶生物有限公司;SPF鸡胚和3周龄SPF鸡均购自浙江立华农业科技有限公司。
鸡毒支原体液体培养基[14]:支原体基础培养基26.4 g溶解于800 mL ddH2O中,高压灭菌15 min,冷却至室温,无菌加入10%马血清;LB液体培养基:Tryptone 8 g、Yeast extract 4 g、NaCl 8 g溶解于800 mL ddH2O中高压灭菌后备用。LB固体培养基:在上述液体LB培养基基础上加入12 g琼脂高压灭菌后制成平板放入4 ℃冰箱备用。
1.2 抗菌药物信息替米考星(含量90%,批号909G201),购自北京索莱宝科技有限公司;泰乐菌素(批号FS1622261),购自天津阿尔塔科技有限公司;泰万菌素(800 U·mg-1)、红霉素(920 U·mg-1,批号Y18F8C29407)、吉他霉素(含量>1 400 U·mg-1,批号L09J9K65033)、泰妙菌素(含量98%,批号X10S6H3193)、氟苯尼考(含量98%,批号S19A8Y34179)、多西环素(含量98%,批号Y30A8C42634)及恩诺沙星(规格98%,批号H20A9Z68212)均购自上海源叶生物科技有限公司;盐酸沃尼妙林(含量98.8%,批号100603),购自湖北龙翔药业科技股份有限公司;林可霉素(批号C14549481)、土霉素(批号C14849549)购自麦克林试剂;大观霉素(批号WD0317B4014J)购自生工生物工程(上海)股份有限公司。
1.3 病原的分离培养与形态观察取死胚卵黄液、卵黄组织、肺和肝于4 mL含100 μg·mL-1浓度青霉素的支原体液体培养基中,37 ℃ 5% CO2培养箱放置5 h后,5 000 r·min-1离心10 min,取上清液1 mL,接种至新的支原体液体培养基中,置于37 ℃、5% CO2培养箱中培养2~3 d,观察培养基颜色变化。待培养基颜色由红变橘黄时,将培养液转接到固体培养基上培养,4~5 d后于显微镜下观察菌落形态,并挑取单菌落,转接于液体培养基中扩大培养。
1.4 细菌L型鉴定将分离株用不含青霉素的培养基连续传代9次,再将其接种于固体支原体培养基上,3~5 d涂片、染色镜检,观察其是否恢复成细菌形态。
1.5 平板凝集试验于50 mL培养基中扩大培养分离菌株,10 000 r·min-1离心15 min,500 μL PBS缓冲液重悬菌体沉淀,取1片干净载玻片,从左边至右分别滴加10 μL MG标准阳性鸡血清、MS标准阳性鸡血清、SPF鸡阴性血清,再分别向血清中滴加10 μL重悬菌液,用枪头将其混匀,1 min观察结果。
1.6 分子生物学鉴定1.6.1 分离菌株基因组粗提 取分离株菌液2 mL,12 000 r·min-1离心15 min,用移液枪吸掉上清部分,用200 μL PBS重悬沉淀,夹上防爆夹,放在浮漂上,水温100 ℃煮10 min,冰上放置5 min,5 000 r·min-1离心5~10 min,吸取上清部分即为菌株的粗提基因组。
1.6.2 支原体16 S rRNA通用引物PCR扩增 根据GenBank中MG Rlow株16S rRNA基因设计引物,由生工生物工程(上海)有限公司合成,上下游引物序列分别为5′-GAGTTTGATCCTGGCTCA-3′和5′-ATTACCGCGGCTGGCAG-3′。对分离菌进行PCR扩增的预期产物大小为500~600 bp。PCR扩增程序:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,72 ℃最后延伸10 min;共30个循环。
1.6.3 PCR产物测序 取10 μL上述PCR产物,在1%琼脂糖凝胶上进行电泳,电压100 V,电泳30 min,对产物条带进行胶回收:具体操作参考Thermo Fisher Scientific胶回收试剂盒说明书进行。测定浓度后,送上海擎科生物公司进行序列测序。将测序结果用BLASTp检索non-redundant protein sequences (nr)数据库,并用MEGA 5.0软件与其它支原体16S rRNA进行序列比对。
1.7 支原体分离菌株生长曲线测定试验将纯化后的分离株转接到支原体液体培养基中,待培养基颜色刚刚变黄,按5%转接比例转接到新的支原体液体培养基中,置于37 ℃、5% CO2培养箱中培养。取培养不同时间点(0、12、15、18、21、24、28、32、36、48和60 h)的菌液,分别测定其颜色改变单位(color change units, CCUs)和菌落形成单位(colony forming units, CFUs)。
1.8 血凝试验在支原体液体培养基中培养MGRlow和待鉴定的分离菌株,至液体变为橘黄色,8 000 r·min-1离心后PBS洗涤2次,最后用PBS重悬并调整菌液浓度,使其OD600 nm值为1.0。取1块细胞凝集板,每孔加入25 μL PBS,取调整好浓度的待测菌液25 μL加入第1孔,吹打均匀后换枪头吸取25 μL至第2孔,重复该操作至第11孔,吸取25 μL弃掉,最后1孔为血细胞对照组。每孔再加入25 μL PBS和25 μL 1%鸡红细胞,震荡混匀,室温40 min观察结果。
1.9 致病性试验1.9.1 SPF鸡胚攻毒试验 将分离株以及MG Rlow分别培养至对数生长期,8 000 r·min-1离心10 min,PBS洗涤2次后用PBS重悬即为待攻毒菌液。将SPF鸡胚在温度38 ℃、湿度60%的孵化箱中进行孵化至7日龄,取35只成功孵化的鸡胚,分为7组,每组5只,分别接种新鲜处理的5株分离株、MG Rlow攻毒菌液(2×105 CCU·只-1),以及PBS (200 μL·只-1),接种方式为卵黄囊接种。接种后继续孵化鸡胚,直至出壳,每天照蛋一次,记录鸡胚死亡情况。
1.9.2 SPF鸡攻毒试验 准备新鲜的分离株和MG Rlow株攻毒菌液,方法同“1.9.1”,取3周龄SPF鸡35只,采取气管灌注方式进行攻毒,每个分离株和MG Rlow各攻毒5只,攻毒剂量为5×107 CCU·只-1,剩余5只按同样方式灌注500 μL PBS作为阴性对照,观察鸡的临床症状,3周后解剖鸡,并拍照记录病理变化。
1.10 最小抑菌浓度(MIC)测定将分离株以及MG Rlow分别培养至对数生长期,以MG菌株编号标记96孔板各行。每行第1孔加入用培养基配制好的两倍最高测试浓度的抗生素200 μL,其后2~12孔则均加入100 μL支原体液体培养基。吸取第1孔100 μL至第2孔,依次稀释直至第10孔吹打混匀后吸弃100 μL。用支原体培养基将原培养液稀释至105 CCU·mL-1。第12孔以及第10~第1孔,由低稀释度到高稀释度依次加入100 μL菌液。其中倒数第二孔为阴性对照,倒数第一孔为阳性对照。置于培养箱,37 ℃温箱孵育4~7 d,每日观察,直至阳性对照孔颜色变黄且阴性对照孔颜色未变,抑制菌株生长不发生颜色变化的最高稀释度即为测试药物的最小抑菌浓度(MIC)。每种药物设3个平行。每种药物的MIC重复测定3次。
2 结果 2.1 病原的分离培养与形态学观察取死胚的卵黄液、卵黄膜、肺和肝的浸泡液,在支原体培养基中培养1~2 d,可见颜色由红变为橘黄,将变黄菌液10倍稀释涂于支原体固体培养基,培养5~7 d可见小水珠样菌落,低倍镜下可见其菌落形态为中央凸起的“油煎蛋状”(图 1),符合支原体的形态特征。

|
A. 分离株在支原体液体培养基中生长后培养基颜色变化;B. 分离株在40倍物镜下菌落形态;C. 分离株在100倍物镜下菌落形态 A. The color of the culture medium changes after the isolated strain grows in the liquid medium of Mycoplasma; B. Colony morphology of isolated strains under a 40× objective lens; C. Colony morphology of isolated strains under a 100× objective lens 图 1 分离株在支原体液体培养基和固体培养基上的生长状态 Fig. 1 The growth of new isolates on liquid medium and solid medium of mycoplasma |
将各分离株用支原体培养基连续传代8~10代,接种于支原体固体培养基上,其菌体依然能通过0.45 μm滤器,并保持其原来菌落形态。说明分离株不是细菌或病毒。
2.3 平板凝集鉴定各分离株能与MG标准阳性鸡血清反应,与MS标准阳性鸡血清、SPF鸡血清不发生凝集反应,见图 2。

|
A~E. 各分离株与血清的反应;F. MG Rlow与血清的反应;1. MG标准阳性鸡血清;2. MS标准阳性鸡血清;3. SPF鸡血清 A-E. The isolates react with sera; F. MG Rlow reacts with sera; 1. MG standard positive chicken sera; 2. MS standard positive chicken sera; 3. SPF chicken sera 图 2 分离菌株平板凝集试验 Fig. 2 Plate agglutination test of isolated strains |
2.4.1 支原体16S rRNA通用引物PCR扩增 将分离株粗提基因组DNA用作模板进行PCR扩增,在550 bp左右可见条带,如图 3。
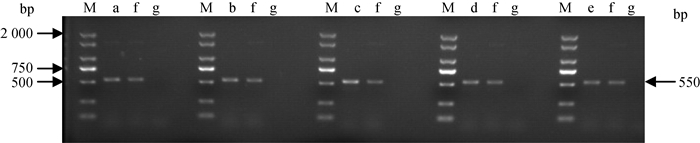
|
M. DM 2000 marker;a~e. 各分离株基因组DNA;f. MG Rlow基因组DNA;g. ddH2O M. DM 2000 marker; a-e. Genomic DNAs of each isolate; f. Genomic DNAs of MG Rlow; g. ddH2O 图 3 分离株用支原体16S rRNA通用引物PCR扩增结果 Fig. 3 The PCR amplification results of different isolates using universal primers for 16S rRNA |
2.4.2 测序与分析 将扩增产物送上海擎科生物公司进行序列测定,用DNA Strar比对分离株和MG 16S rRNA序列,结果显示,分离株的16S rRNA与MG相似性达99.9%,表明这5株分离株均为鸡毒支原体,分别命名为MG 18-31、MG 18-32、MG 18-3、MG 8-13、MG 8-15。
2.5 分离株生长曲线测定各分离株在支原体液体培养基中培养0~60 h的生长情况大致相同,以其中一株MG 18-31为例,可见该菌株在0~32 h均处于滴度上升期,32 h达峰值,此时滴度为109 CCU·mL-1,32 h后滴度开始下降,60 h分离株死亡,分离株CFU计数法生长曲线与CCU计数法生长曲线结果完全一致,如图 4。

|
A. 分离株CCU计数法生长曲线;B. 分离株CFU计数法生长曲线 A. Growth curve based on CCU counting method; B. Growth curve based on CFU counting method 图 4 分离株MG 18-31生长曲线 Fig. 4 Growth curve of MG 18-31 strain |
各分离株(MG18-31、MG 18-32、MG18-3、MG 8-13、MG 8-15)及MG Rlow分别与1%鸡红细胞发生凝集反应,凝集效价为1 ∶16、1 ∶4、1 ∶4、1 ∶4、1 ∶4和1 ∶8,见图 5。

|
A~E. 各分离株与红细胞发生凝集反应;F. MG Rlow与红细胞发生凝集反应;1~11. 血清稀释度分别为1 ∶2、1 ∶4、1 ∶8、1 ∶16、1 ∶32、1 ∶64、1 ∶128、1 ∶256、1 ∶512、1 ∶1 024、1 ∶2 048;12. 阴性对照 A-E. Agglutination reaction of each isolate with red blood cells; F. Agglutination reaction of Rlow with red blood cells; 1-11. Sera were diluted at 1 ∶2, 1 ∶4, 1 ∶8, 1 ∶16, 1 ∶32, 1 ∶64, 1 ∶128, 1 ∶256, 1 ∶512, 1 ∶1 024, 1 ∶2 048, respectively; 12. Negative control 图 5 分离菌株血凝试验 Fig. 5 Hemagglutination test of the different isolates |
分离株和MG Rlow菌液(106 CCU·mL-1,200 μL·只-1)和PBS(200μL·只-1)各接种5枚6~8日龄SPF鸡胚卵黄囊,结果显示感染鸡胚大多于17~21 d死亡,其中MG Rlow、MG 18-31、MG 18-3攻毒鸡胚全部死亡,MG 18-32、MG 8-13出壳一枚,MG 8-15出壳两枚,MG Rlow、MG 18-31、MG 18-3死亡率均为100%,MG 18-32和MG 8-13死亡率为80%,MG 8-15死亡率为60%。死亡胚体表现为胚体发育迟缓、蜷缩,剖检可见鸡气囊有干酪物,出壳感染鸡表现为生长迟缓,精神不振,对照组均正常出壳,见图 6。

|
A~F. MG 18-31、MG 18-32、MG 18-3、MG 8-13、MG 8-15、MG Rlow感染鸡胚死胚剖检气囊病变;G. PBS对照剖检气囊;H~M. MG 18-31、MG 18-32、MG 18-3、MG 8-13、MG 8-15、MG Rlow感染鸡胚蜷缩状死胚;N. 感染鸡胚与PBS对照组出壳后鸡状态对比 A-F. MG 18-31, MG 18-32, MG 18-3, MG 8-13, MG 8-15, MG Rlow infected chicken embryos with dead embryo dissection for balloon lesions; G. PBS control dissection of airbags; H-M Infected chicken embryos with MG 18-31, MG 18-32, MG 18-3, MG 8-13, MG 8-15, and MG Rlow resulted in curled up dead embryos; N. Comparison of chickens hatching from infected chicken embryos and PBS control chicken embryos 图 6 鸡胚致病性试验 Fig. 6 Chicken embryos infection test |
分离株和MG Rlow各攻毒5只三周龄SPF鸡,每只鸡攻毒500 μL,攻毒剂量为108 CCU·mL-1,结果显示鸡在攻毒后10 d左右出现啰音,叫声嘶哑。3周后剖检主要病变为鸡气囊增厚,有干酪样物附着于表面,PBS组气囊未见病变,见图 7。

|
A~G. MG 18-31、MG 18-32、MG 18-3、MG 8-13、MG 8-15、MG Rlow攻毒SPF鸡气囊;G. PBS对照SPF鸡气囊 A-G. Air bags from MG 18-31, MG 18-32, MG 18-3, MG 8-13, MG 8-15, or MG Rlow challenged SPF chicken; G. Air bags from PBS inoculated SPF chicken 图 7 SPF鸡攻毒试验 Fig. 7 SPF chickens infection test |
MG分离株对13种抗生素药物的MIC测定结果见表 1。5株MG分离株对盐酸沃尼妙林(<0.062 5 μg·mL-1)、多西环素(0.062 5 μg·mL-1)、泰妙菌素(0.062 5~0.125 μg·mL-1)及泰万菌素(0.062 5~0.25 μg·mL-1)均表现出较高的敏感性;其次是土霉素(0.125~2 μg·mL-1)、氟苯尼考(0.5~4 μg·mL-1)、大观霉素(1~16 μg·mL-1)及恩诺沙星(2~8 μg·mL-1);对泰乐菌素(4~16 μg·mL-1)、替米考星(8~64 μg·mL-1)、吉他霉素(>32 μg·mL-1)、红霉素(>32 μg·mL-1),特别是对林可霉素(8~128 μg·mL-1)的敏感性较低。
|
|
表 1 MG分离株和标准菌株MG Rlow对13种药物的MIC测定结果 Table 1 The minimum inhibitory concentrations of 13 drugs for 5 MG isolates and standard strain MG Rlow |
1905年英国科学家Dodd首次发现了MG感染火鸡的病例,当时将此病称为“流行性肺肠炎”[15]。1933年Nelson[16]首次从感染鸡群中分离到MG,之后便在全世界范围内广泛传播。Marouf等[17]在进行细菌学检查的332个样本中,发现206个样本呈MG阳性,阳性率为62%。虽然MG感染率很高,但是若无并发症其死亡率并不高,在10%左右。若与其它病原体[如新城疫病毒(Newcastle disease virus,NDV)、鸡传染性支气管炎病毒(infectious bronchitis virus,IBV)、大肠杆菌(Escherichia coli,E. coli)、禽流感病毒(avian influenza virus,AIV)等]混感,死亡率可迅速上升至60%[18]。MG因其独特的感染表现,早期的诊断和预防显得尤为重要。目前,MG鉴别诊断方法包括分离鉴定、血清学及分子生物学检测等。支原体的分离极其困难,成功率不高,尽管这样,分离鉴定依然是诊断支原体感染的“金标准”。临床上常用血清学诊断主要包括血清平板凝集(SPA)、血凝抑制(HI)和酶联免疫吸附(ELISA试验)[19]三种试验方法。血清学诊断的优点在于可检测大量样本、操作简单、快捷、方便,因此临床上对该方法应用较普遍;但其缺点是存在非特异性反应和交叉反应,易出现假阳性结果。分子学检测主要以PCR为主,该方法照比血清学方法更加特异、高效,是目前应用最为广泛的一种检测方法。
本试验对广东某规模化鸡场死鸡胚进行细菌的分离鉴定,结果从中成功分离到5株MG,且其均为卵黄液中分离,可见从鸡胚的卵黄液中分离MG的成功率较高。将这些分离株接到固体培养基上,5 d左右看到和支原体形态相似的菌落。在无青霉素的液体培养基中连续传9代,未见菌落形态发生变化,确定分离株不是细菌或病毒。将分离株菌悬液与MG标准阳性血清混合,可见出现明显凝集颗粒,与MS标准阳性血清和SPF鸡阴性血清混合则未见凝集,初步推测分离株为鸡毒支原体。
致病性与非致病性禽源支原体主要区别在于致病性禽源支原体可吸附鸡、火鸡等的红细胞,产生红细胞凝集反应[20]。血凝试验证实,所分离的5株MG均能产生明显的血凝反应,其血凝效价不完全相同,其中MG18-31株和参考株MG Rlow株的血凝效价较高,分别为1 ∶16及1 ∶8,其余4株MG菌血凝效价均为1 ∶4。鸡胚感染试验结果显示,MG Rlow、MG 18-31、MG 18-3攻毒鸡胚死亡率100%,MG 18-32、MG 8-13攻毒鸡胚死亡率80%,MG 8-15攻毒死亡率为60%。其中血凝效价较高的MG18-31株和参考株MGRlow株攻毒后的鸡胚均显示100%死亡,提示血凝效价高的MG菌株其致病性也可能较强,但血凝效价高低是否与菌株毒力相关还有待进一步研究。
MG菌对鸡胚攻毒的症状比SPF鸡攻毒症状更为明显。死亡胚体表现为胚体发育迟缓、蜷缩,剖检可见鸡气囊有干酪物,将黄色干酪物进行分菌鉴定,均分离到支原体。尽管有小鸡顺利出壳,但其生长缓慢,精神沉郁,极少饮水进食,站立困难,一周以内死亡,说明所分离MG菌株可使鸡胚致弱甚至致死。而SPF鸡攻毒后主要引起鸡声音沙哑、食欲减退、眼眶轻微红肿等表征,剖检后能看到明显的气囊病变,但肝、脾、肺等脏器未见明显病变,仅有个别鸡只有脾肿大现象。结合攻毒试验结果,建议对MG菌株毒力评估采用鸡胚攻毒和SPF鸡攻毒两种评价方式共同进行。
由于没有细胞壁,支原体不受许多抗生素的影响,如β-内酰胺类、糖肽类和针对细胞壁合成的磷霉素。在动物中,针对支原体感染的最有效和最广泛使用的抗菌剂是四环素类、大环内酯类、氟喹诺酮类和截短侧耳素类抗生素。对5株MG临床分离株的药敏试验结果显示,其与标准株MG Rlow的MIC值相比,对于泰万菌素(大环内酯类)、多西环素(半合成四环素类)、盐酸沃尼妙林及泰妙菌素(截短侧耳素类)均具有较高敏感性,与标准株MG Rlow的MIC值无显著性差异;对于大环内酯类的替米考星、泰乐菌素、红霉素、吉他霉素,以及氟喹诺酮类的恩诺沙星而言,则表现出不同程度的耐药趋势。国内外有几项研究报道了MG的体外药敏水平[21-24]。MG对泰妙菌素的MIC值始终低于体外测试的其他抗菌剂的MIC值;大多数MG也对四环素类抗生素敏感,对土霉素和多西环素的MIC值较低;MG对红霉素等大环内酯类药物没有内在的耐药性,大多数菌株对大环内酯类药物敏感。然而本研究发现MG分离株对多种大环内酯类药物,如替米考星、泰乐菌素、红霉素、吉他霉素等存在显著的耐药性,对恩诺沙星也存在一定程度的耐药趋势。由于在国内外都常常使用以恩诺沙星、替米考星、泰乐菌素等来治疗MG感染,所以国内外都出现了不同程度的耐药性,MG耐药性的逐渐攀升增加了临床的治疗压力和成本,因此需要对常用抗生素的耐药机制进行研究以帮助临床解决耐药压力问题,并对临床用药起到指导作用。
4 结论尽管目前鸡毒支原体分离鉴定的案例较多,从死鸡胚中分离培养MG的报道较少见,本研究从广东省某规模化鸡场的死鸡胚卵黄液中成功分离到5株MG,鸡胚和SPF鸡攻毒试验均证实分离株能致死鸡胚,引起鸡气囊炎。药物敏感性试验发现这5株MG均对泰万菌素、多西环素、盐酸沃尼妙林及泰妙菌素有较高敏感性,对替米考星、泰乐菌素、恩诺沙星、红霉素、吉他霉素、林可霉素呈现出不同程度耐药性。该研究为MG的分离鉴定提供可参考的技术方法,为MG攻毒模型建立提供研究基础,为MG感染治疗的用药选择提供参考依据。
| [1] |
AHMAD I, KLEVEN S H, GLISSON J R, et al. Further studies of Mycoplasma gallisepticum serum plate agglutination antigen grown in medium with artificial liposomes substituting for serum[J]. Avian Dis, 1989, 33(1): 140-149. DOI:10.2307/1591079 |
| [2] |
STIPKOVITS L, KEMPF I. Mycoplasmoses in poultry[J]. Rev Sci Tech, 1996, 15(4): 1495-1525. DOI:10.20506/rst.15.4.986 |
| [3] |
ARMOUR N K, FERGUSON-NOEL N. Evaluation of the egg transmission and pathogenicity of Mycoplasma gallisepticum isolates genotyped as ts-11[J]. Avian Pathol, 2015, 44(4): 296-304. DOI:10.1080/03079457.2015.1044890 |
| [4] |
OSMAN K M, ALY M M, AMIN Z M S, et al. Mycoplasma gallisepticum: an emerging challenge to the poultry industry in Egypt[J]. Rev Sci Tech, 2009, 28(3): 1015-1023. DOI:10.20506/rst.28.3.1940 |
| [5] |
ROUSSAN D A, KHAWALDEH G, SHAHEEN I A. A survey of Mycoplasma gallisepticum and Mycoplasma synovaie with avian influenza H9 subtype in meat-type chicken in Jordan between 2011-2015[J]. Poult Sci, 2015, 94(7): 1499-1503. DOI:10.3382/ps/pev119 |
| [6] |
程倩倩. 山西省部分地区鸡支原体病的血清学检测和病原的分离鉴定[D]. 晋中: 山西农业大学, 2020. CHENG Q Q. Serological detection and pathogen identification of Avian mycoplasmosis in some areas of Shanxi Province[D]. Jinzhong: Shanxi Agricultural University, 2020. (in Chinese) |
| [7] |
姜兰兰, 沈光年, 周德刚, 等. 北京市鸡毒支原体和滑液囊支原体血清学调查[J]. 中国动物检疫, 2020, 37(6): 25-29, 72. JIANG L L, SHEN G N, ZHOU D G, et al. Serological investigation on Mycoplasma gallisepticum and Mycoplasma synoviae in Beijing city[J]. China Animal Health Inspection, 2020, 37(6): 25-29, 72. (in Chinese) |
| [8] |
林琳. 闽北地区白羽肉鸡鸡毒支原体感染的病原学调查及其流行菌株的分离鉴定[D]. 福州: 福建农林大学, 2018. LIN L. Etiological investigation of M. gallisepticum in white meat-type chickens in Northern Fujian province and isolation and identification of epidemic strains[D]. Fuzhou: Fujian Agriculture and Forestry University, 2018. (in Chinese) |
| [9] |
郭杨丽, 宋翔, 刘乃芝, 等. 1株鸡毒支原体的分离鉴定及体外敏感中药的筛选[J]. 中国畜牧兽医, 2021, 48(3): 1064-1071. GUO Y L, SONG X, LIU N Z, et al. Isolation and identification of one strain of Mycoplasma gallisepticum and screening of sensitive traditional Chinese medicine in vitro[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(3): 1064-1071. (in Chinese) |
| [10] |
魏津, 王甲, 赵浩然, 等. 不同地区鸡毒支原体的分离鉴定及药物敏感性研究[J]. 中国畜牧兽医, 2023, 50(1): 368-376. WEI J, WANG J, ZHAO H R, et al. Isolation, identification and antimicrobial susceptibility of Mycoplasma gallisepticum from different areas[J]. China Animal Husbandry & Veterinary Medicine, 2023, 50(1): 368-376. (in Chinese) |
| [11] |
隋兆峰, 张侃吉, 徐建义, 等. 山东地区鸡毒支原体分离鉴定及耐药性监测[J]. 中国家禽, 2016, 38(14): 51-54. SUI Z F, ZHANG K J, XU J Y, et al. Isolation, identification and drug resistance monitoring of Mycoplasma gallisepticum in Shandong area[J]. China Poultry, 2016, 38(14): 51-54. (in Chinese) |
| [12] |
牛家强, 徐业芬, 胡思顺, 等. 藏鸡鸡毒支原体的分离鉴定及对常用抗菌药物的敏感性试验[J]. 中国兽医学报, 2018, 38(11): 2084-2087, 2093. NIU J Q, XU Y F, HU S S, et al. Isolation and identification of Mycoplasma gallisepticum from Tibetan chickens in Tibet and its sensitivity to common atimicrobial agents[J]. Chinese Journal of Veterinary Science, 2018, 38(11): 2084-2087, 2093. (in Chinese) |
| [13] |
吴春琳, 黄宝钦, 蓝天韵, 等. 福建白羽肉鸡鸡毒支原体的分离鉴定及最小抑菌浓度测定[J]. 中国畜牧兽医, 2021, 48(4): 1489-1497. WU C L, HUANG B Q, LAN T Y, et al. Isolation, identification and minimum inhibitory concentration determination of Mycoplasma gallisepticum from white-feathered broilers in Fujian[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(4): 1489-1497. (in Chinese) |
| [14] |
陆凤. 鸡毒支原体、滑液支原体二联灭活苗的研究[D]. 兰州: 甘肃农业大学, 2015. LU F. Study on inactivated of mycoplasma gallisepticum disease and mycoplasma synoviae disease combined vaccine[D]. Lanzhou: Gansu Agricultural University, 2015. (in Chinese) |
| [15] |
DODD S. Epizootic pneumo-enteritis of the turkey[J]. J Comp Pathol Ther, 1905, 18: 239-245. DOI:10.1016/S0368-1742(05)80041-4 |
| [16] |
NELSON J B. Studies on an uncomplicated coryza of the domestic fowl: Ⅱ. The relation of the "bacillary" coryza to that produced by exudate[J]. J Exp Med, 1933, 58(3): 297-304. DOI:10.1084/jem.58.3.297 |
| [17] |
MAROUF S, KHALF M A, ALORABI M, et al. Mycoplasma gallisepticum: a devastating organism for the poultry industry in Egypt[J]. Poult Sci, 2022, 101(3): 101658. DOI:10.1016/j.psj.2021.101658 |
| [18] |
BRANTON S L, LEIGH S A, PURSWELL J L, et al. A chronicle of serologic response in commercial layer chickens to vaccination with commercial F strain Mycoplasma gallisepticum vaccine[J]. Avian Dis, 2010, 54(3): 1108-1111. DOI:10.1637/9173-112409-Case.1 |
| [19] |
陈杨, 孟林春, 郭梦娇, 等. 检测鸡毒支原体抗体的间接ELISA方法和HI试验方法的建立及初步应用[J]. 畜牧兽医学报, 2023, 54(5): 2062-2072. CHEN Y, MENG L C, GUO M J, et al. Establishment and preliminary application of indirect ELISA method and HI test for detection of Mycoplasma Gallisepticum antibody[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(5): 2062-2072. (in Chinese) |
| [20] |
郭建华, 陈德威. 鸡毒支原体诊断方法研究进展[J]. 中国兽医杂志, 1998, 24(2): 46-47. GUO J H, CHEN D W. Research progress on diagnostic methods of Mycoplasma gallisepticum[J]. Chinese Journal of Veterinary Medicine, 1998, 24(2): 46-47. DOI:10.3969/j.issn.0529-6005.1998.02.043 (in Chinese) |
| [21] |
HUANG A X, WANG S G, GUO J L, et al. Prudent use of tylosin for treatment of Mycoplasma gallisepticum based on its clinical breakpoint and lung microbiota shift[J]. Front Microbiol, 2021, 12: 712473. DOI:10.3389/fmicb.2021.712473 |
| [22] |
HANNAN P C T. Guidelines and recommendations for antimicrobial minimum inhibitory concentration (MIC) testing against veterinary mycoplasma species[J]. Vet Res, 2000, 31(4): 373-395. DOI:10.1051/vetres:2000100 |
| [23] |
DE JONG A, YOUALA M, KLEIN U, et al. Minimal inhibitory concentration of seven antimicrobials to Mycoplasma gallisepticum and Mycoplasma synoviae isolates from six European countries[J]. Avian Pathol, 2021, 50(2): 161-173. DOI:10.1080/03079457.2020.1861216 |
| [24] |
孔意端, 林居纯, 陈继荣, 等. 鸡毒支原体不同地区分离株对常用抗菌药物的敏感性试验[J]. 动物医学进展, 2008, 29(6): 35-38. KONG Y D, LIN J C, CHEN J R, et al. Sensitivity of Mycoplasma gallisepticum isolates from different geographical location to common atimicrobial agents[J]. Progress in Veterinary Medicine, 2008, 29(6): 35-38. (in Chinese) |
(编辑 白永平)



