2. 湖南农业大学动物医学院畜禽保健湖南省工程中心, 长沙 410128;
3. 长沙绿叶生物科技有限公司, 长沙 410100
2. Hunan Engineering Research Center of Livestock and Poultry Health Care, Colleges of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China;
3. Changsha Luye Biotechnology Co., Ltd, Changsha 410100, China
T-2毒素是由寄居在多种农作物上的镰刀菌属霉菌产生的一种次级代谢产物,是一类具有强烈毒性的A类单端孢霉烯族真菌毒素,在中国的检出率为80%[1],对我国乃至全球的粮食与饲料安全造成严重影响。T-2毒素毒性稳定、不易降解且广泛存在于大麦、小麦、燕麦和玉米等谷物中[2],其毒力大小差异受诸多因素的影响,如接触方式、暴露时间、染毒剂量等,往往幼年动物比成年动物表现更为敏感[3-4]。在啮齿类动物模型中,T-2毒素的半数致死量(LD50)为5~10 mg·kg-1 [5],且血浆中的T-2毒素通常在48 h内可全部清除[6]。T-2毒素中毒可分为急性、亚急性和慢性3种,短期大量摄入T-2毒素可导致急性中毒,动物表现为恶心、腹泻、发育迟滞和体重减轻,严重时可导致死亡[7]。低剂量多次摄入T-2毒素可导致亚急性中毒,动物表现为反应迟缓,骨骼坏死,淋巴细胞减少和脑膜充血[8]。长期低剂量摄入T-2毒素可导致慢性中毒,动物表现为食欲下降、消化道黏膜损伤、神经内分泌紊乱、免疫系统损伤、皮肤坏死、生长抑制及母畜不孕、流产甚至死亡等[9]。已有研究表明, 食用含有T-2毒素的饲粮会引起宿主肠道疾病,比如损伤肠道黏膜免疫应答[10]、干扰肠屏障功能[11]、改变肠道菌群组成[12]。目前,基于动物模型的T-2毒素毒理相关研究大多数为急性攻毒试验,但我国饲料原料及畜禽配合饲料中T-2毒素的污染大多为低水平污染[13]。因此,慢性或亚急性T-2毒素暴露应当优先关注。
单宁(tannins)是一类多酚类化合物,广泛存在于高粱、石榴、柿子以及豆科等粮食作物中。根据其化学结构,单宁主要分为缩合单宁(condensed tannin, CT)和水解单宁(hydrolyzable tannin, HT),CT是由儿茶素、表儿茶素、没食子儿茶素和表没食子儿茶素按照不同比例聚合而成聚合物,而HT则是由没食子酸酯或含糖基的鞣酸及其衍生物组成,其中以单宁酸(tannic acid, TA)为典型[14-15]。一般而言,单宁易与体内的蛋白质、生物碱、多糖、核酸、细胞膜等大分子发生沉淀反应,过量摄入单宁会影响动物对营养物质的吸收与利用,并产生细胞毒性[15-17]。因此,在畜牧养殖业中,单宁通常被视为动物饲料中的抗营养因子。然而,TA中邻位羟基的存在使其具有很强的清除氧自由基的能力,从而具备较强的抗氧化活性[15],动物日粮中适量添加的TA具有抗炎和抗氧化等生物学功能[18-19]。作者前期的研究证明,TA可通过调节死亡受体和线粒体凋亡信号通路修复玉米赤霉烯酮诱导的小鼠卵巢损伤[20]。此外,作者前期的预试验还发现每日灌胃100和200 mg·kg-1 TA对小鼠各项生理指标及肠道健康无显著影响,但400 mg·kg-1 TA可造成小鼠的消化器官损伤。基于前期研究基础,本研究以雄性C57BL/6J小鼠为模型,对小鼠进行低于LD50水平(1 mg·kg-1)的T-2毒素灌胃,且灌胃频率为每周3次,持续10周,建立小鼠低剂量T-2毒素暴露模型,研究低剂量T-2毒素暴露对小鼠结肠组织病理学形态、结肠黏膜屏障和结肠菌群多样性的影响,并评估安全剂量(100 mg·kg-1)的TA对T-2毒素诱导结肠损伤的保护效果,旨在为低剂量T-2毒素污染对动物肠道健康损伤的评估及其防治提供依据。
1 材料与方法 1.1 试剂材料T-2毒素购自普瑞邦生物工程有限公司,TA购自麦克林生化科技有限公司(上海);BCA蛋白检测试剂盒购自杭州联科生物科技有限公司;无水乙醇、氯仿、异丙醇、二甲苯、中性树胶购自国药集团化学试剂有限公司;H&E染色液套装(G1005)、AB-PAS染液套装(G1049)购自武汉Servicebio公司;Trizol、Evo M-MLV反转录试剂盒和SYBR Green Ⅰ试剂盒购自湖南艾科瑞生物工程有限公司;Western blot蛋白Marker、一抗和二抗均购自湖南艾方生物科技有限公司;ECL试剂购自江苏凯基生物技术股份有限公司。
1.2 动物试验36只6周龄雄性C57BL/6J小鼠,购自湖南斯莱克景达实验动物有限公司。小鼠初始体重约为21 g,饲养于标准动物房[温度(22±2)℃,湿度(65±5%)]。实验小鼠饲料为南通特洛菲饲料科技有限公司的LAD0011饲料,主要成分为小麦、玉米、次粉、豆粕,玉米蛋白粉、油脂、啤酒酵母、盐、赖氨酸、蛋氨酸、矿物质、维生素。实验小鼠随机分为3组(每组12只):对照(Ctrl)组、T-2毒素(T2)组和TA干预(T2TA)组。T-2毒素溶于1%无水乙醇,用0.9%生理盐水稀释,T2组、T2TA组按照每日1 mg·kg-1剂量每周灌胃3次(Ctrl组灌胃无菌生理盐水);TA溶于0.9%生理盐水,T2TA组以每日100 mg·kg-1的TA剂量灌胃(Ctrl组和T2组灌胃无菌生理盐水),试验周期10周。试验结束前一天晚上,禁食不禁水8 h。然后按0.01 mL·g-1剂量腹腔注射2.5%三溴乙醇麻醉,最后断颈处死。试验过程符合国家《实验动物福利伦理审查指南》规定,并经湖南农业大学生物医学研究伦理委员会批准(No.43322105)。
1.3 结肠组织病理学分析各组截取5只小鼠结肠组织放至4%多聚甲醛组织固定液中充分浸泡,固定24h,依次进行脱水浸蜡、包埋、切片制成石蜡切片。用于H&E染色、AB-PAS染色和免疫组化染色,镜检,采集图像使用Image-Pro Plus 6.0软件进行统计分析。每组5个样本,每个样本组织切片按照左上、右上、中、左下、右下区域截取5个视野,于每个视野中进行杯状细胞计数以及免疫组化阳性面积分析。H&E染色结果以100×和400×的切片镜检图呈现,AB-PAS染色和免疫组化染色结果以100×和200×的切片镜检图呈现。
1.4 实时荧光定量PCR使用Trizol试剂从结肠组织中提取总RNA,使用Evo M-MLV反转录试剂盒将RNA反转录为cDNA。使用SYBR Green Ⅰ试剂盒和qPCR仪对目的基因表达量进行测定,以β-actin作为内参,用2-ΔΔCt计算mRNA的相对表达量。测定的基因名称和引物序列如表 1所示。
|
|
表 1 PCR引物序列 Table 1 Primer sequences for PCR analysis |
取出适量结肠组织,放入含有RIPA裂解缓冲液和PMSF的离心管冰浴匀浆,以12 000 r·min-1、4℃离心5min,分离上清。以BCA法测定蛋白浓度,随后在沸水中煮沸变性5 min。样品蛋白在SDS-PAGE上分离,转移到PEDF膜。加入一抗轻轻摇晃过夜,洗膜3次,加入二抗孵育1 h,洗膜3次。最后,用ECL试剂对蛋白条带可视化,用Image-Pro Plus 6.0软件对蛋白条带进行定量分析。
1.6 16S rRNA测序结肠菌群多样性检测试验委托上海美吉生物医药科技有限公司基于Illumina Miseq PE300平台完成。微生物群落总DNA抽提根据E.Z.N.A.® Soil DNA Kit说明书操作,使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因V3-V4可变区进行PCR扩增,每个样本3个重复。使用NEXTFLEX Rapid DNA-Seq Kit进行建库,利用Illumina公司的Miseq PE300平台进行测序;对测序数据使用fastp软件对原始测序序列进行质控,使用FLASH软件进行拼接,使用UPARSE软件,根据97%的相似度对序列进行运算分类单位(operational taxonomic units,OTU)聚类并剔除嵌合体。利用RDP classifier对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(v138),设置比对阈值为70%。数据统计分析在美吉生信云平台(https://www.majorbio.com)完成。
1.7 数据分析组织病理学、qPCR以及Western blot检测数据应用SPSS 25.0进行Shapiro-Wilk (S-W)正态性检验,正态分布数据采用单因素方差分析,非正态分布数据采用KruskalWailis秩和检验,结果以“x±s”呈现。结肠微生物α多样性分析组间差异检验使用Kruskal-Wallis秩和检验;β多样性分析方法为偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA);物种差异分析多组比较使用Kruskal-Wallis秩和检验,事后检验为Tukey-kramer法,多重检验校正方法为FDR。P<0.05代表差异显著,P<0.01代表差异极显著。
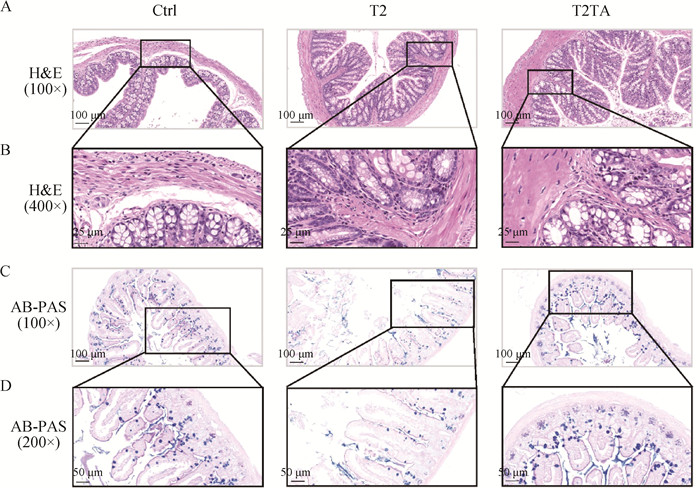
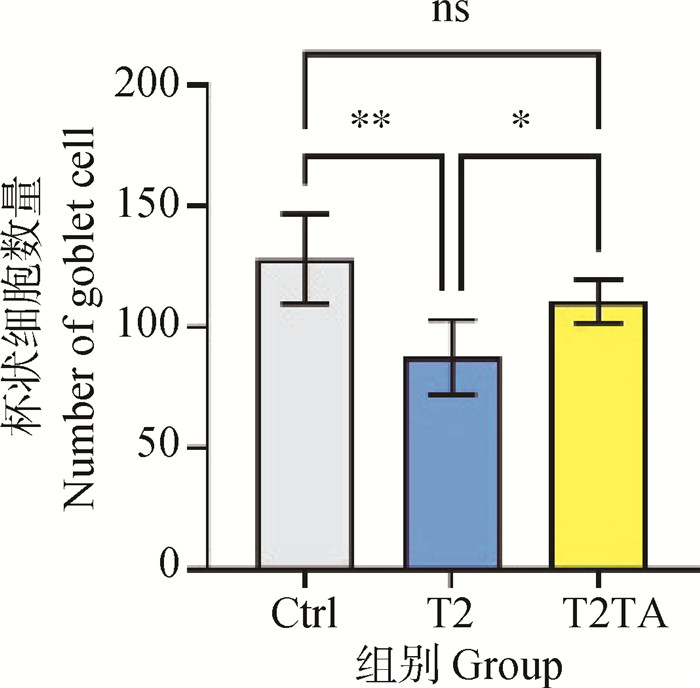
2 结果 2.1 TA缓解T-2毒素引起的小鼠结肠黏膜屏障损伤如图 1A、B所示,3组小鼠结肠组织结构完好,黏膜完整,隐窝结构完整,排列整齐,未见明显炎性细胞浸润。但从AB-PAS染色结果及杯状细胞数量统计中可以看出,与Ctrl组小鼠比较,T2组小鼠结肠黏膜杯状细胞数量极显著减少(P<0.01),而T2TA组相较于T2组小鼠结肠黏膜杯状细胞数目显著增加(P<0.05),且与Ctrl组无显著差异(P>0.05)(图 1C~D、图 2)。
|
A~B. 小鼠结肠H&E染色结果;C~D. 小鼠结肠杯状细胞AB-PAS染色 A-B. H&E staining of mice colon; C-D. AB-PAS staining of mice colonic goblet cells 图 1 小鼠结肠组织病理学变化 Fig. 1 Histopathological changes of mice colon |
|
*. P<0.05, **. P<0.01, ns. P≥0.05 图 2 小鼠结肠杯状细胞数量 Fig. 2 The number of goblet cells in colon |
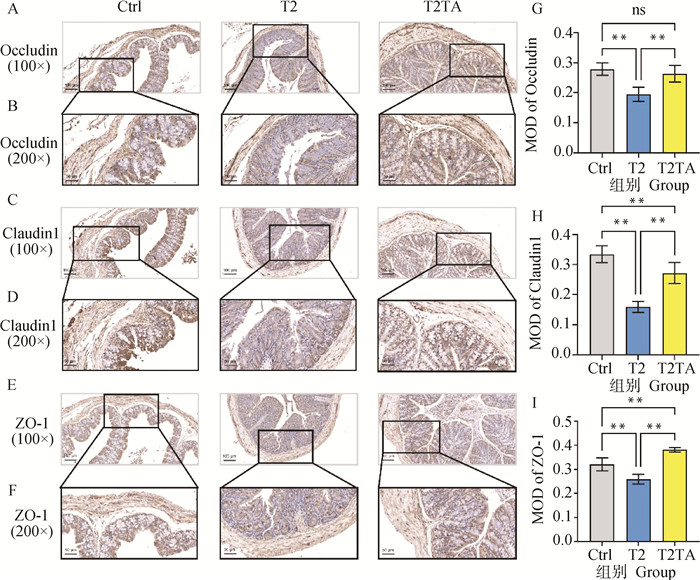
如图 3免疫组织化学染色结果显示,蛋白阳性表达呈棕黄色染色。T2组结肠黏膜中Occludin、Claudin1、ZO-1蛋白表达相较于Ctrl组均出现极显著降低(P<0.01)(图 3A~I)。而TA干预可使Occludin、Claudin1、ZO-1蛋白表达均极显著升高(P<0.01)(图 3A~I)。且T2TA组Claudin1蛋白表达极显低于Ctrl组(P<0.01)(图 3C、D、H),而ZO-1蛋白极显著高于Ctrl组(P<0.01)(图 3E、F、I)。
|
A~F.小鼠结肠Occludin、Claudin1和ZO-1免疫组化染色;G~I.小鼠结肠黏膜Occludin、Claudin1和ZO-1免疫组化阳性区域统计。**. P<0.01, ns. P≥0.05 A-F. Immunohistochemical staining of Occludin, Claudin1 and ZO-1 of mouse colon; G-I. Statistics of immunohistochemically positive areas of Occludin, Claudin1 and ZO-1 in mouse colonic mucosa.**. P<0.01, ns. P≥0.05 图 3 小鼠结肠黏膜通透性相关蛋白表达免疫组化分析 Fig. 3 Immunohistochemical analysis of mouse colonic mucosal permeability-related protein expression |
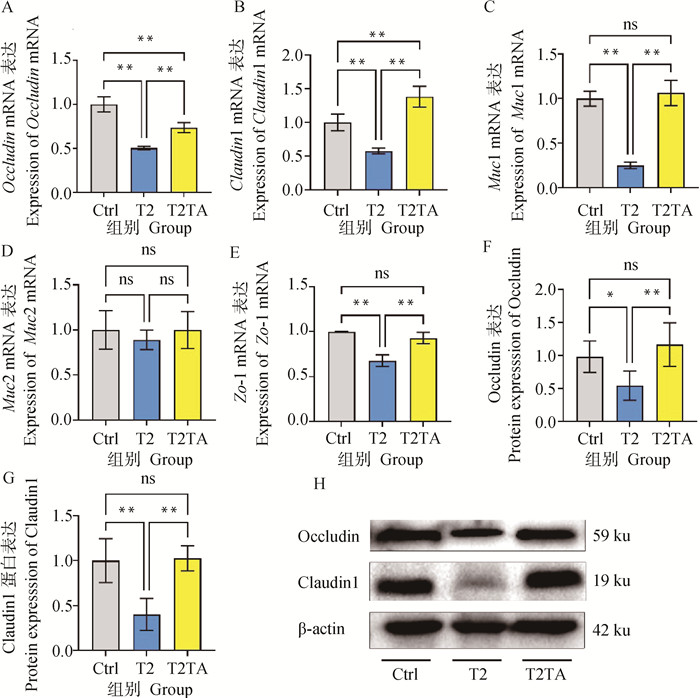
与Ctrl组以及T2TA组相比,T2组的Occludin、Claudin1、Muc1以及Zo-1基因mRNA相对表达量均呈极显著下降(P<0.01),且T2TA组Occludin mRNA相对表达量极显著低于Ctrl组(P<0.01),Claudin1 mRNA相对表达量极显著高于Ctrl组(P<0.01)(图 4A~C,E)。Muc2 mRNA各组间相对表达量无显著差异(P≥0.05)(图 4D)。Western blot结果显示,相较于Ctrl组,T2组Occludin和Claudin1蛋白表达量分别呈现显著(P<0.05)和极显著(P<0.01)下降,而T2TA组相较于T2组,两者均极显著升高(P<0.01)(图 4F~H)。
|
A~E. 小鼠结肠Occludin、Claudin1、Muc1、Muc2和Zo-1基因mRNA相对表达量变化;F~G. 小鼠结肠Occludin和Claudin1蛋白表达量变化;H. Western blot蛋白电泳条带。*. P<0.05, **. P<0.01, ns. P≥0.05 A-E. Relative Occludin, Claudin1, Muc1, Muc2 and Zo-1 mRNA expression; F-G. Relative Occludin and Claudin1 proteins expression; H. Protein bands. *. P<0.05, **. P<0.01, ns. P≥0.05. 图 4 小鼠结肠黏膜通透性相关基因和蛋白表达 Fig. 4 The expression of mucosal permeability related genes and proteins of mice colon |
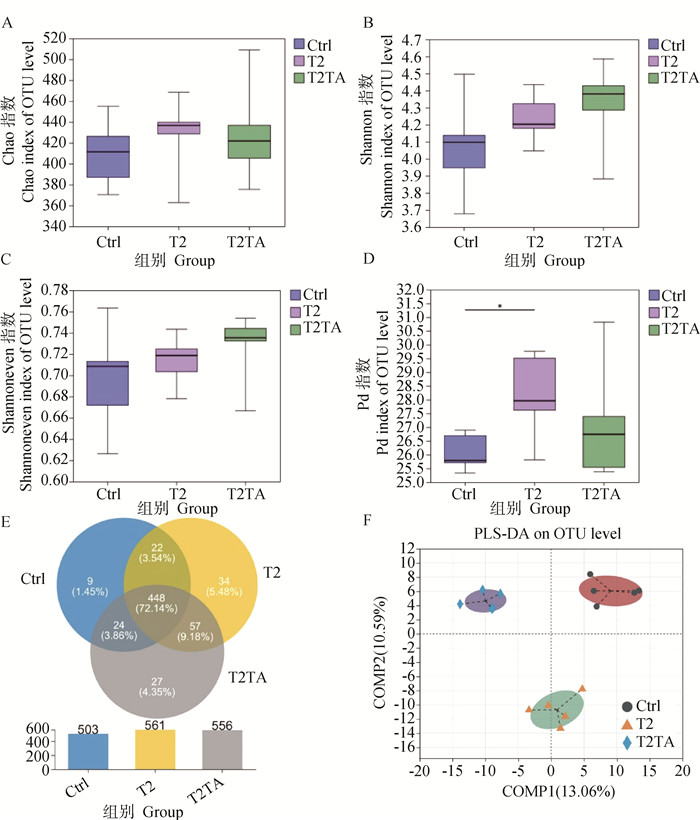
由图 5A~C中结肠菌群α多样性分析可知,各组间OTU水平的Chao、Shannon及Shannoneven指数均无显著差异(P>0.05),即各组小鼠结肠菌群的丰富度、群落多样性以及群落均一性差异不显著。Pd指数反映了样本的谱系多样性,Pd指数越大,说明物种进化多样性越高。如图 5D所示,T2组的Pd指数与Ctrl组相比存在显著差异(P<0.05),即T2组结肠菌群的进化多样性显著升高。如图 5E中OTU水平Venn分析所示,Ctrl组、T2组、T2TA组共检出621个OTU,3组共同的OTU有448个,3组独有的OTU数目分别为9个、34个和27个,Ctrl组和T2组共同的OTU有22个,Ctrl组和T2TA组共同的OTU有24个,T2组和T2TA组共同的OTU有57个。此外,在β多样性分析结果中,PLS-DA分析可见各组样本距离较远,分别聚集在不同的象限中,即各组间小鼠的结肠菌群结构有一定的差异,主成分解释度分别为13.06%和10.59%(图 5F)。
|
A~D. 结肠菌群Chao指数、Shannon指数、Shannoneven指数和Pd指数;E. OTU水平Venn分析;F. OTU水平PLS-DA分析。*. P<0.05 A-D. Chao index, Shannon index, Shannoneven index and Pd index; E. Venn diagram of OTU level; F. PLS-DA analysis at OTU level of specie. *. P<0.05 图 5 小鼠结肠菌群α多样性和β多样性分析 Fig. 5 Species evaluation and samples comparative analysis of mice colon |
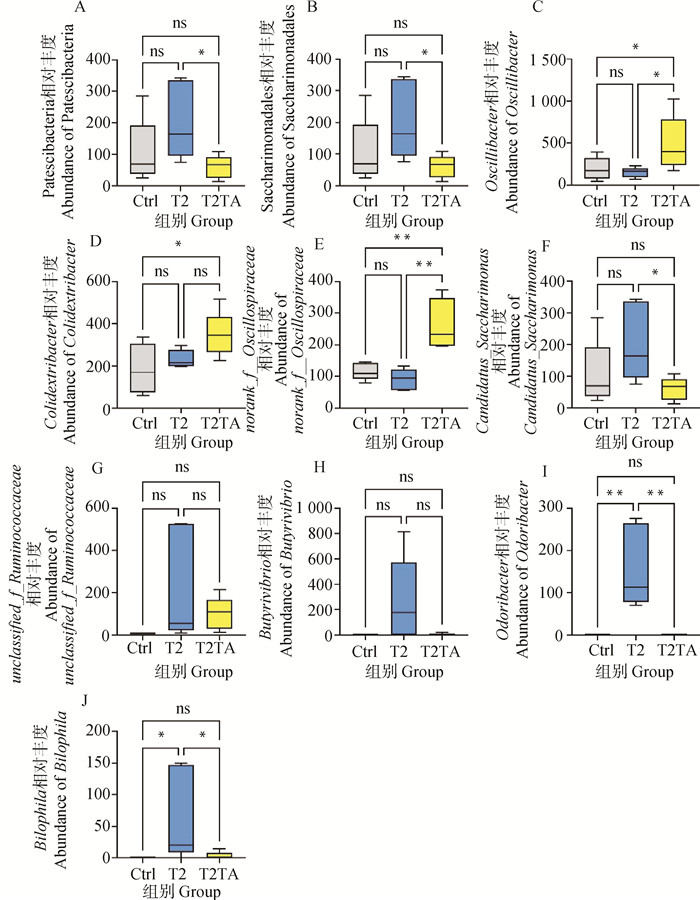
在门水平,各组相对丰度前5的物种依次为拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、脱硫弧菌门(Desulfobacterota)、放线菌门(Actinobacteriota)和疣微菌门(Verrucomicrobiota)(图 6A);差异物种分析结果显示,T2组Patescibacteria丰度显著高于T2TA组(P<0.05),且相对于Ctrl组呈升高趋势(P≥0.05)(图 7A)。在目水平,各组相对丰度前5的物种依次为拟杆菌目(Bacteroidalea)、毛螺菌目(Lachnospirales)、乳酸杆菌目(Lactobacillales)、颤螺菌目(Oscillospirales)和脱硫弧菌目(Desulfovibrionales)(图 6B);差异物种分析结果显示,T2组Saccharimonadales丰度显著高于T2TA组(P<0.05),且相对于Ctrl组呈升高趋势(P≥0.05)(图 7B)。在属水平,各组相对丰度前5的物种依次为norank_f__Muribaculaceae属、Lachnospiraceae_NK4A136_group属、乳酸杆菌属(Lactobacillus)、unclassified_f__Lachnospiraceae属和拟普雷沃菌属(Alloprevotella)(图 6C);差异物种分析结果显示,T2TA组的颤杆菌属(Oscillibacter)丰度显著高于Ctrl组和T2组(P<0.05)(图 7C),Colidextribacter属丰度显著高于Ctrl组(P<0.05)(图 7D),norank_f__Oscillospiraceae属丰度极显著高于Ctrl组和T2组(P<0.01)(图 7E);T2组Candidatus-Saccharimonas属显著高于T2TA组(P<0.05)且相对Ctrl组呈上升趋势(P≥0.05)(图 7F);T2组的臭气杆菌属(Odoribacter)极显著高于Ctrl组和T2TA组(P<0.01)(图 7I),嗜胆菌属(Bilophila)丰度显著高于Ctrl组和T2TA组(P<0.05)(图 7J),且unclassified_f__Ruminoccaceae属和丁酸弧菌属(Butyrivibrio)丰度相对Ctrl组和T2TA组呈升高趋势(P≥0.05)(图 7G、H)。

|
A. 小鼠结肠菌群门物种组成;B. 小鼠结肠菌群目物种组成;C. 小鼠结肠菌群属物种组成 A. Species composition at phylum level; B. Species composition at order level; C. Species composition at genus level 图 6 小鼠结肠菌群物种组成 Fig. 6 Species composition of mice colon |
|
A~J. 小鼠结肠中Patescibacteria门,Saccharimonadales目,颤杆菌属(Oscillibacter),Colidextribacter属,norank_f__Oscillospiraceae属,Candidatus-Saccharimonas属,unclassified_f__Ruminoccaceae属,丁酸弧菌(Butyrivibrio)属,臭气杆菌(Odoribacter)属和嗜胆菌(Bilophila)属相对丰度。*. P<0.05, **. P<0.01. ns. P≥0.05. A-J. Abandence of Patescibacteria, Saccharimonadales, Oscillibacter, Colidextribacter, norank_f__Oscillospiraceae, Candidatus-Saccharimonas, unclassified_f__Ruminoccaceae, Butyrivibrio, Odoribacter and Bilophila. *. P<0.05, **. P<0.01. ns. P≥0.05 图 7 小鼠结肠菌群物种差异分析 Fig. 7 Species differences analysis of mice colon |
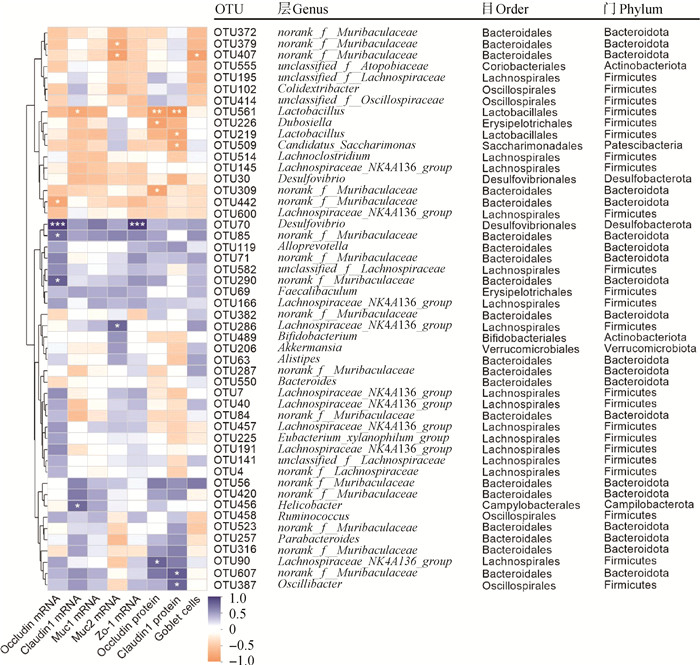
进一步对小鼠结肠菌群物种丰度和结肠屏障相关指标进行了Spearman相关性分析,以此探究结肠菌群物种与结肠屏障之间的相关性。结果如图 8所示,Occludin和Zo-1 mRNA表达水平与脱硫杆菌属丰度呈极显著的正相关(P<0.001);Occludin蛋白表达水平与乳酸杆菌属丰度呈极显著负相关(P<0.01),与Lachnospiraceae_NK4A136_group丰度呈显著正相关(P<0.05)。Claudin1蛋白表达水平与norank_f__Muribaculaceae和颤杆菌目丰度呈显著正相关(P<0.05),与乳酸杆菌属和Candidatus-Saccharimonas属丰度分别呈极显著(P<0.01)和显著(P<0.05)负相关。Muc2 mRNA表达水平与Lachnospiraceae_NK4A136_group丰度呈显著正相关(P<0.05),与norank_f__Muribaculaceae丰度呈显著负相关(P<0.05)。
|
相关性R值以不同颜色表示,*. P<0.05,**. P<0.01,***. P<0.001 Different colors represent correlation R values, *. P<0.05, **. P<0.01, ***. P<0.001 图 8 小鼠结肠菌群物种丰度与结肠屏障相关指标Spearman相关性分析 Fig. 8 Spearman correlation analysis of gut microbiota and colon barrier-associated parameters of mice colon |
本研究结果显示,低剂量T-2毒素暴露不会造成小鼠结肠组织显著的形态损伤和炎症反应,但会使小鼠结肠中的杯状细胞数量极显著减少(图 2)。而TA干预后的小鼠结肠中的杯状细胞数量显著增加。Kruppel样转录因子-4(Kruppel-like factors-4,KLF4)是一类具有锌指结构的转录因子,广泛参与细胞增殖、分化及胚胎发育等多个生命活动的调控,特别是在结肠杯状细胞的分化成熟过程中发挥重要作用[21]。研究表明,IL-8可以通过减少KLF4阻碍杯状细胞的发育[22],因此,TA可能是通过增加结肠中KLF4来促进杯状细胞发育,使杯状细胞数量增加,这表明TA可以缓解低剂量T-2毒素暴露造成的结肠黏膜屏障受损,具有一定的保护结肠屏障功能的作用。而MUC1是最主要的黏蛋白之一,本研究结果显示,低剂量T-2毒素降低小鼠结肠Muc1 mRNA的表达,而TA干预后其表达量显著上升(图 4),验证了TA改善T-2毒素诱导的小鼠结肠黏膜屏障,起到保护小鼠结肠黏膜屏障的作用。在Choi等[23]的研究中,给与肉鸡饲粮中添加TA可增加肠道黏蛋白和紧密连接蛋白表达,提高肠道黏液屏障完整性,同时对肠道菌群也有积极影响,这与本研究结果相印证。
肠道上皮细胞机械屏障是保护肠道健康的另一重要因素,紧密连接蛋白在调节营养物质的运输和防御抗原从管腔进入宿主体循环方面起着关键作用[24-25],其遭到破坏可增加肠道通透性,进而导致炎症出现。紧密连接蛋白主要包括Claudin家族、Occludin家族和ZO家族,各类蛋白之间的相互作用有助于肠道紧密连接屏障的形成[26-27]。本研究结果显示,T-2毒素可以导致结肠中Claudin1和Occludin的mRNA和蛋白表达量显著下降,而TA干预可使之显著升高(图 4)。同时,qPCR结果显示, Zo-1 mRNA表达水平呈现相同的趋势(图 4)。此外,免疫组化结果也证实了Claudin1、Occludin以及ZO-1蛋白表达水平具有相同趋势(图 3)。上述结果表明,低剂量的T-2毒素暴露可导致小鼠结肠黏膜机械损伤,而TA的干预可有效缓解T-2毒素引起的肠道屏障损伤。据研究报道,在断奶仔猪饲粮中添加TA可通过上调ZO-1等紧密连接蛋白mRNA的表达水平,起到改善肠道屏障的作用[28],TA还可显著上调十二指肠中Occludin和Zo-2 mRNA的表达,降低猪肠道上皮通透性,改善肠屏障完整性[29],这些研究与本试验结果相印证。
在本研究中,低剂量的T-2毒素暴露扰乱了小鼠结肠微生物的平衡,改变了结肠菌群结构,这与前人在其他动物模型中的研究结果相似[12]。已有研究证明,适量的TA不仅可以提高肠道对营养物质的吸收和利用,促进肠道健康,还可促进动物肠道内有益菌的增殖,同时抑制有害菌的生长,调节动物肠道菌群丰度的相对稳定[15]。Xu等[30]报道,饲料添加0.15%的TA可有效降低断奶仔猪腹泻,提高肠道屏障功能,改善肠道微生物群落结构。Liu等[31]研究发现,添加适量的TA可以促进肠道内产短链脂肪酸(short chain fatty acids,SCFAs)细菌的生长,可以起到预防炎症和维持肠道稳态的作用。微生物多样性分析结果证明了TA的干预,一定程度上逆转了T-2毒素引起的结肠菌群的改变(图 5)。结肠菌群物种丰度及差异分析结果表明,TA的干预,可使T2组小鼠结肠中的Patescibacteria门、Saccharimonadales目、Candidatus-Saccharimonas属、unclassified_f__Ruminoccaceae属、臭气杆菌属以及嗜胆菌属丰度显著或极显著降低。其中,Candidatus-Saccharimonas属和嗜胆菌属均已被证明是肠道内的有害菌,Candidatus-Saccharimonas属丰度与结肠癌的发病成正相关[32],而高脂饮食会增加肠道中嗜胆菌属丰度[33]。但也有研究发现,臭气杆菌属丰度的降低,结肠炎、非酒精性脂肪肝等代谢性疾病的发生有关[34],在本研究中,T2组臭气杆菌属丰度极显著高于另两组,但对结肠健康并未显示出积极影响,可能与其在肠道菌群中的整体丰度较低有关。此外,TA的干预,可使T2组小鼠结肠中的颤杆菌属和norank_f__Oscillospiraceae属丰度分别显著和极显著升高(图 6、7)。其中,颤杆菌属是已知的可产SCFAs并改善血脂的肠道有益微生物[35]。这些菌群的变化,证明了低剂量T-2毒素暴露会对结肠菌群多样性及物种组成造成损害,而适量的TA干预具有显著的改善效果。
本研究中的Spearman相关性分析结果显示,小鼠结肠Occludin和Zo-1 mRNA表达水平与脱硫弧菌属丰度呈极显著的正相关(图 8);尽管已有报道表明脱硫弧菌属与溃疡性结肠炎、结肠癌和以肥胖、胰岛素抵抗为代表的代谢综合征的发生发展有关[36],但也有最新研究发现,植物提取物在改善高脂饮食诱导的小鼠代谢紊乱的同时,也促进了其肠道内脱硫弧菌属丰度的升高[37],这可能与其属水平下的不同种的功能差异有关。Occludin蛋白表达水平和Muc2 mRNA表达水平均与Lachnospiraceae_NK4A136_group丰度呈显著正相关(图 8)。Lachnospiraceae_NK4A136_group属为毛螺菌科NK4A136家族,毛螺菌科已被认为是一种有益的肠道微生物,可产生SCFAs,改善肠道炎症及提高肠上皮屏障功能[38],这与本研究结论相一致。norank_f__Muribaculaceae属和颤杆菌属均属于产SCFAs细菌,其丰度的增加与肠道免疫反应的改善有显著相关性[35, 39]。乳酸杆菌属被普遍认为是一种有益于肠道健康的益生菌[40],但本研究中乳酸杆菌属丰度与结肠屏障相关指标呈显著负相关(图 8),可能与其在小鼠结肠中丰度较低有关。
4 结论低剂量T-2毒素暴露会导致小鼠结肠屏障损伤和结肠菌群的失调。而TA可以通过缓解T-2毒素造成的杯状细胞数量减少、上调结肠黏膜屏障相关基因及蛋白的表达量水平,缓解T-2毒素引起的小鼠结肠黏膜损伤;同时通过调节T-2毒素诱导的结肠菌群失衡,降低有害菌群丰度、升高有益菌群丰度,最终有效改善小鼠的肠道健康。
| [1] |
WAN J, CHEN B C, RAO J J. Occurrence and preventive strategies to control mycotoxins in cereal-based food[J]. Compr Rev Food Sci Food Saf, 2020, 19(3): 928-953. DOI:10.1111/1541-4337.12546 |
| [2] |
TURNER P C, SNYDER J A. Development and limitations of exposure biomarkers to dietary contaminants mycotoxins[J]. Toxins (Basel), 2021, 13(5): 314. DOI:10.3390/toxins13050314 |
| [3] |
DAI C S, XIAO X L, SUN F F, et al. T-2 toxin neurotoxicity: role of oxidative stress and mitochondrial dysfunction[J]. Arch Toxicol, 2019, 93(11): 3041-3056. DOI:10.1007/s00204-019-02577-5 |
| [4] |
ADHIKARI M, NEGI B, KAUSHIK N, et al. T-2 mycotoxin: toxicological effects and decontamination strategies[J]. Oncotarget, 2017, 8(20): 33933-33952. DOI:10.18632/oncotarget.15422 |
| [5] |
SCHUHMACHER-WOLZ U, HEINE K, SCHNEIDER K. Report on toxicity data on trichothecene mycotoxins HT-2 and T-2 toxins[J]. EFSA Supporting Publ, 2010, 7(7): 65E. |
| [6] |
KUCA K, DOHNAL V, JEZKOVA A, et al. Metabolic pathways of T-2 toxin[J]. Curr Drug Metab, 2008, 9(1): 77-82. DOI:10.2174/138920008783331176 |
| [7] |
NICHOLSON P, CHANDLER E, DRAEGER R C, et al. Molecular tools to study epidemiology and toxicology of fusarium head blight of cereals[J]. Eur J Plant Pathol, 2003, 109(7): 691-703. DOI:10.1023/A:1026026307430 |
| [8] |
SUDAKIN D L. Trichothecenes in the environment: relevance to human health[J]. Toxicol Lett, 2003, 143(2): 97-107. DOI:10.1016/S0378-4274(03)00116-4 |
| [9] |
MEISSONNIER G M, LAFFITTE J, RAYMOND I, et al. Subclinical doses of T-2 toxin impair acquired immune response and liver cytochrome P450 in pigs[J]. Toxicology, 2008, 247(1): 46-54. DOI:10.1016/j.tox.2008.02.003 |
| [10] |
KOLF-CLAUW M, SASSAHARA M, LUCIOLI J, et al. The emerging mycotoxin, enniatin B1, down-modulates the gastrointestinal toxicity of T-2 toxin in vitro on intestinal epithelial cells and ex vivo on intestinal explants[J]. Arch Toxicol, 2013, 87(12): 2233-2241. DOI:10.1007/s00204-013-1067-8 |
| [11] |
GALARZA-SEEBER R, LATORRE J D, BIELKE L R, et al. Leaky gut and mycotoxins: aflatoxin B1 does not increase gut permeability in broiler chickens[J]. Front Vet Sci, 2016, 3: 10. |
| [12] |
WANG C L, WANG X D, HUANG Y X, et al. Effects of dietary T-2 toxin on gut health and gut microbiota composition of the juvenile Chinese mitten crab (Eriocheir sinensis)[J]. Fish Shellfish Immunol, 2020, 106: 574-582. DOI:10.1016/j.fsi.2020.08.019 |
| [13] |
LI A P, HAO W, GUAN S, et al. Mycotoxin contamination in feeds and feed materials in China in year 2020[J]. Front Vet Sci, 2022, 9: 1016528. DOI:10.3389/fvets.2022.1016528 |
| [14] |
PONZIANI F R, PECERE S, GASBARRINI A, et al. Physiology and pathophysiology of liver lipid metabolism[J]. Expert Rev Gastroenterol Hepatol, 2015, 9(8): 1055-1067. DOI:10.1586/17474124.2015.1056156 |
| [15] |
王吉, 王湘林, 肖海思, 等. 单宁的生物活性及其在畜禽生产中的应用[J]. 中国农业大学学报, 2022, 27(4): 164-178. WANG J, WANG X L, XIAO H S, et al. Biological activity of tannin and its application in livestock and poultry production[J]. Journal of China Agricultural University, 2022, 27(4): 164-178. (in Chinese) |
| [16] |
WANG J, XIAO H S, ZHU Y Y, et al. Tannic acid induces the mitochondrial pathway of apoptosis and S phase arrest in porcine intestinal IPEC-J2 cells[J]. Toxins (Basel), 2019, 11(7): 397. DOI:10.3390/toxins11070397 |
| [17] |
王吉, 张琳玉, 刘翔燕, 等. 单宁酸诱导猪肾细胞氧化损伤和凋亡[J]. 动物营养学报, 2020, 32(9): 4327-4336. WANG J, ZHANG L Y, LIU X Y, et al. Tannic acid induces oxidative damage and apoptosis in pig kidney cells[J]. Chinese Journal of Animal Nutrition, 2020, 32(9): 4327-4336. (in Chinese) |
| [18] |
YANG Y, LUO H H, SONG X, et al. Preparation of Galla chinensis oral solution as well as its stability, safety, and antidiarrheal activity evaluation[J]. Evid Based Complement Alternat Med, 2017, 2017: 1851459. |
| [19] |
GIRARD M, THANNER S, PRADERVAND N, et al. Hydrolysable chestnut tannins for reduction of postweaning diarrhea: efficacy on an experimental ETEC F4 model[J]. PLoS One, 2018, 13(5): e0197878. DOI:10.1371/journal.pone.0197878 |
| [20] |
WU J, LI J Y, LIU Y W, et al. Tannic acid repair of zearalenone-induced damage by regulating the death receptor and mitochondrial apoptosis signaling pathway in mice[J]. Environ Pollut, 2021, 287: 117557. DOI:10.1016/j.envpol.2021.117557 |
| [21] |
KATZ J P, PERREAULT N, GOLDSTEIN B G, et al. The zinc-finger transcription factor Klf4 is required for terminal differentiation of goblet cells in the colon[J]. Development, 2002, 129(11): 2619-2628. DOI:10.1242/dev.129.11.2619 |
| [22] |
杨松巍, 王亮, 李虎进, 等. IL-18通过下调KLF4阻碍杯状细胞发育加剧小鼠溃疡性结肠炎[J]. 重庆医科大学学报, 2020, 45(9): 1327-1331. YANG S W, WANG L, LI H J, et al. IL-18 aggravated ulcerative colitis by inhibiting the development of goblet cells through KLF4 in mice[J]. Journal of Chongqing Medical University, 2020, 45(9): 1327-1331. DOI:10.13406/j.cnki.cyxb.002275 (in Chinese) |
| [23] |
CHOI J, LIU G C, GOO D, et al. Effects of tannic acid supplementation on growth performance, gut health, and meat production and quality of broiler chickens raised in floor pens for 42 days[J]. Front Physiol, 2022, 13: 1082009. DOI:10.3389/fphys.2022.1082009 |
| [24] |
BALDA M S, MATTER K. Tight junctions at a glance[J]. J Cell Sci, 2008, 121(Pt 22): 3677-3682. |
| [25] |
ZHOU Y, NI X Q, DUAN L, et al. Lactobacillus plantarum BSGP201683 improves the intestinal barrier of giant panda microbiota-associated mouse infected by enterotoxigenic Escherichia coli K88[J]. Probiotics Antimicrob Proteins, 2021, 13(3): 664-676. DOI:10.1007/s12602-020-09722-y |
| [26] |
FELDMAN G J, MULLIN J M, RYAN M P. Occludin: structure, function and regulation[J]. Adv Drug Deliv Rev, 2005, 57(6): 883-917. DOI:10.1016/j.addr.2005.01.009 |
| [27] |
JIANG Y D, SONG J, XU Y, et al. Piezo1 regulates intestinal epithelial function by affecting the tight junction protein claudin-1 via the ROCK pathway[J]. Life Sci, 2021, 275: 119254. DOI:10.1016/j.lfs.2021.119254 |
| [28] |
SONG Y Y, LUO Y, YU B, et al. Tannic acid extracted from gallnut prevents post-weaning diarrhea and improves intestinal health of weaned piglets[J]. Anim Nutr, 2021, 7(4): 1078-1086. DOI:10.1016/j.aninu.2021.04.005 |
| [29] |
YU J, SONG Y Y, YU B, et al. Tannic acid prevents post-weaning diarrhea by improving intestinal barrier integrity and function in weaned piglets[J]. J Anim Sci Biotechnol, 2020, 11: 87. DOI:10.1186/s40104-020-00496-5 |
| [30] |
XU T T, MA X, ZHOU X C, et al. Coated tannin supplementation improves growth performance, nutrients digestibility, and intestinal function in weaned piglets[J]. J Anim Sci, 2022, 100(5): skac088. DOI:10.1093/jas/skac088 |
| [31] |
LIU X M, MAO B Y, GU J Y, et al. Blautia-a new functional genus with potential probiotic properties?[J]. Gut Microbes, 2021, 13(1): 1875796. DOI:10.1080/19490976.2021.1875796 |
| [32] |
DOS SANTOS CRUZ B C, DA CONCEIÇÃO L L, DE OLIVEIRA MENDES T A, et al. Use of the synbiotic VSL#3 and yacon-based concentrate attenuates intestinal damage and reduces the abundance of Candidatus Saccharimonas in a colitis-associated carcinogenesis model[J]. Food Res Int, 2020, 137: 109721. DOI:10.1016/j.foodres.2020.109721 |
| [33] |
DAHL W J, RIVERO MENDOZA D, LAMBERT J M. Diet, nutrients and the microbiome[J]. Prog Mol Biol Transl Sci, 2020, 171: 237-263. |
| [34] |
HIIPPALA K, BARRETO G, BURRELLO C, et al. Novel Odoribacter splanchnicus strain and its outer membrane vesicles exert immunoregulatory effects in vitro[J]. Front Microbiol, 2020, 11: 575455. DOI:10.3389/fmicb.2020.575455 |
| [35] |
JIN J J, GAO L M, ZOU X L, et al. Gut dysbiosis promotes preeclampsia by regulating macrophages and trophoblasts[J]. Circ Res, 2022, 131(6): 492-506. DOI:10.1161/CIRCRESAHA.122.320771 |
| [36] |
KUSHKEVYCH I, DORDEVIĆ D, KOLLÁR P. Analysis of physiological parameters of Desulfovibrio strains from individuals with colitis[J]. Open Life Sci, 2018, 13(1): 481-488. |
| [37] |
ZHANG Y, PAN H B, YE X Q, et al. Proanthocyanidins from Chinese bayberry leaves reduce obesity and associated metabolic disorders in high-fat diet-induced obese mice through a combination of AMPK activation and an alteration in gut microbiota[J]. Food Funct, 2022, 13(4): 2295-2305. DOI:10.1039/D1FO04147A |
| [38] |
CHEN H L, XING X, ZHANG B, et al. Higher mucosal type Ⅱ immunity is associated with increased gut microbiota diversity in BALB/c mice after Trichinella spiralis infection[J]. Mol Immunol, 2021, 138: 87-98. DOI:10.1016/j.molimm.2021.07.014 |
| [39] |
DONG F, XIAO F F, LI X L, et al. Pediococcus pentosaceus CECT 8330 protects DSS-induced colitis and regulates the intestinal microbiota and immune responses in mice[J]. J Transl Med, 2022, 20(1): 33. DOI:10.1186/s12967-022-03235-8 |
| [40] |
BAI X W, WEI H, LIU W X, et al. Cigarette smoke promotes colorectal cancer through modulation of gut microbiota and related metabolites[J]. Gut, 2022, 71(12): 2439-2450. DOI:10.1136/gutjnl-2021-325021 |
(编辑 白永平)



